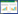扩展功能
文章信息
- 周稳稳, 相会明, 刁红亮, 李永红
- ZHOU Wen-Wen, XIANG Hui-Ming, DIAO Hong-Liang, LI Yong-Hong
- 圆红冬孢酵母利用生物乙醇废水-木薯粉水解液发酵产油
- Lipid production by Rhodosporidium toruloides using bioethanol wastewater-cassava starch hydrolysates
- 微生物学通报, 2015, 42(8): 1433-1441
- Microbiology China, 2015, 42(8): 1433-1441
- 10.13344/j.microbiol.china.150161
-
文章历史
- 收稿日期: 2015-03-02
- 接受日期: 2015-05-26
- 优先数字出版日期(www.cnki.net): 2015-06-17
2. 四川大学 化学工程学院 四川 成都 610065
2. College of Chemical Engineering, Sichuan University, Chengdu, Sichuan 610065, China
随着生物乙醇行业的迅猛发展,大量生物乙醇废水排放为其制造企业带来巨大的污水处理负担。废水中有机物和悬浮物含量高,淀粉质酒精废水化学需氧量COD (Chemical oxygen demand)一般为30 000−70 000 mg/L,为典型的高浓度有机废水,其处理负荷高,因而处理此种废水需耗费较多的基建投资和运行费用[1]。为实现有机废水的无害化、减量化和资源化,需要开发有机废水综合利用途径,回收废水中的有机资源,使之转化成具有高附加值的产品,预处理过的废水再行处理时负荷也会降低,从而实现经济效益、环境效益和社会效益的统一[2]。
以植物油为原料生产生物柴油,仅原料成本就占到总生产成本的70%−85%[3],随着生物柴油产量的日益增加,其原料供应问题日益突出。目前多项研究证明微生物油脂,又称单细胞油脂,是生产生物柴油的良好原料[4, 5]。产油微生物的一大优势就是其碳谱广、适应性强,有很多微生物能利用工农业废料中的有机物作为营养源进行油脂生产。已有一些学者将微生物油脂发酵原料成本高和环境污染问题综合考虑,探索了利用工农业废料、废渣进行微生物发酵生产油脂的新技术,取得了良好的效果。如Xue等研究表明Rhodotorula glutinis可以利用味精废水发酵生产微生物油脂,在进水COD浓度为10 000 mg/L时,得到生物量浓度为2.44 g/L,油脂含量为9.04%,COD降解率可达85.5%[6];Liu等研究发现利用Lipomyces starkeyi处理味精废水,得到生物量浓度3.1 g/L,油脂含量约为16%,油脂产量为0.36 g/L[7];我们最近的研究发现利用圆红冬孢酵母(Rhodosporidium toruloides)处理红薯酒精废水,在优化条件下,COD降解率、生物量浓度和油脂含量分别可达72.3%、3.8 g/L和34.9%[8]。采用有机废水培养产油微生物,可以在实现废水资源转化的同时降低有机废水的处理负荷。
以有机废水为原料生产微生物油脂,提高生产效率的关键之一是获得适应有机废水环境的产油菌株。但是以有机废水为唯一原料进行微生物油脂发酵,培养密度和油脂产量难以提高,这无疑使后续的分离过程成本激增。这主要是由于废水碳源浓度偏低、碳氮比过小[9, 10],营养组成不利于产油微生物积累油脂。若将有机废水与含碳源丰富的其他廉价原料混合处理,既可以得到较高的油脂含量,也可以实现废水的资源化处理,提高排出单位废水的产能,降低有机废水的处理负荷。鉴于此,本文拟通过在高浓度生物乙醇废水中将高产油脂酵母R.toruloides反复驯化,获得能够高效降解生物乙醇废水COD的产油菌株,探索菌株对废水的降解特性;将廉价碳源木薯粉生产微生物油脂和高浓度有机废水降解过程整合,以生物乙醇废水为水源制备生物乙醇废水-木薯粉水解液培养基,明确产油效率高、生物乙醇废水COD降解率高的初始还原糖浓度。以期为提高微生物油脂生产效率、降低生产成本,同时实现高浓度生物乙醇废水的资源化提供有用的参考。
1 材料与方法 1.1 材料 1.1.1 菌种: 实验采用的菌种为圆红冬孢酵母(Rhodosporidium toruloides 2.1389),购于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC)。 1.1.2 种子培养基组成及菌种保藏: R.toruloides 4 °C保藏于YEPD斜面培养基上,种子培养基为YEPD液体培养基[11]。 1.1.3 生物乙醇废水-木薯粉水解液的制备: 生物乙醇废水取自四川某木薯生物乙醇厂蒸馏釜底液。将取得的废水静置后,5 000 r/min离心10 min过滤除去固体残渣等预处理。测定预处理后的生物乙醇废水初始参数为:pH 3.2、COD 27 930 mg/L、还原糖3.7 g/L、总氮含量576 mg/L、总磷含量81.3 mg/L,研究所采用的生物乙醇废水均为经上述预处理后的废水。木薯粉购自广东省揭阳市,木薯粉和废水以1:4 (质量体积比)混合,采用双酶法水解。采用的α-淀粉酶(3 700 U/g)、糖化酶(80 000 U/g)购于北京奥博星生物科技有限公司。生物乙醇废水-木薯粉水解液制备过程如下:(1) 糊化:称取适量木薯粉按1:4 (质量体积比)与适量生物乙醇废水混合,调匀后将pH调至6.0,在95 °C糊化30 min;(2) 液化:调节糊化液pH至6.5,在70 °C下,加入适量氯化钙溶液使其最终浓度为0.4 mol/L,加入适量α-淀粉酶(160 u/g)搅拌2 h;(3) 糖化:加入适量糖化酶 (300 u/g),65 °C下搅拌4 h;(4) 4 000 r/min离心10 min,上清液0.691×105 Pa灭菌20 min后保存备用。得到的水解液用原废水稀释至所需初始还原糖浓度(10、20、30、40和50 g/L)。 1.2 实验方法 1.2.1 菌种的驯化和筛选: 取在YEPD液体培养基中生长28 h的R. toruloides菌种,5 000 r/min离心10 min,用无菌生理盐水洗涤一次,以10% (体积比)接种量接种至生物乙醇废水(27 930 mg/L)中,28 °C、180 r/min培养72 h;取废水培养液以10% (体积比)接种量再次接种于生物乙醇废水中培养72 h;如此反复5次,取0.1 mL乙醇废水培养液,稀释合适倍数,进行平板涂布,28 °C培养,挑选一菌落圆且大的单菌落,得到驯化菌株,暂定名为R.toruloides D5。将驯化菌株与原菌株接种于YEPD种子培养基中,28 °C、180 r/min培养28 h,以10% (体积比)的接种量接种于乙醇废水中,每隔24 h取样,测定生物量浓度和COD,比较驯化前后菌株的生长情况和COD降解效率。 1.2.2 废水初始COD对驯化菌株生长的影响: 将驯化菌株在种子培养基中培养28 h后,取一定体积的种子液于5 000 r/min离心10 min,用无菌生理盐水洗涤一次后,重新悬浮于与种子液等量体积的生理盐水中,以10% (体积比)的接种量接种于生物乙醇废水(COD浓度为27 930 mg/L)和稀释3倍的生物乙醇废水(COD浓度为9 310 mg/L)中,28 °C、 180 r/min培养120 h。每24 h取样测定生物量浓度、COD浓度和残留还原糖浓度,比较初始COD浓度对菌株生长活性的影响。 1.2.3 初始还原糖浓度对酵母生长、产油和废水处理效果的影响: 将驯化菌株制备成28 h种子液于 5 000 r/min离心10 min,用无菌生理盐水洗涤一次,接种于1.1.3中制备的不同初始还原糖浓度的生物乙醇废水-木薯粉水解液中,28 °C、180 r/min培养120 h,每24 h取样测定还原糖浓度、COD和生物量浓度,发酵结束后离心,测定发酵残液中的氮、磷含量。 1.3 分析方法还原糖测定采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[12];生物量浓度测定取30 mL菌液,于4 000 r/min离心5 min,用等量蒸馏水洗涤2次,得到的湿菌体在104 °C烘干至恒重,生物量浓度表示为单位体积(1 L)的菌液中所得的干菌体重量(g),即生物量浓度(g/L)=干菌 重(g)/发酵液体积(L);油脂提取采用酸热法[13],油脂浓度表示为单位体积(1 L)菌液中所得的油脂量(g),油脂浓度(g/L)=油脂重(g)/发酵液体积(L),油脂含量=油脂浓度/生物量浓度×100%;COD通过重铬酸钾法测定,COD降解率=(1−发酵液终COD/废水初始COD)×100%,其中发酵液初始COD浓度为废水引入发酵液的COD浓度,不计算外加碳源引入的COD浓度。外源添加可发酵糖时,先监测发酵液还原糖变化,待还原糖耗尽时(约为1−2 g/L)开始监测COD浓度,为了评估对废水COD的总处理效果,计算COD降解率时未减去残余还原糖引入的COD;培养基上清液总氮通过凯氏定氮法测定[14],总氮降解率=(1−残余氮浓度/废水初始氮浓度)×100%;培养基上清液总磷采用钼酸铵比色法测定(GB 11893-89),总磷降解率=(1−残余磷浓度/废水初始磷浓度)×100%。
2 结果与分析 2.1 驯化菌株与原始菌株在生物乙醇废水中生长性能比较实验比较了驯化5个循环后,通过涂布法筛选得到的菌株与原始菌株在废水中的生长趋势,结果如图 1所示。由图 1可见,原始菌株和驯化菌株在废水中生长时,均表现出24 h的延迟期,此后驯化菌株生物量浓度迅速增加超过原始菌株。在废水中发酵120 h后,驯化菌株的最终生物量浓度较未驯化菌株提高了123.5%。原始菌株实验组达到的最终COD降解率为43.0%,驯化菌株实验组为75.0%。原始菌株和驯化菌株对还原糖的消耗相差并不大,在发酵开始后的48 h内迅速消耗,之后消耗速度缓慢,说明菌株可能优先利用还原糖中的某种糖,最终发酵液中还原糖剩余量均为0.5−1.0 g/L。但COD降解率和生物量相差很明显,说明这两种菌株对废水中其他有机物的消耗能力有所差别。暂将此菌株命名为R.toruloides D5,在以下的生物乙醇废水处理实验中均采用此驯化菌株。
|
|
图 1 原始菌株与驯化菌株COD降解率、生长曲线和糖消耗曲线比较
Figure 1 Time course of COD degradation ratio, biomass concentration and reducing sugar concentration of the original and domesticated strains
注:O:原始菌株;D:驯化菌株. Note: O: original strains; D: domesticated strains. |
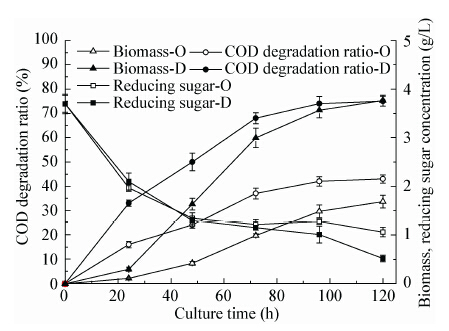
试验比较了R. toruloides D5在原始废水和稀释3倍的废水中发酵时,生物量浓度、COD降解率和残糖含量变化,结果如图 2所示。以原始废水为培养基发酵得到更高的生物量浓度3.8 g/L,采用稀释3倍后的废水培养最终生物量浓度仅为1.6 g/L,是采用原始废水培养所得生物量浓度的41.6%。可见在试验选取的COD范围内随着初始COD升高,酵母生长速率提升,相同时间内得到更高的生物量浓度。从COD的变化趋势也可以看出,无论废水稀释与否,驯化菌株均能迅速降解废水中有机物,且因在COD浓度高的废水中,积累的菌体数量较多,降解的COD负荷也大大增加,原始废水中被降解的COD为20 948 mg/L,COD降解率达到75.0%,稀释后废水最终的COD降解率也可达到69.0%,但被降解的COD仅为6 424 mg/L,故后续实验采用原始废水进行培养基制备。由还原糖监测曲线可知,稀释3倍的废水中还原糖消耗趋势与未稀释废水趋势相似,在发酵开始后的48 h内迅速消耗,之后消耗速度缓慢,最终还原糖浓度低至0.5 g/L左右便不再下降,进一步证明菌株可能优先利用还原糖中的某种糖。
|
|
图 2 初始COD浓度对驯化菌株COD降解率、生长曲线和还原糖消耗的影响
Figure 2 Time course of COD degradation ratio, biomass concentration and reducing sugar concentration of the domesticated strains in the bioethanol wastewater medium with different initial COD
注:1:采用原始废水培养,即初始COD=27 930 mg/L;1/3:采用稀释3倍的废水培养,即初始COD=9 310 mg/L. Note: 1: original wastewater with COD of 27 930 mg/L; 1/3: diluted wastewater with COD of 9 310 mg/L. |
实验考察了生物乙醇废水-木薯粉水解液发酵培养基初始还原糖浓度在10−50 g/L范围内变化时对R. toruloides D5生物量浓度积累、产油和废水COD降解的影响,以找到适合的初始碳源浓度。
如图 3所示,当初始还原糖浓度≤30 g/L时,培养48 h后,生物量浓度随着初始还原糖浓度的升高而升高。与高初始还原糖浓度(40 g/L和50 g/L)相比,酵母在低糖浓度下生长,没有明显的延迟期。在接种后即进入对数生长期,生物量迅速积累。而在高初始还原糖浓度(40 g/L和50 g/L)下出现的延迟期现象可能是由于高糖浓度下发酵液渗透压增加,对酵母的生长具有一定的抑制作用,在前期研究中对圆红冬孢酵母Y4的研究表明,当糖浓度高于40 g/L时,比生长速率出现下降[15]。由各糖浓度下培养液中残糖的变化曲线(图 4)可见,在糖未耗尽时,生物量积累迅速,而在糖耗尽后酵母利用废水中的有机物为替代碳源生长,生物量浓度增长速率变缓。

|
| 图 3 不同初始还原糖浓度下生物量浓度变化曲线 Figure 3 Time course of the biomass concentration under different initial reducing sugar concentration |
|
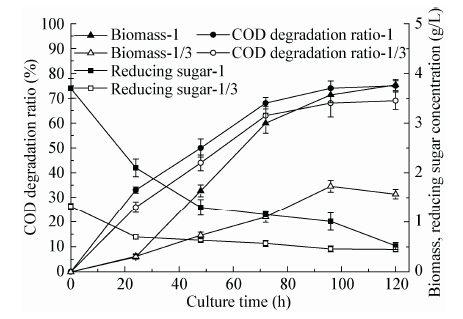
| 图 4 不同初始还原糖浓度下培养液残糖变化曲线 Figure 4 Time course of the reducing sugar concentration under different initial reducing sugar concentration |
图 5描述了在不同初始还原糖浓度下废水COD的降解规律。结果表明:糖浓度由10 g/L升至40 g/L时,对最终的COD降解率没有明显影响,均达到70%左右。初始还原糖浓度为10、20和 30 g/L时,达到最高COD降解率的时间均为120 h左右。而糖浓度升高至40 g/L后,在192 h才达到最高COD降解率。当初始还原糖浓度升高至50 g/L时,发酵192 h后废水中仍有高达6 g/L的还原糖剩余,故实验未测定该实验组COD降解率。由以上实验结果分析可得,当初始还原糖浓度在合适范围内时(10−30 g/L),R.toruloides D5能利用培养基中的糖成分迅速生长,积累的生物量浓度随着糖浓度的升高而升高。以糖耗尽时生物量浓度为横坐标,废水COD降解平均速率[mg/(L·d)]为纵坐标作图(图 6),可以看出在一定范围内(生物量浓度≤14 g/L时)发酵液中生物量浓度与COD降解平均速率成正相关。当糖耗尽后,R.toruloides D5开始降解废水中的有机物,虽然低糖实验组糖耗尽所用的时间较少,但是积累的细胞量也较少,故降解相同量有机物所用的时间较长。反之,糖浓度升高后,积累的生物量增加,降解废水中有机物所用时间变短,故造成了不同初始还原糖浓度下发酵时,几乎同时达到最高COD降解率。而当糖浓度升高至40 g/L以上时,酵母生长表现出明显的延迟期,使得耗尽废水中的糖花费了更长的时间,以致延迟了废水中有机物的降解。
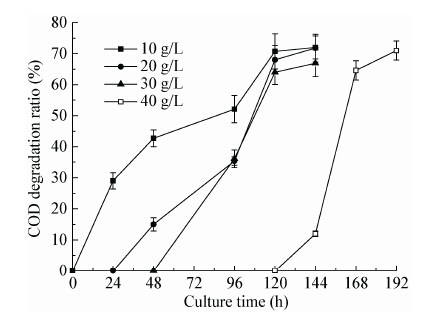
|
| 图 5 不同初始还原糖浓度下培养液COD降解率变化曲线 Figure 5 Time course of the COD degradation ratio under different initial reducing sugar concentration |

|
| 图 6 发酵液糖耗尽时生物量浓度与COD降解平均速率的关系 Figure 6 The relationship of biomass concentration and average COD degradation rate when the reducing sugar was exhausted |
表 1列出了不同初始还原糖浓度下得到最终生物量浓度、油脂含量、油脂浓度以及N、P的去除率等。由表 1中的结果可以看出,随着碳源浓度的升高,油脂含量显著提高,油脂浓度也得到了明显提高。在初始还原糖浓度为40 g/L时获得最高的油脂浓度,但是发酵所需时间延长至192 h。当初始还原糖浓度升高至50 g/L时,生物量浓度反而出现下降,可能是因为当时培养基中的碳氮比升高,不利于生物量的积累,但促进了油脂积累,使最终所得的油脂浓度与初始还原糖浓度为40 g/L的实验组相近,此结果与前期的研究结果相似[15]。各实验组最终总N、P的去除效率均较高,分别达到99%以上和92%以上,说明此工艺可以有效地去除废水的含N和P化合物。
|
还原糖浓度 Reducing sugar concentration (g/L) |
生物量浓度 Biomass concentration (g/L) |
油脂含量 Lipid content (%) |
油脂浓度 Lipid concentration (g/L) |
COD降解率 COD degradation ratio (%) |
总氮降解率 TN removal ratio (%) |
总磷降解率 TP removal ratio (%) |
| 10 | 7.4±0.3 | 23.4±2.8 | 1.73±0.19 | 72.0±3.7 | 99.4±2.3 | 92.9±4.2 |
| 20 | 15.3±0.9 | 19.5±2.6 | 2.99±0.40 | 71.8±4.4 | 98.2±1.6 | 92.8±2.1 |
| 30 | 19.4±1.0 | 18.5±2.3 | 3.59±0.35 | 66.9±4.3 | 99.7±3.6 | 96.9±2.0 |
| 40 | 23.6±1.0 | 28.7±1.7 | 6.77±0.37 | 71.0±3.1 | 99.6±2.0 | 97.4±4.7 |
| 50 | 15.7±0.8 | 40.8±2.9 | 6.40±0.22 | − | 99.1±5.2 | 96.1±3.4 |
生物乙醇废水中含有残余的糖类和产乙醇微生物的代谢产物[16],其中糖类(如葡萄糖)和有些代谢产物(如琥珀酸、乳酸、丙酮酸等)可以作为替代碳源和能源,但是有些代谢产物可能会抑制产油酵母的生长,如糠醛、乙酸等[17, 18]。从本研究试验结果发现,驯化菌株与原始菌株对废水中还原糖的消耗能力相差不大,还原糖在发酵开始的48 h内消耗较快,后消耗缓慢,可能因为废水中的还原糖不是单一糖类,如有研究表明木薯淀粉水解液中主要含有葡萄糖,还含有少量的麦芽糖和麦芽三糖等[19],而酵母可能优先利用其中葡萄糖,如产油酵母Y1和小球藻(Chlorella vulgaris)利用葡萄糖和麦芽糖发酵产油时优势碳源是葡萄糖[20, 21]。在生物乙醇废水中培养R.toruloides 2.1389的实验结果表明其虽能在高浓度生物乙醇废水中生长,但生物量增长缓慢且最终的COD降解率较低,仅能达到40%左右。用特定基质进行微生物驯化是获得适应该特定环境优势菌株的有效方法。Rao等[22]在研究Candida tropicalis利用玉米纤维和甘蔗渣的水解液发酵获得木糖醇的研究中,将该菌用水解液进行多次驯化,使得该菌在水解液中的木糖醇产率由0.45 g/g提高到0.58 g/g。在玉米秸秆水解液环境中对R.toruloides 2.1389进行驯化,经过5个循环后,该菌株在玉米秸秆水解液中的生物量浓度从6.9 g/L增至12.5 g/L[15]。在本研究中,采用高浓度木薯生物乙醇有机废水对R.toruloides 2.1389进行驯化也取得了明显效果,相同条件下培养,驯化菌株生物量浓度是原始菌株的2.2倍、废水最终COD降解率提升了74.4%,而驯化前后菌株对还原糖的消耗相差不大,这说明驯化菌株对废水中非还原糖类的有机物消耗能力比原始菌株明显增强。这些结果证明了筛选得到优势菌株R.toruloides D5适应生物乙醇废水环境,采用该菌株进行废水处理可减少生产中的稀释环节,提高生产效率,降低生产成本。
有机废水初始COD浓度对于微生物生长和COD降解率有显著影响,本研究的结论与采用红薯生物乙醇废水培养产油酵母时相似,随着废水初始COD的升高,生物量浓度和COD降解率也逐步提高[8]。而与味精废水培养粘红酵母结果不同,粘红酵母在COD为20 000 mg/L的味精废水中生长受到明显抑制[6]。通过以上分析,本研究通过在高浓度的生物乙醇废水中驯化筛选得到的菌株性能优良,能够耐受高浓度COD。在试验范围内,废水的COD浓度越高,生物量积累越迅速,降解废水中有机物负荷越大。这为通过产油微生物回收废水中的资源奠定了良好的基础。
生物乙醇废水碳氮比偏低,不利于产油微生物体内油脂积累,可将生物乙醇废水和廉价碳源发酵生产微生物油脂过程整合,实现两种廉价资源的营养互补。生物乙醇废水-廉价碳源混合培养基中碳源浓度影响培养基的碳氮比,从而对酵母生长和产油产生重要影响[11, 23]。引入易被酵母利用的碳源与废水中存在的多种非优势碳源共存,也会影响酵母胞内酶的活性变化[24, 25]。如有些酵母在葡萄糖存在下会使替代碳源代谢途径涉及的酶活性降低,甚至失活,待培养基中的葡萄糖耗尽后才启动替代碳源代谢途径[26]。已有研究报道表明向废水培养基中添加葡萄糖等作为补充碳源培养产油微生物,COD降解率明显下降[7, 27],本研究的实验结果表明,采用木薯生物乙醇废水和木薯粉制备的培养液初始还原糖浓度不超过30 g/L,可以在保证高COD降解率和N、P去除率的前提下,获得较高的生物量浓度和油脂产量(分别为19.2 g/L和3.59 g/L),培养密度比以废水为唯一培养基提高了4倍,实现了微生物油脂生产和高浓度生物乙醇废水处理过程的有机整合。木薯粉为非粮食作物,且在木薯生物乙醇工厂中,相应的生产设备齐全、技术成熟,容易实现技术的整合。
4 结论本研究通过驯化筛选,得到一株能耐受高浓度木薯生物乙醇废水的优势菌株,驯化菌株生物量浓度和COD降解率比原始菌株增高了119.7%和74.4%,采用该菌株处理高浓度生物乙醇废水可省去稀释环节,降低生产成本。木薯生物乙醇废水-木薯粉水解液发酵时,控制初始还原糖浓度低于 30 g/L时,生物量浓度和油脂浓度随初始还原糖浓度的升高而升高,均在120 h时达到最高COD降解率,初始还原糖浓度对最终达到的最大COD降解率无明显影响,废水N、P去除率分别达到99%和92%以上,此廉价碳源与高浓度生物乙醇废水制备的混合培养基具有开发为培养产油微生物廉价培养基的潜力。
| [1] | Niu JT, Tao M, Jin BD. Investigation on circular economy in alcohol production[J]. Liquor-making Science & Technology, 2010(6): 108-112 (in Chinese) 钮劲涛, 陶梅, 金宝丹. 酒精生产中的循环经济探讨[J]. 酿酒科技, 2010(6): 108-112 |
| [2] | Nie YB, Wang N, Cao J. A project example on alcoholproduction wastewater deep treatment and reuse[J]. China Brewing, 2008(22): 68-70 (in Chinese) 聂英斌, 王楠, 曹静. 酒精废水深度处理和回用工程探讨[J]. 中国酿造, 2008(22): 68-70 |
| [3] | Yousuf A, Sannino F, Addorisio V, et al. Microbial conversion of olive oil mill wastewaters into lipids suitable for biodiesel production[J]. Journal of Agricultural and Food Chemistry, 2010, 58(15): 8630-8635 |
| [4] | Minkevich IG, Dedyukhina EG, Chistyakova TI. The effect of lipid content on the elemental composition and energy capacity of yeast biomass[J]. Applied Microbiology and Biotechnology, 2010, 88(3): 799-806 |
| [5] | Papanikolaou S, Aggelis G. Lipids of oleaginous yeasts. Part II: Technology and potential applications[J]. European Journal of Lipid Science and Technology, 2011, 113(8): 1052-1073 |
| [6] | Xue FY, Zhang X, Luo H, et al. A new method for preparing raw material for biodiesel production[J]. Process Biochemistry, 2006, 41(7): 1699-1702 |
| [7] | Liu JX, Yue QY, Gao BY, et al. Microbial treatment of the monosodium glutamate wastewater by Lipomyces starkeyi to produce microbial lipid[J]. Bioresource Technology, 2012, 106: 69-73 |
| [8] | Zhou WW, Wang WR, Li YH, et al. Lipid production by Rhodosporidium toruloides Y2 in bioethanol wastewater and evaluation of biomass energetic yield[J]. Bioresource Technology, 2013, 127: 435-440 |
| [9] | Zhao J, Liu YH, Wei Q. Use the alcohol waste water to produce the animal feed yeast[J]. Liquor Making, 2004, 31(6): 51-52 (in Chinese) 赵军, 刘月华, 魏群. 利用酒精废水生产饲料酵母[J]. 酿酒, 2004, 31(6): 51-52 |
| [10] | Liu JL, Yao YM, Yang LS. On production of feed yeast from alcohol distillation wastewater by mixed cultivation of double Candida utilis[J]. Cereal & Feed Industry, 2005(11): 30-31,34 (in Chinese) 刘建龙, 姚源明, 杨连生. 双株酵母混合培养处理酒精蒸馏废水生产饲料酵母的研究[J]. 粮食与饲料工业, 2005(11): 30-31,34 |
| [11] | Li YH, Liu B, Zhao ZB, et al. Optimized culture medium and fermentation conditions for lipid production by Rhodosporidium toruloides[J]. Chinese Journal of Biotechnology, 2006, 22(4): 650-656 (in Chinese) 李永红, 刘波, 赵宗保, 等. 圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究[J]. 生物工程学报, 2006, 22(4): 650-656 |
| [12] | Miller GL. Use of dinitrosalicylic acid reagent for determination of reducing sugars[J]. Analytical Chemistry, 1959, 31: 426-428 |
| [13] | Li ZF, Zhang L, Shen XJ, et al. A comparative study on four method of fungi lipid extraction[J]. Microbiology China, 2001, 28(6): 72-75 (in Chinese) 李植峰, 张玲, 沈晓京, 等. 四种真菌油脂提取方法的比较研究[J]. 微生物学通报, 2001, 28(6): 72-75 |
| [14] | Huang WK. Food Safety Verification and Analysis[M]. Beijing: China Light Industry Press, 2000: 53-54 (in Chinese) 黄伟坤. 食品检验与分析[M]. 北京: 中国轻工业出版社, 2000: 53-54 |
| [15] | Li YH. Lipid production by Rhodosporidium toruloides[D]. Dalian: Doctoral Dissertation of Dalian University of Technology, 2007 (in Chinese) 李永红. 圆红冬孢酵母菌油脂发酵研究[D]. 大连: 大连理工大学博士学位论文, 2007 |
| [16] | Yuan WJ, Kong L, Zi LH, et al. Simultaneous determination of ethanol, sugar and organic acids in Kluveromyces marxious broth by high performance liquid chromatography- ultraviolet/refractive index detector[J]. Chinese Journal of Analytical Chemistry, 2009, 37(6): 850-854 (in Chinese) 袁文杰, 孔亮, 孜力汗, 等. 高效液相色谱法测定克鲁维酵母菊芋发酵液中的乙醇,糖和有机酸类代谢成分[J]. 分析化学, 2009, 37(6): 850-854 |
| [17] | Tao F, Liu XJ, Fang WM, et al. Effect of by-products on ethanol fermentation by Zymomonas mobilis[J]. Food and Fermentation Industries, 2004, 30(7): 87-89 (in Chinese) 陶飞, 刘小杰, 方维明, 等. 副产物对运动发酵单胞菌酒精发酵的影响[J]. 食品与发酵工业, 2004, 30(7): 87-89 |
| [18] | Qi F, Kitahara Y, Wang Z, et al. Novel mutant strains of Rhodosporidium toruloides by plasma mutagenesis approach and their tolerance for inhibitors in lignocellulosic hydrolyzate[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(5): 735-742 |
| [19] | Wei A, Zhang X, Wei D, et al. Effects of cassava starch hydrolysate on cell growth and lipid accumulation of the heterotrophic microalgae Chlorella protothecoides[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(11): 1383-1389 |
| [20] | Liu X, Wang H, Ruan RS, et al. Influence of different carbon sources on Chlorella vulgaris growth and oil content[J]. Modern Chemical Industry, 2012, 32(10): 66-69 (in Chinese) 刘茜, 王辉, 阮榕生, 等. 不同碳源对小球藻(Chlorella vulgaris)生长及含油量的影响[J]. 现代化工, 2012, 32(10): 66-69 |
| [21] | Ma Y, Men ZH. Selection of carbon source and nitrogen source for high-yield medium for one oleaginous yeast[J]. Journal of Anhui Agricultural Science, 2011, 39(13): 8039-8041 (in Chinese) 马勇, 门中华. 一株产油酵母菌高产培养基的碳源和氮源选择[J]. 安徽农业科学, 2011, 39(13): 8039-8041 |
| [22] | Rao RS, Jyothi CP, Prakasham RS, et al. Xylitol production from corn fiber and sugarcane bagasse hydrolysates by Candida tropicalis[J]. Bioresource Technology, 2006, 97(15): 1974-1978 |
| [23] | Turcotte G, Kosaric N. The effect of C/N ratio on lipid production by Rhodosporidium toruloides ATCC 10788[J]. Biotechnology Letters, 1989, 11(9): 637-642 |
| [24] | Carlson M. Glucose repression in yeast[J]. Current Opinion in Microbiology, 1999, 2(2): 202-207 |
| [25] | Gancedo JM. Yeast carbon catabolite repression[J]. Microbiology and Molecular Biology Reviews, 1998, 62(2): 334-361 |
| [26] | Casal M, Paiva S, Queirós O, et al. Transport of carboxylic acids in yeasts[J]. FEMS Microbiology Reviews, 2008, 32(6): 974-994 |
| [27] | Xue FY, Miao JX, Zhang X, et al. Studies on lipid production by Rhodotorula glutinis fermentation using monosodium glutamate wastewater as culture medium[J]. Bioresource Technology, 2008, 99(13): 5923-5927 |
 2015, Vol. 42
2015, Vol. 42