扩展功能
文章信息
- 孙丽璠, 朱凌峰, 侯剑峰, 王艳萍
- SUN Li-Fan, ZHU Ling-Feng, HOU Jian-Feng, WANG Yan-Ping
- 芽孢杆菌P38中乳酸脱氢酶对其产L-乳酸光学纯度的影响
- Effect of lactate dehydrogenases on the optical purity of L-lactic acid produced in Bacillus sp. P38
- 微生物学通报, 2015, 42(8): 1425-1432
- Microbiology China, 2015, 42(8): 1425-1432
- 10.13344/j.microbiol.china.140883
-
文章历史
- 收稿日期: 2014-11-06
- 接受日期: 2015-02-03
- 优先数字出版日期(www.cnki.net): 2015-03-11
2. 中国科学院微生物研究所 北京 100101
2. Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
乳酸(Lactic acid)是一种能够由可再生碳水化合物转化而来的重要平台化合物,又名丙醇酸[1]。目前已广泛应用于食品、医药、轻工、化工等行业,但其最重要的工业应用是用于合成生物可降解材料——聚乳酸[2]。聚乳酸具有良好的生物相容性和降解性,是理想的绿色高分子材料,具有巨大的市场空间,有望替代石油基塑料产品[3]。因此,高光学纯L-乳酸的生产与应用已成为令人关注的重要研究方向之一。
微生物发酵法生产乳酸的技术已经取得重要进展,并成为乳酸商业化生产的主导技术。自然界中许多微生物都能利用还原糖发酵产生乳酸。单糖尤其是葡萄糖可作为碳源和能源,经EMP途径降解生产丙酮酸,丙酮酸又进一步在乳酸脱氢酶(LDH)的作用下生成乳酸[4]。产D,L-乳酸的乳杆菌中存在L和D两种依赖NAD的LDH,分别催化丙酮酸生成L-乳酸和D-乳酸[5]。
目前,乳酸生产菌株主要分为两类,一类是霉菌中的米根霉(Rhizopus oryzae),另一类是细菌中的乳酸菌(lactic acid bacteria,LAB)。乳酸菌是一类能利用可发酵碳水化合物产大量乳酸的细菌的通称。最早LAB的定义为:革兰氏阳性,无芽孢,接触酶为阴性,缺细胞色素,不好氧,耐酸,营养要求复杂,专性发酵糖,乳酸为其主要终产物等。随着细菌分类学的不断发展,又发现了一些新的、并不完全符合以上限定的LAB,如芽孢乳杆菌属和少数芽孢杆菌属[6]。米根霉发酵能量消耗大,糖酸转化率较低,而LAB中的芽孢杆菌具有营养要求简单、产酸速度快、发酵温度高(50−60°C)、可实现开放式发酵、适应低pH条件,以及生产成本低等优点,逐渐受到重视[7]。Tiina等比较了凝结芽孢杆菌(Bacillus coagulans) SIM-7 DSM 14043与德氏乳杆菌Lactobacillus delbrueckii ssp. lactics DSM 20073生产L-乳酸的发酵条件,结果表明Bacillus coagulans SIM-7 DSM 14043对氮源要求低,能够生成高光学纯度的L-乳酸,产酸速度快,L-乳酸的浓度在21−22 h达到91.6 g/L,发酵温度可达到65°C[8]。本研究所用的菌株Bacillussp. P38是一株可耐受糠醛产L-乳酸的芽孢杆菌,并且可以同时利用葡萄糖和木糖产L-乳酸。利用玉米芯水解液为唯一碳源时,L-乳酸发酵水平超过180 g/L,生产强度达到2.4 g/(L·h),糖酸转化率达到96%,光学纯度大于99%。其发酵水平、生产强度、转化率在已报道的结果中均处于领先地位[9]。目前,该菌株产高光学纯L-乳酸的机理尚不清楚。
本研究以产高光学纯L-乳酸生产菌株Bacillussp. P38为研究对象,通过关键酶异源表达、纯化与酶学特性分析,结合Native-PAGE、实时荧光定量PCR等生物学方法,系统地研究了该菌合成高光学纯L-乳酸的机理。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒:Bacillussp. P38保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC),保藏登记号为CGMCC No. 7312,由中国科学院微生物生理与代谢工程重点实验室(中国科学院微生物研究所)提供。植物乳杆菌L. plantarum ssp. plantarum DSM 20174购自德国微生物菌种保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH,DSMZ)。大肠杆菌Escherichia coli DH5α、E. coli BL21(DE3)购自天根生化科技(北京)有限公司。表达载体pET-28a为本实验室保存。重组质粒pET-28a-ldhL、pET-28a-ldhD、pET-28a-ldhM/L为本研究构建,分别含有来自Bacillussp. P38的L-乳酸脱氢酶基因、D-乳酸脱氢酶基因和苹果酸/L-乳酸脱氢酶基因。
1.1.2 培养基及培养条件:Bacillussp. P38接种于种子培养基(g/L,葡萄糖50,酵母浸出粉10,碳酸钙30)中,45°C、150 r/min摇床培养。L. plantarum ssp. plantarum DSM 20174接种于MRS培养基中,30°C静置培养。含有重组质粒的大肠杆菌接种于LB培养基(含40 mg/L卡那霉素)中,37°C、180 r/min摇床培养。培养基配方参照文献[10]。 1.1.3 主要仪器和试剂:限制性内切酶、T4连接酶、ExTaq酶、Real-time PCR试剂盒等均购自Takara公司。RNA反转录试剂盒、基因组提取试剂盒购自天根生化科技(北京)有限公司。质粒小提试剂盒、纯化试剂盒、RNA提取试剂盒购自美国Omega Biotek公司。Ni-Agarose His标签蛋白纯化试剂盒购自康为世纪有限公司。 1.2 方法 1.2.1 目的基因的克隆和表达:Bacillussp. P38全基因组序列信息(GenBank登录号:JSVI01000000)显示,该菌株具有3个与乳酸代谢相关的基因:ldhL、ldhD和ldhM/L,分别编码L-乳酸脱氢酶(L-LDH)、D-乳酸脱氢酶(D-LDH)和苹果酸/乳酸脱氢酶(M/L-LDH)。根据基因组信息设计引物(表1),使用pfuDNA聚合酶分别扩增得到3个基因。将基因片段经合适的限制性内切酶酶切后连接到表达载体pET-28a上,构建得到重组质粒pET28a-ldhL、pET28a-ldhD、pET28a-ldhM/L,重组质粒经双酶切并测序验证正确后分别转化到E. coli BL21 (DE3)中。| 目的基因 Target gene |
序列 Sequence (5′→3′) |
| ldhL扩增引物 ldhL amplification primer |
GGGCCATGGGCAGCAGCCATCATCATCATCATCACATGAAAAAACTCAATCGTATTGCAG CCGCTCGAGCAATACCGGTGCCATCGTTTC |
| ldhD扩增引物 ldhD amplification primer |
GGGCCATGGGCAGCAGCCATCATCATCATCATCACATGAGAAAAGTTGTTGCCTATGAGACG CCGCTCGAGTGATTTTATCTCCCACCTGCTC |
| ldhM/L扩增引物 ldhM/L amplification primer |
GGGCCATGGGCAGCAGCCATCATCATCATCATCACGTGAAAAAGACAAAATTAGTAGTTGC CCGCTCGAGCGATTTTCCGGTTTTTACCGATGCC |
| ldhL Real-time PCR引物 ldhL Real-time PCR primer |
CGGCAGTATTGTTGCGAAA ACTACGGCACCACGGGAAC |
| ldhD Real-time PCR引物 ldhD Real-time PCR primer |
AAGGCGATTATTCCGATTGC ACTGTCCCCGAACCGATAAC |
| ldhM/L Real-time PCR引物 ldhM/L Real-time PCR primer |
TGCTTTTGATGTCCTGAATGGG GCCGATGACACTTGGTATGCTTA |
| 16S rRNA基因 16S rRNA gene |
TGGTCTGTAACTGACGCTGAGG GGGAGGTCAGAGGATGTCAAGA |
分别将含3种重组载体的E. coli BL21(DE3)以1%接种量接种到LB液体培养基中(含40 mg/L卡那霉素),37°C、180 r/min振荡培养。当OD600达到0.6−0.8时,加入终浓度为0.8 mmol/L的IPTG 16°C过夜诱导蛋白表达。
1.2.2 重组蛋白的纯化:由于重组蛋白N端含组氨酸标签His-tag,因此使用Ni-Agarose His标签蛋白纯化试剂盒纯化。菌体的超声波破碎、层析柱的平衡、可溶性蛋白的上样及杂蛋白的清洗等过程参照试剂盒手册进行。目的蛋白用2 mL Elution buffer (pH 7.9 Tris-HCl 4 mmol/L,咪唑60 mmol/L,NaCl 0.1 mol/L)洗脱并通过超滤管脱盐、浓缩后于−80°C保存。收集各阶段的洗脱液进行SDS-PAGE(13%分离胶,4%浓缩胶)电泳和考马斯亮蓝(R-250)染色分析[10]。 1.2.3 酶活测定:乳酸脱氢酶活性测定采用分光光度法,以丙酮酸钠为底物,NADH为辅酶,利用340 nm处检测NADH的减少量来表征[12]。具体反应体系(200 μL)为:磷酸缓冲液(pH 7.0) 100 mmol/L,丙酮酸钠20 mmol/L,NADH 0.2 mmol/L,酶液适量,测定温度为37°C。空白对照中不含NADH。乳酸脱氢酶的一个酶活单位(1 U)定义为:在特定条件下,每分钟内氧化1 μmol NADH所需要的酶量。
1.2.4 重组蛋白的动力学参数测定:在测得以上各酶的最适反应温度和最适pH后,在最适酶活测定条件下,以不同浓度的底物测定酶活,采用Lineweaver-Burk双倒数作图法,计算L-LDH、D-LDH、M/L-LDH对丙酮酸钠的Km值、Vmax值、Kcat值以及Kcat/Km值[13]。 1.2.5 Native-PAGE检测LDH在体内的活性:非变性聚丙烯酰胺凝胶电泳(Native-PAGE)活性染色技术用于检测Bacillussp. P38体内LDHs的活性。利用Bacillussp. P38和L. plantarum ssp. plantarum DSM 20174的粗酶液进行非变性聚丙烯酰胺凝胶梯度(4%−12%)电泳。电泳后将每条泳道切成胶条进行染色,其中Marker部分采用考马斯亮蓝法,其他部分浸泡在底物溶液中进行显色。底物溶 液组成为:100 mmol/L Tris-HCl缓冲液(pH 8.0),0.1 mmol/L氯化硝基四氮唑蓝(Nitrotetrazolium blue chloride),1 mmol/L NAD,100 mmol/L DL-乳酸钠。染色温度为室温,待酶带清晰后,用蒸馏水漂洗2−3次。 1.2.6 实时荧光定量PCR分析:实时荧光定量PCR用于分析Bacillus sp. P38中乳酸代谢相关基因在不同发酵时期(对数期、稳定期、衰亡期)的转录水平。提取P38三个发酵阶段的RNA,电泳检测样品完整性,并在260 nm波长下测定样品浓度。3个时期的RNA样品分别作为模板进行反转录生成cDNA。以16S rRNA基因为内参,用Premier 5.0软件设计Bacillus sp. P38中各关键酶编码基因和16S rRNA基因序列的高特异性引物(表1)。采用SYBR Premix Ex Taq (TaKaRa)进行实时定量PCR,每个样品做3个平行且保证3个平行的误差在15%之内。 1.2.7 分析方法:Bacillussp. P38菌体破碎粗酶液里LDHs活性是利用液相手性色谱柱检测L-乳酸和D-乳酸的产量来测定。方法如下:将20 mmol/L丙酮酸、20 mmol/L NADH以及0.1 g/L P38粗酶液在37°C孵育1 h,利用液相手性色谱柱检测L-乳酸和D-乳酸的生成量。测定条件为:手性柱流动相为2 mmol/L CuSO4,流速0.5 mL/min,柱温25°C,进样5 μL,紫外检测器检测,检测波长254 nm。发酵液中葡萄糖和L-乳酸用SBA-40C Biosensor来检测。Bacillussp. P38生长曲线采用7200 Visible Spectrophotometer在A600条件下测定。L-乳酸光学纯度的计算公式如下:| $L-乳酸光学纯度=\frac{{{\rm{(L - lactic acid) }}}}{{{\rm{(L - lactic acid)}} + {\rm{(D - lactic acid)}}}} \times 100{\rm{\% }} $ |
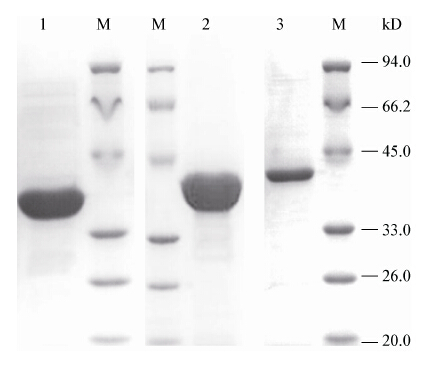
构建的重组质粒pET28a-ldhL、pET28a-ldhD、pET28a-ldhM/L经双酶切和测序验证正确后,分别转化到E. coli BL21(DE3)中进行诱导表达。由于目的蛋白携带His标签,所以通过Ni-Agarose His标签蛋白纯化试剂盒进行蛋白纯化。纯化后的蛋白利用SDS-PAGE进行检测,得到单一条带(图1),其中L-LDH为34.4 kD,D-LDH为36.3 kD,L/M-LDH为36.7 kD,与预测目的蛋白大小一致。收集纯化的蛋白进行后续的酶学性质研究。
|
| 图 1 L-LDH、D-LDH、M/L -LDH的SDS-PAGE分析 Figure 1 Analysis of purified L-LDH,D-LDH,M/L -LDH by SDS-PAGE Note: M: Protein molecular weight marker; 1: L-LDH; 2: D-LDH; 3: M/L -LDH of Bacillus sp. P38. |
在各自最适反应条件下测定L-LDH、D-LDH和M/L-LDH的动力学参数,计算其Km值、Vmax值、Kcat值以及Kcat/Km值(表2)。经检测Bacillussp. P38中乳酸代谢关键酶L-LDH、D-LDH和M/L-LDH均具有催化活性,其中L-LDH的Km值最低,为3.73±0.19。L-LDH对丙酮酸的催化效率(Kcat/Km值)为(7.98±0.80)×103,远高于D-LDH的(2.96±0.30)×103。体外酶学性质研究得出L-LDH对丙酮酸的催化效率和结合能力都比D-LDH高,初步说明了Bacillus sp. P38合成高光学纯L-乳酸的原因。
| 动力学参数 Kinetic parameter | D-LDH | L-LDH | M/L-LDH |
| Km (mmol/L) | 4.10±0.20 | 3.73±0.19 | 5.14±0.11 |
| Vmax (U/mg) | 20.270±1.800 | 50.446±1.430 | 15.300±0.830 |
| Kcat (s−1) | 12.64±1.13 | 29.78±1.37 | 9.25±0.60 |
| Kcat/Km (L/(mol·s)) | (2.96±0.30)×103 | (7.98±0.80)×103 | (1.80±0.20)×103 |
为了研究M/L-LDH的主要功能,分别检测了M/L-LDH作为L-LDH和M-LDH的活性,作为L-LDH时的酶活为2.83 U,作为M-LDH时的酶活为1.47 U。同时以苹果酸为底物进行Bacillus sp. P38全细胞Native-PAGE未检测到苹果酸脱氢酶的活性。为了证明3种酶的产物的光学性质,采用高效液相色谱方法分别对3种酶以丙酮酸为底物、NADH为辅酶时的产物进行检测。结果显示L-LDH、M/L-LDH的产物均为L-乳酸,检测不到D-乳酸。所以,M/L-LDH主要行使L-LDH的功能。同时,L-LDH的Km值(4.10±0.20)低于M/L-LDH (5.14±0.11),L-LDH对丙酮酸的催化效率(Kcat/Km)为(7.98±0.80)×103 L/(mol·s)远高于M/L-LDH (1.80±0.20)×103 L/(mol·s),值得指出的是该酶的主要功能是L-乳酸脱氢酶,其催化产物也证实不产生D-乳酸,所以该酶不会影响Bacillussp. P38菌产生乳酸的光学纯度。
2.3 体内酶活检测通过全细胞Native-PAGE对体内酶活进行了验证(图2),Bacillus sp. P38中只检测到L-LDH,而对照菌DSM 20174 (DL-乳酸生产菌)同时检测到D-LDH和L-LDH。说明Bacillussp. P38在乳酸发酵过程中D-LDH无活力或者活力很低(低于Native-PAGE的检测限),而L-LDH的活力较高。

|
|
图 2
Bacillus sp. P38 和L. plantarum ssp. plantarum DSM 20174 Native-PAGE
Figure 2
Native-Page of Bacillus sp. P38 and L. plantarum ssp. plantarum DSM 20174
注: M: Native marker. Bacillus sp. strain P38 (1) 和L. plantarum ssp. plantarum DSM 20174 (2) 以DL-乳酸钠为底物,全细胞Native-PAGE检测nLDHs. Note: M: Native marker. Active staining of nLDHs after Native-PAGE cell extracts of Bacillus sp. strain P38 (lane 1),L. plantarum ssp. plantarum DSM 20174 (lane 2),were used for the Native-PAGE. DL-Lactate was used as substrates for active staining. |
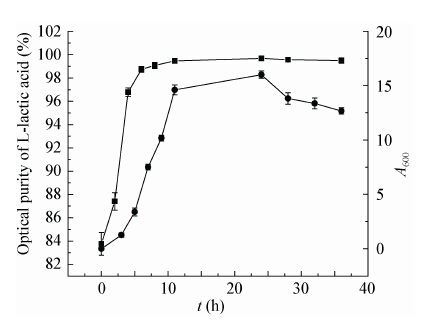
虽然通过体内酶活检测并未测定到D-LDH的酶活力,但是其D-LDH的酶活力是否在发酵过程中有所变化,从而影响了P38菌在不同培养阶段所产乳酸的光学纯度?为此我们进一步测定了Bacillussp. P38在发酵过程中合成的乳酸光学纯度的变化情况,结果如图3所示。在发酵初始阶段,培养基中L-乳酸的光学纯度只有81.1%,在对数生长期(2−11 h)内迅速增长到99.36%,稳定期(24 h)达到最大为99.60%。
|
图 3
Bacillus sp. P38生长曲线和发酵过程中光学纯度变化
Figure 3
The profile of growth curve and the change of optical purity of produced L-lactic acid by Bacillus sp. P38 during fermentations
Note:  : The growth curve of Bacillus sp. P38; : The growth curve of Bacillus sp. P38;  : Time course of optical purity of L-lactic acid produced. : Time course of optical purity of L-lactic acid produced.
|
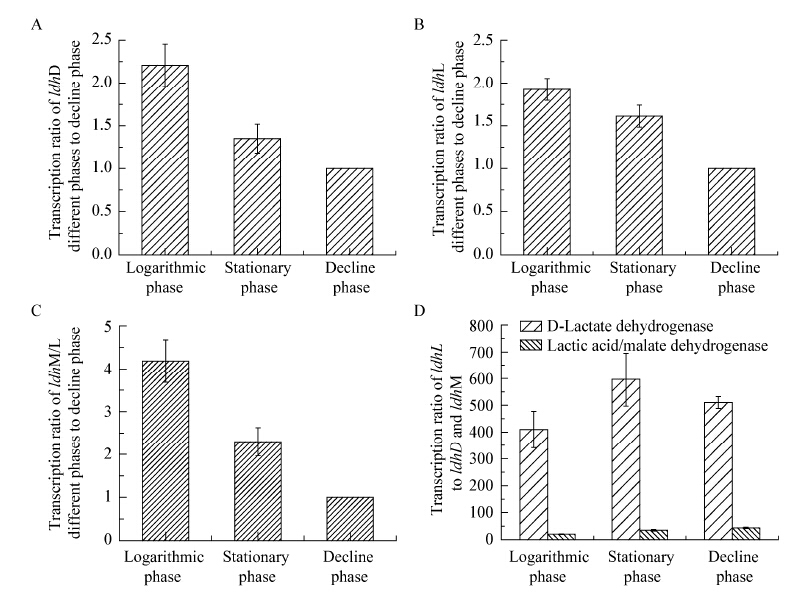
为了了解发酵过程中关键酶的表达情况,我们通过实时荧光定量PCR检测了不同时期乳酸合成相关基因的转录水平。实验数据分析采用经典的2(−ΔΔCT)法。结果如图4所示,Bacillussp. P38中ldhL在对数期的转录水平分别是ldhD和ldhM/L的409.44倍和20.23倍,在稳定期分别是ldhD和ldhM/L的506.18和26.35倍,在衰亡期分别是ldhD和ldhM/L的557.73倍和43.78倍。由于体外酶活证实M/L-LDH主要表现为L-LDH的酶活力。如果将ldhL和ldhM/L的转录水平合并与ldhD比较,在Bacillus sp. P38菌生长对数期时,L-乳酸合成相关的ldhL和ldhM/L的转录水平是D-乳酸合成相关的ldhD转录水平的429.86倍,稳定期是525.64倍,衰亡期是570.51倍。可见L-乳酸合成相关基因的转录水平在Bacillussp. P38中远远高于D-乳酸合成相关的基因,这也很好地解释了Bacillussp. P38高产光学纯L-乳酸的原因。实验结果还表明,同一种乳酸合成基因在对数期的转录水平最高,衰亡期转录水平最低,这也与所产乳酸光学纯度在发酵各阶段的变化相吻合。
|
|
图 4
RT-PCR分析L-LDH、D-LDH、M/L-LDH各发酵阶段转录水平
Figure 4
Determination of the relative transcription levels of ldhD,ldhL,and ldhM/L by RT-PCR analyses
注:不同发酵阶段ldhD (A)、ldhL (B)、ldhM/L(C)的转录水平变化;不同发酵阶段ldhD (D)和ldhM/L相对于ldhL的转录水平变化. Note: Transcript ratio of ldhD (A) different phases to decline phase in Bacillus sp. P38,ldhL (B) different phases to decline phase in Bacillus sp. P38,ldhM/L (C) different phases to decline phase in Bacillus sp. P38,ldhD (D) and ldhM/L to ldhL at different growth phases in Bacillus sp. P38. Error bars represent the standard deviations of the means of three independent experiments. |
Bacillussp. P38是一株具有代表性的产高光学纯L-乳酸的菌株,所产乳酸单体光学纯度高达99.6%。在应用中,该菌所具有的营养要求低、发酵温度高,可实现开放式发酵等优点还可以大大降低生产成本,具有工业大规模生产的潜力。本研究分别从基因、转录和蛋白水平对该菌的乳酸合成进行了比较分析,并结合体外酶学方法揭示关键酶在Bacillussp. P38中的功能,以揭示Bacillussp. P38产高光学纯L-乳酸的机理,为该菌株的工业化应用奠定理论基础。
同型乳酸发酵与异型乳酸发酵是乳酸代谢的两种途径。同型乳酸发酵中乳酸是葡萄糖代谢的唯一产物,经糖酵解途径,l mol葡萄糖可生成2 mol乳酸,理论转化率为100%。但发酵过程中微生物存在其他生理活动,实际转化率在80%以上的即认为是同型乳酸发酵。异型乳酸发酵则经由磷酸戊糖途径生成等摩尔的乳酸、二氧化碳和乙醇(或乙酸)[13]。产D,L-乳酸的乳酸菌中存在L和D两种依赖NADH的LDH,分别催化丙酮酸生成L-乳酸和D-乳酸。如果使乳杆菌的ldhD缺失,则只生产高光学纯度的L-乳酸(理论上光学纯度可达到100%),同时可以大幅提高L-乳酸产量。反之,如果使ldhL缺失则生产高光学纯度的D-乳酸[15]。赵蕊等通过重组NADH氧化酶研究了其对乳酸脱氢酶乳酸氧化活性的影响,得出在NADH经呼吸链代谢掉的生理条件下,LDH催化乳酸氧化的能力会明显提高的结论[16]。朱龙宝等通过构建过量表达乳酸脱氢酶的重组干酪乳杆菌,提高干酪乳杆菌发酵产乳酸的能力。为了进一步提高其产酸能力,添加4 mmol/L激活剂FBP和8 mg/L烟酰胺腺嘌呤二核苷酸(NADH)前体物烟酸,结果表明,重组菌L. casei pMG-ldh乳酸积累128.2 g/L,生产强度达到3.04 g/(L·h),较原始菌株L. casei分别提高了35%和53%,发酵周期缩短6 h[17]。然而,关于乳酸脱氢酶活力变化对所产乳酸光学纯度的研究国内未见报道。
本研究中Bacillussp. P38的3个乳酸代谢关键酶(L-LDH、D-LDH、M/L-DH)中L-LDH和D-LDH对丙酮酸的相对催化效率差异很大,L-LDH催化活性高于D-LDH,Km值小于D-LDH,说明不同菌株中的L-LDH和D-LDH对该菌株所产乳酸光学纯度的影响可能是催化效率的差异造成的。Native-PAGE结果表明Bacillussp. P38中只检测到L-LDH的活性,转录水平分析结果显示,ldhL的转录水平在整个发酵阶段都远远高于另外两个基因,这两个结果充分解释了Bacillussp. P38合成高光学纯L-乳酸的原因。同时ldhD的低水平转录也解释了Bacillussp. P38的产物中含有少量D-乳酸的原因。结合Bacillussp. P38各发酵阶段产物光学纯度和基因转录水平进行分析,结果表明3个乳酸代谢关键基因转录水平从对数期到衰亡期逐渐降低。对数期基因转录水平最高,与L-乳酸对数期的光学纯度一致,随后基因转录水平逐渐降低,相应的L-乳酸光学纯度趋于常数。
综上所述,尽管Bacillus sp. P38全基因组中同时编码了L-乳酸脱氢酶和D-乳酸脱氢酶,但L-乳酸脱氢酶对底物催化活性要高于D-乳酸脱氢酶,体内基本检测不到D-乳酸脱氢酶的活性。转录水平上的研究也证实,L-乳酸脱氢酶基因的转录水平远远高于D-乳酸脱氢酶基因的转录,这也初步阐明了Bacillussp. P38合成高光学纯乳酸的机理。
| [1] | Jiang X, Xue YF, Wang AY, et al. Efficient production of polymer-grade L-lactate by an alkaliphilic Exiguobacterium sp. strain under nonsterile open fermentation conditions[J]. Bioresource Technology, 2013, 143: 665-668 |
| [2] | Gao C, Ma CQ, Xu P. Biotechnological routes based on lactic acid production from biomass[J]. Biotechnology Advances, 2011, 29(6): 930-939 |
| [3] | Fan Y, Zhou C, Zhu X. Selective catalysis of lactic acid to produce commodity chemicals[J]. Catalysis Reviews, 2009, 51(3): 293-324 |
| [4] | Okano K, Tanaka T, Ogino C, et al. Biotechnological production of enantiomeric pure lactic acid from renewable resources: recent chievements, perspectives, and limits[J]. Applied Microbiology and Biotechnology, 2010, 85(3): 413-423 |
| [5] | Wang LM, Zhao B, Liu B, et al. Efficient production of L-lactic acid from corncob molasses, a waste by-product in xylitol production, by a newly isolated xylose utilizing Bacillus sp. strain[J]. Bioresource Technology, 2010, 101(20): 7908-7915 |
| [6] | Guo XH, Ling DW. Lactic Acid Bacteria Modern Research Techniques[M]. Beijing: Science Press, 2013: 4 (in Chinese) 郭兴华, 凌代文. 乳酸细菌现代研究实验技术[M]. 北京: 科学出版社, 2013: 4 |
| [7] | Wang LM, Xue ZW, Zhao B, et al. Jerusalem artichoke powder: a useful material in producing high-optical-purity L-lactate using an efficient sugar-utilizing thermophilic Bacillus coagulans strain[J]. Bioresource Technology, 2013, 130: 174-180 |
| [8] | Tiina M, Karin K, Eerik J. et al. L(+)-lactic acid producer Bacillus coagulans SIM-7 DSM 14043 and its comparison with Lactobacillus delbrueckii ssp. lactis DSM 20073[J]. Enzyme and Microbial Technology, 2007, 39(4): 861-867 |
| [9] | Peng LL, Wang LM, Che CC, et al. Bacillus sp. strain P38: an efficient producer of L-lactate from cellulosic hydrolysate, with high tolerance for 2-furfural[J]. Bioresource Technology, 2013, 149: 169-176 |
| [10] | Fan XR, Sheng P, Li GW. Microbiology Experiment[M]. Bingjing: Higher Education Press, 1999: 67-72 (in Chinese) 范秀容, 沈萍, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 1999: 67-72 |
| [11] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254 |
| [12] | Wrba A, Jaenicke R, Huber R, et al. Lactate dehydrogenase from the extreme thermophile Thermotoga maritima[J]. European Journal of Biochemistry, 1990, 188(1): 195-201 |
| [13] | Zheng Z, Sheng B, Ma C, et al. Relative catalytic efficiencies of ldhL- and ldhD-encoded products is crucial for optical purity of lactic acid produced by Lactobacillus strains[J]. Applied Environmental Microbiology, 2012, 78(9): 3480-3483 |
| [14] | Wang HY, Liu M, Wang HJ, et al. Microrganism metabolic engineering in lactic acid production[J]. The Chinese Journal of Process Engineering, 2006, 6(3): 512-516 (in Chinese) 王海燕, 刘铭, 王化军, 等. 乳酸生产中的微生物代谢工程[J]. 过程工程学报, 2006, 6(3): 512-516 |
| [15] | Li J, Tang Y, Liang FL, et al. Cloning and function analysis of L-lactate dehydrogenase gene from Lactobacillus sp. MD-1[J]. Chinese Journal of Biotechnology, 2004, 20(5): 725-729 (in Chinese) 李剑, 唐赟, 梁凤来, 等. L-乳酸脱氢酶基因克隆及功能分析[J]. 生物工程学报, 2004, 20(5): 725-729 |
| [16] | Zhao R, Huo GC. Effects of recombinant NADH oxidase on the lactate oxidation activity of lactate dehydrogenase[J]. Journal of Anhui Agriculture, 2013, 41(5): 1918-1919,1927 (in Chinese) 赵蕊, 霍贵成. 重组NADH氧化酶对乳酸脱氢酶乳酸氧化活性的影响[J]. 安徽农业科学, 2013, 41(5): 1918-1919,1927 |
| [17] | Zhu LB, Ge F, Li WZ, et al. Over-expression of lactate dehydrogenase in L. casei and fermentation property of the recombinant strain[J]. Food Science, 2013, 34(9): 245-249 (in Chinese) 朱龙宝, 葛飞, 李婉珍, 等. 过量表达乳酸脱氢酶的重组干酪乳杆菌构建及发酵性能[J]. 食品科学, 2013, 34(9): 245-249 |
 2015, Vol. 42
2015, Vol. 42