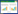扩展功能
文章信息
- 卢冬梅
- LU Dong-Mei
- 微生物合成鸟氨酸的代谢工程研究进展
- Progress in metabolic engineering for microbial synthesis of ornithine
- 微生物学通报, 2015, 42(7): 1391-1399
- Microbiology China, 2015, 42(7): 1391-1399
- 10.13344/j.microbiol.china.140716
-
文章历史
- 收稿日期: 2014-09-21
- 接受日期: 2014-11-13
- 优先数字出版日期(www.cnki.net): 2014-11-26
鸟氨酸(Ornithine,Orn)是一种不参与蛋白质生物合成的碱性氨基酸。1877年杰弗在喂养安息香酸的鸟尿水解产物液中发现了鸟氨酸,因此而得名[1]。鸟氨酸在医药和食品保健品领域中的产品开发主要集中在:(1) 可以降低异常的氨态氮浓度,参与肝脏解毒过程,有效进行肝脏保护和肝脏疾病治 疗[2],如鸟氨酸门冬氨酸复合盐和鸟氨酸苯乙酸盐。德国麦氏大药厂(Merz Pharma GmbH & Co.,KGaA)采用鸟氨酸为原料制备的天门冬氨酸鸟氨酸注射剂(Ornithine Aspartate for Injectio,商品名:雅博司),以及武汉启瑞药业有限公司采用鸟氨酸为原料制备的天门冬氨酸鸟氨酸颗粒剂(Ornithine Aspart ate Granules,商品名:瑞甘),在肝硬化、高血氨症和肝性脑病中得到临床肯定。(2) 鸟氨酸是很好的临床营养剂,可用于外伤和烧伤的恢复[3,4],如鸟氨酸α-酮戊二酸盐。(3) 促进生长激素和类胰岛素生长因子-1合成,促进能量代谢,在结合运动情况下摄食鸟氨酸可减少体内脂肪堆积,增强肌肉和体力,起到减肥保健的作用[5,6,7],如美国大众营养公司(GNC)健安喜运动系列精氨酸鸟氨酸保健片。(4) 是细胞成长因子聚胺合成的前体,有助于美肤作用,如鸟氨酸盐酸盐。(5) 能抑制多胺合成,延缓肿瘤细胞生长,是颇具前景的新型抗癌药物[8],如采用鸟氨酸为原料制备的依氟鸟氨酸,主要用于治疗脑瘤,与亚硝脲类及干扰素合用可增强疗效。在欧洲,鸟氨酸液作为膳食药物来销售,日本将鸟氨酸与肉碱、谷氨酸等作为食品调料来看待。因此鸟氨酸作为医药原料和中间体,以及多功能的保健作用而引起世人的特别关注。
随着鸟氨酸在食品工业和医药工业的应用日益广泛,产量远远不能满足市场的需求。无法大量生产和应用,而且自然界中鸟氨酸存在量少,从而市场竞争日益激烈,因此如何降低成本、提高产量成为很多研究者和生产者关注的焦点。随着基因技术的发展和成熟,利用代谢工程进行鸟氨酸高产菌株的研究已成为迫切需求。
1 微生物合成鸟氨酸的研究现状鸟氨酸的生产方法有化学合成法、酶(包括菌体)法和微生物发酵法。前两者都是以价格昂贵的精氨酸为原料,后者是以廉价碳源(葡萄糖)为原料。鸟氨酸的生产以日本为主,生产厂家主要有味之素、田道制药及协和发酵3家。目前,鸟氨酸仅在日本的市场规模就达到15亿日元,且其需求量正在不断上升。但鸟氨酸的生产却极为不易,日本在20世纪80年代末也还在采用以精氨酸为原料,经碱法水解或利用精氨酸酶水解得到鸟氨酸。发酵法生产鸟氨酸目前还未大量应用于工业化生产。因此,对微生物发酵法生产鸟氨酸的研究具有重大的理论意义和经济意义。
1957年Kinoshita等[9]首先报道了利用谷氨酸棒杆菌的瓜氨酸缺陷型或精氨酸缺陷型的突变株发酵法生产鸟氨酸。Azumalz研究小组报道了具有磺胺胍抗性的谷氨酸棒杆菌的鸟氨酸产量为30.6−35.7 g/L。他们的研究成果几乎都以专利文献的形式发表,而国内对鸟氨酸的研究最近才刚刚起步。天津科技大学食品工程学院陈宁等[10]以谷氨酸棒杆菌为出发菌株,经硫酸二乙酯、紫外线诱变,定向选育出一株鸟氨酸生产菌A1157,该菌株鸟氨酸产量达9.85 g/L。南京工业大学生物与制药工程学院万红贵等[11],考察不同碳氮源对Corynebacterium glutamicum1006发酵产鸟氨酸的影响,采用Plackett-Burman试验设计及中心复合试验设计分析法,对发酵培养基进行了优化研究,优化后的发酵培养基使鸟氨酸产量提高了44.03%。Zhang等[12]以谷氨酸高产菌S9114和谷氨酸棒杆菌GS538为出发菌株,应用原生质体融合技术,定向选育出一株鸟氨酸高产菌株RH169,该菌株L-鸟氨酸产量可达19.3 g/L。
代谢工程(Metabolic engineering)也称途径工程(Pathway engineering),是一门系统分析细胞代谢网络,对细胞代谢途径进行合理设计,并利用基因工程和分子生物学技术,对细胞代谢途径以及代谢途径调控进行改造以积累目的产物的应用学科[13]。Bailey[14]和Stephanopoulos等[15]1991年最先提出了代谢工程的概念。后基因组时代,代谢工程新方法新技术不断出现,为生物合成的应用提供了更广阔的空间,将是工业生物技术革命的下一个浪潮。Lee等[16]通过基因工程手段在argF和argI两个基因的敲除突变株上对argR基因进行敲除,并在培养基中加入适量的精氨酸,产量从argF和argI两个基因的敲除突变株的12.7 mg/L提高到19.3 mg/L。Hwang等[17]构建了argF-argR-proB三基因缺失和argCJBD过量表达的谷氨酸棒杆菌工程菌,结果鸟氨酸产量增加了30%,由12.73 mg/g细胞干重增加到16.49 mg/g细胞干重。近年来,中山大学生命科学学院Jiang等[18,19]利用代谢工程提高了谷氨酸棒杆菌的鸟氨酸产量,使工程菌发酵33 h鸟氨酸产量达到24.1g/L。
2 鸟氨酸代谢途径背景鸟氨酸的代谢途径如图1所示。
|
| 图 1 鸟氨酸的代谢途径 Figure 1 Metabolic pathway of ornithine |
鸟氨酸的合成代谢途径可分成两个阶段,第一阶段是鸟氨酸的前体物质——谷氨酸合成阶段,第二阶段是鸟氨酸合成阶段。不同微生物菌株鸟氨酸的合成代谢途径有所差异,第一阶段的合成代谢途径基本相同,而第二阶段的合成代谢途径有所不同,主要表现在N-乙酰谷氨酸合成酶和N-乙酰谷氨酸激酶的编码基因及其结构存在差异。根据酶的不同,第二阶段合成代谢途径可以分为两种,一种是线形途径[20],另一种是循环途径[21,22]。
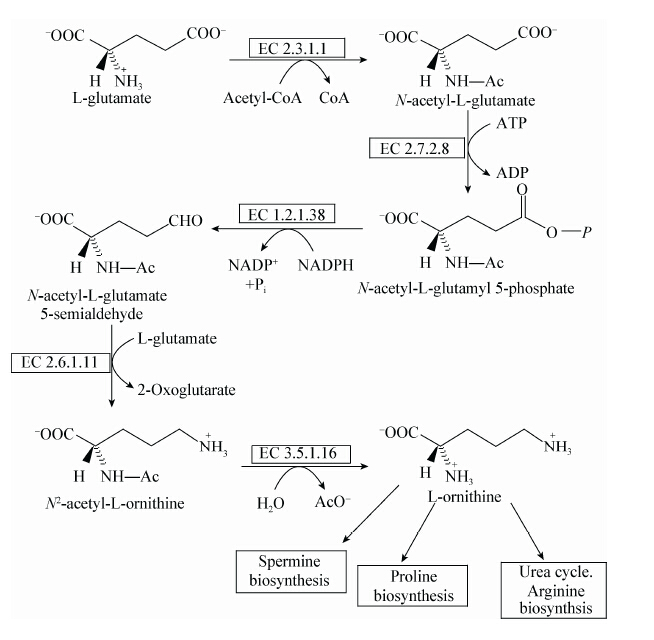
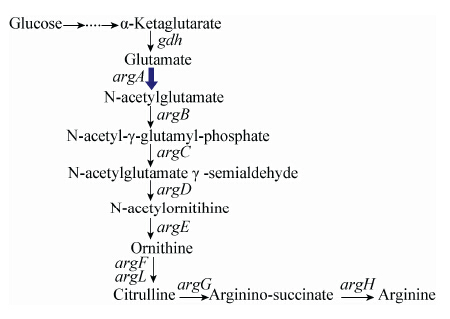
如图2所示,在线形途径中,基因argA编码的N-乙酰谷氨酸合成酶催化N-乙酰谷氨酸的合成,基因argB编码的乙酰谷氨酸激酶催化N-乙酰谷氨酸磷酸的合成。大肠杆菌[23](Escherichia coli)、假单胞铜绿菌[24](Pseudomonas aeruginosa)及古细菌中的硫化裂片菌[20](Sulfolobus solfataricus)采用线形途径。而在循环途径中(图3),基因argJ编码的N-乙酰谷氨酸合成酶催化N-乙酰谷氨酸的合成,然后在乙酰谷氨酸激酶催化下合成N-乙酰谷氨酸磷酸,在此途径中基因argB编码的乙酰谷氨酸激酶是限速酶。同时基因argJ具有双重作用,除了具有编码乙酰谷氨酸合成酶的功能,还具有编码谷氨酸N-乙酰基转移酶功能,该酶能将乙酰基转移至谷氨酸形成乙酰谷氨酸。谷氨酸棒杆菌、嗜温性古细菌、杆状脂肪嗜热菌[25](Bacillus stearothermophilus)、奈瑟氏淋球菌[26](Neisseria gonorrboeae)以及真核微生物都采用循环途径[27]。
|
| 图 2 大肠杆菌中鸟氨酸的合成代谢途径 Figure 2 Biosynthesis pathway of ornithine in Escherichia coli |
|
| 图 3 谷氨酸棒杆菌中鸟氨酸的合成代谢途径 Figure 3 Biosynthesis pathway of ornithine in Corynebaererium glutamicum |
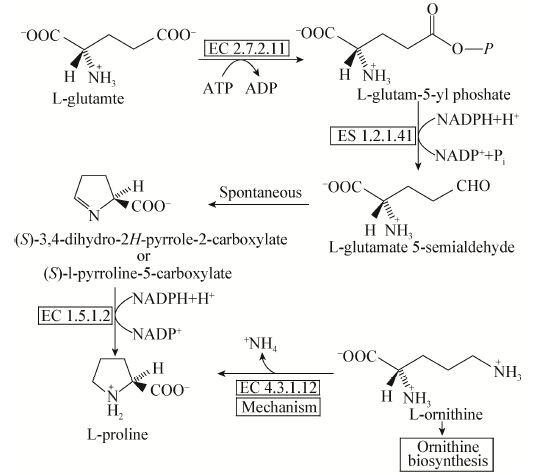
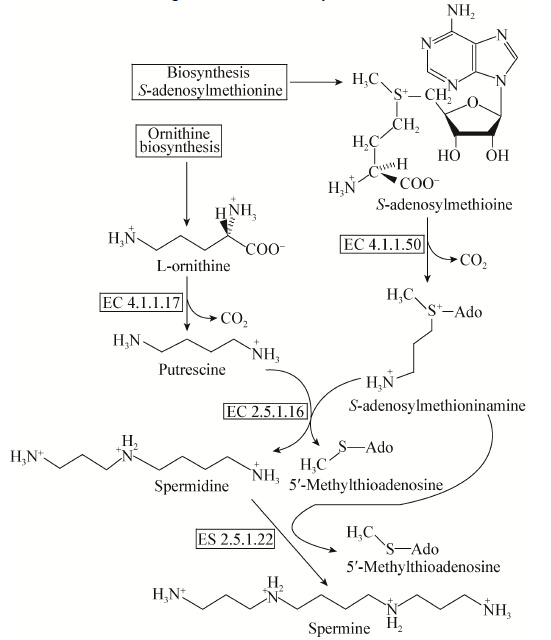
鸟氨酸的分解代谢途径有3个方向:(1) 进入尿素循环,即鸟氨酸循环,参与精氨酸的合成,如图4所示;(2) 参与脯氨酸的合成,如图5所示;(3) 参与多胺的合成,如图6所示。鸟氨酸主要分解代谢途径是尿素循环,即合成无毒的尿素,合成尿素的主要器官是肝脏,但在肾及脑中也可少量 合成。

|
| 图 4 尿素循环 Figure 4 Urea cycle |
|
| 图 5 脯氨酸合成途径 Figure 5 Proline biosynthesis |
|
| 图 6 多胺合成途径 Figure 6 Spermine biosynthesis |
通过理性分析和设计细胞代谢网络,利用代谢工程完成细胞特性改造,可以拓展细胞内现有代谢途径,改变其代谢流,提高目的代谢物的产量,提高能量代谢效率或者产生优良的遗传特征。
3.1 传统代谢工程传统代谢工程通常包括3个重要的步骤[28]:(1) 分析与修饰。通过分析细胞代谢网络,找出关键节点进行细胞途径的修饰。(2) 表型特征。采取合适的遗传改造方法,在关键节点处进行遗传改造,观察遗传改造后细胞的生理、生化和细胞代谢等表型特征。常用的方法有基因敲除、基因过量表达、基因整合、解除调控、反义RNA技术等。(3) 优化设计。对表型特征进行详细分析,根据评价结果设计进一步的修饰,从而确定新一轮的代谢工程策略。
3.1.1 阻断分解代谢途径:阻断Orn到精氨酸的分解代谢途径:Orn在基因argF编码的鸟氨酸氨甲酰转移酶催化下,生成精氨酸。利用基因敲除技术敲除argF基因,可使细胞大量积累鸟氨酸[29]。谷氨酸棒杆菌ATCC13032敲除argF基因后,鸟氨酸产量在基础培养基提高2倍,在发酵培养基提高 5−6倍。阻断Orn到多胺的分解代谢途径:Orn在鸟氨酸脱羧酶催化下,生成腐胺(Putrescine),腐胺进一步转变成亚精胺(Spermidine)及精胺(Spermine)。文献[30]报道,大肠杆菌编码鸟氨酸脱羧酶的speC基因在谷氨酸棒杆菌中表达,可明显提高腐胺的产量。在谷氨酸棒杆菌中,鸟氨酸脱羧酶基因还没有定位。腐胺在基因speE编码的亚精胺合成酶催化下,生成亚精胺。利用基因敲除技术敲除speE基因,可使细胞大量积累鸟氨酸[21]。
3.1.2 强化Orn合成代谢途径:鸟氨酸合成代谢途径,是由谷氨酸经过多步反应最后合成鸟氨酸。在大肠杆菌中,基因argA编码的N-乙酰谷氨酸合成酶是限速酶。通过高拷贝质粒载体使argA过量表达[23],在培养基中加入适量的精氨酸,鸟氨酸产量提高到12.4 mg/L[15]。在谷氨酸棒杆菌中,基因argB编码的N-乙酰谷氨酸激酶是限速酶[31]。Dou等[32]考察了argJ过量表达对精氨酸产量的影响,将argJ基因连接到质粒pJCtac构建重组穿梭质粒pJCtac-argJ,转化到C. crenatumSYPA5-5中,结果精氨酸产量增加16.8%。 3.1.3 阻断竞争代谢途径:谷氨酸合成代谢途径,是由葡萄糖开始,经过EMP途径产生丙酮酸,经由丙酮酸脱氢酶系催化,丙酮酸转变成乙酰辅酶A,进入TCA循环,产生α-酮戊二酸,在谷氨酸脱氢酶作用下,由α-酮戊二酸转变成谷氨酸。另外,α-酮戊二酸在α-酮戊二酸脱氢酶作用下,还可由 α-酮戊二酸转变成琥珀酰辅酶A,因此阻断此竞争代谢途径可以提高Orn的产量。Kim等[33]通过反义RNA技术抑制α-酮戊二酸脱氢酶的表达,从而提高谷氨酸产量。Asakura等[34]对提高谷氨酸棒杆菌的谷氨酸产量进行了研究,结果表明通过基因敲除odhA基因来改变谷氨酸代谢流和通过添加诱导物这两种方法都可以增加谷氨酸产量,而且这两种方法作用可以叠加。此合成代谢途径中的关键基因如pyc、pfkA、gap、gdh等基因的单个或多个表达,也可提高谷氨酸的产量[35]。谷氨酸在基因proB编码的γ-谷氨酰激酶催化下,生成脯氨酸。利用基因敲除技术敲除 proB基因[29],或添加脯氨酸[36],阻断谷氨酸到脯氨酸的代谢途径,可使细胞大量积累鸟氨酸。
3.1.4 解除反馈抑制和反馈阻遏:谷氨酸棒杆菌中argB基因受精氨酸的反馈调节及阻遏蛋白ArgR的阻遏调节,因此在鸟氨酸合成生产中,利用精氨酸营养缺陷菌株,消除精氨酸的反馈抑制,敲除编码阻遏蛋白基因argR,消除或抑制阻遏蛋白的阻遏调节,可很大程度上提高鸟氨酸产量。据文献报道,鸟氨酸合成途径的阻遏蛋白ArgR可结合在关键基因argB的启动子区,阻遏鸟氨酸的合成,可通过敲除或抑制argR基因来抑制阻遏蛋白ArgR的合成,从而提高鸟氨酸的合成量[37,38],鸟氨酸的产量提高15%−22%。
3.1.5 其他:Lee和Cho[39]利用代谢工程技术提高了大肠杆菌W3110的鸟氨酸产量,首先通过切断下游代谢途径和解除反馈抑制来增强鸟氨酸的合成代谢流,即敲除argF、argI和argR三个基因,过量表达argA214基因,基因敲除和基因过量表达产生叠加效果,鸟氨酸产量由0.3 mg/g细胞干重增加到3.2 mg/g细胞干重;然后阻断竞争支路来增强鸟氨酸代谢流,即SpeF和ProB蛋白失活,由5.5 mg/g细胞干重增加到13.2 mg/g细胞干重,鸟氨酸的产量提高了140%。Hwang等[17]构建了argF-argR-proB三基因缺失和argCJBD过量表达的谷氨酸棒杆菌工程菌,结果鸟氨酸产量增加了30%,由12.73 mg/g细胞干重增加到16.49 mg/g细胞干重。 3.2 系统代谢工程系统代谢工程是整合基因组、转录组、蛋白质组、代谢物组、代谢通量组等“组学”技术研究细胞中所有基因和蛋白质的代谢工程研究方法。传统代谢工程只是对个别基因或局部代谢途径进行改造,对微生物代谢网络结构和功能不能准确分析和高效利用,没有从全局的角度去改造细胞,所以具有很大的局限性。高通量组学分析技术和构建基因组水平代谢网络模型等一系列现代系统生物学技术能够从系统水平上分析细胞的代谢功能,弥补传统代谢工程的缺点[28]。系统代谢工程的研究对象是生物体内的网络结构,而不是简单的组成这个网络的单个分子组成成分。一个系统可以是一个基因调控网络、一个代谢途径,也可以是一个细胞、一个组织,甚至可以是一个完整的复杂的生物体。系统代谢工程使代谢工程科学转变为定量描述和预测的科学,研究方法由分解转向整合,成为当今代谢工程研究领域中的新的热点。
系统代谢工程用于微生物合成鸟氨酸的研究有限。Lu等[29]进行氨酸棒杆菌鸟氨酸合成代谢的蛋白质组研究,高产菌株与起始菌株之间的比较蛋白质组学的结果表明,提高内源谷氨酸的供给可以促进鸟氨酸的合成。Shirai等[35]进行谷氨酸棒杆菌鸟氨酸合成代谢的代谢物通量组研究,高产菌株的代谢通量分析证明,pgi、pfkA、gapA、pyk、pyc、gltA和gdh基因编码的酶,催化代谢反应的碳代谢通量明显增加。Jiang等[18]和Kim等[40]进行谷氨酸棒杆菌鸟氨酸合成代谢的能量系统研究,NADP+/NADPH或NAD+/NADH作为脱氢酶的辅酶,对微生物的生长繁殖和能量代谢有重要的影响。在谷氨酸棒杆菌中,合成1 mol鸟氨酸,需要消耗2 mol NADPH,因此适当的提高细胞内的NADPH有利于鸟氨酸的合成。
4 结语鸟氨酸是一种多功能氨基酸,特别引人注目。在医药保健工业上,L-鸟氨酸具有保肝护肝作用,对肝硬化以及无显著特点的感染、癌症、外伤和烧伤恢复有很大的帮助。在食品和化妆品工业上,鸟氨酸的研究和开发有很大的利用空间。微生物合成鸟氨酸虽然有很多优势,但是现在还远远不能满足人们的需求,巨大的市场前景促使科学家不断进行研究,所以提高微生物合成鸟氨酸的产量是一项任重而道远的历程。
微生物合成鸟氨酸与碳中心代谢有很密切的联系。鸟氨酸合成代谢途径与碳中心代谢途径竞争前体代谢物、辅因子和能量等,即与细胞生长需求相竞争。这就需要应用系统代谢工程来进行代谢流分析,结合其他组学研究,考查鸟氨酸合成代谢在哪里消耗碳、辅因子,以及碳中心代谢的能量来自哪里等;应用系统代谢工程来优化细胞生理性能,但是到目前为止,应用于鸟氨酸的系统代谢工程研究很少,要加大这方面的研究力度。另一方面,微生物生长系统需要所有代谢物合成平衡,特别是谷氨酸棒杆菌,氨基酸合成途径受到代谢调控系统严格控制,即鸟氨酸的合成是有限制机制的。在传统代谢工程研究中,阻断鸟氨酸的分解代谢途径,鸟氨酸产量增加显著,而强化合成代谢途径,鸟氨酸产量增加不显著。究其原因,通过敲除竞争途径减少副产物的产生,是对局部代谢途径进行改造,而强化合成代谢途径,特别是中心代谢途径,是对全局代谢途径进行改造,要受到细胞全局调控蛋白、反馈抑制等影响,所以细胞不能大量积累鸟氨酸。这就需要进行鸟氨酸的代谢调控研究,通过系统分析微生物代谢调控网络和代谢功能,利用合成生物学,可以构建初级的微生物细胞工厂。
随着代谢工程日新月异的发展[41],从全局代谢网络调控水平上进行鸟氨酸生物合成过程的深入研究及其药理作用等研究,使鸟氨酸具有巨大的开发价值和广阔的应用前景。微生物发酵法一直存在着产量瓶颈问题,由于发酵生产的效率低,导致生产成本高,鸟氨酸代谢工程改造策略的研究,不仅为降低生产成本实现工业化大规模生产提供了新方法,还为其他生物化学原料,如瓜氨酸、精氨酸和丁二胺等获得高产的工程菌株提供了新思路。
| [1] | Ye H. Study on L-ornithine fermentation condition and analysis of fermentation kinetics[D]. Nanjing: Master’s Thesis of Nanjing University of Tcchnology, 2006 (in Chinese) 叶慧. L-鸟氨酸发酵条件优化及其发酵动力学研究[D]. 南京: 南京工业大学硕士学位论文, 2006 |
| [2] | Salvatore F, Cimino F, Dayello caracciolo M, et al. Mechanism of the protection by L-ornithine-L-aspartatemixture and by L-arginine in ammonia intoxication[J]. Archives of biochemistry and biophysics, 1964, 107(9): 499-503 |
| [3] | Shi HP, Fishel RS, Efron DT, et al. Effect of supplemental ornithine on wound healing[J]. Journal of surgical research, 2002, 106(2): 299-302 |
| [4] | De Bandt JP, Coudrya-Lucas C, Lioret N, et al. A randomized controlled trial of the influence of the mode of enteral ornithine alpha-ketoglutarate administration in burn patients[J]. Journal of nutrition, 1998, 128(3): 563-569 |
| [5] | Elam RP, Hardin DH, Sutton RA, et al. Eeffcts of agrinine and ornithine on srtength, lean body mass and urinay rhydroxyproline in adult males[J]. The journal of sports medicine and physical Fitness, 1989, 29(1): 52-56 |
| [6] | Suminski RR, Robertson RJ, Goss FL, et al. Acute effect of amino acid ingestion and resistance exercise on plasma growth hormone concentration in young men[J]. International journal of sport nutrition, 1997, 7(1): 48-60 |
| [7] | Zajac A, Poprzecki S, Zebrowska A, et al. Arginine and ornithine supplementation increases growth hormone and insulin-like growth factor-1 serum levels after heavy-resistance exercise in strength-trained athletes[J]. Journal of strength and conditioning research, 2010, 24(4): 1082-1090 |
| [8] | Hu XZ. Widely function of health care about L-ornithine[J]. Food Industry, 2006(1): 48 (in Chinese) 胡学智. 具有广泛保健功能的L-鸟氨酸[J]. 食品工业, 2006(1): 48 |
| [9] | Kinoshita S, Nakayama K, Udaka S. The fermentative production of L-ornithine[J]. The journal of general and applied microbiology, 1957, 3: 276-277 |
| [10] | Chen N. Breeding of L-ornithine producing strain and studies on its fermentation conditions[J]. Food and Fermentation Industries, 2000, 27(l): 32-36 (in Chinese) 陈宁. L-鸟氨酸生产菌的选育及其发酵条件的研究[J]. 食品与发酵工业, 2000, 27(l): 32-36 |
| [11] | Wan HG, Ye H, Lu B, et al. Optimization of the medium for L-ornithine fermentation using central composite design[J]. Food and Fermentation Industries, 2006, 32(l): 37-40 (in Chinese) 万红贵, 叶慧, 陆彬, 等. L-鸟氨酸发酵培养基的中心复合法优化[J]. 食品与发酵工业, 2006, 32(l): 37-40 |
| [12] | Zhang JF, Wang JB, Huang JM, et al. Breeding of high-yield L-ornithine-producing strain by protoplast fusion[J]. Amino acids and biotic Resources, 2009, 31(1): 53-57 (in Chinese) 张婧芳, 汪江波, 黄金明, 等. L-鸟氨酸高产菌的原生质体融合育种[J]. 氨基酸和生物资源, 2009, 31(1): 53-57 |
| [13] | Nielsen J. Metabolic engineering[J]. Applied microbiology and biotechnology, 2001, 55(3): 263-283 |
| [14] | Bailey JE. Toward a science of metabolic engineering[J]. Science, 1991, 252(5013): 1668-1675 |
| [15] | Stephanopoulos G, Vallino JJ. Network rigidity and metabolic engineering in metabolite overproduction[J]. Science, 1991, 252(5013): 1675-1681 |
| [16] |
Lee YJ, Cho JY. Genetic manipulation of a primary metabolic pathway for L-ornithine production in |
| [17] |
Hwang JH, Hwang GH, Cho JY. Effect of increased glutamate availability on L-ornithine production in |
| [18] |
Jiang LY, Zhang YY, Li Z, et al. Metabolic engineering of |
| [19] |
Jiang LY, Chen SG, Zhang YY, et al. Metabolic evolution of |
| [20] | Unin R, Glansdorff N, Piérard A, et al. Biosythesis and metabolism of arginine in bacteria[J]. Microbiological reviews, 1986, 50(3): 314-352 |
| [21] |
Sakanyan V, Petrosyan P, Lecocq M, et al. Genes and enzymes of the acetyl cycle of arginine biosythesis in |
| [22] | van de Casteele M, Demarez M, Legrain C, et al. Pathways of arginine biosynthesis in extreme thermophilic archaeo- and eubacteria[J]. Journal of general microbiology, 1990, 136: 1177-1183 |
| [23] |
Rajagopal BS, DePonte J 3rd, Tuchman M, et al. Use of inducible feedback-resistant N-acetylglutamate synthtase genes for enchanced arginine biosynthesis by genetically engineered |
| [24] | Meile L, Leisinger T. Enzymes of arginine biosynthesis in methanogenic bacteria[J]. Experientia, 1984, 40(8): 899-900 |
| [25] |
Savchenko A, Weigel P, Dimova D, et al. The |
| [26] |
Picard FJ, Dillon JR. Cloning and organization of seven arginine biosynthesis genes from |
| [27] |
Davis RH. Compartmental and regulatory mechamisms in the arginine pathway of |
| [28] | Zhang XL. Twenty years development of metabolic engineering[J].Chinese Journal of Biotechnology, 2009, 25(9): 1285-1295(in Chinese) 张学礼. 代谢工程发展20年[J]. 生物工程学报, 2009, 25(9): 1285-1295 |
| [29] |
Lu DM, Liu JZ, Mao ZW. Engineering of |
| [30] |
Schneider J, Eberhardt D, Wendisch VF. Improving putrescine production by |
| [31] |
Yoshida H, Araki K, Nakayama K. Mechanism of L-arginine production by L-arginine-production mutants of |
| [32] |
Dou W, Xu M, Cai D, et al. Improvement of L-arginine production by overexpression of a bifunctional ornithine acetyltransferase in |
| [33] |
Kim J, Hirasawa T, Sato Y, et al. Effect of |
| [34] |
Asakura Y, Kimura E, Usuda Y, et al. Altered metabolic flux due to deletion of |
| [35] |
Shirai T, Fujimura K, Furusawa C, et al. Study on roles of anaplerotic pathways in glutamate overproduction of |
| [36] |
Lee SY, Cho J, Lee HJ, et al. Enhancement of ornithine production in proline-supplemented |
| [37] |
Hwang GH, Cho JY. Implication of gluconate kinase activity in L-ornithine biosynthesis in |
| [38] |
Lee SY, Park JM, Lee JH, et al. Interaction of transcriptional repressor ArgR with transcriptional regulator FarR at the |
| [39] |
Lee YJ, Cho JY. Genetic manipulation of a primary metabolic pathway for L-ornithine production in |
| [40] |
Kim S, Lee CH, Nam SW, et al. Alteration of reducing powers in an isogenic phosphoglucose isomerase ( |
| [41] |
Xu M, Rao Z, Dou W, et al. Site-directed mutagenesis studies on the L-arginine-binding sites of feedback inhibition in N-acetyl-L-glutamate kinase (NAGK) from |
 2015, Vol. 42
2015, Vol. 42