扩展功能
文章信息
- 周稳, 管政兵, 蔡宇杰, 宋晨萌, 廖祥儒
- ZHOU Wen, GUAN Zheng-Bing, CAI Yu-Jie, SONG Chen-Meng, LIAO Xiang-Ru
- 芽胞杆菌漆酶的研究进展
- Progress in the Bacillus laccase
- 微生物学通报, 2015, 42(7): 1372-1383
- Microbiology China, 2015, 42(7): 1372-1383
- 10.13344/j.microbiol.china.140781
-
文章历史
- 收稿日期: 2014-10-12
- 接受日期: 2015-02-12
- 优先数字出版日期(www.cnki.net): 2015-03-04
漆酶(EC 1.10.3.2)是一种含铜多酚氧化酶,能够催化多种酚类化合物氧化,同时将分子氧还原为水,在造纸工业、废水处理、纺织工业、食品加工、生物传感器以及生物诊断等方面都有良好的应用前景[1]。细菌漆酶相对真菌漆酶而言,其氧化还原电势较低,这使得其底物的利用范围受到限制。然而,在高温和碱性环境下,细菌漆酶往往更稳定,适用pH范围也更广[2],因此在工业应用中具有更广阔的前景。
1996年,van Waasbergen等[3]首次发现芽胞杆菌Bacillus sp. SG-1的芽胞具漆酶样(laccase-like)活性,次年,Claus等[4]也发现球形芽胞杆菌(Bacillus sphaericus)的芽胞具有漆酶样活性,芽胞杆菌漆酶的研究由此展开。2001年,Hullo等[5]证实CotA属于漆酶蛋白,该蛋白由cotA基因编码(芽胞外衣蛋白),大小约为65 kD。此后,在地衣芽胞杆菌(B. licheniformis)[6]、Bacillus sp. HR03[7] (也产胞外漆酶,见下文)、短小芽胞杆菌(B. pumilus)[8]、克劳氏芽胞杆菌(B. clausii)[9]等菌中也发现了CotA漆酶。近年来,科研工作者还发现死谷芽胞杆菌(B. vallismortis)[10]、Bacillus sp. XJT-7、坚强芽胞杆菌(B. firmus)[11]、解淀粉芽胞杆菌(B. amyloliquefaciens)[12]和萎缩芽胞杆菌(B. atrophaeus)[13]等菌的芽胞也都具有漆酶活性,而Bacillus sp. HR03[14]、Bacillus sp. ADR[15]、Bacillussp. FOR[16]、蜡状芽胞杆菌(B. cereus)[17]、Bacillus sp. SHC1[18]和特基拉芽胞杆菌(B. tequilensis)[19]等菌可产胞外漆酶,奥德赛芽胞杆菌(B. odysseyi)[20]、B. subtilis WPI[21]、Bacillus sp. UN2[22]等菌可产胞内漆酶,此外,Bacillus sp. VUS[23]、苏云金芽胞杆菌(B. thuringiensis)[24]、Bacillussp. CS-1以及Bacillus sp. CS-2[25]等菌胞内外均能检测到漆酶酶活,可产漆酶而未提及漆酶位置的有耐盐芽胞杆菌(B. halodurans)[26]和纺锤芽胞杆菌(B. fusiformis)[27]。
CotA漆酶是目前研究得最为深入的细菌漆酶种类,科研工作者已对CotA漆酶的结构、酶学性质有了较深的认识,近些年在催化机理、分子生物学方法改造和应用研究方面也取得了不少新的研究进展。
1 芽胞杆菌漆酶的结构与波谱特性漆酶属于多铜氧化酶家族,具有多铜氧化酶的共同特点,即含有4个铜离子结合位点[5, 28]。结构上,不同漆酶的一级序列经多重比对,发现其铜结构位点都是高度保守的,植物、真菌和细菌漆酶也都具有着类似的三维结构(昆虫漆酶尚未见三维结构的报道),但在催化部位,却出现了与它们的功能多样性和进化关系相符合的显著差异[29, 30, 31]。
1.1 氨基酸序列2000年,Alexandre等[32]利用BLAST程序对细菌基因组数据库以及蛋白质数据库中的真菌漆酶蛋白与细菌漆酶蛋白进行比较,得出很多细菌中可能存在漆酶的结论[26]。Martins等[33]将CotA与西葫芦抗坏血酸氧化酶(zucchini ascorbate oxidase,ZAO)和灰盖鬼伞(Coprinus cinereus)漆酶作了序列比较,发现其相似性较低,分别为36.6%和39.3%,而后两者的相似性却达50%。CotA与其他细菌漆酶如大肠杆菌(Escherichia coli)的CueO,嗜热栖热菌(Thermus thermophilus)和抗生素链霉菌(Streptomyces antibioticus)的漆酶的相似性都较低。目前与CotA漆酶亲源关系最近的细菌漆酶是紫灰色链霉菌(S. lavendulae),两者相似性达47%[34, 35]。芽胞杆菌属内的漆酶氨基酸序列也呈现出丰富的多样性。B. subtilis的CotA与其他几个CotA的氨基酸序列一致性都在70%左右[6, 8, 9],而Ruijssenaars等[26]报道的B. halodurans漆酶却由lbh1基因编码,分子量为56 kD,与B. subtilis的CotA氨基酸序列相似性只有19%,与云芝(Trametes versicolor)漆酶的相似性则只有17%。类似报道很多,例如,B. vallismortis fmb-1产的芽胞上的漆酶分子量为 55 kD,Bacillus sp. HR03则既含可重组表达65 kD蛋白的cotA基因,又可分泌分子量为50 kD的胞外漆酶[7, 14, 36]。非CotA漆酶的分子量大小不一,甚至,B. subtilis也能产分子量大小为55 kD的胞内漆 酶[21]。总之,芽胞杆菌漆酶的类型非常多,一些菌株还能同时产不同类型的漆酶。
1.2 酶蛋白的三维结构尽管细菌漆酶与真菌漆酶的序列同源性不高,但几何结构却类似[29]。CotA的折叠结构由3个铜氧还样(cupredoxin-like)结构域组成。第1个铜氧还样结构域(domain 1)起始于一段连接结构域1和2的卷曲片段,由8股β-桶状(β-barrel)结构组成,该卷曲片段可能是细菌漆酶所特有的,用于促进这些结构域的组装。第2个铜氧还样结构域(domain 2)是结构域1和结构域3的桥梁,结构域1和结构域2由一段短α-螺旋片段连接,同时还有一个较大的loop片段连接结构域2和结构域3,在CotA和CueO两种漆酶中,这个区域构成结构域2与结构域3的外部连接,而在真菌漆酶中,结构域2与结构域3基本都由内部连接形成。第3个铜氧还样结构域(domain 3)不仅包含单核铜中心,而且与三核铜中心结合位点的形成有关。此外,结构域3还包含了靠近Ⅰ型铜中心、位于蛋白表面的底物结合位点,三核铜中心平面则位于结构域1和结构域3的中间。另外,有一个loop片段和一段短α-螺旋片段构成的凸出部分在底物结合位点上形成了盖状(lid-like)结构,这个盖状(lid-like)结构可能与底物的结合过程有关,是CotA 独有的特征[28, 37]。
1.3 铜中心与波谱特性CotA具有多铜氧化酶所共有的铜中心结构,其中铜位点因波谱特性被分为三类,分别为Ⅰ型铜(T1,含Cu1)、Ⅱ型铜(T2,含Cu4)和Ⅲ型铜(T3,含Cu2和Cu3)。T1由一个扭曲的双锥体三角形配位构成,包括两个组氨酸与一个半胱氨酸,第4个位点因该位点的氧化还原电势而定,在CotA中为甲硫氨酸[37]。其中的组氨酸如被替换,会对漆酶的酶学性质造成显著影响,甲硫氨酸如被替换成亮氨酸,虽不会影响配位结构,甚至可能会提高氧化还原电势,但也会造成酶活大幅降低,甚至检测不到酶活以及不能形成色素的情况[38, 39]。最新研究表明[40],单核铜中心附近的Asp500通过适当的突变可以降低空间位阻效应,大幅提高反应速率和酶活性。
与其他真菌漆酶一样,CotA漆酶的T1在 600 nm处有特异吸收峰,经电子顺磁共振(electron paramagnetic resonance,EPR)可检测到,是典型的蓝漆酶。T2一端连接着两个组氨酸和一个水分子,另一端与双核中心靠近,不具有特殊的光谱吸收峰。T3拥有6个组氨酸残基,在330 nm处有特异吸收峰,但因Cu2和Cu3间存在反铁磁性耦合作用(antiferromagnetic coupling),T3没有EPR信 号[33, 41]。虽然大多数漆酶符合以上规则,但也有一些漆酶没有这些典型特征。例如,天蓝色链霉菌(S. coelicolor)的小漆酶(small laccase,SLAC)只含两个结构域,并且不含T1[42]。芽胞杆菌中也有例外,如来源于B. vallismortis fmb-103[36]和Bacillus sp. ADR[15]的漆酶在600 nm处都没有吸收峰,后者甚至不能氧化2,2′-连氮-二(3-乙基苯并噻唑-6-磺酸) (ABTS)和丁香醛连氮(SGZ)。
2 芽胞杆菌漆酶的催化作用研究表明[28, 37],漆酶各个铜中心的作用是氧化底物并将获得的电子传递给分子氧。起始催化循环从T1位点开始,4个氧化的底物分子所产生的4个电子经T1转运到三核铜中心,并被三核铜中心平面上O2结合位点上的分子氧所接受,形成了两分子水。氧化之后产生的自由基不稳定,这些自由基会进一步参与一些非酶促反应并形成产物。氧化产生的自由基也可扩散到聚合物的易感位置并与之反应,而聚合物在进一步反应中被降解。在这个过程中,漆酶先被还原,将电子传递出去之后,又氧化到初始状态[43](图 1)。当前对芽胞杆菌漆酶的催化机制研究还较少。在以CotA漆酶为模型的研究中,人们已发现Glu498是位于三核铜中心附近的唯一的质子活性基团,它除了稳定三核铜中心结构之外,还与质子通道密切相关,控制着双氧的结合及其进一步还原,而Asp116也是Glu498质子化调控和协助质子绑定到T2上形成羟基所必不可 少的[44, 45, 46]。
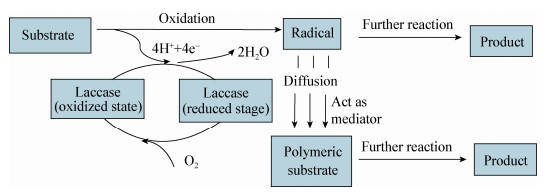
|
| 图 1 漆酶的催化机制 Fig.1 The catalytic mechanism of laccase |
漆酶可以氧化多种有机和无机底物,包括单酚、二酚、多酚、氨基酚、甲氧基苯酚、芳香胺以及抗坏血酸,使之生成相应的苯醌和水,在介体的参与下还能与部分非酚底物反应[1]。漆酶并不能直接将底物氧化生成产物,而通过催化底物产生不稳定的自由基来进行,这些自由基进一步参与非酶促反应进而生成产物。自由基参与的非酶促反应可产生三类作用[47],即交联、多聚体降解和芳香环断裂。迄今为止,人们尚未发现不同来源的漆酶其非酶促反应有何区别,然而,芽胞杆菌漆酶与真菌漆酶的底物范围则不尽相同。已有报道显示[6, 48],芽胞杆菌漆酶不能与邻、间、对苯酚反应,也不与4-氯酚、2,4-二氯苯酚反应,邻位无甲氧基的底物(如香豆酸、肉桂酸)也不能被氧化,而这些底物在真菌漆酶中是可被氧化的。实验证实,苯酚邻位上存在甲氧基的底物更易被氧化,而底物的脂肪链长短对底物氧化的影响可能比邻位是否存在甲氧基更大。2011年,Reiss等[8]研究了CotA漆酶对37种潜在底物的催化活性,结果进一步证实,CotA漆酶会优先氧化至少一个邻位或对位取代基带有孤对电子的取代酚。
2.2 氧化还原电势T1铜位点是底物氧化的限速位点,铜离子在 一价与二价中转换[43]。漆酶要从底物获得电子,则那些底物只能低于或者稍稍高于T1的氧化还原电势。CotA相对真核漆酶最大的不足便是氧化还原电势较低(CotA大约为455 mV,而真菌漆酶大约为 780 mV[49]),这可能是CotA漆酶底物谱异于真菌漆酶的一个重要原因,大大降低了CotA漆酶的应用范围。影响氧化还原电势的因素很多,包括溶剂亲和性、氢键、轴向配位体的类型、偶极取向以及配位体与铜原子的间距。Hong等[50]对比分析了CotA、CueO、SLAC和真菌漆酶(来源于T. versicolor)共4种漆酶,发现T1周围高度保守配位体His(Nδ)-Cys(S)-His(Nδ)对氧化还原电势的影响不大,而轴向氨基酸的性质强烈影响了漆酶的氧化还原电势。他们还发现,多铜氧化酶骨干偶极子(backbone dipoles)能增加氧化还原电势,而侧链和溶剂偶极子(solvent dipoles)却降低氧化还原电势。Mot等[51]对大量漆酶的氨基酸序列进行分析,发现轴向配位体分别为苯丙氨酸、亮氨酸和甲硫氨酸时,其氧化还原电势分别呈高、中、低三个层次。除T1配位层以外,氧化还原电势会因蛋白、底物以及pH条件不同而不同。
通过分子改造获得高氧化还原电势的芽胞杆菌漆酶是一个有价值但具挑战性的工作。Durao 等[38]曾用X射线使Met502位点分别突变为苯丙氨酸和亮氨酸,氧化还原电势分别提高了约60 mV和90 mV,但在不同底物下突变体M502L的Kcat下降了2−4倍,M502F的Kcat下降更严重。之后他们[52]又将Leu386和Ile494替换为丙氨酸,但氧化还原电势和Kcat都有大幅降低。其他一些研究小组也有CotA漆酶氧化还原电势改造效果不佳的报道[39, 44, 53]。2009年,Brissos等[54]尝试通过定向进化来提高CotA漆酶的氧化还原电势,他们建立了CotA漆酶定向进化表达系统,然后通过高通量筛选(High throughput screening,HTS)技术来筛选可以氧化高氧化还原电势染料的漆酶,但尚未见其有获得高氧化还原电势CotA漆酶的报道。
3 芽胞杆菌漆酶的酶学性质芽胞杆菌漆酶在发现之初即以最适温度高,热稳定性强,pH适用范围宽而受到广泛关注。一般而言,蛋白的耐热性是由盐桥、氢键以及α螺旋构像等物理化学结构因素决定的,但漆酶还有自己的特点:真菌漆酶的糖基化往往能提高其耐热性,CotA因3个结构域间的大量疏水相互作用、高浓度的脯氨酸以及紧密的蛋白质包装而耐热性更好,但二硫键对CotA的耐热性并无影响[53, 55]。芽胞本身即具有耐热、耐旱、抗辐射、抗药等特点,在pH、温度、抑制剂、有机溶剂以及金属离子等因素对芽胞漆酶的影响中,芽胞自身的特殊结构也可能起到了一定的作用。
3.1 最适pH与pH稳定性众多研究表明,以ABTS为底物时,芽胞杆菌漆酶的最适pH一般在4.0−5.0之间;而以SGZ和2,6-二甲氧基苯酚(2,6-dimethoxyphenol,DMP)为底物时,最适pH分别分布在6.5−7.5和6.0−8.6之间(表 1)。最适pH范围受底物影响的特性与真菌漆酶类似,但真菌漆酶更适宜酸性条件。以ABTS、SGZ和DMP为底物,真菌漆酶的最适pH主要分布区分别在2.0−4.0、3.5−6.5、3.0−6.2之间[56]。其他细菌漆酶也是在碱性条件下的酶活更高。芽胞杆菌漆酶的pH稳定性非常好,在pH为3.0的环境中保存1 d,残余酶活通常都在20%−50%之间,甚至有保存10 d酶活仍超100%的特例,在碱性条件下保存时间更长(表 1)。相比之下,一些真菌漆酶只能在中性或酸性条件下才有较高的pH稳定性,可见芽胞杆菌漆酶在很宽的pH范围下都有非常好的稳定性[57]。本实验室前期筛选获得一株具高漆酶活性的短小芽胞杆菌菌株W3,酶学性质分析显示该菌株CotA漆酶以DMP为底物的最适pH为7.8,pH稳定性范围为3.0−10.0,温度稳定性范围为20−90 °C;在50 °C、pH 9.0环境下保温10 d,残余酶活性仍有约95%,并能耐受一定浓度的多种有机溶剂及NaCl,显示该CotA漆酶在印染废水脱色处理方面的巨大应用 潜力[58]。
值得注意的是,芽胞杆菌产的胞外漆酶以及其他不依赖于芽胞的漆酶的耐碱能力相对较弱(表 1),但仍有待于深入研究。
| 漆酶来源 Laccase sourse | 漆酶形式 Form of laccase | 最适温度 Temperature optimum (°C) | 最适pH pH optimum | 热稳定性 半衰期[t1/2 (h)]/T (°C) Thermal stability half-life (t1/2 (h))/T (°C) | pH稳定性 残余酶活[pH,t (d)] pH-stability Residual activity (pH, t (d)) | |||
| ABTS | SGZ | DMP | pH 3.0 | pH≥8.0 | ||||
| B. subitilis MB24[33] | sLaca | 75 | 1.87/80 | |||||
| rLacb | 75 | 3.73/80 | ||||||
| B. subtilis WD23[34] | sLac | 60 | 6.8 | 2.50/80 | 50% (9,15) | |||
| isLacc | 70 | 6.8 | ||||||
| rLac | 45 | 7.2 | 0.50/80 | <50% (9,1) | ||||
| B. subtilis WN02[63] | sLac | 60 | 3.0 | 7.0 | 8.6 | 20% (3,1) | ≥100% (10,10) | |
| B. subtilis X1[57] | rLac | 60 | 4.4 | 6.9 | 7.4 | 2.50/80 | 23% (3,1) | 163% (9,10) |
| B. subtilis 168[9] | rLac | 4.0 | 6.5 | 7.0 | 0.83/80 | |||
| B. licheniformis DSM 13[6] | rLac | 85 | 4.2 | 7.0 | 7.0 | |||
| B. licheniformis LS04[64, 65] | sLac | 60 | 4.4 | 6.6 | 7.4 | 20% (3,1) | 102% (9,10) | |
| rLac | 70 | 4.2 | 6.2 | 6.6 | 1.20/80 | 23% (3,1) | ||
| B. pumilus DSM 27[8] | rLac | 70 | 4.0 | 6.5 | 7.0 | 3.50/65 | ||
| B. pumilus W3[58] | rLac | 80 | 4.6 | 7.2 | 7.8 | 6.50/80 | 21% (3,1) | 169% (9,10) |
| B. amyloliquefaciens LC03[66] | sLac | 60 | 3.8 | 6.8 | >4.00/70 | 20% (3,1) | ≥80% (9,10) | |
| B. amyloliquefaciens LS05[67] | sLac | 70 | 3.0 | 6.6 | 4.00/60 | 50% (3,1) | 80% (9,10) | |
| B. amyloliquefaciens 12B[14] | sLac | 80 | 4.0 | |||||
| rLac | 80 | 4.5 | ||||||
| B. sphaericus[4] | sLac | 60 | 6.0 | |||||
| B. vallismortis fmb-103[10, 36] | sLac | 85 | 4.4 | 7.4 | 5.00/80 | 100% (3,10) | 38% (9,10) | |
| psLacd | 82 | 4.8 | 7.4 | 4.00/80 | 40% (3,10) | 85% (9,10) | ||
| Bacillus sp. HR03[7, 14] | eLace | 55 | 5.5 | 5.5 | ||||
| rLac | 4.0 | 7.0 | 7.4 | 0.75/80 | ||||
| Bacillus sp. ADR[15] | eLac | 40 | 4.0 | |||||
| Bacillus sp. FOR[16] | eLac | 35 | 3.0 | 0.38/75 | ||||
| B. tequilensis SN4[19] | eLac | 85 | 5.5 | 6.0 | 8.0 | 3.00/80 | 75% (9,1) | |
| B. clausii KSM-16[9] | rLac | 4.0 | 7.0 | 8.0 | 0.33/80 | |||
| Bacillus SF[59] | psLac | 0.08/60 | 50% (8.5,2) | |||||
| sLac | 66.00/60 | <50% (9.5,3) | ||||||
| isLac | (66.00−80.00)/60 | |||||||
Note: a: Spore laccase; b: Recombinant laccase; c: Immobilized spore laccase; d: The laccase purified from spores; e: Extracellular laccase (non-recombinant).
近年来的多个研究表明,芽胞漆酶的最适温度主要集中在60−80 °C (表 1)。据汪春蕾[34]报道,B. subtilis WD23的漆酶最适温度随重组表达、芽胞和固定化的3种形式而逐次上升,分别为45、60和70 °C,3种形式漆酶的稳定性也依次增强。从芽胞上纯化出来的漆酶,其稳定性比芽胞漆酶差,最适温度也低些。例如,Bacillus SF的芽胞漆酶经纯化后在60 °C的半衰期仅为5 min,而天然芽胞漆酶可达为66 h,固定化的芽胞漆酶则更高[59]。这种从芽胞上纯化出来的漆酶稳定性差可能是纯化过程中蛋白和/或多糖丢失造成的[36]。也有很多报道称重组漆酶热稳定性更好(表 1)。例如,B. amyloliquefaciens 12B的重组漆酶的热稳定性明显强于芽胞漆酶,甚至在100 °C下重组漆酶酶活仍余约90%,而芽胞漆酶的酶活只剩约45%。这种重组漆酶稳定性强于芽胞漆酶的现象可能是由于芽胞蛋白层变性导致崩塌并阻遏漆酶与底物接触所致[60]。令人惊奇的是,Abari等[11]报道的一株海洋细菌Bacillus sp. XJT-7的芽胞在高温灭活之后,漆酶活性比灭活之前更高,原因尚不明确。那些不依赖于芽胞的芽胞杆菌漆酶的稳定性也很特殊。例如,Bacillus sp. ADR分泌的胞外漆酶最适温度为40 °C,在50 °C条件下孵育1 h后酶活即完全消失[15]。此外,对酶分子进行适当改造可以提高热稳定性。例如,Mollania等[61]发现,CotA表面的loop片段与CotA漆酶的热稳定性相关,使loop段的Glu188突变为赖氨酸时,在高温条件下,酶的热稳定性和酶活性都得到了大幅提高。
真菌漆酶的最适温度大多集中在50−70 °C,在50 °C条件下的半衰期从2到70 h不等,真菌漆酶超过60 °C会迅速下降,且耐热性不强[62]。但也有一些特例,如来源于粗毛革孔菌(Coriolopsis gallica)的漆酶在60 °C条件下半衰期为8 d,来源于朱红密孔菌(Pycnoporus cinnabarinus)的漆酶在80 °C条件下半衰期为2 h[55]。
3.3 抑制剂对酶的影响对芽胞杆菌漆酶进行的抑制剂研究主要集中在SDS、EDTA、L-半胱氨酸、叠氮化钠、二硫苏糖醇(Dithiothreitol,DTT)、巯基乙醇、氯化钠几种试剂上。其中,L-半胱氨酸、DTT以及叠氮化钠对漆酶的抑制作用非常明显,0.1 mmol/L时即可抑制
90%左右的酶活。巯基乙醇的抑制作用也很明显,当其浓度达到2.5 mmol/L 即可使酶受到100%的抑制。相对而言,SDS、EDTA、氯化钠的抑制作用不明显,当其浓度分别超过约0.1、25和100 mmol/L时,漆酶逐渐受到较多的抑制[19, 34, 36, 58, 59, 63]。然而,不同来源的漆酶对抑制剂的耐受力差别较大,经重组表达后,漆酶耐抑制的能力也可能发生改变。例如,据Lu等[65]报道,在1.0 mmol/L浓度的SDS的作用下,芽胞漆酶受到30%的抑制,而重组漆酶的酶活反而增加到114%左右。
3.4 有机溶剂对酶的影响很多有机化合物在水介质中难溶或者不溶,而在水中添加适量的有机溶剂往往能增加有机化合物的溶解度,使酶促反应能够顺利进行。这时,有机溶剂对酶的影响至关重要。过高浓度的有机溶剂通常会使酶失活。这是因为,有机溶剂存在时,活性位点的水分子有被替换的可能,同时有机溶剂还可能促使溶液的pH值发生改变,疏水作用和三维结构的形变也会使酶失活[68]。
当前已有不少研究者研究和探讨了有机溶剂对芽胞杆菌漆酶的影响。据报道,甲醇、乙醇、丙酮、乙腈以及二甲亚砜(dimethylsulfoxide,DMSO)在10%和20%的浓度下可促进酶活,前三者在浓度为10%时酶活甚至能提高到142%;当浓度达到50%时,所有有机溶剂都会对芽胞杆菌漆酶造成抑制效果[8, 57, 64]。与其他酶学性质一样,重组漆酶和野生型漆酶的稳定性有时会有很大的不同。例如,在浓度为50%的二甲苯溶液中芽胞漆酶的酶活仍具初始的94.28%,而重组CotA漆酶则只剩下不到15%[34, 65]。合适的碱基突变也可以提高漆酶在有机溶剂中的稳定性。例如,Rasekh等[69]以疏水残基替换蛋白表面带负电荷的氨基酸能够增加热稳定性和有机溶剂稳定性,他们还发现,酶的稳定性依赖于烷基链的长度,而且漆酶的有机溶剂耐受性与热稳定性呈正相关。
有多篇关于真菌漆酶的报道称,漆酶固定化后极大提高了其对有机溶剂的耐受性,甚至在有机溶剂浓度为93%混合液中,漆酶的酶活仍存有10%−20%[47]。目前,芽胞杆菌漆酶固定化的研究较少,尚无人探讨其固定化后在有机溶剂中的稳定性。
3.5 金属离子对酶的影响研究表明,不同金属离子对芽胞杆菌漆酶的影响差异较大。在10 mmol/L的浓度范围下,Li+、Na+、Mg2+、Ca2+、Ba2+对芽胞杆菌漆酶有促进作用,Mg2+、Ca2+和Ba2+的作用尤其明显,K+对酶活有较小的促进,Ag+和Hg2+则严重抑制了漆酶的酶活,Fe3+的也有较小的抑制作用。Mn2+与Zn2+对芽胞杆菌漆酶酶活的影响尚难定论,既有极大促进的报道,又有强烈抑制的报道,这可能与漆酶的来源和处理方法有关[10, 34, 63, 66, 67]。
金属离子中,铜离子对漆酶的影响最大。铜离子是CotA漆酶的必备成分,对漆酶的活性影响很大。在缺铜的情况下,CotA仍然会装配进芽胞外衣,但形成的是失活形式的酶,而当铜过量时也会抑制酶活[33]。三核铜中心含铜位点的正确折叠离不开铜,这一现象可部分解释酶的动力学和稳定性特性的差异。培养基中的含氧量对重组表达在E. coli中的CotA的含铜量影响很大。在好氧环境下,E. coli会表达很多缺铜CotA蛋白,相反,在微好氧并且铜足量的生长环境下,缺铜蛋白相对较少[41]。同时,CotA中的二硫键也影响着催化中心对铜的掺入和释放,在去除二硫键的情况下,铜的掺入和释放速率更快[53]。此外,Gunne等[70]发现有一个铜伴侣蛋白也能影响铜离子插入CotA。E. coli中并无此蛋白。他们将来源于B. licheniformis的CotA和铜伴侣蛋白CopZ共表达在E. coli中,铜的占位率提高了20%,活性提高了26%,为芽胞杆菌漆酶的异源表达提供了新的理论。
4 芽胞杆菌漆酶的应用漆酶由于具有氧化单酚、二酚、多酚、氨基酚、甲氧基苯酚、芳香胺以及抗坏血酸的能力,一直是环保,造纸,纺织乃至食品工业、能源、医疗等行业的研究热点[29]。目前,芽胞杆菌漆酶的应用研究主要集中在以下几方面。
4.1 染料脱色合成染料以污水流的形式从纺织工厂和染料制造工厂排入到环境之中,利用漆酶对合成染料进行脱色处理,为解决染料的环境污染问题提供了一种新方法。目前,白腐真菌漆酶是降解各种染料最高效的漆酶[1]。然而,白腐真菌漆酶极度依赖酸性条件,当环境pH高于7.0时就没有脱色效果了,相反,芽胞漆酶在碱性条件下活性更好,即使在pH 9.0时仍能完成脱色过程[59]。
当前已有关于芽胞杆菌漆酶对偶氮染料、三芳甲烷染料、蒽醌染料、酞菁染料及靛族染料共5类染料脱色的报道,其中尤以偶氮类染料最多[12, 60, 71]。芽胞漆酶对染料的脱色率因染料而异,这种差异是由于染料芳香环上电子供体取代基吸电子能力不同,即是由于染料的结构不同造成的[59]。不同菌种的漆酶脱色效率也会有较大差异。例如,Lu等[12, 64]在pH 9.0条件下,以乙酰丁香酮(acetosyringone,ACE)为氧化还原介体,来源于B. licheniformis LS04的芽胞漆酶在反应1 h时对活性黑5、活性蓝19以及靛蓝胭脂红的脱色率都超过了80%,而来源于B. amyloliquefaciens LC02的芽胞漆酶对靛蓝胭脂红的脱色率在1 h时还不到60%。芽胞漆酶的重复利用率很高。据Zhang等[10]报道,游离态的芽胞漆酶对三芳甲烷类染料反复使用5次仍有相同脱色效果;B. amyloliquefaciens LC02的固定化芽胞漆酶在 pH 9.0的溶液中反复使用15次,脱色效率仍能 达到99%[12]。
废水的成分往往比较复杂,采用多种酶来协同处理是常用的办法。例如,Tamboli等[20]和Kadam等[17]分别将产胞外漆酶的B. odysseyi SUK3和B. cereus EBT1与其他菌株混合培养,最终将得到的漆酶、偶氮还原酶等多种酶一同用于染料脱色,可取得比漆酶单独作用更好的效果。Mendes等[71]还发现,来源于恶臭假单胞菌(Pseudomonas putida)的偶氮还原酶PpAzoR比CotA漆酶具有更广泛的特异性,但最终产物的毒性却比原本染料还高2−3倍,当他们向含偶氮还原酶PpAzoR的废水中加入CotA漆酶时,毒性大幅降低。他们将ppAzoR和cotA两个基因共表达在E. coli里,最终重组菌可使染料废水脱色水平达80%以上,解毒水平上升到50%。本实验室重组表达的短小芽胞杆菌W3菌株的CotA漆酶在碱性条件下(pH 9.0)作用5 h后,对两种偶氮类及两种蒽醌类染料的氧化脱色率均能达到90%以上[58]。
4.2 木质素降解木质素是地球上最丰富的芳香族聚合物,由于其极复杂的杂聚物和高分子量,极难对其进行生物降解,以致在生物制浆、漂白以及制浆废水处理中造成了极大的妨碍。生物酶降解木质素的研究始于20世纪80年代,当前已有大量关于白腐真菌和褐腐真菌的研究,这些真菌能够分泌漆酶、木质素过氧化物酶和锰过氧化物酶[72]。
芽胞杆菌漆酶用于降解木质素的研究较晚。2011年,Ribeiro等[73]首次展开对CotA漆酶降解木质素的研究。他们将木聚糖酶(XynA)及其耐热突变体(XynAG3)分别插入到漆酶(CotA)的表面loop片段中,各形成了一个嵌合体双功能酶。双功能酶既能以协同方式促进酚醛生色团的转移,又能降低卡伯值,其中的CotA-XynAG3在降解纸浆中的酚类化合物时比两个亲本酶混合使用的效率要高2.3倍,反应速率也更快,在硫酸盐纸浆漂白中具有极大的应用潜力。木聚糖与漆酶搭配使效果更好,这是因为木聚糖同木质素、纤维素共同组成了纸浆聚合物基体,木聚糖酶可以降解掉木聚糖而使木质素更多地暴露出来,有利于漆酶或ABTS自由基的进攻,使酚类化合物从纸浆纤维中释放出来。同样的原理,Furtado等[74]将β-1,3-1,4-葡聚糖酶(BglS)与漆酶(CotA)融合在一起形成嵌合体,既能降解木质素,又能产生葡聚糖酶,而且催化效率得到了提高,可协同作用从研磨甘庶渣中释放出还原糖。此外,Chang等[25]发现将Bacillus sp.与乳酸菌共同作用于植物秸秆,可极大地增加纤维素酶的表现力,其中Bacillus sp.产的漆酶用于降解木质素,而乳酸菌可以降解半纤维素。
4.3 生物燃料电池酶法生物燃料电池(Enzymatic biofuel cell,EBFC)是一项新兴的技术,它利用生物催化剂(酶)代替传统的金属催化剂,使燃料的阳极氧化和阴极氧化剂还原从而产生电流。漆酶能够催化氧直接还原为水而在转移4个电子的过程中并不形成过氧化氢这一中间体,因而普遍被人们认为可作为生物燃料电池阴极的生物催化剂[75]。芽胞杆菌漆酶稳定性好,利用它作为生物燃料电池的催化剂是一项有吸引力的研究。2011年,Beneyton等[76]首次报道芽胞漆酶用于生物燃料电池研究,他们将CotA漆酶固定化在了玻碳电极上,通过原位电化学还原功能化产生氨基苯单重氮盐(aminophenyl monodiazonium salts)并出现交联反应。对于还原O2来说,这些经CotA修饰的电极相比来源于T. versicolor的温和性漆酶具有更好的催化性能,CotA漆酶修饰的电极最佳工作温度为45−50 °C,工作7周后其电流仍具初始电流的35%并保持电流稳定,比真菌漆酶具有更好的应用价值。2013年,Beneyton等[77]又开发了一项与光刻工艺兼容的共价酶固定化技术,碳纳米电极图案化在玻璃片上,用于创造一个Y形无膜葡萄糖/O2微流体生物电池,而原来的CotA仍然用作阴极催化剂。
4.4 其他潜在应用除了上述应用外,漆酶还可用于生物修复、有机合成、饮料处理、生物传感器、生物燃料、医疗诊断和医药保健等领域[1, 2, 29],其中有些应用已在细菌漆酶中展开。例如,在生物合成方面,Sousa等[78, 79]分别使用来源于B. subtilis的CotA漆酶和来源于T. versicolor的漆酶对芳香胺进行处理,使得芳香胺发生自偶联而合成了一种可用于染发的新染料,而对取代芳香胺进行处理,可使其发生二聚作用而合成吩嗪(phenazine)和吩噁嗪酮(phenoxazinone)。在生物修复方面,Ulcnik等[80]用真菌漆酶和CotA用于降解生物杀虫剂林丹(lindane)和板硫烷(endosulfan),结果显示CotA漆酶对它们的降解效率比真菌漆酶更高。利用芽胞杆菌漆酶修复橄槛油厂废水污染的土壤和降解沼气化酒糟废水(biomethanated distillery spent wash,BMDS)中的有机物也有其特有的优势[81, 82]。此外,Hosseini-Abari等[13]发现B. athrophaeus的芽胞和微胶囊(芽胞热灭活体)可以使环境中的Ag+还原为Ag元素,最终使得AgNO3转化为纳米粒子,这种方法成本低、利于环保,非常具有工业化应用潜力。细菌漆酶所涉及的应用范围相对于整个漆酶的应用来说还非常狭窄,因细菌漆酶的独特优势,或许会在这些潜在应用中取得真菌漆酶所不可及的成效。
5 展望在很长时间里,真菌漆酶是唯一真正实现工业化应用的漆酶。2011年,Metgen公司开发出商业化的细菌漆酶产品,该公司生产的重组细菌漆酶(商品名为MetZyme,Product No. 10-101-LY)适宜温度范围很宽(4−80 °C),pH适宜范围为3.0−9.0,可应用于制浆造纸行业、高级生物燃料的生产以及废水的处理[2]。细菌漆酶因其耐高温、耐碱性、资源丰富,并且易于在工业宿主生物中表达等优点而广受人们关注。
当前,CotA的结构已基本清楚,芽胞杆菌漆酶的酶学性质也有较多的研究,但离真正工业化仍有一段距离。要解决制约芽胞杆菌漆酶工业化进程的问题,可以从以下几个方面着手:首先,我们要彻底弄清芽胞杆菌漆酶的结构与氧化还原电势之间的关系,以期通过分子生物学方法对其进行改造,提高其氧化还原电势;亦可通过宏基因组文库来筛选高氧化还原电势的细菌漆酶。其次,实现芽胞杆菌漆酶在异源宿主中高效分泌表达,使酶产量大幅提高;同时还可考虑与其他酶实现协同共表达,使酶的作用效果更加优良。另外,还可以通过化学修饰方法结合蛋白质工程来获得更高效的酶,通过酶的固定化处理来提高酶的反复利用率、改善酶的稳定性。我们相信,只要真正解决了芽胞杆菌漆酶的酶催化效率、产量等关键问题,芽胞杆菌漆酶的工业化时代就会马上到来。
| [1] | Madhavi V, Lele SS. Laccase: properties and applications[J]. Bioresources, 2009, 4(4): 1694-1717 |
| [2] | Santhanam N, Vivanco JM, Decker SR, et al. Expression of industrially relevant laccases: prokaryotic style[J]. Trends in Biotechnology, 2011, 29(10): 480-489 |
| [3] | van Waasbergen LG, Hildebrand M, Tebo BM. Identification and characterization of a gene cluster involved in manganese oxidation by spores of the marine Bacillus sp. strain SG-1[J]. Journal of Bacteriology, 1996, 178(12): 3517-3530 |
| [4] | Claus H, Filip Z. The evidence of a laccase-like enzyme activity in a Bacillus sphaericus strain[J]. Microbiological Research, 1997, 152(2): 209-216 |
| [5] | Hullo MF, Moszer I, Danchin A, et al. CotA of Bacillus subtilis is a copper-dependent laccase[J]. Journal of Bacteriology, 2001, 183(18): 5426-5430 |
| [6] | Koschorreck K, Richter SM, Ene AB, et al. Cloning and characterization of a new laccase from Bacillus licheniformis catalyzing dimerization of phenolic acids[J]. Applied Microbiology and Biotechnology, 2008, 79(2): 217-224 |
| [7] | Mohammadian M, Fathi-Roudsari M, Mollania N, et al. Enhanced expression of a recombinant bacterial laccase at low temperature and microaerobic conditions: purification and biochemical characterization[J]. Journal of Industrial Microbiology & Biotechnology, 2010, 37(8): 863-869 |
| [8] | Reiss R, Ihssen J, Thöny-Meyer L. Bacillus pumilus laccase: a heat stable enzyme with a wide substrate spectrum[J]. BMC Biotechnology, 2011, 11: 9 |
| [9] | Brander S, Mikkelsen JD, Kepp KP. Characterization of an alkali- and halide-resistant laccase expressed in E. coli: CotA from Bacillus clausii[J]. Plos One, 2014, 9(6): e99402 |
| [10] | Zhang C, Diao HW, Lu FX, et al. Degradation of triphenylmethane dyes using a temperature and pH stable spore laccase from a novel strain of Bacillus vallismortis[J]. Bioresource Technology, 2012, 126: 80-86 |
| [11] | Abari AH, Emtiazi G, Ghasemi SM. The role of exopolysaccharide, biosurfactant and peroxidase enzymes on toluene degradation by bacteria isolated from marine and wastewater environments[J]. Jundishapur Journal of Microbiology, 2012, 5(3): 479 |
| [12] | Lu L, Zhao M, Li GF, et al. Decolorization of synthetic dyes by immobilized spore from Bacillus amyloliquefaciens[J]. Catalysis Communications, 2012, 26: 58-62 |
| [13] | Hosseini-Abari A, Emtiazi G, Ghasemi SM. Development of an eco-friendly approach for biogenesis of silver nanoparticles using spores of Bacillus athrophaeus[J]. World Journal of Microbiology and Biotechnology, 2013, 29(12): 2359-2364 |
| [14] | Dalfard AB, Khajeh K, Soudi MR, et al. Isolation and biochemical characterization of laccase and tyrosinase activities in a novel melanogenic soil bacterium[J]. Enzyme and Microbial Technology, 2006, 39(7): 1409-1416 |
| [15] | Telke AA, Kalyani DC, Dawkar VV, et al. Influence of organic and inorganic compounds on oxidoreductive decolorization of sulfonated azo dye CI Reactive Orange 16[J]. Journal of Hazardous Materials, 2009, 172(1): 298-309 |
| [16] | Kaushik G, Thakur IS. Purification, characterization and USAGE of thermotolerant laccase FROM Bacillus sp. for biodegradation of synthetic dyes[J]. Applied Biochemistry and Microbiology, 2013, 49(4): 352-359 |
| [17] | Kadam AA, Kamatkar JD, Khandare RV, et al. Solid-state fermentation: tool for bioremediation of adsorbed textile dyestuff on distillery industry waste-yeast biomass using isolated Bacillus cereus strain EBT1[J]. Environmental Science and Pollution Research, 2013, 20(2): 1009-1020 |
| [18] | Rahman NHA, Rahman NA, Abd Aziz S, et al. Production of ligninolytic enzymes by newly isolated bacteria from palm oil plantation soils[J]. Bioresources, 2013, 8(4): 6136-6150 |
| [19] | Sondhi S, Sharma P, Saini S, et al. Purification and characterization of an extracellular, thermo-alkali-stable, metal tolerant laccase from Bacillus tequilensis SN4[J]. Plos One, 2014, 9(5): e96951 |
| [20] | Tamboli DP, Gomare SS, Kalme SS, et al. Degradation of Orange 3R, mixture of dyes and textile effluent and production of polyhydroxyalkanoates from biomass obtained after degradation[J]. International Biodeterioration & Biodegradation, 2010, 64(8): 755-763 |
| [21] | Sheikhi F, Ardakani MR, Enayatizamir N, et al. The determination of assay for laccase of Bacillus subtilis WPI with two classes of chemical compounds as substrates[J]. Indian Journal of Microbiology, 2012, 52(4): 701-707 |
| [22] | Zhao M, Sun PF, Du LN, et al. Biodegradation of methyl red by Bacillus sp. strain UN2: decolorization capacity, metabolites characterization, and enzyme analysis[J]. Environmental Science and Pollution Research, 2014, 21(9): 6136-6145 |
| [23] | Dawkar VV, Jadhav UU, Jadhav SU, et al. Biodegradation of disperse textile dye Brown 3REL by newly isolated Bacillus sp. VUS[J]. Journal of Applied microbiology, 2008, 105(1): 14-24 |
| [24] | Olukanni OD, Osuntoki AA, Awotula AO, et al. Decolorization of dyehouse effluent and biodegradation of Congo Red by Bacillus thuringiensis RUN1[J]. Journal of microbiology and biotechnology, 2013, 23(6): 843-849 |
| [25] | Chang YC, Choi D, Takamizawa K, et al. Isolation of Bacillus sp. strains capable of decomposing alkali lignin and their application in combination with lactic acid bacteria for enhancing cellulase performance[J]. Bioresource Technology, 2014, 152: 429-436 |
| [26] | Ruijssenaars HJ, Hartmans S. A cloned Bacillus halodurans multicopper oxidase exhibiting alkaline laccase activity[J]. Applied Microbiology and Biotechnology, 2004, 65(2): 177-182 |
| [27] | Zhao D, Gu HQ, Cui DZ, et al. The community structure of laccase-like multicopper oxidase-producing bacteria in soil of Liangshui Nature Reserve[J]. Acta Ecologica Sinica, 2012, 32(13): 4062-4070 (in Chinese)赵丹, 谷惠琦, 崔岱宗, 等. 凉水保护区土壤产类漆酶-多铜氧化酶细菌群落结构[J]. 生态学报, 2012, 32(13): 4062-4070 |
| [28] | Solomon EI, Sundaram UM, Machonkin TE. Multicopper oxidases and oxygenases[J]. Chemical Reviews, 1996, 96(7): 2563-2606 |
| [29] | Dwivedi UN, Singh P, Pandey VP, et al. Structure-function relationship among bacterial, fungal and plant laccases[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 68(2): 117-128 |
| [30] | Yu ML, Ni JF. Research advances in the insect laccase[J]. Chinese Journal of Bioprocess Engineering, 2014, 12(1): 80-85 (in Chinese)于孟兰, 倪金凤. 昆虫漆酶的研究进展[J]. 生物加工过程, 2014, 12(1): 80-85 |
| [31] | Givaudan A, Effosse A, Faure D, et al. Polyphenol oxidase in Azospirillum lipoferum isolated from rice rhizosphere: evidence for laccase activity in nonmotile strains of Azospirillum lipoferum[J]. FEMS microbiology letters, 1993, 108(2): 205-210 |
| [32] | Alexandre G, Zhulin IB. Laccases are widespread in bacteria[J]. Trends in Biotechnology, 2000, 18(2): 41-42 |
| [33] | Martins LO, Soares CM, Pereira MM, et al. Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of the Bacillus subtilis endospore coat[J]. Journal of Biological Chemistry, 2002, 277(21): 18849-18859 |
| [34] | Wang CL. Clone and heterologous expression of CotA gene of spore coat protein pocessing bacterial laccase activity[D]. Harbin: Doctoral Dissertation of Northeast Forestry University, 2010 (in Chinese)汪春蕾. 具细菌漆酶活性的芽胞外壁蛋白CotA基因克隆及异源表达研究[D]. 哈尔滨: 东北林业大学博士学位论文, 2010 |
| [35] | Wang TN. Expression of CotA protein from Bacillus subtilis by Pichia pastoris and recombinant protein characterization study[D]. Harbin: Master’s Thesis of Northeast Forestry University, 2012 (in Chinese)王天女. 毕赤酵母表达枯草芽胞杆菌CotA蛋白及重组蛋白的性质研究[D]. 哈尔滨: 东北林业大学硕士学位论文, 2012 |
| [36] | Zhang C, Zhang S, Diao HW, et al. Purification and characterization of a temperature- and pH-stable laccase from the spores of Bacillus vallismortis fmb-103 and its application in the degradation of Malachite Green[J]. Journal of Agricultural and Food Chemistry, 2013, 61(23): 5468-5473 |
| [37] | Enguita FJ, Martins LO, Henriques AO, et al. Crystal structure of a bacterial endospore coat component―A laccase with enhanced thermostability properties[J]. Journal of Biological Chemistry, 2003, 278(21): 19416-19425 |
| [38] | Durao P, Bento I, Fernandes AT, et al. Perturbations of the T1 copper site in the CotA laccase from Bacillus subtilis: structural, biochemical, enzymatic and stability studies[J]. Journal of Biological Inorganic Chemistry, 2006, 11(4): 514-526 |
| [39] | Melo EP, Fernandes AT, Durao P, et al. Insight into stability of CotA laccase from the spore coat of Bacillus subtilis[J]. Biochemical Society Transactions, 2007, 35(Pt 6): 1579-1582 |
| [40] | Nasoohi N, Khajeh K, Mohammadian M, et al. Enhancement of catalysis and functional expression of a bacterial laccase by single amino acid replacement[J]. International Journal of Biological Macromolecules, 2013, 60: 56-61 |
| [41] | Durao P, Chen Z, Fernandes AT, et al. Copper incorporation into recombinant CotA laccase from Bacillus subtilis: characterization of fully copper loaded enzymes[J]. Journal of Biological Inorganic Chemistry, 2008, 13(2): 183-193 |
| [42] | Sherif M, Waung D, Korbeci B, et al. Biochemical studies of the multicopper oxidase (small laccase) from Streptomyces coelicolor using bioactive phytochemicals and site-directed mutagenesis[J]. Microbial Biotechnology, 2013, 6(5): 588-597 |
| [43] | Claus H. Laccases and their occurrence in prokaryotes[J]. Archives of Microbiology, 2003, 179(3): 145-150 |
| [44] | Chen ZJ, Durao P, Silva CS, et al. The role of Glu498 in the dioxygen reactivity of CotA-laccase from Bacillus subtilis[J]. Dalton Transactions, 2010, 39(11): 2875-2882 |
| [45] | Brissos V, Chen ZJ, Martins LO. The kinetic role of carboxylate residues in the proximity of the trinuclear centre in the O2 reactivity of CotA-laccase[J]. Dalton Transactions, 2012, 41(20): 6247-6255 |
| [46] | Silva CS, Damas JM, Chen ZJ, et al. The role of Asp116 in the reductive cleavage of dioxygen to water in CotA laccase: assistance during the proton-transfer mechanism[J]. Acta Crystallographica Section D-Biological Crystallography, 2012, 68(2): 186-193 |
| [47] | Strong PJ, Claus H. Laccase: a review of its past and its future in bioremediation[J]. Critical Reviews in Environmental Science and Technology, 2011, 41(4): 373-434 |
| [48] | Hirose J, Nasu M, Yokoi H. Reaction of substituted phenols with thermostable laccase bound to Bacillus subtilis spores[J]. Biotechnology Letters, 2003, 25(19): 1609-1612 |
| [49] | Pereira L, Coelho AV, Viegas CA, et al. Enzymatic biotransformation of the azo dye Sudan Orange G with bacterial CotA-laccase[J]. Journal of Biotechnology, 2009, 139(1): 68-77 |
| [50] | Hong G, Ivnitski DM, Johnson GR, et al. Design parameters for tuning the type 1 Cu multicopper oxidase redox potential: insight from a combination of first principles and empirical molecular dynamics simulations[J]. Journal of the American Chemical Society, 2011, 133(13): 4802-4809 |
| [51] | Mot AC, Silaghi-Dumitrescu R. Laccases: complex architectures for one-electron oxidations[J]. Biochemistry (Moscow), 2012, 77(12): 1395-1407 |
| [52] | Durão P, Chen Z, Silva CS, et al. Proximal mutations at the type 1 copper site of CotA laccase: spectroscopic, redox, kinetic and structural characterization of I494A and L386A mutants[J]. Biochemical Journal, 2008, 412(2): 339-346 |
| [53] | Fernandes AT, Pereira MM, Silva CS, et al. The removal of a disulfide bridge in CotA-laccase changes the slower motion dynamics involved in copper binding but has no effect on the thermodynamic stability[J]. Journal of Biological Inorganic Chemistry, 2011, 16(4): 641-651 |
| [54] | Brissos V, Pereira L, Munteanu FD, et al. Expression system of CotA-laccase for directed evolution and high-throughput screenings for the oxidation of high-redox potential dyes[J]. Biotechnology Journal, 2009, 4(4): 558-563 |
| [55] | Hilden K, Hakala TK, Lundell T. Thermotolerant and thermostable laccases[J]. Biotechnology Letters, 2009, 31(8): 1117-1128 |
| [56] | Morozova OV, Shumakovich GP, Gorbacheva MA, et al. “Blue” laccases[J]. Biochemistry (Moscow), 2007, 72(10): 1136-1150 |
| [57] | Guan ZB, Zhang N, Song CM, et al. Molecular cloning, characterization, and dye-decolorizing ability of a temperature- and pH-stable laccase from Bacillus subtilis X1[J]. Applied Biochemistry and Biotechnology, 2014, 172(3): 1147-1157 |
| [58] | Guan ZB, Song CM, Zhang N, et al. Overexpression, characterization, and dye-decolorizing ability of a thermostable, pH-stable, and organic solvent-tolerant laccase from Bacillus pumilus W3[J]. Journal of Molecular Catalysis B: Enzymatic, 2014, 101: 1-6 |
| [59] | Held C, Kandelbauer A, Schroeder M, et al. Biotransformation of phenolics with laccase containing bacterial spores[J]. Environmental Chemistry Letters, 2005, 3(2): 74-77 |
| [60] | Loncar N, Bozic N, Lopez-Santin J, et al. Bacillus amyloliquefaciens laccase - From soil bacteria to recombinant enzyme for wastewater decolorization[J]. Bioresource Technology, 2013, 147: 177-183 |
| [61] | Mollania N, Khajeh K, Ranjbar B, et al. Enhancement of a bacterial laccase thermostability through directed mutagenesis of a surface loop[J]. Enzyme and Microbial Technology, 2011, 49(5): 446-452 |
| [62] | Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30(2): 215-242 |
| [63] | Li TL. properties of spore laccase from Bacillus subtilis WN02 and its use in the dye decolorization[D]. Harbin: Master’s Thesis of Northeast Forestry University, 2010 (in Chinese)李泰仑. 枯草芽袍杆菌WN02芽袍漆酶的性质及染料脱色研究[D]. 哈尔滨: 东北林业大学硕士学位论文, 2010 |
| [64] | Lu L, Zhao M, Wang TN, et al. Characterization and dye decolorization ability of an alkaline resistant and organic solvents tolerant laccase from Bacillus licheniformis LS04[J]. Bioresource Technology, 2012, 115: 35-40 |
| [65] | Lu L, Wang TN, Xu TF, et al. Cloning and expression of thermo-alkali-stable laccase of Bacillus licheniformis in Pichia pastoris and its characterization[J]. Bioresource Technology, 2013, 134: 81-86 |
| [66] | Su J. Produce laccase bacteria strain screening and its application[D]. Harbin: Master’s Thesis of Northeast Forestry University, 2013 (in Chinese)栗君. 产漆酶细菌菌株的筛选及其应用[D]. 哈尔滨: 东北林业大学硕士学位论文, 2013 |
| [67] | Xu TF, Lu L, Zhao M, et al. Isolation, identification of a laccase-producing bacterial strain and enzymatic properties of the laccase[J]. Microbiology China, 2013, 40(3): 434-442 (in Chinese)徐腾飞, 卢磊, 赵敏, 等. 一株产漆酶细菌的分离鉴定及酶学性质研究[J]. 微生物学通报, 2013, 40(3): 434-442 |
| [68] | Keum YS, Li QX. Fungal laccase-catalyzed degradation of hydroxy polychlorinated biphenyls[J]. Chemosphere, 2004, 56(1): 23-30 |
| [69] | Rasekh B, Khajeh K, Ranjbar B, et al. Protein engineering of laccase to enhance its activity and stability in the presence of organic solvents[J]. Engineering in Life Sciences, 2014, 14(4): 442-448 |
| [70] | Gunne M, Al-Sultani D, Urlacher VB. Enhancement of copper content and specific activity of CotA laccase from Bacillus licheniformis by coexpression with CopZ copper chaperone in E. coil[J]. Journal of Biotechnology, 2013, 168(3): 252-255 |
| [71] | Mendes S, Farinha A, Ramos CG, et al. Synergistic action of azoreductase and laccase leads to maximal decolourization and detoxification of model dye-containing wastewaters[J]. Bioresource Technology, 2011, 102(21): 9852-9859 |
| [72] | Lv YC, Chen YC, Sun SY, et al. Interaction among multiple microorganisms and effects of nitrogen and carbon supplementations on lignin degradation[J]. Bioresource Technology, 2014, 155: 144-151 |
| [73] | Ribeiro LF, Furtado GP, Lourenzoni MR, et al. Engineering bifunctional laccase-xylanase chimeras for improved catalytic performance[J]. Journal of Biological Chemistry, 2011, 286(50): 43026-43038 |
| [74] | Furtado GP, Ribeiro LF, Lourenzoni MR, et al. A designed bifunctional laccase/β-1,3–1,4-glucanase enzyme shows synergistic sugar release from milled sugarcane bagasse[J]. Protein Engineering Design & Selection, 2013, 26(1): 15-23 |
| [75] | Tan YM, Deng WF, Li YY, et al. Polymeric bionanocomposite cast thin films with in situ laccase-catalyzed polymerization of dopamine for biosensing and biofuel cell applications[J]. Journal of Physical Chemistry B, 2010, 114(15): 5016-5024 |
| [76] | Beneyton T, El Harrak A, Griffiths AD, et al. Immobilization of CotA, an extremophilic laccase from Bacillus subtilis, on glassy carbon electrodes for biofuel cell applications[J]. Electrochemistry Communications, 2011, 13(1): 24-27 |
| [77] | Beneyton T, Wijaya IPM, Ben Salem C, et al. Membraneless glucose/O2 microfluidic biofuel cells using covalently bound enzymes[J]. Chemical Communications, 2013, 49(11): 1094-1096 |
| [78] | Sousa AC, Martins LO, Robalo MP. Laccase-catalysed homocoupling of primary aromatic amines towards the biosynthesis of dyes[J]. Advanced Synthesis & Catalysis, 2013, 355(14/15): 2908-2917 |
| [79] | Sousa AC, Oliveira MC, Martins LO, et al. Towards the rational biosynthesis of substituted phenazines and phenoxazinones by laccases[J]. Green Chemistry, 2014, 16(9): 4127-4136 |
| [80] | Ulcnik A, Cigic IK, Pohleven F. Degradation of lindane and endosulfan by fungi, fungal and bacterial laccases[J]. World Journal of Microbiology and Biotechnology, 2013, 29(12): 2239-2247 |
| [81] | Naclerio G, Falasca A, Petrella E, et al. Potential role of Bacillus endospores in soil amended by olive mill wastewater[J]. Water Science and Technology, 2010, 61(11): 2873-2879 |
| [82] | Yadav S, Chandra R. Detection of persistent organic compounds from biomethanated distillery spent wash (BMDS) and their degradation by manganese peroxidase and laccase producing bacterial strains[J]. Journal of Environmental Biology, 2013, 34(4): 755-764 |
 2015, Vol. 42
2015, Vol. 42