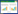扩展功能
文章信息
- 蒋海霞, 周莲, 何亚文
- JIANG Hai-Xia, ZHOU Lian, HE Ya-Wen
- 铜绿假单胞菌生防菌株抑菌代谢产物及其生防应用研究进展
- Research progress in biocontrol strain Pseudomonas aeruginosa: antifungal metabolites and their applications in biocontrol
- 微生物学通报, 2015, 42(7): 1338-1349
- Microbiology China, 2015, 42(7): 1338-1349
- 10.13344/j.microbiol.china.150234
-
文章历史
- 收稿日期: 2015-03-21
- 接受日期: 2015-05-11
- 优先数字出版日期(www.cnki.net): 2015-05-13
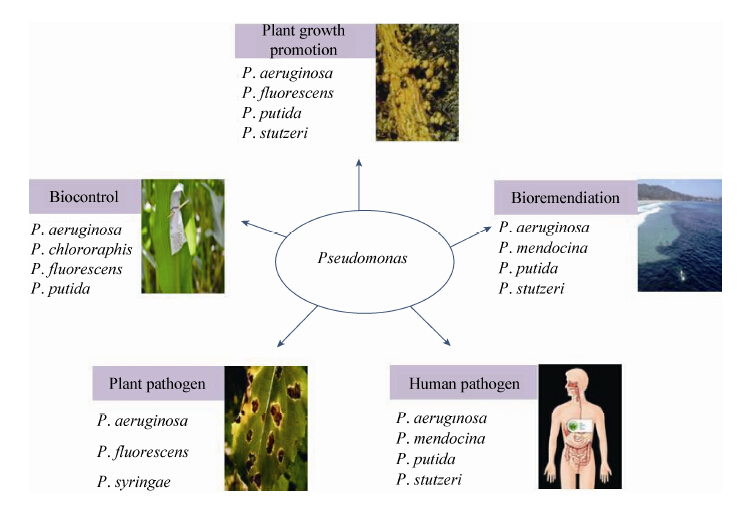
假单胞菌属(Pseudomonas)是一类高度多样性的微生物种群,广泛分布于自然界的各种环境中,如土壤、水、动植物体以及各种生物和环境生态 位[1]。常见的假单胞菌包括:荧光假单胞菌(P.fluorescens)、铜绿假单胞菌(P. aeruginosa)、绿针假单胞菌(P.chlororaphis)、恶臭假单胞菌(P.putida)、丁香假单胞菌(P.syringae)、施氏假单胞菌(P.stutzeri)和门多萨假单胞菌(P.mendocina)。按照功能分,假单胞菌可分为植物根际促生菌、植物病原菌、人类条件致病菌、生物修复菌和生物防治菌(图 1)。过去二十多年中,研究和应用最多的假单胞菌生防菌株是荧光假单胞菌,因其产生抑菌次生代谢产物,具有很好的生物防治效果。已报道的典型假单胞菌生防菌株有:荧光假单胞菌2-79[2]、绿针假单胞菌30-84[3]和GP72[4],通过产生吩嗪-1-羧酸(Phenazine-1-carboxylic acid,PCA)抑制小麦全蚀病菌、辣椒疫霉、黄瓜炭疽病菌、甜瓜蔓枯病菌和水稻纹枯病菌等;荧光假单胞菌Pf-5[5]和CHA0[6]通过产生藤黄绿脓菌素(Pyoluteorin,Plt)、硝吡咯菌素(Pyrrolnitrin,Prn)和2,4-二乙酰藤黄酚(2,4-diacetylphloroglucinol,DAPG)抑制植物病原菌终极腐霉引起的根腐病、立枯丝核菌引起的猝倒病和小麦全蚀病,同时也能抑制植物病原细菌胡萝卜软腐欧氏杆菌引起的马铃薯软腐病;荧光假单胞菌DR54[7]能够产生环状脂多肽(Cyclic lipopeptides,CLPs)-粘质酰胺(Viscosinamide),对植物病原真菌终极腐霉和立枯丝核菌具有显著抗性。
|
| 图 1 假单胞菌的功能应用和环境分布 Figure 1 Functional and environmental spectrum of Pseudomonas spp. |
铜绿假单胞菌(Pseudomonas aeruginosa)是动物和人类的条件性致病菌,尤其是对免疫缺陷和囊性纤维化病人具有较强的感染性,通常会引起肺部及尿道感染,或造成烧伤、伤口等感染[8],是临床上三大条件性致病细菌之一,具有固有和获得性的多重耐药性。其中临床分离的铜绿假单胞菌株PAO1、LESB58和UCBPP-PA14研究得较为深入。近年来,一系列具有很好生物防治效果的根际来源铜绿假单胞菌陆续被分离和鉴定。这些铜绿假单胞菌能分泌多种拮抗植物病原菌的代谢产物,可以防治多种植物真菌或细菌类病害,称之为铜绿假单胞菌生防菌株。对铜绿假单胞菌生防菌株的研究,一方面可以挖掘更多的假单胞菌生防菌株资源,另一方面可以为临床铜绿假单胞菌的研究提供借鉴。本文将系统综述铜绿假单胞菌生防菌株的种类、抑菌代谢产物的多样性及其合成机制与在生物防治上的应用。
2 已报道的铜绿假单胞菌生防菌株1987年比利时的Verstraete团队首次从大麦根际分离到铜绿假单胞菌7NSK2,利用7NSK2的菌液处理种子和土壤,不但可以促进谷物的生长,而且可以改善植物根际微生物的种群[9]。此后二十多年,先后有数十株铜绿假单胞菌生防菌株被分离和鉴定,其中研究比较深入的菌株见表 1。
| 菌株 Strains | 抑菌次生代谢产物 Antifungal metabolites | 抑制的病菌 Inhibited pathogens | 参考文献 References |
| 7NSK2 | 铁载体、绿脓菌素 | 腐霉菌(Pythium)、灰葡萄孢菌(Botrytis cinerea)、 稻瘟菌(Magnaporthe grisea) | [10, 11] |
| NJ-15 | 铁载体 | 尖镰刀菌(Fusarium oxysporum)、 链格孢菌(Alternaria alternate) | [12] |
| JAS-25 | 铁载体 | 镰刀菌(Fusarium)、黑曲霉(Aspergillus niger) | [13] |
| PNA1 | 吩嗪-1-羧酸、吩嗪-1-酰胺 | 尖镰刀菌(Fusarium oxysporum)、 腐霉菌(Pythium) | [14, 15] |
| PA1201 | 吩嗪-1-羧酸、吩嗪-1-酰胺 | 纹枯菌(Rhizoctonia solani)、 白叶枯菌(Xanthomonas oryzae) | [16] |
| M18 | 吩嗪-1-羧酸、藤黄绿脓菌素 | 丝核菌(Rhizoctonia solani)、 疫霉菌(Phytophora capsici) | [17] |
| GC-B26 | 吩嗪-1-羧酸 | 疫霉菌(Phytophora capsici)、 炭疽菌(Colletotrichum) | [18] |
| PUPa3 | 吩嗪-1-酰胺 | 多种病原真菌 | [19] |
| MML2212 | 吩嗪-1-酰胺 | 纹枯菌(Rhizoctonia solani)、白叶枯菌(Xanthomonas oryzae) | [20] |
| ID4365 | 铁载体、吩嗪-1-羧酸 | 白绢菌(Sclerotium rolfsii)、 黑曲霉(Aspergillus niger) | [21] |
| RM-3 | 吩嗪类化合物、铁载体 | 多种病原真菌 | [22] |
| SD12 | 1-羟基吩嗪 | 丝核菌(Rhizoctonia solani) | [23] |
| PGPR2 | 3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺 | 菜豆壳球孢菌(Macrophomina phaseolina) | [24] |
| − | L-2-氨基-4-甲氧基-反式-3-丁烯酸 | 火疫病菌(Erwinia amylovora) | [25] |
| − | 鼠李糖脂 | 腐霉菌(Pythium)、疫霉菌(Phytophora) | [26] |
| PF23 | 胞外多糖 | 菜豆壳球孢菌(Macrophomina phaseolina) | [27] |
| K-187 | − | 镰刀菌(Fusarium) | [28] |
| ZJ1999 | − | 丝核菌(Rhizoctonia solani) | [29] |
| Swu31-2 | − | 青枯菌(Ralstonia solanacearum) | [30, 31] |
Note: −: Information unavailable.
假单胞菌次生代谢产物种类丰富,有24种次生代谢产物已被鉴定[32],这些代谢产物对维持其生态适应性和在复杂的根际生境中繁殖生存有重要意义。铜绿假单胞菌的基因组由高度保守的核心基因组和不同的附加基因组组成。由于附加基因组元件来源于不同种或属细菌的遗传物质横向转移,因此赋予了不同铜绿假单胞菌产生不同次生代谢产物的能力。目前在分离到的铜绿假单胞菌生防菌株中,已报道的抑菌代谢产物主要有嗜铁素类、吩嗪类、藤黄绿脓菌素类和胞外多糖类,还有其他假单胞菌生防菌株不产生的鼠李糖脂和新型抗生素。每株铜绿假单胞菌生防菌株都有同时产生几种抑菌代谢产物的潜力。由于铜绿假单胞菌野生型菌株抑菌次生代谢产物的发酵效价相对较低,研究者在研究其生物合成和调控机制的基础上,通过遗传改造和发酵条件优化等手段提高其发酵效价,为生物农药的开发和应用奠定基础。
3.1 嗜铁素类嗜铁素(铁载体)是假单胞菌生防菌株产生最普遍的抑菌代谢产物。在低铁环境下,铁载体可以螯合环境中微量的铁元素,通过特异的转运系统将铁转移到体内,不仅可以满足自身的生长需要,还可以使环境中的铁浓度降低,抑制病原微生物的生长繁殖,进而达到控制植物病害的目的[33]。铜绿假单胞菌7NSK2[10]、NJ-15[12]、RM-3[22]、JAS-25[13]通过分泌铁载体能抑制不同的植物病原菌(表 1)。
铜绿假单胞菌生防菌株产生的嗜铁素主要有脓青素(Pyoverdine)、绿脓菌螯铁蛋白(Pyochelin)等(图 2)。脓青素的合成路径目前还没有完全明确,pvdA、pvdD、pvdF、pvdI和pvdJ五个基因很有可能直接负责脓青素多肽的合成[34](图 2A)。绿脓菌螯铁蛋白的合成前体是分支酸,在PchA和PchB的催化下,转化成水杨酸,然后在PchC、PchD和PchEFGHI催化下,生成绿脓菌螯铁蛋白。pchR是绿脓菌螯铁蛋白的一个调控基因[32](图 2B)。
吩嗪(Phenazine)是一类含氮的杂环分子。吩嗪类抗生素是许多假单胞菌生防菌株产生的次级代谢产物,具有抑制植物病原真菌生长的功能[2, 3, 4]。吩嗪类抗生素进入细胞后可以作为电子载体传递电子到靶细胞,通过增加胞内超氧化物自由基,使靶细胞中毒死亡[35]。目前为止,已报道的天然吩嗪类抗生素主要有吩嗪-1-羧酸及其衍生物吩嗪-1-酰胺(Phenazine-1-carboxamide,PCN)、1-羟基吩嗪(1-Hydroxyphenazine,1-OH-PHZ)和绿脓菌素(Pyocyanin,PYO)等(图 3A)。铜绿假单胞菌M18[17]、PNA1[14]、GC-B26[18]、ID4365[21]通过分泌PCA能抑制不同的植物病原菌(表 1)。由于PCA分子带有一个羧基(图 3A),导致其在酸性环境中抑菌活性强,在碱性条件下抑菌活性显著下降。PCN分子以中性酰胺基团取代了PCA分子中的羧基基团(图 3A),在不同pH条件下,抑菌活性稳定。铜绿假单胞菌PNA1[15]、PUPa3[19](图 3B)、MML2212[20]、PA1201[16]分泌的PCN具有广谱抗植物真菌和细菌活性。PYO在酸性条件下几乎没有抑菌能力,在中性条件下有一定的抑菌效果[21]。铜绿假单胞菌7NSK2通过铁载体和PYO的协同作用诱导双子叶植物对病原菌的抗性[11]。PYO是一种毒力因子,用于防治真菌病害时,使用浓度在5−10 mg/L是安全的[36]。铜绿假单胞菌SD12产生的1-OH-PHZ能有效抑制立枯丝核菌(Rhizoctonia solani)引起的根腐和枯萎[23](图 3B)。
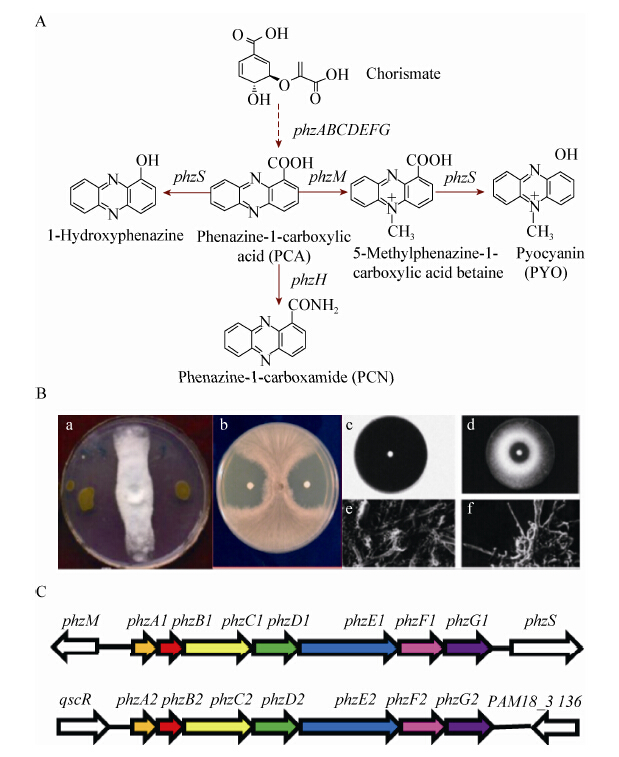
|
|
图 3
铜绿假单胞菌生防菌株吩嗪-1-羧酸及其衍生物的生物合成机制和抑菌活性
Figure 3
Biosyntheic mechanism, antifungal activities of Phenazine-1-carboxylic (PCA) acid and its derivatives in biocontrol strainPseudomonas aeruginosa
注:A:吩嗪-1-羧酸衍生物绿脓菌素、1-羟基吩嗪和吩嗪-1-酰胺;B:抑菌效果:铜绿假单胞菌M18抑制甜瓜蔓枯菌生长(a)[17];1-羟基吩嗪抑制水稻纹枯菌生长(b)[23];吩嗪-1-酰胺抑制菜豆壳球孢菌生长(c−f)[19];C: PCA生物合成基因簇. Note: A: PCA derivatives; B: Antifungal activities: inhibition of Mycosphaerella melonis by M18 (a)[17], inhibition of Rhizoctonia solani by 1-hydroxyphenazine(b)[23] and inhibition of Macrophomina phaseolina by phenazine-1-carboxamide (c−f)[19]; C: PCA biosynthesis gene clusters. |
在铜绿假单胞菌的基因组中,包含两个高度同源的吩嗪-1-羧酸合成基因簇:phzA1B1C1D1E1F1G1 (简称phzA1−G1)和phzA2B2C2D2E2F2G2 (简称phzA2−G2)[37](图 3C)。M18菌株通过两个基因簇之间独特的诱导机制,形成一个级联放大系统,在生长后期或在特定的外界环境刺激下大量产生吩嗪-1-羧酸[38]。莽草酸途径终产物分支酸在吩嗪-1-羧酸合成基因簇的催化下,生
成吩嗪-1-羧酸;吩嗪-1-羧酸在黄素依赖羟化酶PhzS的催化下,转化成1-羟基吩嗪;在甲基转移酶PhzM和黄素依赖羟化酶PhzS的共同催化下,转化成一种致病因子绿脓菌素[39];在修饰酶PhzH的催化下转化成吩嗪-1-酰胺,PhzH在M18中因无义突变而失活[40](图 3A)。吩嗪-1-羧酸合成基因簇的表达受到多个水平的调控:(1) 群体感应调控系统:铜绿假单胞菌至少包含3套群体感应系统:lasI/lasR、rhlI/rhlR和PQS (Pseudomonas quinolone signal)系统。许多调控子通过调节群体感应系统调控PCA的合成。在M18中,LasR通过调节RhlI的表达,实现对PCA合成的负调控[41]。(2) 环境因素调控:通过分析不同温度条件下M18菌株的转录组,发现10.6%的基因表达是温度依赖型的[17]。M18菌株在28 °C条件下产生的吩嗪类物质主要是PCA,而在37 °C条件下产生的吩嗪类物质则主要是PYO[42]。(3) 转录和转录后调控:在M18菌株中,小RNA的分子伴侣蛋白Hfq能够直接结合在phzM基因mRNA富含AU的5′-非编码区,在转录后水平抑制phzM的表达,从而阻遏PCA向PYO转化[43]。RsmY/RsmZ是铜绿假单胞菌中的小RNA分子,能负调控PCA的合成[40]。
M18菌株在中国已经成为生产绿色农药申嗪霉素(吩嗪-1-羧酸)的重要工业菌株,然而相对低的PCA发酵效价阻碍了申嗪霉素的产业化生产。因此,通过基因工程或代谢工程提高PCA的发酵效价成为当务之急。上海交通大学相关团队基于申嗪霉素合成和调控机制的研究结果,先后对M18野生菌株进行了多代遗传改造。首先构建了gacA缺失突变体M18G,其发酵条件经优化后,申嗪霉素的发酵效价提高到2 g/L[44-45];在此基础上,进一步构建了gacA和qscR双突变体M18GQ,使申嗪霉素的发酵效价达到4 g/L[46];在M18GQ菌株中,利用质粒pME6032过表达phzA1−G1基因簇,使申嗪霉素的发酵效价提高到6 g/L[47];申嗪霉素第一合成基因簇(phzA1−G1)的5′-非编码区含有PCA合成的负调控元件,敲除phzM、phzS和这段非编码区后,申嗪霉素的发酵效价可达4.8 g/L[48]。
3.3 藤黄绿脓菌素(Pyoluteorin,Plt)Plt是一种芳香族聚酮类抗生素,化学名称为2,3-二氯-5-[2′,6′-二羟基苯甲酰基]吡咯(图 4A)。P1t最早由Takeda[49]从铜绿假单胞菌T359和IF03455分离得到。Plt对卵菌属真菌抑制性最强,尤其能够有效地抑制植物病原菌终极腐霉(Pythium ultimum)[6]。Plt与PCA混配对水稻纹枯病菌的抑制有增效作用[17]。
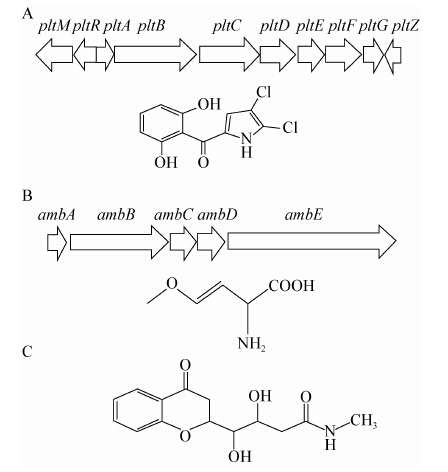
|
|
图 4
3种抑菌次生代谢产物的合成基因簇及其化学结构式
Figure 4
Biosynthesis gene clusters and chemical structure of three kinds of antifungal metabolites
注:A:藤黄绿菌素[32];B:L-2-氨基-4-甲氧基-反式-3-丁烯 酸[54];C:3,4-羟基-N-甲基-4-苯并二氢脓吡喃酮-丁酰胺[24]. Note: A: Pyoluteorin[32]; B: L-2-amino-4-methoxy-trans-3-butenoic acid[54]; C: 3,4-Dihydroxy methyl 4-chromanone butanamide[24]. |
藤黄绿脓菌素的生物合成基因簇包括操纵子pltABCDEFG、转录调控基因pltR、pltM和pltZ (图 4A)。PltR可通过Plt自我诱导启动Plt合成基因簇的表达[50]。pltZ对Plt的合成具有负调控作用。在铜绿假单胞菌M18中,突变pltZ后,Plt的合成量比野生型提高4.4倍[51]。次生代谢阻遏蛋白RsmA抑制Plt的合成[52]。许煜泉团队构建了rsmA突变株M18R,其发酵条件经优化后,使Plt的发酵效价达600 mg/L,表明藤黄绿脓菌素作为生物农药具有商业应用推广的良好前景[53]。
3.4 L-2-氨基-4-甲氧基-反式-3-丁烯酸(L-2- amino-4-methoxy-trans-3-butenoic acid,AMB)L-2-氨基-4-甲氧基-反式-3-丁烯酸(图 4B)是铜绿假单胞菌生防菌株产生的另一类抗生素,可强烈抑制梨火疫病菌(Erwinia amylovora),也可以干扰早熟禾杂草种子的萌发[25]。AMB和荧光假单胞菌WH6产生的4-甲酸基氨基氧基乙烯基氨基乙酸(4-Formylaminooxyvinylglycine)的生物活性类似,但是两者的抑菌机制并不完全相同。
Lee等[54]通过点突变和异源表达的方式,在铜绿假单胞菌PAO1中鉴定了L-2-氨基-4-甲氧基-反 式-3-丁烯酸的合成基因簇ambABCDE (图 4B),并推测了AMB的合成路径:在AmbB和AmbE两个酶催化下生成一个长的前体多肽,然后在AmbC和AmbD两个酶催化下先后羟基化,随后生成AMB。将AMB的合成基因簇ambABCDE在生物防治模式株荧光假单胞菌CHA0中异源表达,可以产生AMB,能有效防治果园中的梨火疫病菌[25]。
3.5 3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺(3,4-Dihydroxy methyl 4-chromanone butanamide)为了适应根际生境,铜绿假单胞菌生防菌株的基因组通过来源于不同种或属细菌的遗传物质横向转移,获得了一些临床分离的铜绿假单胞菌中不存在的基因。Illakkiam等[24]从绿豆根际分离到一株铜绿假单胞菌PGPR2,可抑制菜豆壳球孢(Macrophomina phaseolina)引起的绿豆炭腐病。抑菌次生代谢产物经过提取、纯化,被鉴定为3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺(图 4C),是一种新型抗生素,对菌丝的破坏方式类似吩嗪类化合物的作用方式。
基于PGPR2的基因组草图,Illakkiam等[55]初步推测新型抗生素3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺的合成路径如下:乙酰辅酶A和生物素羧化而成丙二酸单酰辅酶A;5个分子的丙二酸单酰辅酶A再和1个分子的乙酰辅酶A缩合,生成己酮化合物;己酮化合物再经过环化和缩合生成不同的色酮中间体。3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺的基本色酮骨架的生成可能经过类似的反应。然而,色酮单元中芳香环的脱羟基方式和侧链分子获得的线路及其自身连到色酮上的方式仍然不清楚。需要通过进一步研究找出3,4-二羟基-N-甲基-4-苯并二氢吡喃酮-丁酰胺的合成基因簇及其调控基因,进而通过遗传和代谢改造提高这种新型抗生素的发酵效价。铜绿假单胞菌产生的苯并二氢吡喃-4-酮衍生物有望开发成新型的生物农药。
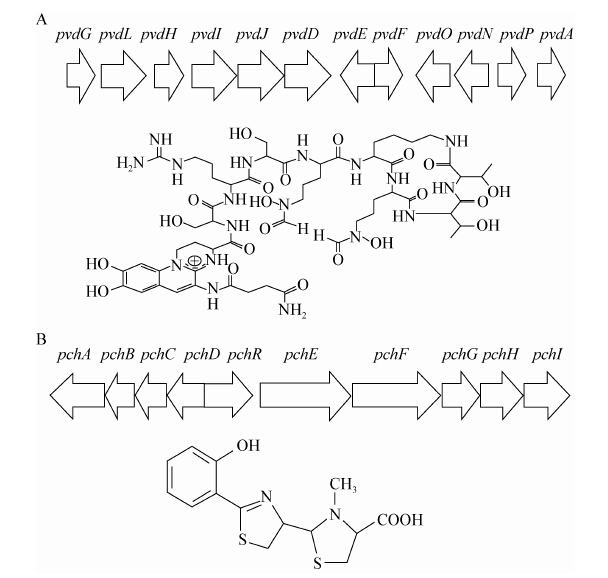
3.6 鼠李糖脂(Rhamnolipid)和胞外多糖类铜绿假单胞菌产生的鼠李糖脂可以修复人类所造成的环境污染,包括土壤、水、海岸线及海底中的油、金属或其他污染物[56, 57],同时鼠李糖脂具有良好的抑制真菌的活性。Stanghellini等[26]发现铜绿假单胞菌所产的表面活性剂鼠李糖脂对瓜果腐霉(Pythium aphanidermatum)和辣椒疫霉的游动孢子萌发具有抑制作用。作为一种新的活性成分,鼠李糖脂生物杀菌剂已获得美国联邦批准登记(68 FR 24456)。
鼠李糖脂是由一个或两个β-羟基疏水脂肪酸通过β-糖苷与一到两个鼠李糖分子链接形成。鼠李糖脂的结构多样,发酵产物中一般主要含有4种鼠李糖脂,学术界一般用R1−R4 (或RLl−RL4,RH1−RH4)表示(图 5)。在铜绿假单胞菌中,β-羟基疏水脂肪酸在RhlA和RhlB的催化下生成单鼠李糖脂,其合成受到rhlR基因调控;单鼠李糖脂在RhlC的催化下可生成双鼠李糖脂(图 5)。利用载体将rhlA、rhlB和rhlC导入异源宿主大肠杆菌中,可使鼠李糖脂在该菌株中大量合成[58]。
胞外多糖可以拮抗植物病原菌[59]。铜绿假单胞菌PF23分离于印度的植物根际,在盐胁迫条件下高产胞外多糖。PF23分泌的胞外多糖(主要是葡萄糖和半乳糖)对菜豆壳球孢引起的向日葵碳腐病有显著的抑制作用[27]。
4 铜绿假单胞菌生防菌株的抑菌代谢产物在生物防治上的应用铜绿假单胞菌生防菌株的研究历史较短,目前大多数铜绿假单胞菌生防菌株在生物防治上的应用局限于活菌防治。由于微生物活菌制剂货架期短,有效定殖能力差,在大田中的防治效果不稳定;而且铜绿假单胞菌是一种条件致病菌,不宜扩散到环境中,所以利用铜绿假单胞菌代谢产物作为微生物源农药防治病害是理想的选择。铜绿假单胞菌M18,1996年分离于上海郊区甜瓜根际,能同时分泌PCA和Plt等两种不同类型的抗真菌物质[60],其PCA产品申嗪霉素低毒、无残留,可以有效防治瓜类枯萎病(Fusarium)、辣椒疫病(Phytophora capsici)和水稻纹枯病(Rhizoctonia solani)。其中,1%申嗪霉素悬浮剂对水稻纹枯病的防治效果与当前使用的主导农药井冈霉素相当。2011年3月,申嗪霉素原药及其1%悬浮剂获得中国农业部农药登记证(编号:PD20110314、PD20110315)[61]。申嗪霉素在我国南方区域防治病害的效果比在北方理想,这是因为我国南方土壤呈酸性,有利于有效成分吩嗪-1-羧酸的活性稳定。目前,上海交通大学相关团队构建了新的M18工程菌株,开发了以吩嗪-1-酰胺为主要成分的“交大2号”生物农药,因为吩嗪-1-酰胺在酸性和碱性土壤中活性都稳定,所以在我国南方和北方都可以应用于防治小麦赤霉病(Fusarium graminearum)。铜绿假单胞菌GC-B26产生的PCA对辣椒疫霉和黄瓜炭疽病菌(Colletotrichum)都有很好的防治效果,其最小抑制浓度为5 mg/L,药效仅次于商业化的甲霜灵和百菌清[18];铜绿假单胞菌ID4365产生的PCA对花生白绢病(Sclerotium rolfsii)的最小抑制浓度是29 mg/L,对黑曲霉(Aspergillus niger)、镰刀菌和炭疽病也有一定的抑制作用[21]。铜绿假单胞菌M18产生的Plt对土传病害抑制效果良好,但是在生物防治过程中发现,Plt自身化学结构并不稳定,在贮存和大田使用过程中易被降解;在碱性溶液(pH 7.8)和紫外光照射条件下,Plt稳定性较差,半衰期只有4−15 d[62]。因此,利用Plt作为先导化合物,开发稳定的Plt衍生物作为生物农药值得进一步研究。目前许多铜绿假单胞菌生防菌株的有效杀菌成分尚未得到鉴定。铜绿假单胞菌K-187分离于中国台湾土壤,其产生的抗菌活性物质能有效抑制镰刀菌等多种真菌[28];任小平等从浙江水稻根际分离获得一株铜绿假单胞菌ZJ1999,其粗提液对水稻纹枯病菌的抑制效果显著[29]。张伏军等从重庆黔江烟草根际分离获得一株铜绿假单胞菌swu31-2[30],其活性物质粗提物对烟草青枯病(Ralstonia solanacearum)的防治效果为60.32%,防效好于农用链霉素[31]。
5 总结与展望近年来,铜绿假单胞菌生防菌株的显著抑菌活性引起了研究者们极大的关注。一系列抑菌次生代谢产物被分离和鉴定。随着基因组测序技术的迅速发展,尚未鉴定的抑菌次生代谢产物及其合成途径与调控机制将不断被揭示和阐明。利用微生物产生的次生代谢产物(抗生素)防治植物病害有很多优点,但是长期单一使用容易产生抗药性问题,所以急需开发更多的抗生素品种。近几十年来,人们对铜绿假单胞菌生防菌株抑菌代谢产物的合成机制与遗传改造进行了一定程度的研究,目前已有一些生防制剂问世,但仍然存在许多问题。例如:铜绿假单胞菌生防菌株活菌制剂在大田中效果不稳定,对农作物病原菌的田间防治效果不如实验室中的离体试验;铜绿假单胞菌生防菌株抑菌次生代谢产物的发酵效价较低,影响了产业化发展的进程;在长期所处环境的压力下,不同生境来源的铜绿假单胞菌株进化出不同的致病基因型,根际分离的铜绿假单胞菌生防菌株相比临床分离的铜绿假单胞菌毒性较低[17],但仍然对人体和动物具有一定的毒性。因此,应更注重铜绿假单胞菌生防菌株抑菌代谢产物的研究和应用;通过基因工程和代谢工程改造,提高抑菌代谢产物的发酵效价;通过比较基因组学,敲除铜绿假单胞菌生防菌株中的致病相关基因,降低其致病性和细胞毒性,为产业化生产提供安全保障。
| [1] | Silby MW, Winstanley C, Godfrey SA, et al. Pseudomonas genomes: diverse and adaptable[J]. FEMS Microbiology Reviews, 2011, 35(4): 652-680 |
| [2] | Thomashow LS, Weller DM, Bonsall RF, et al. Production of the antibiotic phenazine-1-carboxylic acid by fluorescent Pseudomonas species in the rhizosphere of wheat[J]. Applied and Environmental Microbiology, 1990, 56(4): 908-912 |
| [3] | Pierson LS, Thomashow LS. Cloning and heterologous expression of the phenazine biosynthetic locus from Pseudomonas aureofaciens 30-84[J]. Molecular Plant-Microbe Interactions, 1992, 5(4): 330-339 |
| [4] | Liu HM, He YJ, Jiang HX, et al. Characterization of a phenazine-producing strain Pseudomonas chlororaphis GP72 with broad-spectrum antifungal activity from green pepper rhizosphere[J].Current Microbiology, 2007, 54(4): 302-306 |
| [5] | Nowak-Thompson B, Chaney N, Wing JS, et al. Characterization of the pyoluteorin biosynthetic gene cluster of Pseudomonas fluorescens Pf-5[J]. Journal of Bacteriology, 1999, 181(7): 2166-2174 |
| [6] | Schnider U, Keel C, Blumer C, et al. Amplification of the housekeeping sigma factor in Pseudomonas fluorescens CHA0 enhances antibiotic production and improves biocontrol abilities[J].Journal of Bacteriology, 1995, 177(18): 5387-5392 |
| [7] | Nielsen TH, Sφrensen J. Production of cyclic lipopeptides by Pseudomonas fluorescens strains in bulk soil and in the sugar beet rhizosphere[J].Applied and Environmental Microbiology, 2003, 69(2): 861-868 |
| [8] | Breidenstein EB, de la Fuente-Nú?ez C, Hancock RE. Pseudomonas aeruginosa: all roads lead to resistance[J].Trends in Microbiology, 2011, 19(8): 419-426 |
| [9] | Iswandi A, Bossier P, Vandenabeele J, et al. Relation between soil microbial activity and the effect of seed inoculation with the rhizopseudomonas strain 7NSK2 on plant growth[J].Biology and Fertility of Soils, 1987, 3(3): 147-151 |
| [10] | Buysens S, Heungens K, Poppe J, et al. Involvement of pyochelin and pyoverdin in suppression of Pythium-induced damping-off of tomato by Pseudomonas aeruginosa 7NSK2[J].Applied and Environmental Microbiology, 1996, 62(3): 865-871 |
| [11] | de Vleesschauwer D, Cornelis P, H?fte M. Redox-active pyocyanin secreted by Pseudomonas aeruginosa 7NSK2 triggers systemic resistance to Magnaporthe grisea but enhances Rhizoctonia solani susceptibility in rice[J]. Molecular Plant-Microbe Interactions, 2006, 19(12): 1406-1419 |
| [12] | Bano N, Musarrat J. Characterization of a new Pseudomonas aeruginosa strain NJ-15 as a potential biocontrol agent[J].Current Microbiology, 2003, 46(5): 324-328 |
| [13] | Sulochana MB, Jayachandra SY, Kumar SKA, et al. Antifungal attributes of siderophore produced by the Pseudomonas aeruginosa JAS-25[J].Journal of Basic Microbiology, 2014, 54(5): 418-424 |
| [14] | Anjaiah V, Koedam N, Nowak-Thompson B, et al. Involvement of phenazines and anthranilate in the antagonism of Pseudomonas aeruginosa PNA1 and Tn5 derivatives toward Fusarium spp. and Pythium spp.[J]. Molecular Plant-Microbe Interactions, 1998, 11(9): 847-854 |
| [15] | Tambong JT, Hofte M. Phenazines are involved in biocontrol of Pythium myriotylum on cocoyam by Pseudomonas aeruginosa PNA1[J].European Journal of Plant Pathology, 2001, 107(5): 511-521 |
| [16] | Zhou L, Jiang HX, Jin KM, et al. Isolation, identification and characterization of rice rhizobacterium Pseudomonas aeruginosa PA1201 producing high level of biopesticide “Shenqinmycin” and phenazine-1-carboxamide[J]. Acta Microbiologica Sinica, 2015, 55(4): 401-411 (in Chinese) 周莲, 蒋海霞, 金凯明, 等. 高产申嗪霉素和吩嗪-1-酰胺的水稻根际铜绿假单胞菌PA1201分离、鉴定与应用潜力[J]. 微生物学报, 2015, 55(4): 401-411 |
| [17] | Wu DQ, Ye J, Ou HY, et al. Genomic analysis and temperature-dependent transcriptome profiles of the rhizosphere originating strain Pseudomonas aeruginosa M18[J].BMC Genomics, 2011, 12: 438 |
| [18] | Lee JY, Moon SS, Hwang BK. Isolation and in vitro and in vivo activity against Phytophthora capsici and Colletotrichum orbiculare of phenazine-1-carboxylic acid from Pseudomonas aeruginosa strain GC-B26[J].Pest Management Science, 2003, 59(8): 872-882 |
| [19] | Kumar RS, Ayyadurai N, Pandiaraja P, et al. Characterization of antifungal metabolite produced by a new strain Pseudomonas aeruginosa PUPa3 that exhibits broad-spectrum antifungal activity and biofertilizing traits[J].Journal of Applied Microbiology, 2005, 98(1): 145-154 |
| [20] | Shanmugaiah V, Mathivanan N, Varghese B. Purification, crystal structure and antimicrobial activity of phenazine-1-carboxamide produced by a growth-promoting biocontrol bacterium, Pseudomonas aeruginosa MML2212[J].Journal of Applied Microbiology, 2010, 108(2): 703-711 |
| [21] | Rane MR, Sarode PD, Chaudhari BL, et al. Exploring antagonistic metabolites of established biocontrol agent of marine origin[J].Applied Biochemistry and Biotechnology, 2008, 151(2/3): 665-675 |
| [22] | Minaxi, Saxena J. Characterization of Pseudomonas aeruginosa RM-3 as a potential biocontrol agent[J].Mycopathologia, 2010, 170(3): 181-193 |
| [23] | Dharni S, Alam M, Kalani K, et al. Production, purification, and characterization of antifungal metabolite from Pseudomonas aeruginosa SD12, a new strain obtained from tannery waste polluted soil[J].Journal of Microbiology and Biotechnology, 2012, 22(5): 674-683 |
| [24] | Illakkiam D, Ponraj P, Shankar M, et al. Identification and structure elucidation of a novel antifungal compound produced by Pseudomonas aeruginosa PGPR2 against Macrophomina phaseolina[J].Applied Biochemistry and Biotechnology, 2013, 171(8): 2176-2185 |
| [25] | Lee X, Azevedo MD, Armstrong DJ, et al. The Pseudomonas aeruginosa antimetabolite L-2-amino-4-methoxy-trans-3- butenoic acid inhibits growth of Erwinia amylovora and acts as a seed germination-arrest factor[J].Environmental Microbiology Reports, 2013, 5(1): 83-89 |
| [26] | Stanghellini ME, Miller RM. Biosurfactants: Their identity and potential efficacy in the biological control of zoosporic plant pathogens[J].Plant Disease, 1997, 81(1): 4-12 |
| [27] | Tewari S, Arora NK. Multifunctional exopolysaccharides from Pseudomonas aeruginosa PF23 involved in plant growth stimulation, biocontrol and stress amelioration in sunflower under saline conditions[J].Current Microbiology, 2014, 69(4): 484-494 |
| [28] | Wang SL, Yieh TC, Shih IL, et al. Production of antifungal compounds by Pseudomonas aeruginosa K-187 using shrimp and crab shell powder as a carbon source[J].Enzyme and Microbial Technology, 1999, 25(1): 142-148 |
| [29] | Ren XP, Xie GL, Wang X, et al. Application and colonization of Pseudomonas aeruginosa ZJ1999 for biocontrol of Rhizoctonia solani, pathogen of rice sheath blight[J]. Chinese Journal of Biological Control, 2006, 2(1): 54-57 (in Chinese) 任小平, 谢关林, 王笑, 等. 铜绿假单胞菌ZJ1999对水稻纹枯病的防治及其在水稻上的定殖[J]. 中国生物防治, 2006, 2(1): 54-57 |
| [30] | Zhang FJ, Lin LP, Tang J, et al. Selection and identification of one antagonistic bacterium against tabacco wilt pathogens[J]. Journal of Southwest Universtiy (Natural Science Edition), 2007, 29(9): 91-94 (in Chinese) 张伏军, 林立鹏, 唐婧, 等. 一株烟草青枯菌拮抗细菌的筛选及鉴定[J]. 西南大学学报: 自然科学版, 2007, 29(9): 91-94 |
| [31] | Hu JH, Zhang FJ, Lan XQ, et al. Analysis of the colonization of tabacco rhizosphere bacterium swu31-2 and its control effect on tabacco bacterial wilt[J]. Plant Protection, 2009, 35(5): 89-94 (in Chinese) 胡军华, 张伏军, 蓝希钳, 等. 烟草根际细菌铜绿假单胞菌swu31-2的定殖能力及其对烟草青枯病的防治作用[J]. 植物保护, 2009, 35(5): 89-94 |
| [32] | Gross H, Loper JE. Genomics of secondary metabolite production by Pseudomonas spp.[J].Natural Products Report, 2009, 26(11): 1408-1446 |
| [33] | Duijff BJ, Meijer JW, Bakker P, et al. Siderophore-mediated competition for iron and induced resistance in the suppression of Fusarium wilt of carnation by fluorescent Pseudomonas spp.[J].Netherland Journal of Plant Pathology, 1993, 99(5/6): 277-289 |
| [34] | Lamont IL, Martin LW. Identification and characterization of novel pyoverdine synthesis genes in Pseudomonas aeruginosa[J].Microbiology, 2003, 149(4): 833-842 |
| [35] | Levy E, Eyal Z, Chet I, et al. Resistance mechanisms of Septoria tritici to antifungal products of Pseudomonas[J].Physiological and Molecular Plant Pathology, 1992, 40(3): 163-171 |
| [36] | Priyaja P, Jayesh P, Philip R, et al. Pyocyanin induced in vitro oxidative damage and its toxicity level in human, fish and insect cell lines for its selective biological applications[J]. Cytotechnology, 2014. DOI: 10.1007/s10616-014-9765-5 |
| [37] | Mavrodi DV, Bonsall RF, Delaney SM, et al. Functional analysis of genes for biosynthesis of pyocyanin and phenazine-1-carboxamide from Pseudomonas aeruginosa PAO1[J].Journal of Bacteriology, 2001, 183(21): 6454-6465 |
| [38] | Li YQ, Du XL, Lu ZJ, et al. Regulatory feedback loop of two phz gene clusters through 5′-untranslated regions in Pseudomonas sp. M18[J].PLoS One, 2011, 6(4): e19413 |
| [39] | Parsons JF, Greenhagen BT, Shi K, et al. Structural and functional analysis of the pyocyanin biosynthetic protein PhzM from Pseudomonas aeruginosa[J].Biochemistry, 2007, 46(7): 1821-1828 |
| [40] | Ren B, Shen HF, Lu ZJ, et al. The phzA2-G2 transcript exhibits direct RsmA-mediated activation in Pseudomonas aeruginosa M18[J].PLoS One, 2014, 9(2): e89653 |
| [41] | Lu JS, Huang XQ, Zhang MY, et al. The distinct quorum sensing hierarchy of las and rhl in Pseudomonas sp. M18[J].Current Microbiology, 2009, 59(6): 621-627 |
| [42] | Huang JF, Xu YQ, Zhang HY, et al. Temperature-dependent expression of phzM and its regulatory genes lasI and ptsP in rhizosphere isolate Pseudomonas sp. strain M18[J].Applied and Environmental Microbiology, 2009, 75(20): 6568-6580 |
| [43] | Wang GH, Huang XQ, Li SN, et al. The RNA chaperone Hfq regulates antibiotic biosynthesis in the rhizobacterium Pseudomonas aeruginosa M18[J].Journal of Bacteriology, 2012, 194(10): 2443-2457 |
| [44] | Li YQ, Jiang HX, Xu YQ, et al. Optimization of nutrient components for enhanced phenazine-1-carboxylic acid production by gacA-inactivated Pseudomonas sp. M18G using response surface method[J].Applied Microbiology and Biotechnology, 2008, 77(6): 1207-1217 |
| [45] | Li YQ, Jiang HX, Du XL, et al. Enhancement of phenazine-1-carboxylic acid production using batch and fed-batch culture of gacA inactivated Pseudomonas sp. M18G[J].Bioresource Technology, 2010, 101(10): 3649-3656 |
| [46] | Su JJ, Zhou Q, Zhang HY, et al. Medium optimization for phenazine-1-carboxylic acid production by a gacAqscR double mutant of Pseudomonas sp. M18 using response surface methodology[J].Bioresource Technology, 2010, 101(11): 4089-4095 |
| [47] | Zhou Q, Su JJ, Jiang HX, et al. Optimization of phenazine-1-carboxylic acid production by a gacA/qscR-inactivated Pseudomonas sp. M18GQ harboring pME6032Phz using response surface methodology[J].Applied Microbiology and Biotechnology, 2010, 86(6): 1761-1773 |
| [48] | Du XL, Li YQ, Zhou WP, et al. Phenazine-1-carboxylic acid production in a chromosomally non-scar triple-deleted mutant Pseudomonas aeruginosa using statistical experimental designs to optimize yield[J].Applied Microbiology and Biotechnology, 2013, 97(17): 7767-7778 |
| [49] | Takeda R. Pseudomonas pigments I: Pyoluteorin, a new chlorine-containing pigment produced by Pseudomonas aeruginosa[J].Hako Kogaku Zasshi, 1958, 36(7): 281-286 |
| [50] | Brodhagen M, Henkels MD, Loper JE. Positive autoregulation and signaling properties of pyoluteorin, an antibiotic produced by the biological control organism Pseudomonas fluorescens Pf-5[J].Applied and Environmental Microbiology, 2004, 70(3): 1758-1766 |
| [51] | Huang XQ, Zhu DH, Xu YQ, et al. Identification and characterization of pltZ, a gene involved in the repression of pyoluteorin biosynthesis in Pseudomonas sp. M18[J].FEMS Microbiology Letters, 2004, 232(2): 197-202 |
| [52] | Zhang XH, Wang SL, Geng HF, et al. Differential regulation of rsmA gene on biosynthesis of pyoluteorin and phenazine-1-carboxylic acid in Pseudomonas sp. M18[J]. World Journal of Microbiology & Biotechnology, 2005, 21(6): 883-889 |
| [53] | He YJ, Hu HB, Xu YQ, et al. A new biological pesticide, pyoluteorin[J]. Agrochemicals, 2006, 45(3): 155-157 (in Chinese) 何延静, 胡洪波, 许煜泉, 等. 新型生物农药藤黄绿脓菌素[J]. 农药, 2006, 45(3): 155-157 |
| [54] | Lee X, Fox A, Sufrin J, et al. Identification of the biosynthetic gene cluster for the Pseudomonas aeruginosa antimetabolite L-2-amino-4-methoxy-trans-3-butenoic acid[J].Journal of Bacteriology, 2010, 192(16): 4251-4255 |
| [55] | Illakkiam D, Shankar M, Ponraj P, et al. Genome sequencing of a mung bean plant growth promoting strain of P. aeruginosa with biocontrol ability[J]. International Journal of Genomics, 2014. DOI: 10.1155/2014/123058 |
| [56] | Abalos A, Vi?as M, Sabaté J, et al. Enhanced biodegradation of Casablanca crude oil by a microbial consortium presence of a rhamnolipid produced by Pseudomonas aeruginosa AT10[J].Biodegradation, 2004, 15(4): 249-260 |
| [57] | Nie MQ, Yin XH, Ren CY, et al. Novel rhamnolipid biosurfactants produced by a polycyclic aromatic hydrocarbon-degrading bacterium Pseudomonas aeruginosa strain NY3[J].Biotechnology Advances, 2010, 28(5): 635-643 |
| [58] | Cui CZ, Zeng C, Zhang JY, et al. Identification of one strain producing high level of rhamnolipid, clone and expression of the related genes[C]. The 2nd Session of the China Young Scholars on Microbial Genetics Symposium, 2006 (in Chinese) 崔长征, 曾驰, 张甲耀, 等. 一株高产鼠李糖脂菌株的分离鉴定及其相关基因的克隆与表达[C]. 第二届中国青年学者微生物遗传学学术研讨会论文集, 2006 |
| [59] | Orsod M, Joseph M, Huyop F. Characterization of exopolysaccharides produced by Bacillus cereus and Brachybacterium sp. isolated from Asian sea bass (Lates calcarifer)[J].Malaysian Journal of Microbiology, 2012, 8(3): 170-174 |
| [60] | Ge YH, Huang XQ, Wang SL, et al. Phenazine-1-carboxylic acid is negatively regulated and pyoluteorin positively regulated by gacA in Pseudomonas sp. M18[J].FEMS Microbiology Letters, 2004, 237(1): 41-47 |
| [61] | Fang YL, Sun S, Shen Y, et al. Progress on the development and application of biopesticide Shenqinmycin[J]. Chinese Journal of Pesticide Science, 2014, 16(4): 387-393 (in Chinese) 方运玲, 孙爽, 申阅, 等. 微生物源农药申嗪霉素的研制与应用[J]. 农药学学报, 2014, 16(4): 387-393 |
| [62] | Zhang JF. Stabilization and degradation of a new biological pesticide, pyoluteorin[D]. Shanghai: Master’s Thesis of Shanghai Jiao Tong Universtiy, 2008 (in Chinese) 张靖芳. 新型农药藤黄绿菌素(Pl)的稳定性及其降解特性研究[D]. 上海: 上海交通大学硕士学位论文, 2008 |
 2015, Vol. 42
2015, Vol. 42