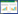扩展功能
文章信息
- 曹礼, 徐琳
- CAO Li, XU Lin
- 微生物降解3,5,6-三氯-2-吡啶醇的研究进展
- Research progress in microbial degradation of 3,5,6-trichloro-2-pyridinol
- 微生物学通报, 2015, 42(6): 1158-1164
- Microbiology China, 2015, 42(6): 1158-1164
- 10.13344/j.microbiol.china.140876
-
文章历史
- 收稿日期: 2014-11-06
- 接受日期: 2015-04-13
- 优先数字出版日期(www.cnki.net): 2015-04-15
2. 河西学院 甘肃省河西走廊特色资源利用重点实验室 甘肃 张掖 734000
2. Key Laboratory of Hexi Corridor Resourses Utilization of Gansu, Hexi University, Zhangye, Gansu 734000, China
3,5,6-三氯-2-吡啶醇(3,5,6-trichloro-2- pyridinol,TCP)是杀虫剂毒死蜱和甲基毒死蜱以及除草剂绿草定和绿草定-2-丁氧基乙酯的主要中间代谢产物,其分布遍及土壤、水体、空气和生物体内[1, 2, 3, 4, 5]。同时,TCP也是合成上述农药的中间体化合物,是它们共同的母体结构(图1)。在这些农药的生产过程中,TCP也被排放到生产区域附近而污染土壤和水体环境[6]。
|
| 图1 3,5,6-三氯-2-吡啶醇及其农药母体化合物的结构 Figure 1 Chemical structure of 3,5,6-trichloro-2-pyridinol and its parent compounds |
20世纪60年代以来,许多国家开始禁止或限制使用有机氯农药,有机磷农药一度成为品种最多、应用最广泛的农药。自2007年1月起,我国全面禁止使用和销售甲基对硫磷、甲胺磷、对硫磷、磷胺、久效磷等5种高毒有机磷农药。2008年,我国选出了以毒死蜱、吡蚜酮等为代表的5种高效低毒低残留有机磷杀虫剂作为今后的主导品种,替代了甲胺磷、对硫磷和久效磷等为代表的5种高毒有机磷农药。然而,以毒死蜱为代表的这些农药长期和大规模使用,使得大量残留农药在土壤以及水体中富集。据统计,2008年毒死蜱全球销量达 10万t,国内销量为1.8万t,每年以10%增长,释放到环境中的毒死蜱代谢物TCP,估计将达到 6万t[7]。随着毒死蜱需求的增长,其释放到环境中的TCP也不断增加。
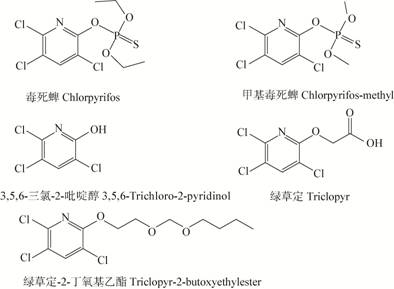
1 TCP的生态毒性TCP在不同pH值有不同的存在形态。pH值小于其pKa (pKa=4.55)时,以两性离子形态存在,如图2所示。而在中性pH时,TCP是带有电荷的分子,具有较高的水溶性和迁移性,比母体化合物更易淋溶或渗漏到深层土壤及水体环境中[8],在低浓度下就能够对水生生物和陆生生物产生中等毒 性[9],从而对土壤和水体环境带来较大的污染[10, 11, 12]。
|
| 图2 TCP在pH小于pKa时的存在状态 Figure 2 The section of TCP under the condition of pH<pKa |
TCP在环境中蓄积后,对环境中的真菌和细菌生长有较强的抑制作用,阻止微生物对TCP和毒死蜱的降解。Baskaran等指出,TCP对环境微生物的毒性比毒死蜱更高,TCP 对土壤细菌群落的毒性是毒死蜱的2.5倍[13]。当TCP的含量超过50 mg/L时会对TCP本身的降解产生抑制作用,同 时抑制其他有机化合物的降解,进一步加重环境中TCP以及其他有机污染物的累积残留,影响环境系统自我修复的功能[14]。
TCP对人体有害,如果被吞咽,能够引起眼部损伤[9]。Meeker等在研究毒死蜱及其代谢产物对人体的影响时指出,当人体受到毒死蜱的毒害后,它们在人体内代谢产生的TCP会使男性精子的质量下降,同时产生的TCP还会造成体内睾丸激素的下降[15, 16]。Hunter等研究发现,怀孕母鼠肝脏中TCP含量是其胎儿肝脏中TCP的5倍,而胎儿大脑中的TCP含量却是怀孕母鼠肝脏中的2−4倍,说明胎儿的神经系统更容易受到TCP的影响[17]。
2 降解TCP的微生物环境中TCP的进一步降解是毒死蜱完全脱毒的关键,因为在毒死蜱的降解过程中,生成的二乙基硫代磷酸酯相对容易发生生物降解,而TCP在环境中较难降解,所以毒死蜱的彻底脱毒取决于TCP的降解。
微生物是TCP降解的主要驱动力。1997年,Feng等首次从环境中筛选到一株有氧条件下能以TCP作为唯一碳源和能源的TCP降解菌株Pseudomonas sp. ATCC 700113,70 h可以降解 40 mg/L TCP,完全降解100 mg/L的TCP需要3周时间[18]。1998年,Robertson等研究毒死蜱在甘蔗田中的降解动态时发现,毒死蜱降解产物TCP的快速降解是土壤微生物作用所致[19]。目前为止,从不同地域不同环境中分离筛选到TCP降解菌株,部分毒死蜱降解菌能够继续分解TCP为其他产物,如Bacillus latersprorus DSP、Alcaligenes faecalis DSP3、Sphingomonassp. Dsp-2、Paracoccussp. TRP、Bacillus pumilus C2A1、Synechocystis sp. PUPCCC 64、Cupriavidussp. DT-1等[10, 20, 21, 22, 23, 24, 25]。另外,也有一些仅能降解TCP但是不能降解毒死蜱的菌株被筛选和鉴定。如Racke等对土壤中TCP的降解进行研究,发现微生物能显著提高TCP的降解速率,表明TCP的矿化主要是微生物作用的结果[26]。Feng等分离出一株有氧条件下能以TCP作为唯一碳源和能源的TCP降解菌株Pseudomonassp. ATCC 700113,后来将该菌株命名为M285,70 h可以降解40 mg/L的TCP[18]。Li等通过富集培养的方法分离的一株TCP降解菌株Ralstoniasp. T6,可以在 12 h内降解100 mg/L的TCP[3]。Cao等分离的菌株Cupriavidus pauculus P2对TCP降解速度最快,10 h内可以将100 mg/L 的TCP完全降解[27]。
由于TCP对环境中的真菌和细菌生长有较强的抑制作用[28],所以目前报道的能矿化TCP的菌株大多降解低浓度的TCP,一般在4−30 d才能完全降解50−100 mg/L的TCP。菌株Pseudomonas sp. ATCC 700113能在3 周内完全降解100 mg/L的TCP,但是不能降解高于200 mg/L的TCP[18]。Burkholderiasp. KR100 在144 h可以完全降解 100 mg/L的TCP,但却不能降解高于300 mg/L 的TCP[2]。
也有少量可以耐受或降解高浓度TCP的菌株被报道,如Alcaligenes faecalisDSP3在10 d内可以完全降解100 mg/L 的TCP,该菌株的生长和降解不受TCP 浓度的影响,即使TCP 的浓度达到 800 mg/L该菌株也能较好生长[10]。Ralstoniasp. T6可以在80 h内完全降解700 mg/L 的TCP[3]。菌株Cupriavidus pauculus P2在70 h内可以将800 mg/L的TCP完全降解[27],这是目前能降解最高起始浓度TCP的菌株。
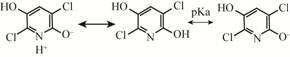
3 TCP微生物降解途径的研究进展不同的微生物对TCP的降解途径有所差异,归纳起来,TCP主要有3种类型的降解途径。(1) 烷基化反应途径。如图3A所示,TCP经微生物作用生成3,5,6-三氯-2-甲氧基吡啶(TCMP)或3,5,6-三氯-2-甲基吡啶(TMP)[29]。如Racke等对土壤中毒死蜱的微生物降解研究表明,毒死蜱首先水解生成TCP,进而降解为TCMP,最终矿化为水,二氧化碳和铵离子[9]。(2) 还原脱氯途径。如图3B所示,在缺氧或厌氧条件下,TCP脱掉环结构上的2个氯原子生成氯吡啶酚。如菌株Bacillus latersprorus DSP可将TCP还原生成6-氯-2-吡啶酚,最后被矿化[24]。Singh和Walke
|
|
图3
微生物降解TCP的3种途径
Figure 3
Three possible pathways for TCP microbial degradation
注:1:TCP的烷基化反应;2:TCP的还原脱氯途径;3:TCP的氧化脱氯途径. Note: 1: The alkylationpathway of TCP; 2: The reductive dehalogenation of TCP; 3: The oxidative dehalogenation of TCP. |
推测3-氯-2-吡啶酚是毒死蜱微生物降解的产物之 一[30]。Lu等在研究菌株Cupriavidus sp. DT-1降解TCP过程中检测到3个中间代谢产物,分别鉴定为5,6-二氯-2-吡啶醇、6-氯-2-吡啶醇和2-吡啶醇,并认为TCP降解首先是一个连续还原脱氯的过程,TCP分子上的3个氯原子可以被连续脱去然后生成2-吡啶醇[22]。(3) 氧化脱氯途径。如图3C所示,Bhuimbar等研究发现,Micrococcusspp.和Bacillusspp.可以将TCP转化为二氯二羟基吡啶,最后产生3,6-二羟基吡啶-2,5-二酮[31]。Cao等将菌株Cupriavi dus pauculus P2在降解TCP过程中产生的绿色代谢产物鉴定为3,6-二羟基吡啶-2,5-二酮[32]。Li等发现,菌株Ralstoniasp. T6可以将TCP降解的绿色中间代谢产物3,6-二羟基吡啶-2,5-二酮进一步转化为5-氨 基-2,4,5-三羰基戊酸(ATOPA)[33]。
4 TCP微生物降解基因和酶的研究进展目前关于毒死蜱降解机制和代谢途径的研究,多数仅集中在毒死蜱到TCP这一步转化,而对于TCP进一步降解的代谢途径及编码TCP降解酶的基因报道不多。2010年Math等从奶牛瘤胃的宏基因组文库中克隆一个长1 800 bp的TCP降解基因(tcp3A),它编码的TCP水解酶与NCBI 数据库中酰胺水解酶的序列相似性最大,为24%−26%。将该基因连接在表达载体pET-28a上,然后转化到Escherichia coli,获得的重组菌株可以降解TCP[34],但是在TCP降解产物、降解机理及代谢途径方面,并没有进一步的报道。
Cao等[32]通过转座子突变的方法建立了菌株Cupriavidus pauculus P2的突变株文库,从中筛选到3株丧失TCP降解能力的突变株,通过SEFA-PCR,分别扩增出突变株中Tn5转座子插入位置的上下游序列,将其测序后进行分析和拼接,得到一个包含5个基因的基因簇,将基因tcpA1和tcpB1异源表达显示,与菌株Ralstonia eutropha JMP134中2,4,6-三氯苯酚的脱氯作用非常相似[35, 36],TcpA1和TcpB1共同负责TCP的脱氯,生成3,6-二羟基吡 啶-2,5-二酮,如图4所示。
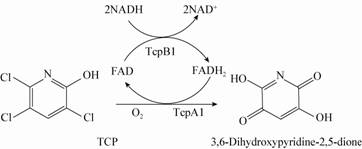
|
| 图4 菌株P2中TcpA1和TcpB1在TCP脱氯反应中的作用 Figure 4 The proposed functions of TcpA1 and TcpB1 during TCP dechlorination in Cupriavidus pauculus P2 |
Li等从菌株Ralstoniasp. T6中分别克隆到2个与TCP降解相关的基因簇tcpRXA和dhpRIJK,基因簇tcpRXA编码的产物可以将TCP转化为3,6-二羟基吡啶-2,5-二酮,而基因簇dhpRIJK编码的产物可以将3,6-二羟基吡啶-2,5-二酮进一步转化为5-氨基-2,4,5-三羰基戊酸(ATOPA),并最终被矿化,如图5所示[33]。
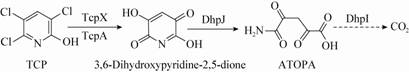
|
| 图5 菌株T6中TCP的降解途径 Figure 5 Proposed metabolic pathway for TCP in Ralstonia sp. T6 |
随着高效低毒农药在市场中需求量的增加,毒死蜱等的大量使用将导致环境中大量TCP的产生。TCP具有较高的水溶性和迁移性,容易进入深层土壤及水体环境,从而引起广泛的污染。微生物是TCP降解的主要驱动力,对TCP降解微生物的研究将有助于对TCP污染环境的修复。TCP降解相关的酶及其编码的基因在菌株Cupriavidus pauculus P2[32]和菌株 Ralstoniasp. T6[33]中被发现,但是,在这2个菌株将TCP降解为3,6-二羟基吡啶-2,5-二酮的过程中,与Bhuimbar等[31]的研究不同的是,并没有发现包括1个或2个氯原子的中间代谢产物,其详细的降解机制及降解中所涉及的酶还有待进一步的研究;同时,5-氨基-2,4,5-三羰基戊酸在TCP降解菌株中的进一步代谢有待阐明。
目前,环境中残留农药的微生物降解是环境微生物学领域研究的热点之一,在各种去除污染的措施中,通过微生物对污染环境进行的生物修复因其高效、安全、成本低、无二次污染等优点而具有良好的发展前景。微生物对环境污染物的生物修复作用能否最终实现,不仅依赖于其本身的降解能力,还依赖于农药的性质、环境因子(温度、盐度、pH、氧化还原电位、营养可利用程度)以及降解细菌与土著微生物之间的竞争能力等其他因素。但是,目前对于TCP污染环境的生物修复的研究,大多集中在TCP降解菌株降解特性的研究及其分子降解机制的研究,仍停留在实验室研究阶段。对于将来大规模的污染环境中TCP的生物修复,应通过各种方法和措施优化降解环境,强化降解条件,提高微生物对TCP的降解能力和降解速度,从而更有效地修复污染环境。
目前,菌株Cupriavidus pauculus P2的全基因组测序已经完成,随着研究的深入,TCP完整的代谢途径及其降解机制将被阐明,TCP新降解基因的发现、以及降解酶构象和动力学的研究等,将会有新的进展,这将为微生物应用于污染物的实际修复提供理论指导,大大有助于对毒死蜱和TCP的污染产品或地区开展高效而彻底的生物修复工作。
| [1] | Baglieri A, Nègre M, Trotta F, et al. Organo-clays and nanosponges for acquifer bioremediation: adsorption and degradation of triclopyr[J]. Journal of Environmental Science and Health, Part B, 2013, 48(9): 784-792 |
| [2] | Kim JR, Ahn YJ. Identification and characterization of chlorpyrifos-methyl and 3,5,6-trichloro-2-pyridinol degrading Burkholderia sp. strain KR100[J]. Biodegradation, 2009, 20(4): 487-497 |
| [3] | Li J, Liu J, Shen W, et al. Isolation and characterization of 3,5,6-trichloro-2-pyridinol-degrading Ralstonia sp. strain T6[J]. Bioresource Technology, 2010, 101(19): 7479-7483 |
| [4] | McMullin RT, Bell FW, Newmaster SG. The effects of triclopyr and glyphosate on lichens[J]. Forest Ecology and Management, 2012, 264: 90-97 |
| [5] | Morgan MK, Sheldon LS, Croghan CW, et al. Exposures of preschool children to chlorpyrifos and its degradation product 3,5,6-trichloro-2-pyridinol in their everyday environments[J]. Journal of Exposure Analysis and Environmental Epidemiology, 2005, 15(4): 297-309 |
| [6] | Feng Y, Racke KD, Bollag JM. Use of immobilized bacteria to treat industrial wastewater containing a chlorinated pyridinol[J]. Applied Microbiology and Biotechnology, 1997, 47(1): 73-77 |
| [7] | Liang C. The market prospect of 3,5,6-trichloro-2-pyridinol sodium is worth looking forward to[J]. Fine Chemical Industrial Raw Materials and Intermediates, 2009(5): 33-35 (in Chinese)梁诚. 三氯吡啶醇钠市场前景值得期待[J]. 精细化工原料及中间体, 2009(5): 33-35 |
| [8] | Manclús JJ, Montoya A. Development of immunoassays for the analysis of chlorpyrifos and its major metabolite 3,5,6-trichloro-2-pyridinol in the aquatic environment[J]. Analytica Chimica Acta, 1995, 311(3): 341-348 |
| [9] | Racke KD. Environmental fate of chlorpyrifos[J]. Reviews of Environmental Contamination and Toxicology, 1993, 131: 1-150 |
| [10] | Yang L, Zhao Y, Zhang B, et al. Isolation and characterization of a chlorpyrifos and 3,5,6-trichloro-2-pyridinol degrading bacterium[J]. FEMS Microbiology Letters, 2005, 251(1): 67-73 |
| [11] | Ling Y, Wang H, Yong W, et al. The effects of washing and cooking on chlorpyrifos and its toxic metabolites in vegetables[J]. Food Control, 2011, 22(1): 54-58 |
| [12] | Zhang Z, Wu ZP. Determination of chlorpyrifos-methyl residues in tomato, hot pepper and eggplant[J]. Food Science, 2011, 32(22): 257-259 (in Chinese)张征, 武中平. 番茄, 辣椒, 茄子中甲基毒死蜱残留量测定[J]. 食品科学, 2011, 32(22): 257-259 |
| [13] | Baskaran S, Kookana RS, Naidu R. Contrasting behaviour of chlorpyrifos and its primary metabolite, TCP (3,5,6-trichloro-2-pyridinol), with depth in soil profiles[J]. Soil Research, 2003, 41(4): 749-760 |
| [14] | Racke KD, Fontaine DD, Yoder RN, et al. Chlorpyrifos degradation in soil at termiticidal application rates[J]. Pesticide Science, 1994, 42(1): 43-51 |
| [15] | Meeker JD, Singh NP, Ryan L. Urinary levels of insecticide metabolites and DNA damage in human sperm[J]. Human Reproduction, 2004, 19(11): 2573-2580 |
| [16] | Meeker JD, Barr DB, Hauser R. Thyroid hormones in relation to urinary metabolites of non-persistent insecticides in men of reproductive age[J]. Reproductive Toxicology, 2006, 22(3): 437-442 |
| [17] | Hunter DL, Lassiter TL, Padilla S. Gestational exposure to chlorpyrifos: comparative distribution of trichloropyridinol in the fetus and dam[J]. Toxicology and Applied Pharmacology, 1999, 158(1): 16-23 |
| [18] | Feng Y, Racke KD, Bollag J. Isolation and characterization of a chlorinated-pyridinol-degrading bacterium[J]. Applied and Environmental Microbiology, 1997, 63(10): 4096-4098 |
| [19] | Robertson LN, Chandler KJ, Stickley BDA, et al. Enhanced microbial degradation implicated in rapid loss of chlorpyrifos from the controlled-release formulation suSCon® Blue in soil[J]. Crop Protection, 1998, 17(1): 29-33 |
| [20] | Anwar S, Liaquat F, Khan QM, et al. Biodegradation of chlorpyrifos and its hydrolysis product 3,5,6-trichloro-2-pyridinol by Bacillus pumilus strain C2A1[J]. Journal of Hazardous Materials, 2009, 168(1): 400-405 |
| [21] | Li X, He J, Li S. Isolation of a chlorpyrifos-degrading bacterium, Sphingomonas sp. strain Dsp-2, and cloning of the mpd gene[J]. Research in Microbiology, 2007, 158(2): 143-149 |
| [22] | Lu P, Li Q, Liu H, et al. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by Cupriavidus sp. DT-1[J]. Bioresource Technology, 2013, 127: 337-342 |
| [23] | Singh DP, Khattar JIS, Nadda J, et al. Chlorpyrifos degradation by the cyanobacterium Synechocystis sp. strain PUPCCC 64[J]. Environmental Science and Pollution Research, 2011, 18(8): 1351-1359 |
| [24] | Wang X, Chu XQ, Yu YL, et al. Characteristics and function of Bacillus latersprorus DSP in degrading chlorpyrifos[J]. Acta Pedologica Sinica, 2006, 43(4): 648-654 (in Chinese)王晓, 楚小强, 虞云龙, 等. 毒死蜱降解菌株Bacillus latersprorus DSP的降解特性及其功能定位[J]. 土壤学报, 2006, 43(4): 648-654 |
| [25] | Xu G, Zheng W, Li Y, et al. Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by a newly isolated Paracoccus sp. strain TRP[J]. International Biodeterioration & Biodegradation, 2008, 62(1): 51-56 |
| [26] | Racke KD, Robbins ST. Factors affecting the degradation of 3,5,6-trichloro-2-pyridinol in soil[A]//Pesticide Transformation Products: Fate and Significance in the Environment[M]. Washington, DC: American Chemical Society, 1991: 92-107 |
| [27] | Cao L, Liu H, Zhang H, et al. Characterization of a newly isolated highly effective 3,5,6-trichloro-2-pyridinol degrading strain Cupriavidus pauculus P2[J]. Current Microbiology, 2012, 65(3): 231-236 |
| [28] | Racke KD, Fontaine DD, Yoder RN, et al. Chlorpyrifos degradation in soil at termiticidal application rates[J]. Pesticide Science, 1994, 42(1): 43-51 |
| [29] | Wu CY, Chen N, Li QF, et al. Research progress in chlorpyrifos degrading microorganisms and biodegrading mechanisms[J]. Chinese Journal of Tropical Crops, 2011, 32(10): 1989-1994 (in Chinese)武春媛, 陈楠, 李勤奋, 等. 毒死蜱降解菌及其降解机理研究进展[J]. 热带作物学报, 2011, 32(10): 1989-1994 |
| [30] | Singh BK, Walker A. Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews, 2006, 30(3): 428-471 |
| [31] | Bhuimbar MV, Kulkarni AN, Ghosh JS. Detoxification of chlorpyriphos by Micrococcus luteus NCIM 2103, Bacillus subtilis NCIM 2010 and Pseudomonas aeruginosa NCIM 2036[J]. Research Journal of Environmental and Earth Sciences, 2011, 3(5): 614-619 |
| [32] | Cao L, Xu J, Wu G, et al. Identification of two combined genes responsible for dechlorination of 3,5,6-trichloro-2-pyridinol (TCP) in Cupriavidus pauculus P2[J]. Journal of Hazardous Materials, 2013, 260: 700-706 |
| [33] | Li J, Huang Y, Hou Y, et al. Novel gene clusters and metabolic pathway involved in 3,5,6-trichloro-2-pyridinol degradation by Ralstonia sp. strain T6[J]. Applied and Environmental Microbiology, 2013, 79(23): 7445-7453 |
| [34] | Math RK, Islam SMA, Cho KM, et al. Isolation of a novel gene encoding a 3,5,6-trichloro-2-pyridinol degrading enzyme from a cow rumen metagenomic library[J]. Biodegradation, 2010, 21(4): 565-573 |
| [35] | Belchik SM, Xun L. Functions of flavin reductase and quinone reductase in 2,4,6-trichlorophenol degradation by Cupriavidus necator JMP134[J]. Journal of Bacteriology, 2008, 190(5): 1615-1619 |
| [36] | Xun L, Webster CM. A monooxygenase catalyzes sequential dechlorinations of 2,4,6-trichlorophenol by oxidative and hydrolytic reactions[J]. Journal of Biological Chemistry, 2004, 279(8): 6696-6700 |
 2015, Vol. 42
2015, Vol. 42