扩展功能
文章信息
- 鲍林林, 陈永娟, 王晓燕
- BAO Lin-Lin, CHEN Yong-Juan, WANG Xiao-Yan
- 河流沉积物氮循环主要微生物的生态特征
- Ecological characteristics of nitrogen cycling microbes in river sediments
- 微生物学通报, 2015, 42(6): 1141-1150
- Microbiology China, 2015, 42(6): 1141-1150
- 10.13344/j.microbiol.china.140644
-
文章历史
- 收稿日期: 2014-08-27
- 接受日期: 2014-11-02
- 优先数字出版日期(www.cnki.net): 2014-11-04
2. 首都师范大学 首都圈水环境研究中心 北京 100048
2. Research Center of Aquatic Environment in the Capital Region, Capital Normal University, Beijing 100048, China
沉积物是水环境中各种元素的最终归 属——“汇”,水体中营养物质通过各种途径进入沉积物并最终被固定,由于天然水体物理化学生物条件的动态变化,固定下来的营养物质容易转化和释放,而使沉积物成为潜在的污染“源”(内源)。因其特殊的生境条件(上覆水的覆盖),沉积物中含有丰富的微生物资源,对沉积物-水界面的物质循环起到了良好的推动作用,微生物的功能特征能够反映和改善环境的生态特征,从而有助于规模性环境问题发生的解释和预防[1],反之,过量营养物质导致的富营养化、水华和赤潮等水质问题也会影响沉积物中微生物的群落特征和功能[2]。
氮是生物体结构组成和生化过程进行的重要物质基础,氮在生物地球化学循环中的迁移转化(即氮循环),及其与相应功能微生物的相互作用决定了氮对生态环境的影响。随着厌氧氨氧化细菌(anaerobic ammonia oxidation,anammox)[3, 4]和氨氧化古菌(ammonia-oxidizing archaea,AOA)[5]的相继发现和深入研究,人们对全球氮循环的认识不断深入。氮循环是受人类活动干扰后(氮的过量活化,使自然界原有的固氮、脱氮失去平衡)对人类生产生活影响作用最大(水体富营养化、温室气体排放等)的生物地球化学循环之一。氮循环功能微生物广泛存在于土壤、地表水和沉积物中,是调节环境固氮、脱氮平衡的关键,其对污染物质的迁移转化和生态平衡的协调具有重要意义[6]。
氮素污染是诱发河流水质问题的关键因子,过量氮素对河流生态系统的破坏直接关系到下游水体的生态平衡,沉积物对污染物质的源汇效应逐渐成为河流水体氮素污染防控的关键,而河流沉积物中氮循环微生物的功能作用对河流的氮素污染治理和生态修复具有重要意义。沉积物中微生物的活性和氧化还原条件决定了过量氮素的有效转化和输出[7],微生物对氮素的迁移转化和去除效率随着河道水文动态、经济自然环境条件的变化而各有差异。本文重点介绍了河流沉积物中氮循环主要功能微生物生态特征的研究进展,总结了国内外学者以分子生物技术为主要手段进行相关研究的主要成果,以全面了解河流沉积物氮循环微生物的生态特征及其与环境因子响应关系,并提出了今后研究和应用需关注的重点。
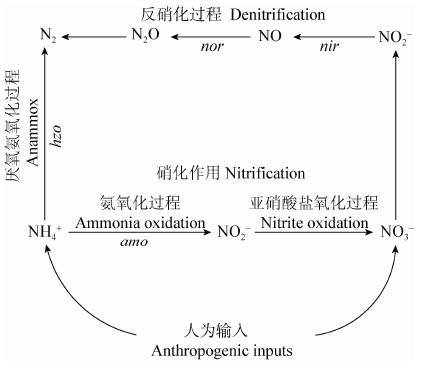
1 河流沉积物中主要氮循环微生物类群河流沉积物氮循环主要包括硝化过程、反硝化过程和厌氧氨氧化过程(图1),整个系统在微生物的驱动下有效运转。人为活动日渐成为河流过量氮素输入的主要来源,沉积物中污染物质的源汇效应对微生物的氮循环具有积极作用。硝化过程的第一步氨氧化作用是氮循环的关键限速步骤,是全球氮循环的中心环节,主要的功能微生物为氨氧化细菌(AOB)和氨氧化古菌(AOA)[8, 9],亚硝酸盐氧化过程主要由亚硝酸盐氧化菌(NOB)驱动,NOB和氨氧化微生物的协同作用保证了硝化过程的有效进行。反硝化作用和厌氧氨氧化作用是重要的脱氮过程,决定了环境中过量活性氮释放,也关系到温室气体N2O的产生效率,分别由反硝化细菌和厌氧氨氧化细菌所驱动[10]。微生物对氮素的转化和去除是河流生态系统平衡的关键,氮循环功能微生物的群落特征、功能作用及其与环境因子的响应关系对全球生态系统的物质循环具有重要作用。
1.1 AOA和AOB氨氮在功能微生物的作用下,经氨单加氧酶(ammonia monooxygenase,amo)的催化进一步转化为亚硝酸盐(NO2−),由此启动生物氮循环,因此,硝化过程的氨氧化作用是全球氮循环的关键限速步骤[11]。具有氨单加氧酶基因的变形菌纲的氨氧化细菌(ammonia-oxidizing bacteria,AOB)一直被认为是这一过程的主要功能微生物,直到海洋泉古菌中amo基因的发现[12],以及第一株氨氧化古菌Nitrosopumilus maritimus的分离培养[5],氨氧化古菌(AOA)在海洋、土壤等环境中的作用逐渐凸显,成为氨氧化过程的重要参与者。利用氨单加氧酶α亚基基因(amoA)作为分子标记,进行环境中AOB和AOA多样性、丰度和群落结构等的研究,氨氧化过程的生物驱动机制也得到了进一步的认识。
|
| 图1 河流沉积物氮循环主要过程及功能微生物 Figure 1 Nitrogen cycle driven by microorganisms in river sediment |
AOA的生态特征具有一定的环境来源性,基于amoA基因序列的系统发育分析研究表明,河流生态系统中的AOA明显不同于土壤和海洋环境的类群[7, 13]。淡水及其沉积物中的amoA基因主要从属于Nitrosotalea和Nitrosoarchaeum类群,而海洋和土壤的类群则分别属于Nitrosopumilus和Nitrosophaera[13]。同样广泛分布于各类环境的AOB则主要包括β-变形菌纲的Nitrosomonas和Nitrosospira,以及仅在海洋和盐湖中发现的γ-变形菌纲的Nitrosococcus[7, 14]。在大多数海洋和土壤等环境中AOA的群落特征和功能作用居主导地位,AOA的amoA基因丰度远高于AOB[15],且淡水中AOA比AOB更适于厌氧、低pH条件和低NH4+浓度的生境[16, 17]。但是,在红树林沉积物[14]、河流沉积物[18]、岸边湿地[19]以及耕作土壤[20]等环境中AOB的群落丰度似乎更具优势。
河流生态系统复杂多变,受人类活动影响剧烈,在水体和沉积物两个主要的亚环境中,AOA和AOB的群落特征也存在差异。研究表明,达到饮用水标准的东江,其水体中的AOA丰度是AOB的2−4倍,而其沉积物中AOB的丰度却高于AOA,表明淡水环境中AOA比AOB更适合于低NH4+环境,沉积物较高的营养物质更有利于AOB生长[18]。王超等[21]对子牙河氨氧化微生物分布特征的研究发现,NH4+富集的表层沉积物中AOB的丰度是AOA的8.51倍,且AOB在硝化过程中作用更大。NH4+污染严重的北运河中,沉积物AOB的丰度也显著高于AOA,细菌amoA基因拷贝数是古菌的2−11倍[22]。已有的研究常把AOB在河流沉积物中的群落特征,与亚硝酸盐氧化过程相结合,进行硝化活性和环境因子响应的研究[23, 24, 25, 26]。随着淡水生态系统中古菌研究的逐渐深入,AOA在河流沉积物中的分布特征和对硝化过程的贡献作用,及其与AOB的群落功能差异还有待进一步研究。
1.2 亚硝酸盐氧化菌氨氧化作用和亚硝酸盐氧化作用共同构成了硝化过程,亚硝酸盐氧化作用是将氨氧化作用的产物NO2−进一步氧化为NO3−的过程,主要由亚硝酸盐氧化菌(Nitrite-oxidizing bacteria,NOB)所驱动。NOB类群在海洋和陆地生态系统中具有明显分异,4个主要类群中γ和δ变形菌纲的Nitrococcus和Nitrospina主要来自海洋环境,而α变形菌纲的Nitrobacter和独特门类的Nitrospira则主要来源于土壤和淡水,及污水处理厂等环境[24, 27]。NOB在河流沉积物中广泛分布,与氨氧化微生物相互作用,促进硝化进程和氮的有效转化。以Nitrobacter为优势菌种的NOB的数量达到细菌总数的80%以上时,NO2−转化率接近100%[28],NOB群落丰度受制于氧亲和力更高的AOB时,硝化效率也明显受到抑制[26],而且其菌群在水层中的多样性高于沉积物[29]。以16S rRNA基因为分子标记的研究表明,在一般性河流[营养物质较低,如Niida River (日本)[25]和小型低地流[23]]沉积物中,NOB的群落丰度高于AOB,群落组成以Ntrospira类群为主,对河流生态系统的硝化作用具有重要作用。随着AOA在各种环境中的广泛分布,AOA、AOB和NOB在河流沉积物中的合作、竞争关系,及其对硝化速率的影响值得深入探讨。
1.3 反硝化细菌反硝化作用是反硝化细菌以NO3−为最终电子受体进行无氧呼吸,将NO3−和NO2−转化为N2O或N2的还原过程,主要由异养兼性厌氧的反硝化细菌在缺氧条件下完成[30]。反硝化过程是在硝酸盐还原酶(编码基因主要为narG和napA)、亚硝酸盐还原酶(nirS和nirK) 、NO还原酶(norB)和N2O还原酶(nosZ)四种酶的连续催化下进行的[31],其中亚硝酸盐还原酶是反应的关键酶,nirS基因具有分子大小相似且形态结构相对保守的优点,常被作为反硝化细菌分子标记的编码基因[32]。反硝化细菌在各种环境均有分布,主要包括Pseudomonas、Paracoccus、Rhizobium和Achromobacter等类群[31]。
反硝化细菌是河流沉积物中脱氮的主要微生物,沉积物-水界面动态变化特殊的生境有利于反硝化细菌呈现较高的群落多样性和丰富度,并与AOB合作有效地去除过量氮素[33]。反硝化作用在全球氮循环过程中的脱氮效率,常用分子标记结合稳定同位素示踪的方法进行定量研究[34, 35, 36],如利用N15标记NO3−进行微生物异化效率的研究,结果表明河流生态系统中反硝化作用对NO3−的转化率最高可达到96.16%[35]。此外,反硝化作用产生的温室气体N2O虽然是该过程的中间产物,但其显著的释放速率关系到全球气候环境变化[37, 38]。可见,利用分子标记和同位素示踪,不仅能够量化氮循环的效率,还能有效评估河流沉积物反硝化过程对N2和N2O排放的贡献作用。
1.4 厌氧氨氧化细菌在厌氧条件下,NH4+与NO2−作为厌氧氨氧化细菌(anammox)的营养基质,厌氧氨氧化作用即是以NH4+作为电子供体直接将NO2−反硝化为N2的过程[30]。16S rRNA基因分子生物学方法鉴定出anammox的菌群属于分支很深的浮霉菌门,包括Candidatus brocadia、Candidatus kuenenia和Candidatus scalindua属[39],功能基因hzo (hydrazine-oxidoreductase,肼氧化还原酶)也常被作为鉴定anammox功能特征的分子标记。研究表明,anammox广泛存在于高氮负荷而且氧浓度有限的废水处理系统及海洋沉积物中,而且具有可观的脱氮作用,如在海洋沉积物中约有24%−67%氮损失是由anammox造成的[40]。在河流生态系统中anammox的功能特征也逐渐受到关注,太湖流域沉积物中anammox的除氮效率可以达到10.7%[41],Colne Estuary (英国)沉积物中厌氧氨氧化作用产生的N2占全部氮损失的30%[42],可见河流沉积物anammox的脱氮作用也十分显著。反硝化过程第一步受到抑制时,厌氧氨氧化活性也随之降低[43],两个脱氮过程的共同作用对环境中过量氮素的去除具有重要作用。稳定同位素标记也成为研究环境中反硝化作用与厌氧氨氧化作用脱氮(N2)相对贡献率的常用方法,而河流沉积物中两种微生物总的除氮效率和相对贡献作用的定量分析还有待深入。同样是对氨氮进行氧化,厌氧氨氧化过程和氨氧化过程却适宜于不同的氧条件,过程机制也截然不同,探讨该两个过程对氨氮转化的贡献效率和相互作用具有重要意义,也是河流沉积物氮循环需要关注的重点。
2 影响河流沉积物氮循环微生物的主要因素 2.1 环境因子的作用 2.1.1 氮素:作为氮循环的直接参与者,氮素水平的高低直接影响氮循环功能微生物的群落特征和功能作用[44, 45]。NH4+是影响氨氧化微生物的主要因子,由于淡水中AOA比AOB更适于厌氧、低NH4+的生境[16, 17],东江水体NH4+浓度低,AOA的丰度明显高出AOB 2−3个数量级[16],而在NH4+等 营养物质含量较高的沉积物中AOB的丰度则高于AOA[18]。东江沉积物中anammox群落丰度与NO2−含量存在显著的正相关关系,NO2−、NO3−和碳氮比是影响anammox群落结构的主要环境因子[46];Sáenz等[47]的研究表明anammox群落在河流沉积物NH4+和NO3−含量都很充足的区域分布更为广泛,由此看来,沉积物中NH4+和硝态氮的可利用性是影响anammox群落特征的关键因子。此外,Hu等[48]研究钱塘江沉积物anammox群落特征时发现,总有机氮与anammox丰度呈正相关关系,而有机碳对其群落分布和多样性也具有显著的影响作用,碳素(碳源)作为另一种重要的营养物质也是制约微生物群落特征的重要因子,沉积物碳循环等其他物质循环对氮循环功能微生物的影响也值得进一步探索。氮营养物质也同样作用于微生物过程的功能效率,Zhou等[43]的研究表明,内陆河沉积物中NO3−含量增加时,厌氧氨氧化作用和反硝化作用的活性相应增强,而当反硝化过程第一步受到抑制时,因NO2−的产量降低导致厌氧氨氧化活性也降低。Magalhães等[49]通过室内模拟实验发现,在砂质沉积物中添加NO3−和低浓度的NH4+能够促进反硝化进程,N2O和N2的释放比率也随之而增加。大量氮素输入New Rvier (美国)时,河口沉积物潜在的厌氧氨氧化活性最高,anammox对N2排放的贡献率可达到14.1%[50]。
2.1.2 溶氧:对于耗氧的硝化过程,溶氧(DO)是保证微生物活性至关重要的因子。AOA在低氧的环境中比AOB的群落丰度高[17],而AOB对环境DO变化的敏感性比AOA高[21]。在低氧的河流沉积物中,AOB的氧亲和力比NOB强,所以AOB的丰度也高于NOB[26];DO降低还会导致NOB多样性的下降[29]。Nakamura等[25]通过光照条件下NH4+氧化速率的研究发现,因河流沉积物表层光合作用增强,O2能够渗透到更深的层次,从而促进硝化细菌(AOB和NOB)的活性范围和NH4+的转化。河流沉积物水界面DO随着河流水文动态变化强烈,硝化过程微生物(如AOB)和反硝化细菌能够表现出良好的合作关系,硝化过程在DO充足时为反硝化过程提供足够的NO3−,使得反硝化细菌在缺氧条件下将NO3−以N2O或N2的形式释放,而有效地去除河流中过量的活性氮[33]。 2.1.3 季节变化:河流季节性的水文(丰水/枯水)、气候(温度的高低)状况变化很大,已有研究表明河流浮游细菌的群落丰度和多样性随季节变化呈显著差异[51],沉积物微生物的群落功能随之也会呈现不同特征。模拟实验发现,干湿条件的变化能呈现硝化过程和反硝化过程不同的需氧条件,有利于沉积物中对氮素的去除[52];而当实验温度增加,沉积物反硝化活性(≤35 °C)和厌氧氨氧化活性(≤25 °C)随之线性增加[43]。以N2O生产率反映的反硝化活性研究表明,Seine River (法国)沉积物秋、冬季的NO3−还原率(反硝化速率)高于春、夏季[38],而Ohio River (美国)反硝化产生的N2O夏季最高,冬季最低[37];以N2排放率反映的厌氧氨氧化速率的研究表明,太湖流域沉积物在夏季和初秋的除氮效率最高,冬季最低[41]。Plum Island Sound地下河口(美国)的沉积物中,春季AOB的丰度及其潜在硝化效率均高于夏末[53],辽河不同季节的温度变化和营养盐输入水平差异,使得河口沉积物中反硝化细菌数量春季最多,夏季最低[54]。更深入的研究表明,在溶解氧高硝化活性强的夏季,反硝化作用还原的NO2−是厌氧氨氧化过程进行的主要NO2−源,而冬季硝化过程不彻底,氨氧化过程产生的NO2−成为厌氧氨氧化作用的主要NO2−源[55]。综上所述,氮循环微生物的季节变化是DO、活性温度和营养水平等各种因子复杂作用的结果,也是氮循环各环节之间相互支配和协调的结果。 2.1.4 其他环境因子:pH是影响氨氧化微生物群落特征的主要因素。已有研究表明AOA在低pH环境中具有主导作用[17],AOB适宜生长的pH的范围为7.0−8.5,而低pH条件抑制AOB生长[21]。如钱塘江沉积物中AOA的amoA基因拷贝数和AOA与AOB的丰度比均随着pH值的增加而降低,表明AOA在低pH环境中占主导地位[56],而Cao等[57]在珠江口的研究表明,其沉积物中AOB对pH的变化比AOA更敏感,且AOB群落多样性与pH存在显著的相关性。盐度是河口地区沉积物微生物特征的主要影响因素,从河口内部到海岸大陆架盐度逐渐升高,沉积物中硝酸和亚硝酸还原酶的功能基因拷贝数逐渐减少,反硝化作用效率也逐渐降低[58],而在一定的浓度范围内,盐度的增加能够提升沉积物中微生物的硝化速率[49],中盐度(6.3−24.7 PSU)条件下沉积物的潜在硝化效率最高[53]。盐度变化也会影响微生物的群落结构,在高盐度沉积物中AOB大部分属于Nitrosospira类群,低盐度和中盐度条件下AOB则主要与Nitrosospira和Nitrosomonas类群相关,AOB群落多样性也随盐度的增加而降低[59]。
河流悬浮颗粒物也能影响水体和沉积物的微生物活性和氮素的转化,悬浮颗粒物浓度增加,水体亚硝酸盐氧化速率增加,硝化能力增强[60, 61],反硝化速率也随之线性增加,而且上覆水的扰动能够促进沉积物的反硝化活性[62]。此外,沉积物中的重金属如Cd、Cu等也能够影响氮循环微生物特别是反硝化细菌的丰度、多样性和群落活性[63]。
总之,微生物与环境因子的响应关系,对全面了解河流沉积物氮循环功能类群的生态特征至关重要。不同区域的主要影响因子也因环境条件的不同而有所不同,营养盐、DO、季节(温度)、pH等均是河流沉积物氮循环主要微生物的重要影响 因素。
2.2 河道控制管理措施的影响河流显著的水文动态变化对微生物群落结构和功能具有显著影响,上游水量和水质的控制管理直接关系到下游水体(尤其是湖泊、海洋)的物质能量平衡。一般河流设有诸如水库、大坝、橡胶坝等水力控制措施,其进行水流控制的同时对河流微生物和营养元素的分布具有重要影响[51],如库坝内沉积物中氮循环微生物对过量氮素的吸附、降解和去除,能够缓解下游河段的水质状况。鲍林林等[22]在北运河的研究发现,闸坝下游上覆水和沉积物中的氮素等营养物质的含量明显低于普通河段的含量,沉积物中amoA基因的拷贝数也相对较高。受春季径流农业非点源高浓度NO3−输入的影响,Kaskaskia River (美国)下游水库库坝内沉积物中的反硝化活性比上游河道的高,且硝化速率与NO3−的浓度成正比,对河流过量NO3−的去 除具有重要作用[64]。但是水库内相对的静水状态,可能会导致底层DO过低,而影响需氧微生物的群落特征,如官厅水库底泥中NOB的多样性明显低于水层[29]。
另一方面,河流岸边带状湿地的设置对河流水质管理具有积极作用。位于北运河沙河水库附近植被型岸边湿地,其沉积物的营养物质含量明显低于裸露岸边带沉积物中的,且植被型岸边湿地沉积物反硝化作用对水体营养元素具有显著的去除效 果[65]。河岸带状湿地沉积物中anammox的群落多样性较高,冬、夏季能够分别利用氨氧化过程和硝酸盐还原产生的NO2−进行厌氧氨氧化作用,有利于活性氮的去除[55]。河底反硝化生物反应器[66]和生物膜[34, 67]的设置也能够提高河流沉积物的反硝化 效率。
2.3 污水处理厂的干扰污水处理厂的构建和运行对降低水环境污染具有至关重要的作用,但其运行过程中又对环境具有两个负面影响:处理退水对流域水质的影响和脱水污泥对环境的危害[68]。污水处理厂排放的处理退水含有大量的氮、磷、有机物和微生物,易导致水体污染负荷超标,对河流原本的生态系统影响很 大[69]。研究表明,污水处理厂废水汇入Hahndorf River (澳大利亚)后,从排放口至河流下游,沉积物中NH4+、总磷含量不断升高,amoA和narG基因丰度显著增加,微生物群落多样性受退水影响后降低,原有优势类群如Sphingomonadaceae和Nitrospiraceae等受干扰后消失[70]。高含氮量的退水进入Negev Desert (以色列)的河流后,其沉积物中微生物功能不足以降解和去除过量氮素,部分水体富营养化态势严峻[71]。污水处理退水大量有机物的输入,对河流硝化作用具有一定抑制作用,排放口沉积物的硝化效率和硝化细菌丰度均低于排放口上游沉积物,从排放口顺流而下硝化活性又逐渐恢复[72];受造纸厂过量有机质输入的影响,AOB丰度明显低于未受干扰河段沉积物中的丰度[73]。污水处理系统中的特有微生物经退水进入河流,也会干扰河流生态系统原有的生物体系。北运河是北京市主要的排污河道,其沉积物中部分氨氧化微生物与污水处理厂废水和活性污泥中发现的类群相似性很高[22]。Seine River (法国)流域上游沉积物中的NOB的主要种类为Nitrobacter,受污水处理厂退水的影响,大量Nitrospira类群成为下游河道沉积物中的主要NOB类群[27]。Mußmann等[74]通过接种活性污泥的试验也发现,活性污泥中的AOB的Nitrosomonas oligotropha/ureae类群和NOB的Nitrospira分支Ⅰ类群极易侵占河流沉积物表层生物膜的生态位成为其主要的硝化细菌。总之,污水处理厂对河流生态系统的干扰具有很大的负面效应,有必要通过改进污水处理工艺来降低退水带来的生态风险。
3 展望综上所述,氮循环微生物广泛活跃在河流沉积物中,对河流生态环境的平衡、过量氮素的迁移转化发挥着积极地作用,同时也推动着水生态系统沉积物氮循环功能微生物研究的深入发展。对比海洋和土壤等生态系统,河流沉积物的氮循环微生物特征复杂而多变,且人为干扰剧烈。我国江河众多,氮素污染和水体富营养化现象普遍存在,水质性缺水等环境问题日趋严峻,将水生态系统的污染防治与沉积物微生物氮代谢相结合,从微生物生态学的角度探索沉积物氮素的微生物降解过程,对推动氮素污染控制和生态修复进程至关重要。
对于今后河流沉积物氮循环功能微生物生态特征的研究,提出还需重点关注的几个方面:
(1) 氮循环功能微生物的整体认识。氮循环是多层次的循环系统,除了硝化过程、反硝化过程和厌氧氨氧化过程,河流沉积物环境中还应加强亚硝酸盐氨化(DNRA)、氨化作用等过程的研究。其中,DNRA过程通过还原NO2−将氮素以NH4+的形态保留在环境中,直接影响氮素的去除效率和氨氧化、硝化过程的微生物作用[35],所以,利用分子生物学技术手段,针对相应的16S rRNA基因或功能酶编码基因,进行相应功能微生物群落特征、种类鉴别,及其与环境因子响应关系的研究,对进一步掌握河流生态系统的氮循环具有重要意义。
(2) 不同过程功能类群的相互作用和同一过程多种功能基因/种类的研究。以NH4+为电子供体NO2−为电子受体的厌氧氨氧化过程,其所需的NO2−可以由氨氧化和反硝化两个过程提供,涉及到不同环境条件下不同功能微生物的协作,对氮循环的转化机制和效率也具有重要意义。同一过程往往由多种功能类群或基因所主导,如AOA和AOB所驱动的氨氧化过程在不同条件下具有不同功能优势,由多种还原酶作用的反硝化过程具有多种特殊的功能酶编码基因,群落形成机制也存在差异,它们的群落多样性、功能效率和相互关系还有待深入 研究。
(3) 基于N同位素标记方法的过程速率和不同类群相对贡献率的研究。微生物活性是表征其在环境中功能效率的重要指标,常以物质的转化效率来衡量,同位素标记为定量化研究微生物活性提供了可靠的方法。如15N标记NH4+和NO3−进行反硝化作用与厌氧氨氧化作用脱氮贡献率的研究,但是关于AOA、AOB的相对贡献率和其他循环过程的微生物活性相关研究还不常见。
(4) 城市河流沉积物氮循环功能作用的研究和河道生物处理技术的开发。城市人口增加和工业化发展,对城市内部水环境构成极大压力,河流普遍受到不同程度的氮污染,并导致富营养化水体和大面积缺氧区的形成,在外源污染进行有效控制的同时,河流沉积物对水体的二次污染威胁巨大。针对城市河流沉积物中氮的形态分布、迁移转化和微生物的群落功能的研究,以及积极探索和应用有效的生态修复技术,对城市河流水生态系统和城市的良好发展具有重要意义。
| [1] | Yue WZ, Huang XP. Advance in biogeochemistry studies onnitrogen and phosphorus in offshore sediment[J]. Joural ofOceanography in Taiwan Strait, 2003, 22(3): 407-414 (inChinese)岳维忠, 黄小平. 近海沉积物中氮磷的生物地球化学研究进展[J]. 台湾海峡, 2003, 22(3): 407-414 |
| [2] | Qu JH, Li BZ, Yuan HL. Methodology in studies of microbialresource in sediment[J]. Acta Ecologica Sinica, 2007, 27(6):2636-2641 (in Chinese)屈建航, 李宝珍, 袁红莉. 沉积物中微生物资源的研究方法及其进展[J]. 生态学报, 2007, 27(6): 2636-2641 |
| [3] | Mulder A, Graaf AA, Robertson LA, et al. Anaerobic ammoniumoxidation discovered in a denitrifying fluidized bed reactor[J].FEMS Microbiology Ecology, 1995, 16(3): 177-184 |
| [4] | Graaf AA, Bruijn P, Robertson LA, et al. Autotrophic growth ofanaerobic ammonium-oxidizing microorganisms in a fluidizedbed reactor[J]. Microbiology, 1996, 142(8): 2187-2196 |
| [5] | Könneke M, Bernhard AE, de la Torre JR. Isolation of anautotrophic ammonia-oxidizing marine archaeon[J]. Nature,2005, 437(7058): 543-546 |
| [6] | Canfield DE, Glazer AN, Falkowski PG. The evolution andfuture of earth’s nitrogen cycle[J]. Science, 2010, 330(6001):192-196 |
| [7] | Gong J, Song YJ, Zhang XL. Phylogenetic and functionaldiversity of nitrogen cycling microbes in coastal sediments[J].Biodiversity Science, 2013, 21(4): 433-444 (in Chinese)龚俊, 宋延静, 张晓黎. 海岸带沉积物中氮循环功能微生物多样性[J]. 生物多样性, 2013, 21(4): 433-444 |
| [8] | He JZ, Zhang LM. Advances in ammonia-oxidizingmicroorganisms and global nitrogen cycle[J]. Acta EcologicaSinica, 2009, 29(1): 406-415 (in Chinese)贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展[J].生态学报, 2009, 29(1): 406-415 |
| [9] | Jin T, Zhang T, Yan QM. Characterization and quantification ofammonia-oxidizing archaea (AOA) and bacteria (AOB) in anitrogen-removing reactor using T-RFLP and qPCR[J]. AppliedMicrobiology and Biotechnology, 2010, 87(3): 1167-1176 |
| [10] | Zhu GB, Wang SY, Wang Y, et al. Anaerobic ammonia oxidationin a fertilized paddy soil[J]. The ISME Journal, 2011, 5(12):1905-1912 |
| [11] | Francis CA, Beman JM, Kuypers MMM. New processes andplayers in the nitrogen cycle: the microbial ecology of anaerobicand archaeal ammonia oxidation[J]. The ISME Journal, 2007,1(1): 19-27 |
| [12] | Francis CA, Roberts KJ, Beman JM, et al. Ubiquity and diversityof ammonia-oxidizing archaea in water columns and sedimentsof the ocean[J]. Proceedings of the National Academy ofSciences of the United States of America, 2005, 102(41):14683-14688 |
| [13] | Cao HL, Auguet JC, Gu JD. Global ecological pattern ofammonia-oxidizing archaea[J]. PLoS One, 8(2): e52853 |
| [14] | Li M, Cao HL, Hong YG, et al. Spatial distribution andabundances of ammonia-oxidizing archaea (AOA) andammonia-oxidizing bacteria (AOB) in mangrove sediments[J].Applied Microbiology and Biotechnology, 2011, 89(4):1243-1254 |
| [15] | Jia ZJ, Weng JH, Lin XG, et al. Microbial ecology of archaealammonia oxidation―a review[J]. Acta Microbiologica Sinica,2010, 50(4): 431-437 (in Chinese)贾仲君, 翁佳华, 林先贵, 等. 氨氧化古菌的生态学研究进展[J]. 微生物学报, 2010, 50(4): 431-437 |
| [16] | Liu ZH, Huang SB, Sun GP, et al. Diversity and abundance ofammonia-oxidizing archaea in the Dongjiang River[J].Microbiological Research, 2011, 166(5): 337-345 |
| [17] | Erguder TH, Boon N, Wittebolle L, et al. Environmental factorsshaping the ecological niches of ammonia-oxidizing archaea[J].FEMS Microbiology Reviews, 2009, 33(5): 855-869 |
| [18] | Sun W, Xia C, Xu M, et al. Distribution and abundance ofarchaeal and bacterial ammonia oxidizers in the sediments of theDongjiang River, a drinking water supply for Hong Kong[J].Microbes and Environments, 2013, 28(4): 457-465 |
| [19] | Wang XY, Wang C, Bao LL, et al. Impact of carbon sourceamendment on ammonia-oxidizing microorganisms in reservoirriparian soil[J]. Annals of Microbiology, 2014.DOI:10.1007/s13213-014-0979-8 |
| [20] | Wang XY, Wang C, Bao LL, et al. Abundance and communitystructure of ammonia-oxidizing microorganisms in reservoirsediment and adjacent soils[J]. Applied Microbiology andBiotechnology, 2014, 98(4): 1883-1892 |
| [21] | Wang C, Shan BQ. The distribution of aerobic ammoniaoxidizing microorganisms in Ziya River, Haihe Basin[J]. ActaScientiae Circumstantiae, 2012, 32(12): 2943-2950 (in Chinese)王超, 单保庆. 子牙河水系水和沉积物耗氧氨氧化微生物分布特征[J]. 环境科学学报, 2012, 32(12): 2943-2950 |
| [22] | Bao LL, Chen YJ, Wang XY. Diversity and abundance ofammonia-oxidizing prokaryotes in surface sediments of BeiyunRiver[J]. China Environmental Science, 2015, 35(1): 179-189 (inChinese)鲍林林, 陈永娟, 王晓燕. 北运河沉积物中氨氧化微生物的群落特征[J]. 中国环境科学, 201, 35(1): 179-189 |
| [23] | Altmann D, Stief P, Amann R, et al. In situ distribution andactivity of nitrifying bacteria in freshwater sediment[J].Environmental Microbiology, 2003, 5(9): 798-803 |
| [24] | Cébron A, Berthe T, Garnier J. Nitrification and nitrifyingbacteria in the lower Seine River and Estuary (France)[J].Applied and Environmental Microbiology, 2003, 69(12):7091-7100 |
| [25] | Nakamura Y, Satoh H, Kindaichi T, et al. Community structure,abundance, and in situ activity of nitrifying bacteria in riversediments as determined by the combined use of moleculartechniques and microelectrodes[J]. Environmental Science and Technology, 2006, 40(5): 1532-1539 |
| [26] | Yang XN, Lin XR, Fu SY, et al. Effect of dissolved oxygen onthe vertical distribution of nitrifying bacteria in Tidal Riversediment[J]. Acta Scientiarum Naturalium UniversitatisSunyatseni, 2013, 52(5): 91-96 (in Chinese)杨旭楠, 林兴锐, 符诗雨, 等. 感潮河流沉积物中溶解氧对硝化细菌垂向分布的影响[J]. 中山大学学报: 自然科学版, 2013,52(5): 91-96 |
| [27] | Cébron A, Garnier J. Nitrobacter and Nitrospira genera asrepresentatives of nitrite-oxidizing bacteria: detection,quantification and growth along the lower Seine River(France)[J]. Water Research, 2005, 39(20): 4979-4992 |
| [28] | Dong YJ, Wang SY, Wang CX, et al. Enrichment and sludgecharacteristics analysis of nitrite oxidizing bacteria (NOB)[J].China Environmental Science, 2013, 33(11): 1978-1983 (inChinese)董怡君, 王淑莹, 汪传新, 等. 亚硝酸盐氧化菌(NOB)的富集培养与其污泥特性分析[J]. 中国环境科学, 2013, 33(11):1978-1983 |
| [29] | Zhang HC, Sun YJ, Chen C, et al. Diversity of nitrifying bacteriain sediment and water in Guanting Reservoir[J]. Journal ofBeijing Normal University (Natural Science Edition), 2013,49(Z1): 282-285 (in Chinese)张慧淳, 孙寓姣, 陈程, 等. 官厅水库水体及底泥中硝化功能细菌的群落多样性研究[J]. 北京师范大学学报: 自然科学版,2013, 49(Z1): 282-285 |
| [30] | Guo JH, Peng YZ. Heterotrophic nitrification anaerobicammonia oxidation and archaeal ammonia oxidation in a newnitrogen cycle[J]. Acta Scientiae Circumstantiae, 2008, 28(8):1489-1498 (in Chinese)郭建华, 彭勇臻. 异养硝化、厌氧氨氧化及古菌氨氧化与新的氮循环[J]. 环境科学学报, 2008, 28(8): 1489-1498 |
| [31] | Walter GZ. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews, 1997, 61(4):533-616 |
| [32] | Song YN, Lin ZM, Lin Y. Response of denitrifying bacteriacommunity structure and abundance to nitrogen in paddyfields[J]. Chinese Journal of Eco-Agriculture, 2012, 20(1): 7-21(in Chinese)宋亚娜, 林智敏, 林艳. 氮肥对稻田土壤反硝化细菌群落结构和丰度的影响[J]. 中国生态农业学报, 2012, 20(1): 7-21 |
| [33] | Pei YS, Wang J, Wang ZY, et al. Characteristics ofammonia-oxidizing and denitrifying bacteria at theriver-sediment interface[J]. Procedia Environmental Sciences,2010, 2: 1988-1996 |
| [34] | Storey RG, Williams DD, Fulthorpe RR. Nitrogen processing inthe hyporheic zone of a pastoral stream[J]. Biogeochemistry,2004, 69(3): 285-313 |
| [35] | Washbourne IJ, Crenshaw CL, Baker MA. Dissimilatory nitratereduction pathways in an oligotrophic freshwater ecosystem:spatial and -temporal trends[J]. Aquatic Microbial Ecology, 2011,65(1): 55-64 |
| [36] | Wenk CB, Zopfi J, Blees J, et al. Community N and O isotopefractionation by sulfide-dependent denitrification and anammoxin a stratified lacustrine water column[J]. Geochimica etCosmochimica Acta, 2014, 125(15): 551-563 |
| [37] | Beaulieu JJ, Shuster WD, Rebholz JA. Nitrous oxide emissionsfrom a large, impounded river: the Ohio River[J]. EnvironmentalScience and Technology, 2010, 44(19): 7527-7533 |
| [38] | Laverman AM, Garnier JA, Mounier EM. Nitrous oxideproduction kinetics during nitrate reduction in river sediments[J].Water Research, 2010, 44(6): 1753-1764 |
| [39] | Qin YJ, Zhou SF. Research progress on anaerobicammonium-oxidation bacteria[J]. Chinese Journal of Ecology,2007, 26(11): 1867-1872 (in Chinese)秦玉洁, 周少芬. 厌氧氨氧化菌的研究进展[J]. 生态学杂志,2007, 26(11): 1867-1872 |
| [40] | Thamdrup B, Dalsgaard T. Production of N2 through anaerobicammonium oxidation coupled to nitrate reduction in marinesediments[J]. Applied and Environmental Microbiology, 2002,68(3): 1312-1318 |
| [41] | Zhao YQ, Xia YQ, Kana TM, et al. Seasonal variation andcontrolling factors of anaerobic ammonium oxidation infreshwater river sediments in the Taihu Lake region of China[J].Chemosphere, 2013, 93(9): 2124-2131 |
| [42] | Dong LF, Smith CJ, Papaspyrou S, et al. Changes in benthicdenitrification, nitrate ammonification, and anammox processrates and nitrate and nitrite reductase gene abundances along anestuarine nutrient gradient (the Colne Estuary, UnitedKingdom)[J]. Applied and Environmental Microbiology, 2009,75(10): 3171-3179 |
| [43] | Zhou S, Borjigin S, Riya S, et al. The relationship betweenanammox and denitrification in the sediment of an inland river[J].Science of the Total Environment, 2014, 490: 1029-1036 |
| [44] | Gao ZQ, Zhu L, Zhu W, et al. Diversity of denitrifying bacteriaby encoding nirS gene from surface sediments of the Pear RiverEsturary[J]. Oceanologia et Limnologia Sinica, 2012, 43(6):1114-1121 (in Chinese)高志强, 朱玲, 朱伟, 等. 珠江口表层沉积物nirS 型反硝化微生物多样性[J]. 海洋与湖泊, 2012, 43(6): 1114-1121 |
| [45] | Abell GCJ, Ross DJ, Keane JP, et al. Nitrifying and denitrifyingmicrobial communities and their relationship to nutrient fluxesand sediment geochemistry in the Derwent Estuary, Tasmania[J].Aquatic Microbial Ecology, 2013, 70(1): 63-75 |
| [46] | Sun W, Xu MY, Wu WM, et al. Molecular diversity anddistribution of anammox community in sediments of theDongjiang River, a drinking water source of Hong Kong[J].Journal of Applied Microbiology, 2014, 116(2): 464-476 |
| [47] | Sáenz JP, Hopmans EC, Rogers D, et al. Distribution ofanaerobic ammonia-oxidizing bacteria in a subterraneanestuary[J]. Marine Chemistry, 2012, 136/137: 7-13 |
| [48] | Hu BL, Shen LD, Zheng P, et al. Distribution and diversity ofanaerobic ammonium-oxidizing bacteria in the sediments of theQiantang River[J]. Environmental Microbiology Reports, 2012,4(5): 540-547 |
| [49] | Magalhães CM, Joye SB, Moreira RM, et al. Effect of salinityand inorganic nitrogen concentrations on nitrification anddenitrification rates in intertidal sediments and rocky biofilms ofthe Douro River estuary, Portugal[J]. Water Research, 2005,39(9): 1783-1794 |
| [50] | Lisa JA, Song BK, Tobias CR, et al. Impacts of freshwaterflushing on anammox community structure and activities in theNew River Estuary, USA[J]. Aquatic Microbial Ecology, 2014,72(1): 17-31 |
| [51] | Yu Y, Wang XY, Zhang PF. Spatial distribution of planktonicbacterial community and its relationship to water quality inBeiyun River[J]. Asian Journal of Ecotoxicology, 2012, 7(3):337-344 (in Chinese)于洋, 王晓燕, 张鹏飞. 北运河水体浮游细菌群落的空间分布特征及其与水质的关系[J]. 生态毒理学报, 2012, 7(3):337-344 |
| [52] | Zhang Y, Yan BX. Research on influence of ditch sedimentspurifying nitrogen from wate under drying and wettingconditions[J]. Journal of Soil and Water Conservation, 2011,25(3): 113-116 (in Chinese)张燕, 阎百兴. 干湿条件对沟渠沉积物净化水体氮素的影响研究[J]. 水土保持学报, 2011, 25(3): 113-116 |
| [53] | Bernhard AE, Tucher J, Giblin AE, et al. Functionally distinctcommunities of ammonia-oxidizing bacteria along an estuarinesalinity gradient[J]. Environmental Microbiology, 2007, 9(6):1439-1447 |
| [54] | Fan JF, Chen JY, Chen LG, et al. Research on denitrifying bacteriaquantification and diversity in Liaohe Estuary sediments[J]. ActaOceanologica Sinica, 2011, 33(3): 94-102 (in Chinese)樊景风, 陈佳莹, 陈立广, 等. 辽河口沉积物反硝化细菌数量及多样性的研究[J]. 海洋学报, 2011, 33(3): 94-102 |
| [55] | Wang SY, Zhu GB, Peng YZ, et al. Anammox bacterialabundance, activity, and contribution in riparian sediments of thePearl River Estuary[J]. Environmental Science & Technology,2012, 46(16): 8834-8842 |
| [56] | Liu S, Shen LD, Lou LP, et al. Spatial distribution and factorsshaping the niche segregation of ammonia-oxidizingmicroorganisms in the Qiantang River, China[J]. Applied andEnvironmental Microbiology, 2013, 79(13): 4065-4071 |
| [57] | Cao HL, Hong YG, Li M, et al. Diversity and abundance ofammonia-oxidizing prokaryotes in sediments from the coastalPearl River estuary to the South China Sea[J]. Antonie vanLeeuwenhoek, 2011, 100(4): 545-556 |
| [58] | Smith CJ, Nedwell DB, Dong LF, et al. Diversity and abundanceof nitrate reductase genes (narG and napA), nitrite reductasegenes (nirS and nrfA), and their transcripts in estuarinesediments[J]. Applied and Environmental Microbiology, 2007,73(11): 3612-3622 |
| [59] | Bernhard AE, Donn T, Giblin AE, et al. Loss of diversity ofammonia-oxidizing bacteria correlates with increasing salinity inan estuary system[J]. Environmental Microbiology, 2005, 7(9):1289-1297 |
| [60] | Dang HY, Luan XW, Chen RP, et al. Diversity, abundance anddistribution of amoA-encoding archaea in deep-sea methane seepsediments of the Okhotsk Sea[J]. FEMS Microbioogyl Ecology,2010, 72(3): 370-385 |
| [61] | Xia XH, Yang ZF, Huang GH, et al. Nitrification in naturalwaters with high suspended-solid content—a study for theYellow River[J]. Chemosphere, 2004, 57(8): 1017-1029 |
| [62] | Liu T, Xia XH, Liu SD, et al. Acceleration of denitrification inturbid rivers due to denitrification occurring on suspendedsediment in oxic waters[J]. Environmental Science &Technology, 2013, 47(9): 4053-4061 |
| [63] | Zhang XL, Agogué H, Dupuy C, et al. Relative abundance ofammonia oxidizers, denitrifiers, and anammox bacteria insediments of hyper-nutrified estuarine tidal flats and in relationto environmental conditions[J]. Clean-Soil Air Water, 2013,41(6): 1-9 |
| [64] | Wall LG, Tank JL, Royer TV, et al. Spatial and temporalvariability in sediment denitrification within an agriculturallyinfluenced reservoir[J]. Biogeochemistry, 2005, 76(1): 85-111 |
| [65] | Wang CX, Zhu GB, Wang Y, et al. The purification function ofriparian wetlands on the eutrophicated river[J]. Acta ScientiaeCircumstantiae, 2012, 32(1): 51-56 (in Chinese)王朝旭, 祝贵兵, 王雨, 等. 岸边带湿地对富营养化河流的净化作用研究[J]. 环境科学学报, 2012, 32(1): 51-56 |
| [66] | Elgood Z, Robertson WD, Schiff SL, et al. Nitrate removaland greenhouse gas production in a stream-bed denitrifyingbioreactor[J]. Ecological Engineering, 2010, 36(11):1575-1580 |
| [67] | Boulêtreau S, Salvo E, Lyautey E, et al. Temperature dependenceof denitrification in phototrophic river biofilms[J]. Science of theTotal Environment, 2012, 416: 323-328 |
| [68] | Li M, Zhang XH, Li YW, et al. Environmental impacts ofsewage treatment system based on emergy analysis[J]. ChineseJournal of Applied Ecology, 2013, 24(2): 488-496 (in Chinese)李敏, 张小洪, 李远伟, 等. 基于能值的污水处理系统环境影响分析[J]. 应用生态学报, 2013, 24(2): 488-496 |
| [69] | Daniel MHB, Montebelo AA, Bernardes MC, et al. Effects ofurban sewage on dissolved oxygen, dissolved inorganic andorganic carbon, and electrical conductivity of small streamsalong a gradient of urbanization in the Piracicaba River basin[J].Water, Air, & Soil Pollution, 2002, 136(1/4): 189-206 |
| [70] | Wakelin SA, Colloff MJ, Kookana RS. Effect of wastewatertreatment plant effluent on microbial function and communitystructure in the sediment of a freshwater stream with variableseasonal flow[J]. Applied and Environmental Microbiology,2008, 74(9): 2659-2668 |
| [71] | Angel R, Asaf L, Ronen Z, et al. Nitrogen transformations anddiversity of ammonia-oxidizing bacteria in a desert ephemeralstream receiving untreated wastewater[J]. Microbial Ecology,2010, 59(1): 46-58 |
| [72] | Montuelle B, Balandras B, Volat B, et al. Effect of wastewatertreatment plant discharges on the functional nitrifyingcommunities in river sediments[J]. Aquatic Ecosystem Health &Management, 2003, 6(4): 381-390 |
| [73] | Abell GCJ, Ross DJ, Keane J, et al. Niche differentiation ofammonia-oxidising archaea (AOA) and bacteria (AOB) inresponse to paper and pulp mill effluent[J]. Microbiology ofAquatic Systems, 2014, 67(4): 758-768 |
| [74] | Mußmann M, Ribot M, von Schiller D, et al. Colonization offreshwater biofilms by nitrifying bacteria from activatedsludge[J]. FEMS Microbiology Ecology, 2013, 85(1): 104-115 |
 2015, Vol. 42
2015, Vol. 42