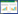扩展功能
文章信息
- 黄庆庆, 吉文汇, 杜斌, 程玉强, 孙建和
- HUANG Qing-Qing, JI Wen-Hui, DU Bin, CHENG Yu-Qiang, SUN Jian-He
- 高效广谱猪链球菌7型前噬菌体裂解酶的挖掘及活性研究
- ining and evaluating the high-effectiveness and broad-spectrum endolysin encoded by prophage harbored in Streptococcus suis serotype 7
- 微生物学通报, 2015, 42(06): 1052-1059
- Microbiology China, 2015, 42(06): 1052-1059
- 10.13344/j.microbiol.china.140678
-
文章历史
- 收稿日期: 2014-09-10
- 接受日期: 2014-11-17
- 优先数字出版日期(www.cnki.net): 2014-11-17
猪链球菌是一种人畜共患病原菌,可引起脑膜炎、败血症、关节炎、心内膜炎等疾病,严重的可致人死亡[1]。现已发现该菌荚膜抗原血清型有35种以上,大多数致病性血清型为1−9型和14型[2],2型为世界范围内流行的一个主要血清型,除2型菌株外,7型菌株也是经常分离到的血清型之一。随着7型菌株的频繁发现[3, 4],对其防控研究也就显得非常必要。金黄色葡萄球菌也是一种人畜共患病原菌,多重耐药性及耐甲氧西林金黄色葡萄球菌(MRSA)呈全球性扩散、传播,严重威胁着人类健康。目前,临床上主要采用抗生素治疗细菌感染,但由于抗生素滥用等原因,近年来细菌耐药加剧。应用抗生素治疗耐药细菌感染已面临巨大挑战,研发高效、广谱抗菌药物具有理论和现实意义。
研究发现,噬菌体编码的裂解酶是治疗细菌感染的一种新型、具有潜力的抗菌物质。裂解酶是噬菌体感染细菌后期[5, 6]合成的肽聚糖水解酶,通过降解宿主菌细胞壁,释放子代噬菌体,达到裂解宿主菌的目的。裂解酶具有较高的特异性,仅攻击特定细菌,并不影响人体正常菌群和细胞。因此,裂解酶作为潜在的抗感染药物具有重要的研究价值[7]。
目前国内外报道的大多数裂解酶均来源于裂解性噬菌体,其裂菌谱相对较窄[8, 9],而且较多病原菌较难获得裂解性噬菌体,从而给裂解酶的研发带来一定的难度。研究发现大多数细菌的基因组中存在前噬菌体(prophage)序列,且其中一般含有编码裂解酶的基因,这给研发裂解酶提供了新的策略和途径。尽管如此,由于不同结构组成的裂解酶其裂菌效率和裂菌谱差异很大,因此挖掘高效、广谱的裂解酶基因非常重要。研究发现具有酰胺酶催化域的裂解酶一般活性较高[10, 11, 12],同时,具有SH3b结合域的裂解酶呈现相对较宽的裂解谱,甚至可以裂解不同种的细菌[13]。据此,本文基于GenBank中猪链球菌前噬菌体基因信息,通过挖掘、筛选,发现了一猪链球菌球菌7型菌株编码的高效、广谱裂解酶Ly7917[14],Ly7917的发现为临床上治疗多种革兰阳性菌的混合感染带来了希望。
1 材料与方法 1.1 材料菌株与质粒:质粒pET28a(+)由本实验室保存;猪链球菌2型菌株Streptococcus suis 2-1 (即SS2-1)、05-465、19-2(A)、5-2、ZY05719、HA9801、HA9802、HA05729-1、29、S. suis 2-H (即SS2-H)、11-1、S. suis 2-4 (即SS2-4)、006731,7型菌株S. suis 7 (即SS7),9型菌株S. suis 9 (即SS9),马链球菌兽疫亚种参考株ATCC35246,沙门氏菌,枯草芽孢杆菌和大肠杆菌由本实验室保存。耐甲氧西林金黄色葡萄球菌菌株PNB49、DL44-2、SD2-17-1、DL57-3、DZ92、PNB5、PNB25、PN31、DL56-1由上海兽医研究所提供。金黄色葡萄球菌菌株ATCC25913和05P361、05Q132、05-L189、K185、B52分别由上海市动物疫病预防控制中心和上海交通大学农业与生物学院食品科学实验室提供。猪链球菌7型菌株7917基因组DNA由南京农业大学惠赠。
主要的酶和试剂:2×Taq Master mix购于上海翊圣生物科技有限公司;FastPfu DNA Polymerase购于北京全式金生物技术有限公司;限制性核酸内切酶FastDigest EcoR I、FastDigest Hind III和Rapid DNA Ligation Kit购于Thermo公司;质粒提取试剂盒和胶回收试剂盒购于TIANGEN公司。
1.2 裂解酶基因的挖掘挖掘并筛选GenBank上登录的猪链球菌前噬菌体的裂解酶基因,并在smart.embl-heidelberg.de/网站上进行功能域的预测,从而挖掘出潜在的高效广谱的裂解酶基因并进行深入研究。
1.3 裂解菌的培养猪链球菌和沙门氏菌的培养:菌液按1%转接于含2%胎牛血清的THB培养基中,37 °C、150 r/min培养6−8 h至菌液生长到OD600达到0.8−1.0。
金黄色葡萄球菌的培养:菌液按1%转接于BHI培养基中,37 °C、150 r/min培养2−4 h至菌液生长到OD600达到0.8−1.0。
枯草芽孢杆菌和大肠杆菌的培养:菌液按1%转接于LB培养基中,37 °C、150 r/min培养2−4 h至菌液生长到OD600达到0.8−1.0。
1.4 裂解酶基因的克隆参照GenBank中猪链球菌7917菌株的基因组DNA序列(GenBank登录号为KC348601.1),设计两条引物F和R,并在两条引物的5′端分别插入限制性核酸内切酶EcoR I和Hind III酶切位点,引物序列如下:F:5′-ACCGAATTCATGACAACAGT AAATGAAGCA-3′;R:5′-ACGAAGCTTTTATTTAA AAGTACCCCAGGC-3′。
PCR反应体系:引物F (10 μmol/L) 2 μL,引物R (10 μmol/L) 2 μL,猪链球菌7917菌株的基因组DNA 1 μL,5×FastPfu buffer 10 μL,2.5 mmol/L dNTPs 5 μL,DNA Polymerase 1 μL,去离子水 29 μL。PCR反应条件:95 °C 2 min;95 °C 20 s,60 °C 20 s,72 °C 15 s,30个循环;72 °C 5 min。反应结束后,取5 μL产物采用1%的琼脂糖凝胶电泳检测,并用胶回收试剂盒回收PCR产物。
1.5 重组表达质粒pET28a(+)-Ly7917的构建采用常规方法构建重组表达质粒。双酶切体系:FastDigest EcoR I 1 μL、FastDigest Hind III 1 μL、10×FastDigest green buffer 3 μL、DNA or pET28a(+) 10 μL、去离子水15 μL。37 °C酶切30 min。采用胶回收试剂盒回收产物,保存在−20 °C。连接体系:Rapid ligation buffer 2 μL、DNA 5 μL、pET28a(+) 1 μL、T4 DNA Ligase 1 μL、去离子水1 μL,22 °C连接30 min。反应结束后将连接产物转化至Escherichia coli DH5α感受态细胞、涂板、挑单克隆,采用PCR和双酶切的方法鉴定pET28a(+)- ly7917重组阳性克隆,并将筛选到的阳性克隆送生工生物工程(上海)股份有限公司测序。将所测的序列用DNAMAN比对分析,挑选与目的基因比对相似性达到100%的单克隆抽提质粒,转化Escherichia coli BL21并保菌。
1.6 Ly7917融合蛋白的表达将冻存的菌种pET28a(+)-ly7917-BL21按1:100转接至卡那霉素抗性的LB液体培养基中,37 °C、150 r/min培养12−14 h,复苏菌种,将复苏的菌种按1:100转接至1 L卡那霉素抗性的LB液体培养基中,相同条件下培养3−4 h至菌液生长到OD600达到0.6,加入IPTG至终浓度为1 mmol/L,27 °C诱导4−6 h,取5 ml菌液样品进行SDS-PAGE电泳检测。剩余菌液用25 ml PBS重悬后,超声波破碎,取上清获得Ly7917蛋白粗提液,保存于4 °C,用于活性检测,部分粗提液经Ni柱纯化后获得纯化蛋白,用于活性单位和裂菌谱的测定。
1.7 融合蛋白的活性检测采用平板裂解实验检测融合蛋白的活性。将 50 ml培养至OD600为1.0的猪链球菌2型菌株HA9801用1 mL PBS重悬后与10 mL 0.7%的THB上层琼脂混匀,倒平板,打孔,共打4个孔,编号为A、B、C、D。A孔加入100 μL Ly7917蛋白粗提液,B、C、D孔为对照,每孔分别加入等量的青霉素、空载体粗提液和PBS。37 °C 孵育至少24 h后,观察有无裂菌圈。
1.8 裂菌活性单位的测定采用浊度递减实验测定裂解酶Ly7917的活性单位。将培养到OD600达到1.0的HA9801重悬至OD650为0.6[8]制成细菌悬液,将细菌悬液加入96孔板中,每孔加100 μL,随后每孔细菌悬液中加 100 μL倍比稀释的起始浓度为3.27 g/L的Ly7917,每组设置3个重复,37 °C孵育30 min,测定细菌浊度下降百分数,能够使 细菌浊度下降50%的酶抗生素的最高稀释度的倒数定义为该蛋白制剂的一个活性单位(Unit/mL)[8]。对照组每孔加入等量的PBS和120 mmol/L咪唑。
1.9 裂菌谱的测定采用浊度递减实验检测Ly7917对不同菌株的裂解效率。链球菌2型菌株S. suis 2-1 (即SS2-1)、05-465、19-2(A)、5-2、ZY05719、HA9801、HA9802、HA05729-1、29、S. suis 2-H (即SS2-H)、11-1、S. suis 2-4 (即SS2-4)、00673,7型菌株S. suis 7 (即SS7),9型菌株S. suis 9 (即SS9),马链球菌兽疫亚种参考株ATCC35246,沙门氏菌、枯草芽孢杆菌,大肠杆菌和金黄色葡萄球菌菌株(PNB49、DL44-2、SD2-17-1、DL57-3、DZ92、PNB5、PNB25、PN31、DL56-1、05P361、05Q132、ATCC25913、05-L189、K185、B52)按1.7的方法培养和处理后分别加入96孔板,然后每孔加入100 μL Ly7917至终浓度为1.635 g/L,每组设置3个重复,37 °C孵育30 min,计算细菌浊度下降百分数,测定裂解酶Ly7917对不同菌株的裂解效率。
2 结果与分析 2.1 裂解酶基因的挖掘通过对国内外已发表的噬菌体编码裂解酶的结构和组成分析发现,具有酰胺酶催化域的裂解酶一般活性较高[10, 11, 12],具有SH3b结合域的裂解酶呈现相对较宽的裂解谱[13]。据此,从GenBank中筛选出具有代表性的猪链球菌前噬菌体裂解酶A、B和C (图1),其中,裂解酶A[14] (GenBank序列号:KC348600)共有278个氨基酸残基,功能域由两部分组成,其中结合域为SH3b;裂解酶B[15] (GenBank序列号:EF563971)共有802个氨基酸残基,功能域由7部分组成,结构比较复杂,蛋白分子量较大;裂解酶C[14] (GenBank序列号:KC348601.1)即为Ly7917,由246个氨基酸残基组成,功能域有两部分组成,8−146为CHAP催化域和167−235为SH3b结合域分子量为27 kD。通过比较、分析和预试验,最终筛选出Ly7917作为目标裂解酶,并进行深入研究。

|
| 图1 猪链球菌噬菌体裂解酶功能域预测 Figure 1 Functional domains prediction of streptococcus suis phage lysins |
以猪链球菌7型菌株7917基因组为模板,用引物F、R扩增ly7917基因,电泳结果显示扩增出了一条大小约750 bp的产物,与目的基因大小 一致。
2.3 重组质粒pET28a(+)-ly7917的双酶切鉴定从E. coli DH5α中抽提质粒pET28a(+)-ly7917,用EcoR I和Hind III进行双酶切鉴定,结果显示大约在750 bp处有一条带,大小与目的基因相符,另一条带为载体(图2)。
|
| 图2 pET28a(+)-ly7917重组质粒的双酶切图谱 Figure 2 pET28a(+)-ly7917 digested with EcoR I and Hind III 注:1:DM5000核酸Marker;2:EcoR I和Hind III双酶切的pET28a(+)-ly7917;3:EcoR I和Hind III双酶切的ly7917;4:EcoR I和Hind III双酶切的pET28a(+);5:pET28a(+). Note: 1: DM5000 DNA marker; 2: pET28a(+)-ly7917 digested with EcoR I and Hind III; 3: ly7917 digested with EcoR I and Hind III; 4: pET28a(+) digested with EcoR I and Hind III; 5: pET28a(+). |
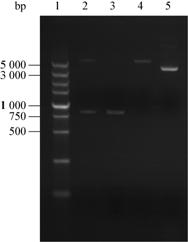
取表达菌培养至OD600达到0.6时加入诱导剂IPTG至终浓度为1 mmol/L,27 °C 诱导4−6 h,进行SDS-PAGE电泳检测融合蛋白表达情况。结果显示,诱导组在30 kD处有一条明显的蛋白条带,未加诱导剂组和空载体组均未出现条带(图3)。蛋白粗提液经Ni柱纯化后浓度约为3.27 g/L,1 L表达菌可获得纯化蛋白32.7 mg。
|
|
图3
大肠杆菌重组表达Ly7917蛋白的SDS-PAGE分析
Figure 3
SDS-PAGE analysis of E. coli expressed fusion protein Ly7917
注:1:Blue Plus II protein marker;2:IPTG诱导组;3:未诱导组;4:诱导的pET28a(+)空载体组;5:纯化后的Ly7917.
Note: 1: Blue Plus II protein marker; 2: Induced with IPTG; 3: Uninduced with IPTG; 4: Empty vector pET28a(+) induced with IPTG; 5: Purified Ly7917. |
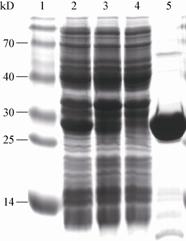
以猪链球菌2型高致病力菌株HA9801为裂解菌,采用平板裂解实验检测Ly7917粗提液能否裂解HA9801,以青霉素作为对照。A孔加入100 μL Ly7917粗提液,B孔加入等量的青霉素,C孔和D孔分别加入空载体粗提液和PBS。结果显示A孔能够形成透亮的裂菌圈,B孔可以形成模糊可见的抑菌圈,C、D均不能形成裂菌圈(图4)。Ly7917粗提液有活性,能够裂解猪链球菌2型菌株HA9801。
|
|
图4
平板裂解实验检测Ly7917粗提液的裂解活性
Figure 4
Plate lysis assay for detecting lysin activity of crude Ly7917
注:A:加入100 μL Ly7917粗提液;B:加入100 μL青霉素;C:加入100 μL空载体粗提液;D:加入100 μL PBS. Note: A: added 100 μL crude Ly7917; B: added 100 μL penicillin; C: added 100 μL crude empty vector; D: added 100 μL PBS. |
以HA9801为裂解菌,采用浊度递减实验测定纯化蛋白Ly7917的活性单位。37 °C孵育30 min,测定细菌浊度下降百分数,能够使细菌浊度下降50%的蛋白制剂最高稀释度的倒数定义为该蛋白制剂的一个活性单位(Unit/mL)[8]。结果显示:在37 °C条件下,当原浓度为3.27 g/L的Ly7917稀释倍数为1:211时,37 °C孵育30 min后能够使HA9801的浊度下降50% (图5)。因此,Ly7917的活性为 2 048 Unit/mL,626 Unit/mg,每个活性单位所含的Ly7917重组蛋白的量为1.60 µg。
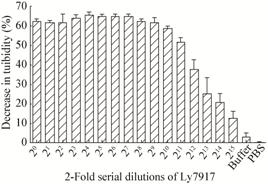
|
| 图5 以HA9801为裂解菌 Ly7917活性单位的测定 Figure 5 Lysin activity of Ly7917 to HA9801 |
采用浊度递减实验测定Ly7917对猪链球菌2型、7型、9型、马链球菌兽疫亚种参考株ATCC35246、大肠杆菌、沙门氏菌、枯草芽孢杆菌和金黄色葡萄球菌的裂解效率。试验结果表明Ly7917对猪链球菌2型、7型、9型、马链球菌兽疫亚种参考株ATCC35246和金黄色葡萄球菌都具有裂解作用,而且对大多数猪链球菌2型菌株较敏感,裂解活性较高(图6)。
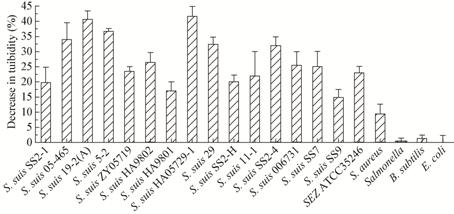
|
| 图6 Ly7917对不同菌株的裂解效率 Figure 6 Range of activity of Ly7917 towards tested bacteria |
噬菌体是一种感染原核细胞的病毒,依据侵染细菌机制的不同,可将噬菌体分为裂解性噬菌体和溶源性噬菌体。裂解性噬菌体通过吸附、侵入、增殖、组装和释放5个阶段杀死病原菌。溶源性噬菌体侵染宿主后,将其基因组整合至宿主菌基因组上,并随宿主菌基因组的复制而复制,成为前噬菌体,其在特定的条件下(如丝裂霉素C诱导等),噬菌体DNA可与宿主菌DNA分离,进入裂解循环,裂解宿主菌。猪链球菌裂解性噬菌体分离比较困难,SMP是目前国内分离到的唯一一种猪链球菌裂解性噬菌体[16],因此试图应用裂解性噬菌体防控耐药性猪链球菌存在难度。裂解酶是噬菌体感染细菌后期[5, 6]合成的肽聚糖水解酶,具有裂菌作用。相对于噬菌体而言裂解酶的裂菌谱更广,例如SMP仅能够裂解2株猪链球菌2型株,而其编码的裂 解酶LySMP能够裂解15株猪链球菌2型菌株;除此之外,LySMP对猪链球菌7型和9型也具有裂解作用[7],提示噬菌体裂解酶具有广阔的开发应用前景。
目前国内外报道的大多数裂解酶均来源于裂解性噬菌体,其裂菌谱相对较窄[8, 9],而且较多病原菌较难获得裂解性噬菌体,从而给裂解酶的研发带来一定的难度。研究发现大多数细菌的基因组中均存在前噬菌体(Prophage)序列,且在其中一般含有编码裂解酶的基因,这给研发裂解酶提供了新的策略和途径。因此,本文基于GenBank中猪链球菌前噬菌体基因信息,从一猪链球菌球菌7型菌株中成功挖掘、筛选出一高效、广谱的裂解酶Ly7917[14]。显然,基于细菌基因组挖掘前噬菌体裂解酶技术的建立,为临床上治疗多种革兰氏阳性菌的混合感染提供了可能。
Ly7917的高效、广谱的裂菌特性归功于其功能域的组成:它同时具备CHAP酰胺酶催化域和SH3b结合域。大多数噬菌体裂解酶具有“双结构域结构”的特点:氨基端结构域具有催化活性,能够特异性的切断肽聚糖中的化学键,羧基端结构域可以与宿主菌细胞壁上的特异性底物结合[17, 18]。裂解酶在裂解细菌时催化域主要作用于肽聚糖上的糖苷键和肽键,CHAP催化域作用位点为肽侧链和交联桥之间的氨基或肽键连接,肽聚糖酰胺连接在细菌种间往往是保守的[19],因此相应的裂解酶具有高效、广谱的裂菌特性,如国外发现的裂解酶PlySs2对化脓性链球菌、MRSA、VISA等多种革兰氏阳性致病菌都具有裂解作用[20]。
Ly7917是继PlySs2[20]之后,国内首次筛选到的一株广谱高效的猪链球菌噬菌体裂解酶,Ly7917对链球菌、葡萄球菌等革兰氏阳性菌的许多菌株都具有高效裂解活性。相比国内外报道的一些噬菌体裂解酶裂菌谱窄的缺点而言,该裂解酶在裂菌谱上有了新的拓展。到目前为止,国内外均没有关于用噬菌体裂解酶治疗体内多种细菌引起的混合感染的相关报道,鉴于Ly7917在裂菌谱和杀菌效率上的大幅提升,其将在临床抗菌治疗上具有重要的潜在应用价值。
在治疗细菌感染时,裂解酶比抗生素具有更好的特异性,抗生素在抑制病原菌的同时也抑制了肠道菌群的正常繁殖,并引起不良后遗症,如腹泻和难辨梭状芽孢杆菌并发症等。相比之下,裂解酶可特异性地杀死特定病原体,而不影响其他正常菌 群[6],但不足的是裂解酶的特异性限制了其在治疗混合感染时的应用。Ly7917高效、广谱的裂菌特性为临床上关于用一种裂解酶治疗多种革兰氏阳性菌引起的混合感染的研究提供了强有力的素材。
最新研究表明,流感大流行时化脓链球菌、肺炎球菌和耐甲氧西林金黄色葡萄球菌引起的二次感染死亡率达到90%以上[21, 22, 23, 24]。莫匹罗星和多链丝霉素是目前仅有的能够治疗黏膜上病原菌定殖的两种抗生素,但是由于抗生素的滥用,金黄色葡萄球菌对这两种抗生素均产生了耐药性[25]。虽然有些噬菌体裂解酶能够特异性地裂解肺炎球菌、链球菌或者金黄色葡萄球菌,可为临床上利用噬菌体裂解酶治疗口腔和鼻黏膜上病原菌的定殖带来新的希望[8, 9, 11, 26, 27, 28],但美中不足的是,需要多种裂解酶混合用药才能够治疗多种病原菌的感染。而Ly7917对链球菌和葡萄球菌等多种菌株都具有裂解活性,因此,未来在流感大流行时也许可以尝试采用裂解酶作用于易感人群,抑制致病性链球菌和葡萄球菌的增殖,有效地减少这些细菌的继发感染[29]。
总之,我们发现了一个高效、广谱的噬菌体裂解酶,该裂解酶能够高效裂解猪链球菌2型、7型、9型、马链球菌兽疫亚种参考株、金黄色葡萄球菌(包括耐甲氧西林金黄色葡萄球菌)等多种革兰氏阳性病原菌。而且,该裂解酶制备、纯化便捷、产量高、对环境条件的耐受能力强(将另文发表)。这些特性都为临床上利用裂解酶治疗混合感染带来了希望。
| [1] | Gottschalk M, Segura M. The pathogenesis of the meningitis caused by Streptococcus suis: the unresolved questions[J]. Veterinary Microbiology, 2000, 76(3): 259-272 |
| [2] | Gottschalk M, Segura M, Xu J. Streptococcus suis infections in humans: the Chinese experience and the situation in North America[J]. Animal Health Research Reviews/Conference of Research Workers in Animal Diseases, 2007, 8(1): 29-45 |
| [3] | MacLennan M, Foster G, Dick K, et al. Streptococcus suis serotypes 7, 8 and 14 from diseased pigs in Scotland[J]. The Veterinary Record, 1996, 139(17): 423-424 |
| [4] | Aarestrup FM, Jorsal SE, Jensen NE. Serological characterization and antimicrobial susceptibility of Streptococcus suis isolates from diagnostic samples in Denmark during 1995 and 1996[J]. Veterinary Microbiology, 1998, 60(1): 59-66 |
| [5] | O’Flaherty S, Ross RP, Coffey A. Bacteriophage and their lysins for elimination of infectious bacteria[J]. FEMS Microbiology Reviews, 2009, 33(4): 801-819 |
| [6] | Fischetti VA. Bacteriophage lysins as effective antibacterials[J]. Current Opinion in Microbiology, 2008, 11(5): 393-400 |
| [7] | Wang Y, Sun JH, Lu CP. Purified recombinant phage lysin LySMP: an extensive spectrum of lytic activity for swine Streptococci[J]. Current Microbiology, 2009, 58(6): 609-615 |
| [8] | Nelson D, Loomis L, Fischetti VA. Prevention and elimination of upper respiratory colonization of mice by group A Streptococci by using a bacteriophage lytic enzyme[J]. Proceedings of National Academy of Science of the United States of America, 2001, 98(7): 4107-4112 |
| [9] | Loeffler JM, Nelson D, Fischetti VA. Rapid killing of Streptococcus pneumoniae with a bacteriophage cell wall hydrolase[J]. Science, 2001, 294(5549): 2170-2172 |
| [10] | Idelevich EA, von Eiff C, Friedrich AW, et al. In vitro activity against Staphylococcus aureus of a novel antimicrobial agent, PRF-119, a recombinant chimeric bacteriophage endolysin[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(9): 4416-4419 |
| [11] | Daniel A, Euler C, Collin M, et al. Synergism between a novel chimeric lysin and oxacillin protects against infection by methicillin-resistant Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy, 2010, 54(4): 1603-1612 |
| [12] | Schmelcher M, Powell AM, Becker SC, et al. Chimeric phage lysins act synergistically with lysostaphin to kill mastitis-causing Staphylococcus aureus in murine mammary glands[J]. Applied and Environmental Microbiology, 2012, 78(7): 2297-2305 |
| [13] | Becker SC, Foster-Frey J, Stodola AJ, et al. Differentially conserved Staphylococcal SH3b_5 cell wall binding domains confer increased staphylolytic and streptolytic activity to a Streptococcal prophage endolysin domain[J]. Gene, 2009, 443(1/2): 32-41 |
| [14] | Tang F, Bossers A, Harders F, et al. Comparative genomic analysis of twelve Streptococcus suis (pro)phages[J]. Genomics, 2013, 101(6): 336-344 |
| [15] | Ju CX, Gu HW, Lu CP. Characterization and functional analysis of atl, a novel gene encoding autolysin in Streptococcus suis[J]. Journal of Bacteriology, 2012, 194(6): 1464-1473 |
| [16] | Ma YL, Lu CP. Isolation and identification of a bacteriophage capable of infecting Streptococcus suis type 2 strains[J]. Veterinary Microbiology, 2008, 132(3/4): 340-347 |
| [17] | Diaz E, Lopez R, Garcia JL. Chimeric phage-bacterial enzymes: a clue to the modular evolution of genes[J]. Proceedings of National Academy of Science of the United States of America, 1990, 87(20): 8125-8129 |
| [18] | Garcia P, Garcia JL, Garcia E, et al. Modular organization of the lytic enzymes of Streptococcus pneumoniae and its bacteriophages[J]. Gene, 1990, 86(1): 81-88 |
| [19] | Vollmer W, Blanot D, de Pedro MA. Peptidoglycan structure and architecture[J]. FEMS Microbiology Reviews, 2008, 32(2): 149-167 |
| [20] | Gilmer DB, Schmitz JE, Euler CW, et al. Novel bacteriophage lysin with broad lytic activity protects against mixed infection by Streptococcus pyogenes and methicillin-resistant Staphylococcus aureus[J]. Antimicrobial Agents and Chemotherapy, 2013, 57(6): 2743-2750 |
| [21] | Morens DM, Taubenberger JK, Fauci AS. The persistent legacy of the 1918 influenza virus[J]. The New England Journal of Medicine, 2009, 361(3): 225-229 |
| [22] | Brundage JF, Shanks GD. What really happened during the 1918 influenza pandemic? The importance of bacterial secondary infections[J]. The Journal of Infectious Diseases, 2007, 196(11): 2 |
| [23] | Brundage JF, Shanks GD. Deaths from bacterial pneumonia during 1918-19 influenza pandemic[J]. Emerging Infectious Diseases, 2008, 14(8): 1193-1199 |
| [24] | Hussell T, Wissinger E, Goulding J. Bacterial complications during pandemic influenza infection[J]. Future Microbiology, 2009, 4(3): 269-272 |
| [25] | Hudson IR. The efficacy of intranasal mupirocin in the prevention of Staphylococcal infections: a review of recent experience[J]. The Journal of Hospital Infection, 1994, 27(2): 81-98 |
| [26] | Cheng Q, Nelson D, Zhu S, et al. Removal of group B Streptococci colonizing the vagina and oropharynx of mice with a bacteriophage lytic enzyme[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(1): 111-117 |
| [27] | Rashel M, Uchiyama J, Ujihara T, et al. Efficient elimination of multidrug-resistant Staphylococcus aureus by cloned lysin derived from bacteriophage phi MR11[J]. The Journal of Infectious Diseases, 2007, 196(8): 1237-1247 |
| [28] | Schuch R, Nelson D, Fischetti VA. A bacteriolytic agent that detects and kills Bacillus anthracis[J]. Nature, 2002, 418(6900): 884-889 |
| [29] | McCullers JA, Karlstrom A, Iverson AR, et al. Novel strategy to prevent otitis media caused by colonizing Streptococcus pneumoniae[J]. PLoS Pathogens, 2007, 3(3): e28 |
 2015, Vol. 42
2015, Vol. 42