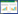扩展功能
文章信息
- 杜茂林, 付瑞敏, 谷亚楠, 薛婷婷, 吕睿, 陈五岭
- DU Mao-Lin, FU Rui-Min, GU Ya-Nan, XUE Ting-Ting, Lü Rui, CHEN Wu-Ling
- 油田采出水石油烃降解菌分离、鉴定及高通量选育复合诱变菌株
- Isolation, identification and breeding of petroleum-degrading bacteria in oilfield produced water by UV-plasma complex mutagenesis
- 微生物学通报, 2015, 42(6): 1001-1009
- Microbiology China, 2015, 42(6): 1001-1009
- 10.13344/j.microbiol.china.150023
-
文章历史
- 收稿日期: 2015-01-09
- 接受日期: 2015-03-16
- 优先数字出版日期(www.cnki.net): 2015-03-09
2. 河南教育学院 人口与生命科学系 河南 郑州 450046
3. 陕西省微生物研究所 陕西 西安 710069
2. Population and Life Department, Henan Institute of Education, Zhengzhou, Henan 450046, China
3. Microbiology Institute of Shaanxi, Xi’an, Shaanxi 710069, China
由于石油开采、运输和使用过程中的污染、遗漏以及含油污水、钻井废弃液的肆意排放,石油烃类物质(Total petroleum hydrocarbons,TPHs)引起的污染已对人体健康和生态环境造成了巨大危害,并已成为一项世界性环境污染难题[1]。石油污染环境的修复研究越来越受到人们的重视,目前针对TPHs污染环境的修复主要包括物理方法(如吸附法、超声波分离法、气浮法)、化学方法(如氧化法和破乳法等)以及生物修复法。其中微生物修复技术由于具有处理费用低、操作简单、无二次污染等优点而被公认为具有广阔的应用前景[2]。如何获得高效、广谱、稳定、适应性强的TPHs降解菌是微生物技术修复石油污染环境的关键。据报道,自然界中已知的能够降解石油污染物的微生物菌群达二百多种,TPHs降解率最高达47%[3, 4, 5, 6]。野生型菌株对TPHs降解普遍存在作用周期较长、降解效率低等问题,故采用高新技术选育出具有高代谢能力的TPHs降解菌具有重要的现实意义。
目前针对TPHs高效降解菌株的选育主要采用传统的物理诱变(X射线、He-Ne激光、紫外线)、化学诱变(LiCl、亚硝基胍、碱基类似物)或者两者相结合的方式,这些诱变方法通常存在毒性强、效率低、工作量大等不足。等离子体诱变是近年来新兴的一种高效率诱变技术,具有操作简便、条件温和、安全性高、诱变快速、突变率高等特点,可以大大提高菌种突变的强度和突变库容量[7, 8, 9]。将等离子体与紫外线复合使用,既可克服紫外线单独诱变时负突变率高、子代生长缓慢的缺点,又可避免单一诱变所产生的诱变饱和效应,再结合多功能酶标仪高通量筛选技术,能够有效弥补常规诱变育种的不足[10, 11]。
为获得遗传性状稳定的TPHs高效降解菌株,本研究从国内主要油田采出水中分离野生型TPHs优势降解菌,并对其进行紫外线与等离子体复合诱变,然后通过96孔板发酵法替代摇瓶培养法,结合酶标仪紫外双波长光谱法快速测定TPHs含量,建立一种高通量筛选TPHs降解菌株的新方法。本研究结果将为今后石油烃污染环境修复菌种的大规模选育及进一步应用提供参考。
1 材料与方法 1.1 样品及试剂采出水样品取自国内各主要油田(大庆油田、长庆油田、新疆油田、辽河油田、中原油田)的不同采出水处理站,样品取回后4 °C保存;原油样品由长庆油田采油三厂提供。
配置微生物分离纯化常用培养基所需试剂及提取、检测用试剂皆为国产分析纯。
1.2 培养基无机盐培养基(g/L):CuCl2 0.000 5,FeSO4 0.005,ZnCl2 0.005,MnCl2·4H2O 0.05,CaCl2 0.02,K2HPO4 4.0,KH2PO4 0.5,MgSO4·7H2O 1.0,NaCl 1.0,无菌水1 L,用4 mol/L NaOH调节pH至7.5。
石油烃降解培养基:在无机盐培养基中加入灭菌(1×105 Pa,20 min)的原油至终浓度为100 mg/L。固体培养基加入1.5%琼脂。
LB培养基(g/L):胰蛋白胨10,氯化钠10,酵母提取物5,加水至1 L,NaOH调整pH为7.4−7.6,高压蒸汽灭菌(1×105 Pa,20 min)后使用。固体培养基需加入1.5%琼脂。
1.3 检测方法 1.3.1 菌数检测及致死率计算:菌数检测采用活菌平板菌落计数法以及血球计数板计数法:致死率(%)=(诱变前总菌数−诱变后总菌数)×100/诱变前总菌数。 1.3.2 TPHs含量测定:(1) 酶标仪双波长紫外光谱法。孔板发酵中TPHs含量的测定利用BioTek公司Synergy 2型多功能酶标仪简化的双波长紫外光谱法完成,TPHs中带有C=C共轭双键的有机化合物在紫外区215−230 nm处有特征吸收,而含有简单非共轭双键和具有n电子的生色基团有机化合物在250−300 nm范围内有较强吸收带,吸收强度与特殊键化合物含量成正比例。TPHs紫外光谱的特征峰值一般位于225 nm及254 nm处。以石油醚为萃取剂(石油醚:发酵液=1:2,体积比),根据225 nm和254 nm双波长下吸光度差值确定TPHs含量[12]。(2) 红外光谱法。TPHs含量的红外光谱法测定参照HJ/T 637-2012[13]。利用四氯化碳萃取样品中的TPHs (四氯化碳:发酵液=2:3,体积比),并使其通过含硅胶填料(40 μm,60 A pores) 0.5 g的固相提取小柱,四氯化碳冲洗。将经硅胶吸附后的萃取液转移至4 cm比色皿中,以四氯化碳作为参比溶液,于2 930、2 960、3 030 cm−1处测量其吸光度A2 930、A2 960、A3 030,与标准样品对比计算TPHs的浓度。
1.4 菌株分离取油田采出水样品各1 mL分别加入到装有49 mL LB培养基的摇瓶中,35 °C、180 r/min富集培养48 h,检测菌体数量的变化。当菌体浓度达到107 CFU/mL左右时,将0.1 mL菌悬液稀释涂布于石油烃降解平板培养基初筛,35 °C恒温培养48 h,选择在石油烃平板培养基上透明圈明显、生长茁壮的单菌落接入装有50 mL石油烃降解液体培养基摇瓶中复筛(每株菌接3摇瓶),35 °C、180 r/min培养72 h,红外光谱法检测发酵液中TPHs含量,计算TPHs降解率,将降解率最高的菌株分离保存备用。
1.5 菌株鉴定菌株的形态学鉴定参照《常见细菌系统鉴定手册》[14],培养24 h后观察菌落形态。生理生化鉴定利用BioMerieux公司全自动微生物分析仪(Vitek 2 Compact)及其配套的革兰氏阴性菌鉴定卡GN分析完成。分子生物学鉴定利用通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-TACGGCTACCTTACGACTT-3′对菌株PW04的16S rRNA基因序列进行PCR扩增,100 μL PCR反应体系分装两管:10×缓冲液10 μL,MgCl2(25 mmol/L) 6 μL,dNTPs (10 mmol/L) 2.5 μL,DNA模板(20−50 ng/L) 2 μL,引物(10 μmol/L)各1.5 μL,双蒸水70 μL。PCR反应条件:95 °C 3 min;95 °C 50 s,52 °C 50 s,72 °C 2 min,30个循环;72 °C 10 min。引物合成以及PCR产物的纯化和测序由上海生工生物工程技术服务有限公司完成。利用Blast将菌株的16S rRNA基因序列与GenBank数据库中已知的序列进行比较,并采用MEGA 5.05软件构建系统发育树[15]。
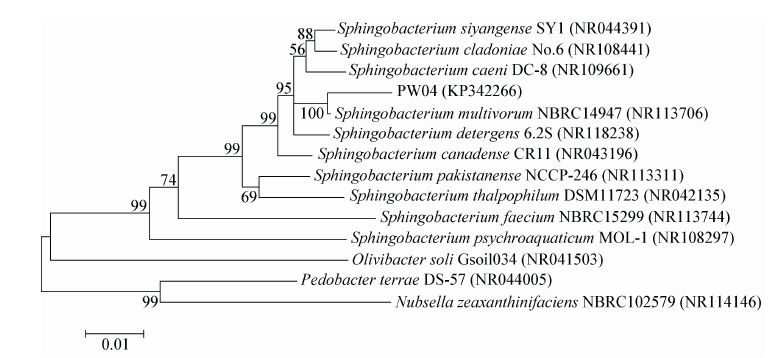
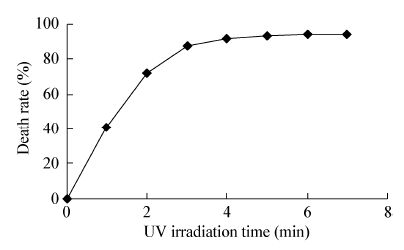
1.6 紫外线-等离子体复合诱变 1.6.1 菌悬液制备:将菌株PW04接种于LB液体培养基中,35 °C培养至对数生长期,1 000×g离心15 min收集菌体,用无菌生理盐水洗涤2次后制成菌悬液。血球计数板计数并调节菌体浓度为1.0×107/mL左右备用。 1.6.2 紫外线诱变:取对数生长期菌悬液5 mL,转入直径9 cm的培养皿中,磁力搅拌。紫外灯(功率15 W,照射距35 cm)分别照射1、2、3、4、5、6、7 min。取诱变后菌悬液0.1 mL稀释涂平板,以不经诱变的菌悬液为对照,培养48 h计算致死率。 1.6.3 紫外线-等离子体复合诱变:取对数生长期菌悬液5 mL于紫外灯下照射2 min,红光下,取0.2 mL均匀涂布于无菌平皿中,无菌风吹干形成菌膜,镜检无细胞重叠,以氦气为工作气体,气流量设定为10 L/min,作用距离3.0 mm,作用功率120 W的等离子体射线辐照处理[16, 17],处理时间分别设定为10、20、30、40、50、60、70 s。将经过不同辐照时间处理的菌株以2 mL无菌生理盐水洗脱制成菌悬液。以未经诱变的菌株为对照,稀释涂平板,培养48 h,计算致死率。 1.7 孔板培养取经复合诱变的菌悬液0.1 mL,涂布于LB平板上,根据生长菌落的圆整和丰满度挑取一定数量的菌株转接到96孔种子孔板,种子孔板装有100 μL的LB液体培养基。对照孔接入未经诱变菌株,于35 °C、180 r/min的恒温摇床培养48 h后转入发酵孔板培养。发酵孔板装有700 μL石油降解培养基,接种量为10%,于 35 °C、180 r/min振荡培养72 h[18]。
1.8 高通量检测将发酵孔板置于孔板离心机中1 000×g离心30 min;取上清液200 μL加入空白孔板中,另加入100 μL石油醚,35 °C恒温摇床中180 r/min振荡10 min后,每孔移取200 μL加入酶标板中,利用多功能酶标仪检测225 nm和254 nm下的吸光值差,计算发酵孔板中TPHs含量。
1.9 摇瓶培养及遗传稳定性测定由高通量筛选得到TPHs高效降解菌,为了保证其遗传稳定性,将其连续传代5次,每次传代后经种子摇瓶和发酵摇瓶培养,并测定发酵液中TPHs含量。种子摇瓶装液量50 mL,于35 °C、180 r/min的恒温摇床中培养48 h;发酵摇瓶装液量100 mL,接种量10%,35 °C、180 r/min 培养72 h。红外光谱法测定TPHs含量。
2 结果与分析 2.1 菌株分离从石油降解平板上挑取透明圈大、生长茁壮的单菌落,将其分别接入石油降解摇瓶中,计算其TPHs降解率结果如表1所示。所分离的菌株对TPHs降解率平均为46.6%,降解率最高可达57.5%,选取TPHs降解率最高的菌株PW04保存备用。
| 菌株编号 Strain number | 菌株来源 Isolate source | 石油烃含量 TPHs content (mg/L) | 石油烃降解率 TPHs-degrading rate (%) |
| PW01 | 长庆油田 | 49.1±1.6 | 50.1 |
| PW02 | 长庆油田 | 60.2±1.1 | 39.8 |
| PW03 | 辽河油田 | 54.7±1.8 | 45.3 |
| PW04 | 新疆油田 | 42.5±0.7 | 57.5 |
| PW05 | 中原油田 | 49.8±1.5 | 50.2 |
| PW06 | 大庆油田 | 56.4±0.7 | 43.6 |
| PW07 | 新疆油田 | 59.1±0.6 | 40.6 |
菌株PW04在LB培养基中生长时菌落呈乳白色,圆形,凸起,边缘整齐,大小约为(0.8−1.0) μm× (2.0−3.0) μm,革兰氏染色阴性,菌体呈梭棒形。利用全自动微生物分析仪检测菌株PW04生化实验详情如表2所示,菌株PW04与多食鞘氨醇杆菌(Sphingobacterium multivorum)典型生化谱相似度达95%。以16S rRNA基因序列一致性为基础构建相关种属细菌在内的系统发育树,结果如图1所示,菌株PW04与Sphingobacterium multivorum NBRC14947相似性高达100%。综上所述,由油田采出水中筛选的石油烃优势降解菌PW04可以确定为多食鞘氨醇杆菌(Sphingobacterium multivorum)。
| 反应型 Reaction type | 结果 Results | 反应型 Reaction type | 结果 Results | 反应型 Reaction type | 结果 Results |
| APPA | + | PyrA | + | dCEL | + |
| H2S | − | AGLTp | + | GGT | − |
| BGLU | + | dMAN | − | BXYL | + |
| ProA | − | PLE | + | URE | − |
| SAC | + | dTRE | + | MNT | − |
| ILATk | − | SUCT | − | AGAL | + |
| GlyA | − | LDC | − | CMT | − |
| O129R | + | IMLTa | − | ILATa | − |
| ADO | − | IARL | − | BGAL | + |
| BNAG | + | dGLU | + | OFF | − |
| dMAL | + | dMNE | + | BAlap | − |
| LIP | − | TyrA | + | dSOR | − |
| dTAG | − | CIT | − | 5KG | − |
| AGLU | + | NAGA | + | PHOS | + |
| ODC | − | IHISa | − | BGUR | + |
| GGAA | + | ELLM | − |
|
| 图1 基于16S rRNA基因序列同源性的菌株PW04系统发育树状图 Figure.1 Phylogenetic tree showing the relationship of strains PW04 on 16S rRNA gene sequence 注:括号中的序号代表菌株的GenBank登录号;分支点上的数字代表计算1 000次聚类到一起的几率;标尺刻度代表1%的序列差异.Note: The sequence number in the bracket means the GenBank accession number of the strain. The number at the node means the percentage of occurrence in 1 000 boot-straped trees. The scale bar means 1% sequence difference. |
|
| 图2 紫外线诱变菌体致死率曲线 Figure.2 UV irradiated celled rate curve |
|
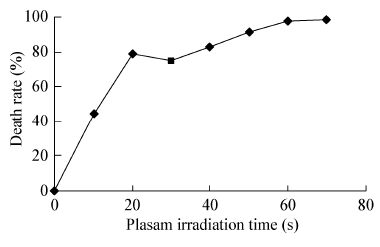
| 图3 等离子体诱变菌体致死率曲线 Figure.3 Plasam irradiated celled rate curve |
|
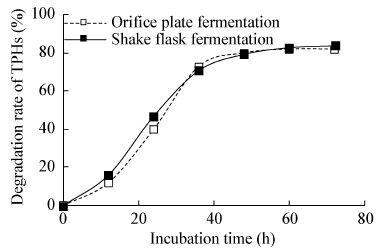
| 图4 孔板发酵与摇瓶发酵TPHs降解率曲线 Figure.4 Degradation rate of TPHs by shake flask and orifice plate fermentation |
发酵初期,摇瓶发酵培养菌株的TPHs降解率较高,但在培养约36 h后,孔板发酵的TPHs降解率超过摇瓶发酵并持续到约48 h后,孔板发酵菌株TPHs降解率不再增加为止。造成这一现象的原因可能是S. multivorum PW04降解TPHs为需氧过程[19],初期摇瓶含氧量相对较高,培养36 h后孔板的溶氧状况较摇瓶好。同时TPHs检测方法的不同也是出现这一现象的重要原因。孔板发酵与摇瓶发酵整体上有较好的相关性,可利用其替代摇瓶发酵验证菌株TPHs降解效率。
2.4.2 TPHs高效降解菌株筛选:复合诱变所得突变株对TPHs降解率结果如表3所示(同一菌株接3个发酵孔,TPHs含量取平均值,发酵孔编号为相邻3个平行实验中TPHs降解率最高孔编号)。从2个96孔板中共筛选出TPHs降解率在80%以上的突变型菌株4株,其中菌株S. multivorum PW04-H10的TPHs降解率最高,达85.1%,与野生型菌株S. multivorum PW04相比,降解率提高了48%。| 孔板编号 Orifice plate number | 发酵孔编号 Fermentation hole number | 石油烃含量 TPHs content (mg/L) | 石油烃降解率 TPHs-degrading rate (%) |
| 1 | B5 | 24.2±0.4 | 75.8 |
| D7 | 26.6±0.3 | 73.4 | |
| F1 | 20.2±1.0 | 79.8 | |
| H10 | 14.9±0.3 | 85.1 | |
| A6 (CK) | 42.9±0.7 | 57.1 | |
| 2 | A6 | 17.3±0.7 | 82.7 |
| C11 | 20.7±0.7 | 79.3 | |
| E8 | 22.5±0.5 | 77.5 | |
| F3 | 15.4±0.5 | 84.6 | |
| G9 | 17.1±0.4 | 82.9 | |
| H6 (CK) | 42.3±0.9 | 57.7 |
选取TPHs降解率在80%以上的4株突变型菌株:S. multivorum PW04-H10、S. multivorum PW04-F3、S. multivorum PW04-G9和S. multivorum PW04-A6进行传代培养,并通过摇瓶发酵确定每一代菌株的TPHs降解率,结果如表4所示。
| 菌株编号 Strain number | 石油烃降解率 TPHs-degrading rate (%) | ||||
| I | II | III | IV | V | |
| PW04-H10 | 84.9±0.3 | 84.1±0.9 | 84.3±0.4 | 84.6±0.4 | 84.6±0.4 |
| PW04-F3 | 82.7±0.9 | 82.0±0.3 | 81.3±0.9 | 79.8±0.6 | 79.4±1.1 |
| PW04-G9 | 82.5±0.5 | 82.8±0.4 | 82.4±0.3 | 83.1±0.6 | 83.3±0.5 |
| PW04-A6 | 82.6±0.3 | 82.7±0.4 | 82.5±0.6 | 81.7±0.5 | 82.3±0.6 |
| CK | 57.2±0.4 | 58.1±0.7 | 57.6±0.6 | 57.7±1.0 | 57.4±0.7 |
经单因素方差分析,突变株S. multivorum PW04-H10、S. multivorum PW04-G9和S. multivorum PW04-A6不同世代对TPHs降解率的差异不显著,说明这3株菌的TPHs降解遗传稳定性较好。而菌株S. multivorum PW04-F3的TPHs降解率在不同世代差异极显著且呈逐渐下降的趋势,说明该突变株遗传稳定性差,菌株退化严重。综上,选取菌株S. multivorum PW04-H10、S. multivorum PW04-G9和S. multivorum PW04-A6进行后续研究。
3 讨论紫外线诱变是微生物育种中最为常用的方法,但是单纯的紫外线诱变效果并不理想,段盛文等[20]
利用紫外诱变选育的TPHs降解菌降解率仅为42.85%。因此,有学者采用紫外线-激光复合诱变、紫外线-微波复合诱变等方法对野生型TPHs降解菌进行诱变,以提高其TPHs降解率,通过上述诱变方式获得的突变株其TPHs降解率最高可达75%[21, 22, 23, 24, 25]。等离子体作为一种新型诱变手段,通过适当剂量的中性活性粒子作用于微生物致其细胞结构和DNA损伤修复能力发生改变最终引起突变[26]。本研究首次对筛选的野生型TPHs降解菌进行紫外线与等离子复合诱变处理,所选育出的突变株TPHs降解率最高可达85.1%,较野生型菌株提高了48%,较其他方式获得的突变株提高约13.5%,实验结果显示所得突变株遗传性能稳定,展现了良好的诱变效果,推测其原因是由于紫外线诱变作用于DNA,使其产生嘧啶二聚体,但微生物本身具有自我修复机制,而等离子体诱变通过其活性粒子作用于微生物细胞,改变其DNA损伤修复机制,突破了紫外单独诱变的局限,故可以筛选出TPHs降解率较高的优秀突变株。
复合诱变过程中产生大量的突变体,常规手段(如摇瓶发酵和红外光谱检测)选育TPHs高效降解突变株操作复杂、成本高,难以实现高通量筛选。以96孔板替代摇瓶发酵,采用酶标仪紫外双波长光谱法快速测定突变株的TPHs含量,该技术微型、高效、低成本,96孔板一次即可培养检测96个样品,实现了突变株的快速筛选。
本文主要集中于TPHs高效降解菌株的诱变及选育工作,还缺乏对紫外与等离子体复合诱变的机理以及TPHs降解机理等方面的研究。此外,遗传稳定性分析只进行到了第五代,这些都需要在今后的实际生产应用过程中做进一步探讨和研究。
4 结论将紫外线和等离子体两种诱变技术复合使用,通过96孔板发酵处理,结合多功能酶标仪建立的高通量筛选方法,最终选育出3株TPHs高效降解菌株S. multivorum PW04-H10、S. multivorum PW04-G9和S. multivorum PW04-A6,TPHs降解率分别达到了85.1%、82.7%和82.9%。降解率最高的突变型菌株S. multivorum PW04-H10与野生型菌株相比,提高了48%。经单因素方差分析,这3株突变菌对TPHs降解遗传性状稳定,基本实现了选育的目的,可直接应用于石油烃污染环境的修复中。
| [1] | Cao YZ, Shi LY, Li LH. Petroleum hydrocarbons contaminatedsites and related risk based management strategy[J]. AsianJournal of Ecotoxicology, 2007, 2(3): 265-272 (in Chinese)曹云者, 施烈焰, 李丽和, 等. 石油烃污染场地环境风险评价与风险管理[J]. 生态毒理学报, 2007, 2(3): 265-272 |
| [2] | Song H. Microbial bioremediation technology of petroleumhydrocarbon pollutants[J]. Enviroment Science andManagement, 2013, 38(2): 83-88 (in Chinese)宋华. 石油烃类污染物的微生物修复技术[J]. 环境科学与管理, 2013, 38(2): 83-88 |
| [3] | Akio U, Yukiya I. Isolation and characterization of bacteria fromoil contaminated with diesel oil and the possible use of these inautochthonous bioaugmentation[J]. World Journal ofMicrobiology & Biotechnology, 2007, 23(12): 1739-1745 |
| [4] | Su GC, Zhou CY, Cai HN, et al. Effectiveness of the cleaningperformance of the bacterial strain Acinetobacter sp. SG06-02 inthe petroleum hydrocarbon-polluted intestine of clams[J]. WorldJournal of Microbiology & Biotechnology, 2008, 3(24): 383-386 |
| [5] | Huang XD, El-Alawi Y, Gurska J, et al. A multi-processphytoremediation system for decontamination of persistent totalpetroleum hydrocarbons (TPHs) from soils[J]. MicrochemicalJournal, 2005, 81(1): 139-147 |
| [6] | Yanto DHY, Tachibana S. Biodegradation of petroleumhydrocarbons by a newly isolated Pestalotiopsis sp. NG007[J].International Biodeterioration & Biodegradation, 2013, 85(11):438-450 |
| [7] | Zhang XR, Huang JX, Luo S. The mutagentc effect on a strainproducing PHB by cooperation of UV and He-Ne Laser[J]. ActaPhotonica Sinica, 2005, 34(5): 682-685 (in Chinese)张晓瑞, 黄建新, 罗莎. He-Ne 激光和紫外线对PHB产生菌的复合诱变效应[J]. 光子学报, 2005, 34(5): 682-685 |
| [8] | Zhang X, Zhang XF, Wang LY, et al. Recent progress onatmospheric and room temperature plasma mutation breedingtechnology and its applications[J]. CIESC Journal, 2014, 65(7):2676-2684 (in Chinese)张雪, 张晓菲, 王立言, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7): 2676-2684 |
| [9] | Pang DQ, Zhou PP, Lu MB, et al. Breeding of high glutathioneproducing atrain by plasma-UV complex mutagenesis[J]. LifeScience Research, 2014, 11(3): 238-241 (in Chinese)庞德钦, 周蓬蓬, 鲁明波, 等. 等离子体-紫外线复合诱变选育高产谷胱甘肽酵母菌[J]. 生命科学研究, 2014, 11(3):238-241 |
| [10] | Ji YZ, Tan TW, Du LX. Study on mutation breeding of the lipaseproducing strain Rhizopus arrhizus with low energy N+ ionbeam implantation[J]. Journal of Biotechnology, 2008,136(Suppl): S337 |
| [11] | Feng F, Zhao W, Sun SS. Studies on high throughput screeningfor calcium gluconate high producing strains[J]. Food andFermentation Industries, 2012, 38(2): 74-77 (in Chinese)冯芳, 赵伟, 孙姗姗. 高通量筛选葡萄糖酸钙高产菌株[J].食品与发酵工业, 2012, 38(2): 74-77 |
| [12] | Fu SH, Liu YA. Detecting oil content in power plant oilywastewater using double wavelength ultravioletspectrophotometric method[J]. Industrial Water & Wastewater,2012, 43(6): 88-90 (in Chinese)傅仕海, 刘玉安. 双波长紫外法测定电厂废水含油量[J]. 工业用水与废水, 2012, 43(6): 88-90 |
| [13] | HJ/T 637-2012. Water uality-determination of petroleum oilsand animal and vegetable oils-infrared spectrophotometry[S].Beijing: China Environmental Science Press, 2012 (in Chinese)HJ/T 637-2012. 水质石油类和动植物油类的测定红外分光光度法[S]. 北京: 中国环境科学出版社, 2012 |
| [14] | Dong XZ, Cai MY. Common Acterial System IdentificationManual[M]. Beijing: Science Press, 2001: 353-419 (in Chinese)东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 353-419 |
| [15] | Altschul SF, Madden TL, Schaffer AA, et al. Gapped blast andpsi blast: a new generation of protein dadebase searchprograms[J]. Nucleic Acids Research, 1997, 25(17): 3389-3402 |
| [16] | Zhang LP, Cheng HC, Tian LS, et al. Breeding of high yieldphytase bacterium by UV-plasma complex mutagenesis[J].China Feed, 2006(9): 13-15 (in Chinese)张丽萍, 程辉彩, 田连生, 等. 植酸酶高产菌株的紫外线-空气等离子体复合诱变选育[J]. 中国饲料, 2006(9): 13-15 |
| [17] | Dong XY, Teng H, Xiu ZL. Selection of strain exposed underplasma discharge with enhanced 1,3-propanediol production andkinetic analysis of batch fermentation[J]. The Chinese Journal ofProcess Engineering, 2011, 11(2): 304-311 (in Chinese)董晓宇, 滕虎, 修志龙. 高产1,3-丙二醇的等离子体诱变菌株选育及发酵动力学分析[J]. 过程工程学报, 2011, 11(2):304-311 |
| [18] | Zhang H, Guo CL, Lu GN, et al. Screening and fermentationoptimization of a biosurfactant-producing oil-degradingbacteriums[J]. Journal of Agro-Environment Science, 2013,32(11): 2185-2192 (in Chinese)章慧, 郭楚玲, 卢桂宁, 等. 具有产表面活性剂功能石油降解菌的筛选及其发酵条件优化[J]. 农业环境科学学报, 2013,32(11): 2185-2192 |
| [19] | Tang JC, Wang RG, Niu XW, et al. Enhancement of soilpetroleum remediation by using a combination of ryegrass(Lolium perenne) and different microorganisms[J]. Soil andTillage Research, 2010, 110(1): 87-93 |
| [20] | Duan SW, Liu ZC, Zheng K. Petroleum degradation capacity ofSphingobacterium bambusaue and its UV-mutants[J].Microbiology China, 2013, 40(12): 2336-2341 (in Chinese)段盛文, 刘正初, 郑科, 等.Sphingobacterium bambusaue及其紫外诱变菌株的石油降解功能[J]. 微生物学通报, 2013,40(12): 2336-2341 |
| [21] | Zhang YB, Liu HT, Zhao YK. UV-mutagenesis improvement onan efficient petroleum degradation strain[J]. Chemistry &Bioengineering, 2013, 30(7): 71-73张云波, 刘海涛, 赵雅坤. 一株高效石油降解菌的紫外微波复合诱变改良[J]. 化学与生物工程. 2013, 30(7): 71-73 (inChinese) |
| [22] | Dellagnezze BM, Sousa GV, Martins LL, et al. Bioremediationpotential of microorganisms derived from petroleumreservoirs[J]. Marine Pollution Bulletin, 2014, 89(12): 191-200 |
| [23] | Mancera-López ME, Esparza-García F, Chávez-Gómez B, et al.Bioremediation of an aged hydrocarbon contaminated soil by acombined system of biostimulation bioaugmentation withfilamentous fungi[J]. International Biodeterioration &Biodegradation, 2008, 61(2): 151-160 |
| [24] | Sathishkumar M, Binupfiya AR, Ho BS, et al. Biodegradation ofcrude oil by individual bacterial strains and a mixed bacterialconsoainm isolated from hydrocarbon contaminated areas[J].Clean, 2008, 369(1): 92-96 |
| [25] | Li MY. Breeding of oil-degrading bacterium and study onpetroleum hydrocarbons degradation[D]. Xiʼan: Masterʼs Thesisof Northwest University, 2011 (in Chinese)李茂毅. 石油烃降解菌株的选育以及对石油中烃类物质降解的研究[D]. 西安: 西北大学硕士学位论文, 2011 |
| [26] | Liu RM, Liang LY, Ma JF, et al. An engineering Escherichia colimutant with high succinic acid production in the definedmedium obtained by the atmospheric and room temperatureplasma[J]. Process Biochemistry, 2013, 48(11): 1603-1609 |
 2015, Vol. 42
2015, Vol. 42