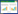扩展功能
文章信息
- 周璇, 李军英, 伍刚, 周丹, 谢波
- ZHOU Xuan, LI Jun-Ying, WU Gang, ZHOU Dan, XIE Bo
- 维生素B12在细菌与真核藻类相互作用中的功能研究进展
- The roles of vitamin B12 in the interaction between bacteria and eukaryotic algae
- 微生物学通报, 2015, 42(5): 913-919
- Microbiology China, 2015, 42(5): 913-919
- 10.13344/j.microbiol.china.141018
-
文章历史
- 收稿日期: 2014-12-17
- 接受日期: 2015-01-22
- 优先数字出版日期(www.cnki.net): 2015-03-03
2. 贵州师范学院 化学与生命科学学院 贵州 贵阳 550018
2. School of Chemistry and Life Sciences, Guizhou Normal College, Guiyang, Guizhou 550018, China
细菌和藻类都属于自然界中数量极其庞大的物种,广泛存在于土壤、水体等环境中,对生物圈中物质循环和能量流动起着重要作用,两者共存于同一环境时也将发生直接或间接的相互作用。1972年,美国科学家Bell和Mitchell引入“藻际环境(Phycosphere)”这一概念,意在描述藻类生物分泌胞外产物促进周边细菌生长的一种微环境区域[1]。在藻际环境中,藻与细菌都可以产生各自的胞外产物,如氨基酸、多肽、糖类、维生素和毒性因子等,对共存的对方既可能有促进,也可能有抑制的作 用[2]。这些相互作用对藻与细菌的生理功能、群落组成、抵抗逆境、生态功能的发挥、藻华的产生和消退、重要代谢物的生成等方面具有重要影响。研究细菌与藻类的相互作用不仅有助于深入认识两者在自然界中发挥生态功能的方式和机理,也将有利于改造和利用这些生物,如环境治理和生物质能源等产业。近年来一些综述文章已经介绍了淡水水华、海洋赤潮、水产养殖和污染治理等过程中菌-藻相互作用的形式和特点[3, 4, 5, 6, 7, 8]。
藻类生物包含了原核和真核两大类,因此 菌-藻之间的相互作用涉及到种类繁多的生物。同其他物种之间的相互作用类似,菌-藻相互作用也具有宿主专一性、代谢物的交换与信号传导等特点[9, 10, 11]。研究表明来源于细菌的维生素对许多真核藻类的生理功能起到重要作用,而维生素B12 (VB12)由于其独特的性质、来源和功能在细菌-真核藻类相互作用研究中受到了越来越多的关注[12, 13, 14, 15, 16]。本文将主要介绍近年来细菌-真核藻类相互作用中维生素B12的功能研究,并讨论该领域近期的发展方向。
1 VB12的特性VB12是一种水溶性含钴的咕啉类化合物,又称钴胺素(Cobalamin),最初被应用于恶性贫血的控制,在20世纪四五十年代被首次从肝脏中分离得到并鉴定出结构,于1972年实现人工合成[17]。VB12是结构最复杂的维生素,由中心咕啉环、中心环轴向上配基部分(R)和含有核苷酸环的向下配基组成(图 1)[18]。由于R配基的不同,VB12具有多种存在形式,在生物体中具有重要辅酶功能的VB12主要为腺苷钴胺素(Adenosylcobalamin)和甲基钴胺素(Methylcobalamin)[19]。

|
|
图 1
VB12的结构与甲硫氨酸的生物合成途径
Figure 1
Structure of Vitamin B12 and the biosynthetic pathway of methionine
注:A:VB12的结构,R可为甲基、腺苷或氰等不同基团;B:甲硫氨酸合成途径,甲硫氨酸可由VB12-非依赖型甲硫氨酸合成酶METE或VB12-依赖型甲硫氨酸合成酶METH催化完成,下游生成产物主要为蛋白质和甲基化反应供体S-腺苷甲硫氨酸(S-AdoMet).
Note: A: The structure of Vitamin B12, the upper ligand R can be CH3 (Methylcobalamin), 5¢-deoxyadenosine (Adenosylcobalamin), or CN (Cyanocobalamin). B: The biosynthetic pathway of methionine, methionine formation is catalyzed by VB12-independent METE or VB12-dependent METH, and methionine is mainly used to synthesize proteins and S-AdoMet. |
目前已知的VB12依赖型酶有二十多种[17, 19],主要包括:以腺苷钴胺素为辅酶的异构酶,如甲基丙二酰辅酶A变位酶MCM (methylmalonyl-CoA mutase)、谷氨酸变位酶(Glutamate mutase)、核糖核苷酸还原酶(Ribonucleotide reductase)等;甲基钴胺素依赖型的甲基转移酶,如甲硫氨酸合成酶METH (Methionine synthase H)。这些VB12依赖型酶在不同物种中分布并不均匀:在细菌中可以发现几乎所有VB12依赖型酶;高等动物中只含有2种,即甲基丙二酰辅酶A变位酶MCM和甲硫氨酸合成酶METH;而高等植物却不含有任何已知的VB12依赖型酶[20]。
VB12是在自然界中唯一一种只能由细菌(包括真细菌和古细菌)合成的维生素,该合成过程需要20种以上的酶参与,在不同的细菌中会有所不同,如Pseudomonas denitrificans可在有氧条件下合成VB12,而Salmonella typhimurium只能在厌氧条件下合成VB12[21]。某些细菌只具有部分合成途径,如大肠杆菌只能在添加了前体物钴啉醇酰胺(Cobinamide)的情况下才能够合成VB12[22, 23]。由于产VB12细菌是自然界VB12的唯一来源,这些细菌对其他需要VB12的生物将具有重要影响[24]。
2 细菌-真核藻类互作中的VB12 2.1 真核藻类对VB12的依赖性目前报道真核藻类生物中以VB12作为辅酶的酶有3种:VB12依赖型甲硫氨酸合成酶METH、核糖核苷酸还原酶RNRII和甲基丙二酰辅酶A变位酶MCM[25]。这些VB12依赖型酶的存在使得产VB12细菌在真核藻类的生长繁殖过程中起到重要作用,也奠定了两者相互作用的生化基础。
在甲硫氨酸合成途径中,一些真核藻类还存在一种VB12非依赖型甲硫氨酸合成酶METE,在无VB12条件下也可催化生成甲硫氨酸和四氢叶酸(图 1B)[25, 26]。METE和METH两者并无明显的同源性且具有不同的催化机制[26]:METE直接催化甲基由CH3-H4PteGlun转移到homocysteine的反应,底物CH3-H4PteGlun上的Glu基团数至少为3;而METH催化的反应中需要结合VB12作为甲基转移过程中的中间体,底物CH3-H4PteGlun上的Glu基团数可以为1,在完成反应后,METH-VB12需要额外的还原体系和AdoMet使酶重新活化。
基因组学的研究结果表明,甲硫氨酸合成酶METE和METH在真核藻类的分布与VB12的依赖性有着直接的联系[25]:对15种真核藻类基因组序列的分析揭示出约一半藻类基因组中只含有METH基因,这些藻类的生长严格必需VB12;莱茵衣藻(Chlamydomonas reinhardtii)等一些藻类同时含有METH和METE,在无VB12的条件下也可由METE合成甲硫氨酸,在生长中并不需要VB12;只有两种藻类(Coccomyxa sp.和Cyanidioschyzon merolae)只含有METE而不含有METH,在生长中也不需要VB12。由此可以看出,如果藻类基因组只含有METH,则这种藻类(Emiliania huxleyi除外)的生长必需VB12;而如果这种藻类含有METE,其生长则不需要VB12。值得思考的是,METH在真核藻类基因组中的存在频率明显要高于METE,暗示着VB12依赖型的甲硫氨酸合成方式在这些生物的进化过程中具有很高的保守性,在生理生化功能上可能扮演着更重要的角色[25]。
2.2 产VB12细菌与真核藻类的共生形式以上研究表明,约一半真核藻类在生长中严格需要外源VB12[12, 20],而海洋有害藻华中大部分藻类也都是VB12缺陷型[16]。近年来,藻类如何获得足够的VB12已经成为藻类生物学研究中的一个重要问题。
由于地理位置和测量技术的不同,自然环境中可溶性VB12的含量在不同文献中的差异较大。例如,在地中海和东北太平洋等海洋环境中可溶性的VB12含量为0−10 pmol/L,而在美国长岛和南加州一些海湾地带VB12含量分别可达5-87 pmol/L和0-30 pmol/L[27, 28]。尽管某些区域VB12含量可以满足一些藻类生长对VB12的最低需要,而大部分地区的VB12实际上处于检测线以下的水平[15],这意味着在不同微观环境中VB12的浓度将是一种藻类生长的限制因子。而Co这一微量元素的含量也是VB12形成的制约因素之一。Sañudo-Wilhelmy等的研究表明VB12可以显著促进大体型浮游藻类 (>5 μm)的生长,VB12和氮素往往是这些藻类生长共同的限制因子[28]。Koch等发现额外添加VB12或与其他限制因子(N或Fe)联用都可以显著促进浮游藻类的生物量,并且改变生物群落的结构[29]。这些结果表明VB12对水体藻类生长、初级生产力以及物种群落结构都有重要影响。
作为自然界VB12的唯一来源,产VB12细菌对真核藻类的生长将具有重要作用。研究结果已经表明,某些真核藻类可以在与产VB12细菌的共生中获得充足的VB12。Croft等在VB12依赖型的前沟藻Amphidinium operculatum的培养物中分离到具有产VB12能力的盐单胞菌Halomonas sp.,两者可以相互交换光合产物和VB12,形成稳定的互惠共生体 系[12]。Wagner-Dobler等在利马原甲藻Prorocentrum lima中分离到共生细菌Dinoroseobacter shibae,并测定了该菌的基因组序列,结果表明该菌具有合成VB1和VB12的能力,并提供这些维生素用以维持藻类宿主的生长能力[30]。
实验室共培养实验也证实,VB12依赖型真核藻类可与产VB12细菌形成互惠的共生体系:细菌提供VB12给藻类,而藻类提供光合产物给细菌作为碳源。如Kazamia等发现VB12依赖型藻类Lobomonas rostrata可以与产VB12的百脉根根瘤菌Mesorhizobium loti在无外加碳源和VB12的培养基中长期共生[31],说明两者可以互相利用对方产生的有益代谢物,而外源添加的碳源或VB12反而会扰动两者的平衡。在上述研究的基础上,Grant等结合实验数据和数学模型分析VB12是简单的来自细菌的裂解释放还是受到相互作用的调控这一问 题[32]。结果表明共生体系中VB12的产量远高于细菌单独培养时的产量,模型分析同样支持VB12的产生受到藻类共生的调控。这些结果暗示着两者共生时将存在着一些分子识别和调控机制。
2.3 VB12促进真核藻类的耐热能力温度是生物最为敏感的外部环境因子之一,环境温度超过正常温度范围时,生物体内生理生化反应、个体生长和发育将受到危害,严重条件下会有致死效应。以莱茵衣藻为例,在超过正常生长温度(25 °C) 10 °C的条件下,细胞生长速度和生物量严重下降,而在高温40−42 °C条件下会很快死 亡[33, 34]。藻类的耐热研究将有助于深入了解藻类抵御逆境和响应气候变化的生理生化机制,也有利于增强藻类抗逆的能力来提高有益产物的产量。
在关于莱茵衣藻耐热的研究中,我们发现某些产VB12细菌(多为根瘤菌[18])在与莱茵衣藻共生时可以显著地增强衣藻的耐热能力,并初步阐明了其机理:在高温逆境下莱茵衣藻METE基因的表达受到严重抑制,而METH基因仍然保留部分表达量;在VB12存在情况下只有METH可以维持酶活并满足甲硫氨酸合成的需要,从而提高莱茵衣藻的耐热能力[14]。这表明VB12不仅对真核藻类的生长有作用,在抵抗逆境中也发挥着重要作用。研究还发现,在增强莱茵衣藻耐热能力的功能上,产VB12细菌多来自于α-Proteobacteria,暗示着两者的共生具有一定的宿主专一性[14]。这些结果为进一步深入研究产VB12细菌-真核藻类相互作用的分子机制奠定了新的基础。
与上述结果类似的是,甲硫氨酸合成途径在多种生物的正常生理活动和逆境反应中都起着重要作用。大肠杆菌在高温和氧化逆境下METE将迅速失活,菌体表现为甲硫氨酸缺陷型的表型[35, 36],而METE关键氨基酸的突变(C645A)可使蛋白耐受氧化并可提高菌体抗高温和醋酸盐的能力[37];植物体内约20%的甲硫氨酸将用于合成蛋白质参与各种生理功能,其余80%将用于合成生物体内主要的甲基供体S-腺苷甲硫氨酸,用于DNA、RNA和蛋白质等分子的甲基化反应[38];在高温处理下一些植物METE基因的表达也会被抑制[39];VB12可显著影响动物体内蛋白质组学图谱[40]和DNA的甲基化特 征[41]。这些结果也提示着我们在VB12分子机制研究中应注重甲硫氨酸下游产物的生理生化功能。
2.4 VB12调控真核藻类基因表达机制VB12在参与酶促生化反应时,也会对细胞内其他代谢途径或基因表达进行调控。研究表明,在多种真核藻类中,VB12的存在可以显著抑制METE的表达[12, 25]。Bertrand等研究了甲藻Phaeodactylum tricornutum和Thalassiosira pseudonana在不同VB12浓度情况下的转录组和蛋白质组,发现在低VB12情况下,甲藻具有多种方式应对VB12的缺乏:提高VB12转运蛋白表达量CBA1,降低对VB12的需求和减少甲硫氨酸合成酶活性[42]。Helliwell等对莱茵衣藻的研究表明,VB12除了抑制METE以外,还将抑制S-腺苷同型半胱氨酸水解酶S-adenosylhomocysteine hydrolase (SAHH)和丝氨酸羟甲基转移酶Serine hydroxymethyltransferase 2 (SHMT2)的表达[43]。然而,VB12如何调控这些基因的表达还有许多待解之谜。在原核生物中,VB12可以通过结合核糖开关(Riboswitch)对目标基因的表达进行调节[44],而在真核藻类中,目前还没有发现VB12特异型的核糖开关[43]。
一些研究也证实细菌与真核藻类共生中一方的基因表达将受到对方的调控。Teplitski等研究了莱茵衣藻分泌物对具有产VB12能力的苜蓿根瘤菌的影响,结果表明衣藻分泌物中含有细菌群体感应分子(N-acyl-l-homoserine lactone,AHL)类似物,并可以调节细菌的群体感应功能[45]。我们的实验结果表明在高温条件下衣藻METE基因的表达将受到野生型根瘤菌的严重抑制,而不受VB12合成突变体的抑制。这些结果为全面分析共生双方如何相互调控基因表达提供了研究基础。
3 展望综上所述,我们可以看到VB12由于其独特的性质、来源和功能在细菌与真核藻类相互作用中具有重要的作用,相关研究成果将有助于我们了解自然环境中细菌与藻类之间的互惠共生的原理和生态学意义,以及物种间协同进化的认识。以此为重要内容的细菌-真核藻类相互作用研究有望成为一种模式体系,用以从共生双方分子互作的机理、代谢产物的交换、遗传上的协同调控以及共生的生态效应等角度,拓展原核生物与真核生物特别是微生物与低等浮游植物之间分子相互作用的新研究领域(图 2)。结合近期的研究进展,我们认为有几个方面应得到重点关注。

|
| 图 2 细菌-真核藻类相互作用的研究模式 Figure 2 The research mode of bacteria-algae interaction |
在许多研究证实产VB12细菌与真核藻类之间互惠共生的同时,应关注到在自然环境中两者共生的真实形式。特别是在不同环境条件情况下,应加强研究这些相互作用对彼此双方适应环境因子和气候变化的作用。此外,由于生态系统的复杂性,也应将这种共生放在多物种与环境相互作用的背景下,研究各因子之间的相互作用网络与相关生态效应。
3.2 分子机理研究产VB12细菌与真核藻类的相互作用的分子机理研究方兴未艾。许多细节问题亟待解决,如:细菌与藻类共生过程中VB12的分泌和转运,甲硫氨酸下游产物在藻类生理生化过程中的作用,高温逆境下宿主专一性及其机理,共生双方之间的信号传导与新基因的功能鉴定等。一些基因组信息已知、遗传操作技术成熟的物种,如根瘤菌和莱茵衣藻等,应在图 2的模式中成为研究主体,这些机制研究将极大丰富我们对细菌与藻类之间分子相互作用的认识。
3.3 研究方法的改进转录组、蛋白质组、基因甲基化组、单细胞拉曼光谱检测等方法是近年来快速发展的技术,在生物学研究的各领域有着广阔的应用前景。在产VB12细菌与真核藻类共生研究中,应注重这些新方法与传统微生物学、分子生物学技术的有机结合,以加快取得重要的研究进展。
3.4 应用研究应加强以上基础研究与实际应用的结合。由于VB12在细菌与真核藻类相互作用中的重要性,相关研究成果应在有害水华的预警和防治、水产养殖、藻类培养技术的优化、藻类产量和抗逆水平的提高等领域寻求积极的应用。
| [1] | Bell W, Mitchell R.Chemotactic and growth responses of marine bacteria to algal extracellular products[J]. Biological Bulletin, 1972, 1439(2):265-277 |
| [2] | Cole JJ.Interactions between bacteria and algae in aquatic ecosystems[J]. Annual Review of Ecology Evolution and Systematics, 1982, 13:291-314 |
| [3] | Wang SP, Cao YC, Li ZJ, et al.The relationship between bacteria andmicroalgae in water environment and its practical application[J]. South China Fisheries Science, 2008, 4(1):76-80 (in Chinese)王少沛,曹煜成,李卓佳,等.水生环境中细菌与微藻的相互关系及其实际应用[J].南方水产科学, 2008, 4(1):76-80 |
| [4] | Li D, Li Y, Zheng TL.Advance in the research of marine algicidal functional bacteria and their algicidal mechanism[J]. Advances in Earth Science, 2013, 28(2):243-252(in Chinese)李东,李祎,郑天凌.海洋溶藻功能菌作用机理研究的若干进展[J].地球科学进展, 2013, 28(2):243-252 |
| [5] | Zhou J, Chen GF, Zhu XS, et al.A review of the relationship between algae and bacteria in harmful algal blooms[J]. Acta Ecologica Sinica, 2014, 34(2):269-281(in Chinese)周进,陈国福,朱小山,等.赤潮过程中"藻-菌"关系研究进展[J].生态学报, 2014, 34(2):269-281 |
| [6] | Wu XD, Ruan RS, Wang H, et al.Current status and prospect of sewage purification with the algal-microbe symbiotic system[J]. Environmental Engineering, 2014, 32(3):34-37(in Chinese)巫小丹,阮榕生,王辉,等.菌藻共生系统处理废水研究现状及发展前景[J].环境工程, 2014, 32(3):34-37 |
| [7] | Amin SA, Parker M, Armbrust E.Interactions between diatoms and bacteria[J]. Microbiology and Molecular Biology Reviews, 2012, 76(3):667-684 |
| [8] | Stocker R, Seymour JR.Ecology and physics of bacterial chemotaxis in the ocean[J]. Microbiology and Molecular Biology Reviews, 2012, 76(4):792-812 |
| [9] | Goecke F, Thiel V, Wiese J, et al.Algae as an important environment for bacteria-phylogenetic relationships among new bacterial species isolated from algae[J]. Phycologia, 2013, 52(1):14-24 |
| [10] | Amin SA, Green DH, Hart MC, et al.Photolysis of iron-siderophore chelates promotes bacterial-algal mutualism[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(40):17071-17076 |
| [11] | Thompson AW, Foster RA, Krupke A, et al.Unicellular cyanobacterium symbiotic with a single-celled eukaryotic alga[J]. Science, 2012, 337(6101):1546-1550 |
| [12] | Croft MT, Lawrence AD, Raux-Deery E, et al.Algae acquire vitamin B12 through a symbiotic relationship with bacteria[J]. Nature, 2005, 438:90-93 |
| [13] | Sañudo-Wilhelmy SA, Cutter LS, Durazo R, et al.Multiple B-vitamin depletion in large areas of the coastal ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(35):14041-14045 |
| [14] | Xie B, Bishop S, Stessman D, et al.Chlamydomonas reinhardtii thermal tolerance enhancement mediated by a mutualistic interaction with vitamin B12-producing bacteria[J]. The ISME Journal, 2013, 7:1544-1555 |
| [15] | Sañudo-Wilhelmy SA, Gómez-Consarnau L, Suffridge C, et al. The role of B vitamins in marine biogeochemistry[J]. Annual Review of Marine Science, 2014, 6:339-367 |
| [16] | Tang YZ, Koch F, Gobler CJ.Most harmful algal bloom species are vitamin B1 and B12 auxotrophs[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(48):20756-20761 |
| [17] | Brown KL.The chemistry and enzymology of vitamin B12[J]. Chemical Reviews, 2005, 105:2075-2149 |
| [18] | Campbell GR, Taga ME, Mistry K, et al.Sinorhizobium meliloti bluB is necessary for production of 5, 6-dimethylbenzimidazole, the lower ligand of B12[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(12): 4634-4639 |
| [19] | Gruber K, Puffer B, Kräutler B.Vitamin B12-derivatives-enzyme cofactors and ligands of proteins and nucleic acids[J]. Chemical Society Reviews, 2011, 40:4346-4363 |
| [20] | Croft MT, Warren MJ, Smith AG.Algae need their vitamins[J]. Eukaryotic Cell, 2006, 5(8):1175-1183 |
| [21] | Roth JR, Lawrence JG, Bobik TA.Cobalamin (coenzyme B12): synthesis and biological significance[J]. Annual Review of Microbiology, 1996, 50:137-181 |
| [22] | Volcani BE, Toohey JI, Barker HA.Detection of cobamide coenzymes in microorganisms by the ionophoretic bioautographic method[J]. Archives of Biochemistry and Biophysics, 1961, 92:381-391 |
| [23] | Raux E, Schubert HL, Warren MJ.Biosynthesis of cobalamin (vitamin B12):a bacterial conundrum[J]. Cellular and Molecular Life Sciences, 2000, 57:1880-1893 |
| [24] | Degnan PH, Taga ME, Goodman AL.Vitamin B12 as a modulator of gut microbial ecology[J]. Cell Metabolism, 2014, 20(5):769-778 |
| [25] | Helliwell KE, Wheeler GL, Leptos KC, et al.Insights into the evolution of vitamin B12 auxotrophy from sequenced algal genomes[J]. Molecular Biology and Evolution, 2011, 28(10): 2921-2933 |
| [26] | Koutmos M, Datta S, Pattridge KA, et al.Insights into the reactivation of cobalamin-dependent methionine synthase[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(44):18527-18532 |
| [27] | Bonnet S, Tovar-Sánchez A, Panzeca C, et al.Geographical gradients of dissolved vitamin B12 in the Mediterranean Sea[J]. Frontiers in Microbiology, 2013, 4:126 |
| [28] | Sañudo-Wilhelmy SA, Gobler CJ, Okbamichael M.Regulation of phytoplankton dynamics by vitamin B12[J]. Geophysical Research Letters, 2006, 33(4):L04604 |
| [29] | Koch F, Marcoval MA, Panzeca C, et al.The effect of vitamin B12 on phytoplankton growth and community structure in the Gulf of Alaska[J]. Limnology and Oceanography, 2011, 56(3): 1023-1034 |
| [30] | Wagner-Dobler I, Ballhausen B, Berger M, et al.The complete genome sequence of the algal symbiont Dinoroseobacter shibae: a hitchhiker's guide to life in the sea[J]. The ISME Journal, 2010, 4:61-77 |
| [31] | Kazamia E, Czesnick H, Nguyen TTV, et al.Mutualistic interactions between vitamin B12-dependent algae and heterotrophic bacteria exhibit regulation[J]. Environmental Microbiology, 2012, 14(6):1466-1476 |
| [32] | Grant MA, Kazamia E, Cicuta P, et al.Direct exchange of vitamin B12 is demonstrated by modelling the growth dynamics of algal-bacterial cocultures[J]. The ISME Journal, 2014, 8(7): 1418-1427 |
| [33] | Vítová M, Bišová K, Hlavová M, et al.Chlamydomonas reinhardtii:duration of its cell cycle and phases at growth rates affected by temperature[J]. Planta, 2011, 234:599-608 |
| [34] | Hema R, Senthil-Kumar M, Shivakumar S, et al.Chlamydomonas reinhardtii, a model system for functional validation of abiotic stress responsive genes[J]. Planta, 2007, 226(3):655-670 |
| [35] | Mogk A, Tomoyasu T, Goloubinoff P, et al.Identification of thermolabile Escherichia coli proteins:prevention and reversion of aggregation by DnaK and ClpB[J]. The EMBO Journal, 1999, 18(24):6934-6949 |
| [36] | Hondorp ER, Matthews RG.Oxidative stress inactivates cobalamin-independent methionine synthase (MetE) in Escherichia coli[J]. PLoS Biology, 2004, 2:e336 |
| [37] | Mordukhova EA, Pan JG.Evolved Cobalamin-independent methionine synthase (MetE) improves the acetate and thermal tolerance of Escherichia coli[J]. Applied and Environmental Microbiology, 2013, 79(24):7905-7915 |
| [38] | Giovanelli J, Mudd SH, Datko AH.Quantitative analysis of pathways of methionine metabolism and their regulation in Lemna[J]. Plant Physiology, 1985, 78(3):555-560 |
| [39] | Xu C, Huang B.Root proteomic responses to heat stress in two Agrostis grass species contrasting in heat tolerance[J]. Journal of Experimental Botany, 2008, 59(15):4183-4194 |
| [40] | Hannibal L, DiBello PM, Jacobsen DW.Proteomics of vitamin B12 processing[J]. Clinical Chemistry and Laboratory Medicine, 2013, 51(3):477-488 |
| [41] | Fernàndez-Roig S, Lai SC, Murphy MM, et al.Vitamin B12 deficiency in the brain leads to DNA hypomethylation in the TCblR/CD320 knockout mouse[J]. Nutrition&Metabolism, 2012, 9:41 |
| [42] | Bertrand EM, Allen AE, Dupont CL, et al.Influence of cobalamin scarcity on diatom molecular physiology and identification of a cobalamin acquisition protein[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 109(26):1762-1771 |
| [43] | Helliwell KE, Scaife MA, Sasso S, et al.Unravelling vitamin B12-responsive gene regulation in algae[J]. Plant Physiology, 2014, 165(1):388-397 |
| [44] | Nahvi A, Barrick JE, Breaker RR.Coenzyme B12 riboswitches are widespread genetic control elements in prokaryotes[J]. Nucleic Acids Research, 2004, 32(1):143-150 |
| [45] | Teplitski M, Chen H, Rajamani S, et al.Chlamydomonas reinhardtii secretes compounds that mimic bacterial signals and interfere with quorum sensing regulation in bacteria[J]. Plant Physiology, 2004, 134(1):1-10 |
 2015, Vol. 42
2015, Vol. 42