扩展功能
文章信息
- 初亚男, 封利颖, 张婕妤, 邹秉杰, 周国华
- CHU Ya-Nan, FENG Li-Ying, ZHANG Jie-Yu, ZOU Bing-Jie, ZHOU Guo-Hua
- 环介导等温扩增技术改进的研究进展
- A systematic review of the research progress and improvement of loop-mediated isothermal amplification
- 微生物学通报, 2015, 42(4): 729-735
- Microbiology China, 2015, 42(4): 729-735
- 10.13344/j.microbiol.china.140607
-
文章历史
- 收稿日期: 2014-08-09
- 接受日期: 2014-11-14
- 优先数字出版日期(www.cnki.net): 2014-11-20
2. 南京大学医学院 江苏 南京 210002
2. Medical School of Nanjing University, Nanjing, Jiangsu 210002, China
2000年由日本学者Notomi等[1]创建了环介导等温扩增法(Loop-mediated isothermal amplification,LAMP)至今,该技术针对待检测靶标核酸设计一对外引物,一对内引物,利用具有链置换作用的 Bst DNA聚合酶进行靶标的识别和延伸,对待测靶标进行超指数扩增。该技术扩增灵敏度高、反应简单快速,因而被广泛应用于病原微生物[2, 3, 4, 5, 6]、胚胎性别鉴定[7, 8]、转基因相关检测[9]等方面。然而LAMP技术在应用的过程中还存在一些问题:(1) 在线引物设计软件Primer Explorer version 4为其推广应用提供了便捷的引物设计平台。但是该平台仅能对200 bp左右的靶标核苷酸进行引物设计,无法设计小于100 bp和用于SNP分析的引物。(2) 如果能在缩短检测时间和简化模板预处理方面做出改进,可降低检测成本,进一步提高该技术的推广和应用价值。(3) 由于LAMP方法的扩增产物是长短不一的混合物,如何对多重靶标的扩增产物进行区分是目前的一个难题。(4) 核酸扩增方法容易造成气溶胶污染,LAMP方法超高的检测灵敏度决定了该方法在实际应用中更容易受到假阳性污染的影响,只有防止假阳性污染才能保障得到准确可靠的检测结果。因此本文从LAMP技术方法的改进、缩短反应时间和简化模板预处理的方法、多重产物分析、防止假阳性污染四个方面进行了讨论总结。本文综述了研究人员通过改进方法拓展了LAMP技术的检测对象[10, 11, 12];通过缩短反应时间、简化模板预处理和多重产物分析实现了简化操作步骤的目的;通过发展各类闭管检测方法避免了假阳性污染的发生。期望本文的讨论总结有助于促进以该技术为基础的理论和应用创新,最终使LAMP技术在实际应用中发挥更重要的价值。
1 LAMP技术方法的改进 1.1 滚环扩增法与LAMP法的级联应用LAMP技术由于引物设计的需要,主要用于长度在200 bp左右片段的特异性检测,尚无法对小于100 bp的短片段核酸序列进行分析,2008年Marciniak等利用基于连接反应的可环化探针(Circularizable oligonucleotide probes)巧妙地将LAMP扩增和滚环扩增结合起来,成功实现了31 bp短片段核酸的快速检测。该方法首先设计含有FIP (Forward inner primer)和BIP (Backward inner primer)引物结合区域及短片段特异性识别区域的Padlock探针,目标短片段同Padlock探针上的互补序列结合后,在DNA连接酶的作用下使Padlock探针成环;其次,BIP引物与探针环结合后可在Bst聚合酶的作用下进行滚环扩增,延伸后的序列中含有FIP引物结合的位点,通过几轮的链置换反应就可以获得标准的哑铃型扩增结构,进行后期的LAMP扩 增[10]。LAMP方法和其他方法的级联应用可以将各方法进行优势互补,为拓展LAMP方法的应用范围提供了很好的设计思路。
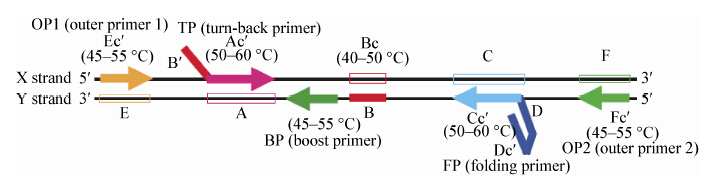
1.2 新型SMAP2技术Bst酶识别的特异性一直是困扰LAMP技术进行SNP分析的重要因素。2007年Mitani等[11]根据LAMP方法的原理,发明了一种可采用全血在 30 min快速检测SNP的方法,命名为SMAP2 (Smart amplification process version 2),该方法采用了一种来自酸热脂环酸芽孢杆菌的具有新型链置换作用的AacDNA聚合酶和来自栖热水生菌的错配识别蛋白TaqMutS。针对模板的5个特异性区域设计5条不对称的LAMP引物:外引物(OP1/OP2)、辅助引物(BP)、不对称内引物(TP/FP)。引物设计如图 1所示,XY为互补的两条DNA模板,TP的3′端与X链Ac′区域相同,5′端与B链下游约15-40个碱基区域相同;FP的3′端与Y链的Cc′区域相同,5′端为一个自行退火形成的发卡结构。SNP位点目前根据经验可设计在FP、TP、BP的3′末端3个碱基之一,或者是在TP的5′末端的3个碱基之一,BP引物有类似环状引物加快反应速率的作用,但有时也可在其中设计SNP识别位点。此外协调好Tm值与引物的退火位置是设计关键,要选择40%−60% GC含量的区域,还需避免引物自身出现的二级结构。
在循环反应中,通过外引物和不对称内引物的延伸置换,可以形成一端为颈环型互补,另一端为发夹型互补的不对称哑铃结构。在引物延伸的过程中,如果与引物不匹配就会产生一种鼓泡结构,Taq MutS蛋白可以很准确地识别并牢固结合这种结构,抑制Aac DNA聚合酶的结合和延伸,从而阻止这种不匹配的结构继续延伸,达到对SNP进行识别的目的。Mitani等[11]将此方法成功应用于乙醛脱氢酶2在G1543A位点、CYP2C19在G681A位点野生型和突变型的区分,并且还设计了用于进行SMAP2引物设计的在线软件(http://www.smapdna.com)。2008年Tatsumi等[13]对SMAP2进行了改进,一次检测就能发现一个氨基酸密码子的任何变化。
2 缩短反应时间和简化模板预处理的方法 2.1 基于LAMP技术改进缩短反应时间的方法最初报道的LAMP法扩增程序需要95 °C、 5 min的预变性,冷却后加入Bst聚合酶,然后进行65 °C的恒温反应,2001年Nagamine等[14]研究发现LAMP方法可以省略预变性步骤直接进行扩增反应,这样就免除了操作过程耗费的时间,且无需热循环仪可以在一个温度下进行,能在60 min内将几个拷贝的靶基因扩增到109水平。2002年,他又通过在LAMP反应中添加2条环形引物的方法,使反应时间缩短近一半,大大提高了扩增效率[15]。Yano等[16]在使用LAMP方法对肠毒素大肠杆菌的LT1和ST1基因进行的研究中,通过加入环引物的方式可使扩增时间从60 min缩至35 min。近年NEB公司开发的新型Bst链置换聚合酶,在新增了热启动性的同时比普通的Bst酶具有更快的延伸活性,也可以有效地提高扩增效率。
2.2 基于LAMP反应原理改进缩短反应时间的方法近年来Xu等[12]基于LAMP原理进行引物设计改进发明了CPA (Cross priming amplification)新型扩增方法,原理见图 2,该方法保留了LAMP扩增方法中一侧外引物折叠形成的颈环结构,设计了一对交叉扩增引物和一对剥离引物,在扩增靶序列的两端引入交叉引物杂交位点,以线性结构和颈环状结构的方式进行扩增,通过引物的反复杂交、延伸和扩增产物的自我折叠及延伸,产生多个引物杂交位点,同时进行聚合酶的延伸反应,因此扩增速度非常快,可1 h完成结核分枝杆菌的检测,最低可检出4个菌体的阳性样本。
2.3 简化模板预处理的方法LAMP法使用的聚合酶是具有链置换作用的Bst DNA聚合酶,该酶对检测模板中的一些抑制成分不敏感,基于该酶良好的耐受性,可适当简化模板核酸的提取过程,既可节约成本,又可减少操作步骤。Ihira等[17]在检测人疱疹病毒时,将待测血清与LAMP反应体系先于96 °C加热30 s,再加入Bst DNA聚合酶进行恒温反应,大大降低了血清对LAMP反应的抑制性,使检测的灵敏度由原来的 1 000拷贝提高到10拷贝。Paris等[18]对恙虫病进行检测时,将待检血液进行99 °C加热3 min后, 13 000 r/min离心3 min取上清,获得直接用于检测的模板。2007年Kaneko等[19]进行了LAMP对培养基成分耐受性的研究,发现LAMP方法对各种培养基成分具有较强的耐受性,样品可以不进行纯化而直接进行LAMP扩增。2008年Njiru等[20]对非洲锥体虫病的检测中发现,通过简单的加热和离心能实现对血液、脑脊液、血清样本的提取,取2-4 μL上清就可以进行LAMP反应。
3 多重产物分析的方法同时对多重靶标进行检测和分析可以有效降低成本、减少工作量,是更理想的检测手段,多重LAMP技术是必然的发展趋势,如何对多重靶标的扩增产物进行区分是目前的一个难题。传统的多重PCR可通过产物的长度标记不同来源的靶标,实现多重产物的分析。而在多重LAMP扩增产物分析中,由于LAMP扩增产物结构复杂且为长短不一的混合物,我们是否也可以借鉴多重PCR的长度标记来实现多重产物分析呢?2007年Iseki等[21]在内引物FIP和BIP中间的连接子区域引入限制性内切酶识别位点。通过限制性内切酶对LAMP扩增产物进行酶切,利用电泳分析酶切产物的长度标记不同来源的靶标,成功应用于牛巴贝西虫属的两种寄生虫检测。但是该方法也存在明显的不足。首先,对于二级结构复杂的LAMP扩增产物,由于产物自身形成的空间位阻会影响限制性内切酶的识别和切割效率,较难分析获得特异性酶切产物条带;其次,依靠酶切后特异性片段标记不同来源靶标扩增产物的方法,对LAMP引物的设计要求非常严格,且根据LAMP引物的设计原则可选择的特异性片段长度范围有限。因此后期发展了基于荧光标记的多重产物分析方法,2010年Aonuma等[22]在对蚊子体内伯氏疟原虫和犬恶丝虫的研究中分别设计了2组特异性的LAMP引物,将FITC和Cy5.5标记在2组FIP引物上,扩增产物电泳后经紫外照射分别显示绿色和红色荧光,实现了两重LAMP扩增产物的分析。但是基于荧光标记的多重分析方法,增加了试剂成本,也容易受到荧光检测仪器的限制,降低了多重检测通量。所以2012年Liang等[23]提出了一种基于序列标签和焦磷酸测序技术的多重LAMP产物分析方法,该方法将序列特异性标签标记在FIP引物中,使其对不同模板的扩增产物进行标记。同时在序列标签附近插入一段切刻内切酶切割位点,待扩增结束后通过切刻内切酶切割出一个缺口,然后进行焦磷酸测序,当加入对应的dNTP时,聚合酶会以非切割链为模板,沿着切口的3′端进行延伸,从而产生对应的信号。为了特异性检测不同的模板,除了“报告碱基”外,还需要设计“间隔碱基”。因为DNA序列中只有4种碱基A、T、G、C,每种碱基标记一种来源的模板最多能同时标记、区分4种模板,在“报告碱基”后必需加入一个“间隔碱基”对序列进行阻遏,以防止后续dNTP加入导致的DNA延伸反应而产生进一步的延伸信号。利用该原理Liang等[23]成功对血液病毒中的乙肝病毒、丙肝病毒、艾滋病病毒和梅毒螺旋体的四重LAMP产物进行了有效区分。但该方法也有其不足之处,这种开管式产物分析方法无法避免气溶胶污染的风险。在闭管进行多重产物分析方面,Mahony等[24]也做出了尝试,2013年他们提出了基于溶解曲线法分析A型和B型流感病毒,将A/H1流感病毒和A/H3流感病毒的引物覆盖区域的Tm值限定在86.6 °C,将B型流感病毒的引物覆盖区域的Tm值限定在82.7 °C,利用Tm值的差异有效区分了两种型别的流感病毒。多重LAMP扩增产物的分析还存在一些问题需要解决,探索一种多重闭管扩增产物分析的方法是今后比较理想的发展方向。
4 防止假阳性污染的方法LAMP技术可以在1-2 h获得约109以上的目标片段,对扩增产物检测方法的研究是该技术诞生以后的一个热点,传统的扩增产物检测方法有电泳法[1]和荧光试剂显色[25]等,这些需要开管操作的产物检测方法极易产生气溶胶污染,造成下次扩增时出现假阳性。避免假阳性污染可通过两种途径实现:(1) 闭管检测扩增产物防止产物形成气溶胶;(2) 降解携带在气溶胶上的扩增产物避免产物污染。
4.1 焦磷酸镁沉淀闭管检测技术早在2001年Mori等[26]就提出了根据反应副产物焦磷酸离子和反应体系中的镁离子生成的焦磷酸镁白色沉淀来观察。若管内液体浑浊,离心或静置后有白色沉淀积于管底则为阳性,否则为阴性。由于闭管对扩增产物进行检测所以不会产生气溶胶污染,但白色沉淀肉眼判定具有主观性,于是2004年Mori等[27]设计了实时浊度检测装置,可对反应进行实时定量检测。但该浊度仪价格昂贵且仅能应用于浊度依赖的检测,应用范围狭窄,2008年Njiru等[20]将SYTO-9荧光染料加入LAMP扩增体系采用实时荧光PCR仪的FIM通道实现了LAMP扩增的实时监测,为LAMP闭管检测的发展提供了新思路。
4.2 金属离子指示剂闭管检测技术2008年钙黄绿素首次被Tomita等[28]应用于LAMP扩增产物的检测。该技术利用钙黄绿素能与Mg2+结合形成复合物产生很强的荧光而与Mn2+结合则会显著降低荧光的原理,通过紫外灯激发阳性可产生绿色荧光。但是钙黄绿素产物分析法需在体系中额外添加Mn2+,这会对LAMP扩增效率产生影响。因此Goto等[29]报道了另外一种指示剂羟基萘酚蓝,该指示剂显色不需额外添加任何成分。与钙黄绿素法的比较结果表明Mn2+的加入使反应灵敏度降低了一个数量级,而羟基萘酚蓝对灵敏度无影响。该法也被用于甲型流感病毒H1N1及人乳头状瘤病毒(Human papilloma virus,HPV)等的检测[30, 31, 32]。
4.3 SYBR Green I蜡封闭管检测技术SYBR Green I染料是LAMP开管产物分析时最常用的显色剂,但高浓度的扩增产物在进行开管操作时极易造成气溶胶污染。为了避免污染,最直接的方法就是将染料提前加入LAMP反应体系,反应结束后生成的LAMP产物即可与SYBR Green I染料结合显色。但是实现可视化检测所需的SYBR Green I染料浓度很高,从1/10至1/100稀释不等,若在反应前将该浓度染料加入反应体系,会严重抑制LAMP反应[33]。2013年Liang等[34]采用微晶蜡将SYBR Green I染料密封于管底,LAMP反应结束后加热使微晶蜡融化释放染料显色,既实现了高灵敏荧光染料检测又解决了由于开盖引起的气溶胶污染问题。近期该方法已成功用于恶性疟原虫的检测,提供了一种可用于现场快速筛查的方法[35]。
4.4 UDG酶降解法UDG酶很早即被应用于PCR扩增中防污 染[36, 37, 38]。因此也有人考虑将UDG酶应用于LAMP扩增的防污染。2014年Hsieh等[39]在LAMP扩增产物中插入dUTP,在1 h的预扩增和常规扩增中间加入UDG酶室温孵育过程,降解含有dUTP的扩增产物,实验结果表明本方法可有效消除阿克级的延迟型假阳性污染。
5 展望LAMP技术目前共有39个国家及地区有相关文章记载,已经遍及亚洲、欧洲、北美洲、南美洲及非洲的世界五大洲,仅2013年PubMed中LAMP相关论文已高达1 125篇,2000年首篇关于LAMP技术的文章引用频率已达到2 606次[1],广阔的应用前景是推动其不断进行改进的动力。本文综述的改进方法各有优劣,我们可以在现有方案设计的思路中汲取灵感,在此基础上从如下几个方面进行创新。首先,从方法学方面,可以进行引物设计的局部改造也可以考虑和其他方法的拼接、组合进行优势互补,拓展其应用领域[40];其次,在简化模板预处理方面,可以充分利用Bst酶耐受性高的特点减少操作步骤降低成本;再次,在多重产物分析中,可以考虑闭管多重产物分析的新方向;此外,在防止假阳性污染方面,可以根据LAMP反应高Mg2+和高焦磷酸盐的特点开发出新的闭管检测方法;最后,在硬件改造中还可以设计扩增检测一体式卡盒,使扩增产物密封于卡盒中可同样起到避免气溶胶污染的作用。相信未来LAMP技术会在应用中不断完善,发挥更重要的应用价值。
| [1] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63 |
| [2] | Sharma K, Bansal R, Sharma A, et al. Loop-mediated isothermal amplification for rapid diagnosis of tubercular uveitis[J]. JAMA Ophthalmol, 2014, 132(6): 777-778 |
| [3] | Scheel CM, Zhou Y, Theodoro RC, et al. Development of a loop-mediated isothermal amplification method for detection of Histoplasma capsulatum DNA in clinical samples[J]. Journal of Clinical Microbiology, 2014, 52(2): 483-488 |
| [4] | Chu YN, Cheng SJ, Liang C, et al. Visual isothermal amplification for rapid detection and genotyping of avian influenza virus[J]. Journal of Chinese Practical Diagnosis and Therapy, 2011, 25(7): 670-673 (in Chinese) 初亚男, 成思佳, 梁超, 等. 可视化等温扩增法快速筛查并分型禽流感病毒[J]. 中华实用诊断与治疗杂志, 2011, 25(7): 670-673 |
| [5] | Cheng SJ, Chen ZY, Chu YN, et al. Sensitive detection of influenza A H1N1 virus by isothermal amplification in a single tube[J]. Chinese Journal of Analytical Chemistry, 2011, 39(3): 335-340 (in Chinese) 成思佳, 陈之遥, 初亚男, 等. 单管高灵敏度等温扩增技术快速检测甲型H1N1流感病毒[J]. 分析化学, 2011, 39(3): 335-340 |
| [6] | Hara-Kudo Y, Konishi N, Ohtsuka K, et al. Detection of verotoxigenic Escherichia coli O157 and O26 in food by plating methods and LAMP method: a collaborative study[J]. International Journal of Food Microbiology, 2008, 122(1/2): 156-161 |
| [7] | Wright CF, Burton H. The use of cell-free fetal nucleic acids in maternal blood for non-invasive prenatal diagnosis[J]. Human Reproduction Update, 2009, 15(1): 139-151 |
| [8] | Zhang L, Huang CH, Huang H, et al. Application of LAMP in sex identification on embryos[J]. Modern Journal of Animal Husbandry and Veterinary Medicine, 2006(6): 9-11 (in Chinese) 张立, 黄春华, 黄河, 等. LAMP 法性别鉴定在胚胎工程技术中的应用[J]. 现代畜牧兽医, 2006(6): 9-11 |
| [9] | Liu M, Luo Y, Tao R, et al. Sensitive and rapid detection of genetic modified soybean (roundup ready) by loop-mediated isothermal amplification[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(11): 2365-2369 |
| [10] | Marciniak J, Kummel A, Esener S, et al. Coupled rolling circle amplification loop-mediated amplification for rapid detection of short DNA sequences[J]. Biotechniques, 2008, 45(3): 275-280 |
| [11] | Mitani Y, Lezhava A, Kawai Y, et al. Rapid SNP diagnostics using asymmetric isothermal amplification and a new mismatch-suppression technology[J]. Nature Methods, 2007, 4(3): 257-262 |
| [12] | Xu G, Hu L, Zhong H, et al. Cross priming amplification: mechanism and optimization for isothermal DNA amplification[J]. Scientific Reports, 2012(2): 246 |
| [13] | Tatsumi K, Mitani Y, Watanabe J, et al. Rapid screening assay for KRAS mutations by the modified smart amplification process[J]. The Journal of Molecular Diagnostics, 2008, 10(6): 520-526 |
| [14] | Nagamine K, Watanabe K, Ohtsuka K, et al. Loop-mediated isothermal amplification reaction using a nondenatured template[J]. Clinical Chemistry, 2001, 47(9): 1742-1743 |
| [15] | Nagamine K, Hase T, Notomi T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes, 2002, 16(3): 223-229 |
| [16] | Yano A, Ishimaru R, Hujikata R. Rapid and sensitive detection of heat-labile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]. Journal of Microbiological Methods, 2007, 68(2): 414-420 |
| [17] | Ihira M, Akimoto S, Miyake F, et al. Direct detection of human herpesvirus 6 DNA in serum by the loop-mediated isothermal amplification method[J]. Journal of Clinical Virology, 2007, 39(1): 22-26 |
| [18] | Paris DH, Blacksell SD, Newton PN, et al. Simple, rapid and sensitive detection of Orientia tsutsugamushi by loop-isothermal DNA amplification[J]. Transactions of the Royal Society of Tropical Medicine and Hygiene, 2008, 102(12): 1239-1246 |
| [19] | Kaneko H, Kawana T, Fukushima E, et al. Tolerance of loop-mediated isothermal amplification to a culture medium and biological substances[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(3): 499-501 |
| [20] | Njiru ZK, Mikosza AS, Armstrong T, et al. Loop-mediated isothermal amplification (LAMP) method for rapid detection of Trypanosoma brucei rhodesiense[J]. PLoS Neglected Tropical Diseases, 2008, 2(1): e147 |
| [21] | Iseki H, Alhassan A, Ohta N, et al. Development of a multiplex loop-mediated isothermal amplification (mLAMP) method for the simultaneous detection of bovine Babesia parasites[J]. Journal of Microbiological Methods, 2007, 71(3): 281-287 |
| [22] | Aonuma H, Yoshimura A, Kobayashi T, et al. A single fluorescence-based LAMP reaction for identifying multiple parasites in mosquitoes[J]. Experimental Parasitology, 2010, 125(2): 179-183 |
| [23] | Liang C, Chu Y, Cheng S, et al. Multiplex loop-mediated isothermal amplification detection by sequence-based barcodes coupled with nicking endonuclease-mediated pyrosequencing[J]. Analytical Chemistry, 2012, 84(8): 3758-3763 |
| [24] | Mahony J, Chong S, Bulir D, et al. Multiplex loop-mediated isothermal amplification (M-LAMP) assay for the detection of influenza A/H1, A/H3 and influenza B can provide a specimen-to-result diagnosis in 40 min with single genome copy sensitivity[J]. Journal of Clinical Virology, 2013, 58(1): 127-131 |
| [25] | Iwamoto T, Sonobe T, Hayashi K. Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex, M. avium, and M. intracellulare in sputum samples[J]. Journal of Clinical Microbiology, 2003, 41(6): 2616-2622 |
| [26] | Mori Y, Nagamine K, Tomita N, et al. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochemical and Biophysical Research Communications, 2001, 289(1): 150-154 |
| [27] | Mori Y, Kitao M, Tomita N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. Journal of Biochemical and Biophysical Methods, 2004, 59(2): 145-157 |
| [28] | Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877-882 |
| [29] | Goto M, Honda E, Ogura A, et al. Colorimetric detection of loop-mediated isothermal amplification reaction by using hydroxy naphthol blue[J]. Biotechniques, 2009, 46(3): 167-172 |
| [30] | Lu CB, Luo L, Yang MJ, et al. Colorimetric detection of HPV6 and HPV16 by loop mediated isothermal amplification[J]. Chinese Journal of Virology, 2011, 27(1): 64-70 (in Chinese) 芦春斌, 罗乐, 杨梦婕, 等. 基于颜色判定的环介导等温扩增技术检测HPV6和HPV16[J]. 病毒学报, 2011, 27(1): 64-70 |
| [31] | Nie K, Wang DY, Qin M, et al. Colorimetric detection of human influenza A H1N1 virus by reverse transcription loop mediated isothermal amplification[J]. Chinese Journal of Virology, 2010, 26(2): 81-87 (in Chinese) 聂凯, 王大燕, 秦萌, 等. 基于颜色判定的环介导逆转录等温扩增技术检测人甲型H1N1流感病毒基因[J]. 病毒学报, 2010, 26(2): 81-87 |
| [32] | Goto M, Shimada K, Sato A, et al. Rapid detection of Pseudomonas aeruginosa in mouse feces by colorimetric loop-mediated isothermal amplification[J]. Journal of Microbiological Methods, 2010, 81(3): 247-252 |
| [33] | Espy MJ, Uhl JR, Sloan LM, et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing[J]. Clinical Microbiology Reviews, 2006, 19(1): 165-256 |
| [34] | Liang C, Cheng SJ, Chu YN, et al. A closed-tube detection of loop-mediated isothermal amplification (LAMP) products using a wax-sealed fluorescent intercalator[J]. Journal of Nanoscience and Nanotechnology, 2013, 13(6): 3999-4005 |
| [35] | Jiang ZM, Ma XP, Yin ZJ, et al. A closed-tube isothermal amplification method for highly sensitive and visualized detection of Plasmodium Falciparum[J]. Progress in Modern Biomedicine, 2014, 14(26): 5014-5018 (in Chinese) 江再茂, 马雪萍, 殷竹君, 等. 单管可视化环介导等温扩增技术快速检测恶性疟原虫[J]. 现代生物医学进展, 2014, 14(26): 5014-5018 |
| [36] | Pang J, Modlin J, Yolken R. Use of modified nucleotides and uracil-DNA glycosylase (UNG) for the control of contamination in the PCR-based amplification of RNA[J]. Molecular and Cellular Probes, 1992, 6(3): 251-256 |
| [37] | Poddar SK, Sawyer MH, Connor JD. Optimized PCR amplification of influenza a virus RNA using Tth DNA polymerase, incorporating uracil N glycosylase (UNG) in a single tube reaction[J]. Journal of Clinical Laboratory Analysis, 1997, 11(6): 323-327 |
| [38] | Udaykumar, Epstein JS, Hewlett IK. A novel method employing UNG to avoid carry-over contamination in RNA-PCR[J]. Nucleic Acids Research, 1993, 21(16): 3917-3918 |
| [39] | Hsieh K, Mage PL, Csordas AT, et al. Simultaneous elimination of carryover contamination and detection of DNA with uracil-DNA-glycosylase-supplemented loop-mediated isothermal amplification (UDG-LAMP)[J]. Chemical Communications, 2014, 50(28): 3747-3749 |
| [40] | Sun JS, Chen SJ, Shi J. Gold nanoparticles for the detection of single nucleotide polymorphism: an update[J]. Journal of Medical Postgraduate, 2012, 25(1): 85-88 (in Chinese) 孙加司, 陈思娇, 史记. 纳米金检测单核苷酸多态性的应用进展[J]. 医学研究生学报, 2012, 25(1): 85-88 |
 2015, Vol. 42
2015, Vol. 42