扩展功能
文章信息
- 沈宁燕, 肖安风, 蔡慧农, 杨秋明
- SHEN Ning-Yan, XIAO An-Feng, CAI Hui-Nong, YANG Qiu-Ming
- 乳酸钠促进法夫酵母虾青素合成代谢流作用分析
- Metabolic flux regulation of sodium lactate on astaxanthin synthesis during Phaffia rhodozyma fermentation
- 微生物学通报, 2015, 42(4): 634-645
- Microbiology China, 2015, 42(4): 634-645
- 10.13344/j.microbiol.china.140568
-
文章历史
- 收稿日期: 2014-07-24
- 接受日期: 2014-10-28
- 优先数字出版日期(www.cnki.net): 2014-11-03
2. 福建省食品微生物与酶工程重点实验室 福建 厦门 361021
3. 厦门市食品生物工程技术研究中心 福建 厦门 361021
2. Fujian Provincial Key Laboratory of Food Microbiology and Enzyme Engineering, Xiamen, Fujian 361021, China
3. Food Bio-Engineering Research Center of Xiamen, Xiamen,Fujian 361021, China
虾青素是一种备受关注的含氧类胡萝卜素,它具备显著的着色效果,并有提高存活率、饲料转化率等作用,因此被广泛应用于饲料和水产养殖行 业[1]。其很强的清除自由基和抗氧化的能力,可有效地保护细胞组织、DNA等免受氧的损伤[2],此外虾青素用于延缓衰老和治疗由老龄化引发的某些疾病,能增加机体免疫力、抑制肿瘤发生,近期研究证实了它具有抗幽门螺旋杆菌[3]、抗动脉硬化、降糖及预防糖尿病肾病的作用[4,5]。因此在食品、医药等方面也有广阔的应用前景[6,7]。
法夫酵母(Phaffia rhodozyma)是生产虾青素的生物来源之一,因其在培养过程中不需光照、可异氧代谢、能利用大多数糖、生长快、可高密度培养等优点而成为当前研究的重点[8],但因法夫酵母产虾青素成本较高,虾青素含量低从而使工业化的生产受到一定的限制。目前,国内外学者对法夫酵母高产菌株选育、发酵工艺优化等方面进行了许多工作,法夫酵母虾青素的产量已达到60 mg/L[9]。根据相关报道,在培养基中添加某些化学物质或是虾青素合成的前体物质,有利于增加法夫酵母虾青素的含量和产量:Johnson等[10]在培养液中加入番茄汁,令虾青素的单位产量提高到814 mg/kg干细胞。Gu等[11]在培养基中加入0.2%的乙醇,虾青素的单位产率得到了一定程度的提高,其中乙醇的作用机制与增强HMG-CoA还原酶的活性有关。Meyer等[9]在法夫酵母分批发酵培养过程中滴加乙酸,虾青素含量达到1 430 mg/kg干细胞。Yamane等[12]在法夫酵母两步式分批发酵过程的中后期流加乙醇,令虾青素的产率得到显著提高。Flores-Cotera等[13]发现培养基中添加柠檬酸盐可以显著提高法夫酵母的色素产量,但对虾青素的合成影响不大。林舒乐等[14]添加0.2%乳酸钠培养法夫酵母,虾青素含量达到647 mg/kg干细胞,比对照组高出46.2%。
代谢通量分析(MFA)基于质量守恒和代谢中间产物拟稳态假设,对细胞组成、底物和产物浓度的变化速率的测定,通过细胞内代谢网络的模型化推导和代谢中间产物的质量平衡,计算出各代谢途径的通量。得到的代谢通量图可反应不同培养条件下,不同发酵阶段细胞内的碳流向,可确定细胞代谢途径中分支点的性质(刚性、柔刚性或柔性),识别替代途径,计算胞内的未知通量,计算最大理论转化率等[15]。本研究利用MFA的方法,对比分析用葡萄糖作为碳源和添加乳酸钠进行发酵培养的代谢通量分布情况,从细胞生理代谢的角度对乳酸钠促进法夫酵母产虾青素进行阐释。
1 材料与方法 1.1 菌种Phaffia rhodozyma JMU-VDL668菌株:以Phaffia rhodozyma Pst-1菌株(德国柏林工业大学Stahl教授赠送)为出发菌株,经紫外诱变,用薄层色谱法筛选得到该菌株虾青素占总类胡萝卜素 的95%。
1.2 培养基斜面培养基:4°麦汁添加2.5%琼脂。
无碳源组合培养基(g/L):(NH4)2SO4 5.0,KH2PO4 3.0,MgSO4·7H2O 0.5;金属离子、维生素和微量元素成分(mg/L):CaCl2·2H2O 10.00,H3BO3 2.67,CuSO4·5H2O 0.80,KI 0.27,MnCl2 2.67,Na2MoO4·2H2O 1.07,ZnSO4·7H2O 12.00,CoCl2 0.80,FeSO4·7H2O 8.00,泛酸钙2.67,生物素0.13,肌醇66.67,烟酸2.67,对氨基苯甲酸(PABA) 0.53,盐酸吡哆醇2.67,盐酸硫铵2.67。
1.3 种子培养取2 °C保藏的斜面菌种一环至4°麦汁平板,划线分离,22 °C培养5 d,挑取单菌落保存至斜面培养基。从斜面上挑一环菌接种于30 mL无碳源组合培养基(添加20 g/L葡萄糖)于250 mL三角瓶中,22 °C、90 r/min振荡培养48 h。
1.4 发酵分批发酵:以无碳源组合培养基,加入18 g/L葡萄糖和2 g/L乳酸钠作为碳源,进行发酵培养,与加入20 g/L葡萄糖的培养基进行发酵作为对照。按10%的接种量接入培养好的种子液,22 °C、90 r/min振荡培养120 h。分别在12、14、72和74 h取样测定其生物量、虾青素产量、残糖、丙酮酸和乳酸。
分批补料发酵:以无碳源组合培养基,加入 30 g/L葡萄糖作为初始碳源进行分批补料发酵。按10%的接种量接入装有4 L培养基的7 L发酵罐内,发酵至24 h在实验组中加入乳酸钠,对照组中加入同体积的无菌水。此后,实验组以27%葡萄糖和3%乳酸钠的混合溶液进行补料,对照组以30%葡萄糖溶液进行补料,控制发酵液中的糖浓度在15−25 g/L之间。发酵过程保持相对溶氧在30%左右,通过流加氨水控制pH 4.0左右。
1.5 生物量的测定取5 mL发酵液于3 500 r/min离心10 min后,用蒸馏水洗涤离心2次,于105 °C烘干至恒重称重。
1.6 虾青素含量测定>采用二甲亚砜(DMSO)法:取5 mL发酵液,离心后用去离子水洗涤离心2次,加2 mL 75 °C的DMSO破壁,最后用乙醇提取并定容,在474 nm下测其OD值,用2 mL DMSO和8 mL乙醇混匀调零。以Sigma公司的虾青素标准品作标准曲线,回归得到线性标准曲线方程。
1.7 发酵液残糖测定 1.8 有机酸测定方法采用HPLC测定,色谱条件:色谱仪:Waters公司1525型高效液相色谱仪;色谱柱:Atlantis T3 5.0 μm,4.6 mm×150 mm;流动相:20 mmol/L NaH2PO4缓冲液,pH 2.7;检测波长:210 nm;流速:0.5 mL/min;进样量:20 mL;柱温:30 °C。
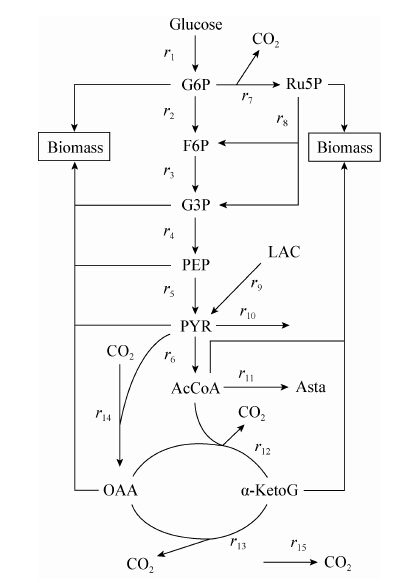
1.9 法夫酵母生物合成虾青素的代谢网络根据An等[18]对细胞组成参考测定并报道的相关数据文献建立法夫酵母生物合成虾青素的简化代谢网络,并做出如下简化和假设:法夫酵母对葡萄糖的代谢主要是通过EMP途径和TCA循环,也有少量通过PP途径进行代谢;假设细胞生长过程的各个阶段细胞组分基本一致,这是因为一般菌体组分中的RNA、DNA和主要氨基酸的含量相差不大,而且即使有变化,对模型的通量分布的影响也不大。细胞生长对各种前体物质的需求系数参考孙乃霞等[19]相关研究结果;为简化代谢网络,把直线反应合并为一个反应,设定乙酰辅酶A合成虾青素为线性反应;在两个取样点之间的时间段内,设定细胞内环境处于拟稳态,代谢网络中间的代谢产物变化速率为0。基于上述假设,法夫酵母代谢网络如图1所示。
|
|
图 1 法夫酵母代谢网络
Figure 1 The metabolic reaction network of Phaffia rhodozyma
注:G6P:6-磷酸葡萄糖;Ru5P:5-磷酸核酮糖;F6P:6-磷酸果糖;G3P:3-磷酸甘油醛;PEP:磷酸烯醇式丙酮酸;PYR:丙酮酸;LAC:乳酸;AcCoA:乙酰辅酶A;OAA:草酰乙酸;α-KetoG:酮戊二酸;Asta:虾青素. Note: G6P: Glucose 6-phosphate; Ru5P: 5-phosphate ribulose; F6P: Fructose 6-phosphate; G3P: Glyceraldehyde 3-phosphate; PEP: Phosphoric acid enol pyruvic acid; PYR: Pyruvic acid; LAC: Lactic acid; AcCoA: Acetyl coenzyme A; OAA: Oxaloacetic acid; α-KetoG: Ketoglutaric acids; Asta: Astaxanthin. |
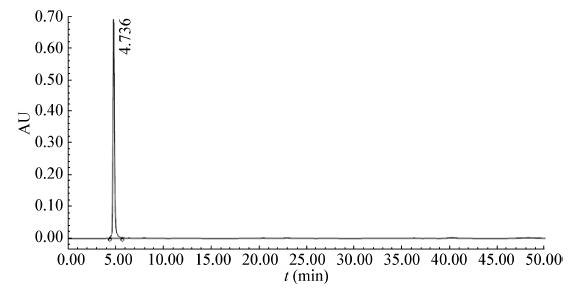
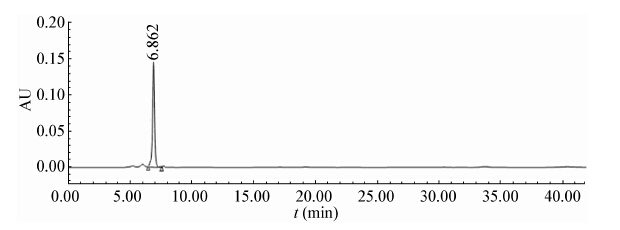
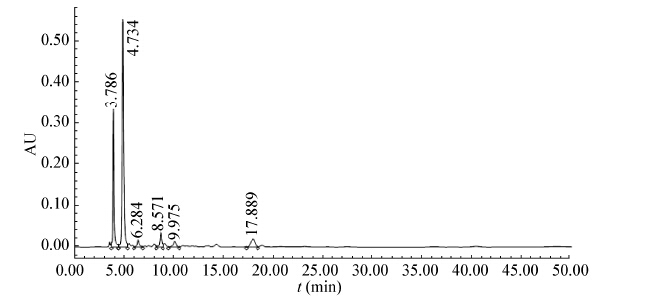
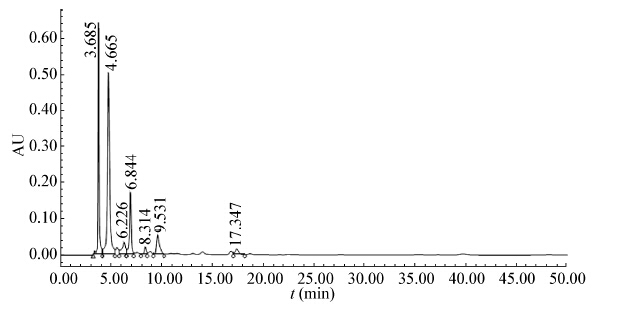
HPLC测定图谱如图2 −5所示。其中图2、3分别为丙酮酸和乳酸的标准品。图4、5为发酵液的测定图谱。
通过HPLC对发酵液的分析,可知在实验所采用的培养条件下,细胞分泌至发酵液中的有机酸主要为丙酮酸,其他副产物的量相对而言非常小,可以忽略不计。
|
| 图 2 丙酮酸的高效液相色谱图 Figure 2 HPLC spectra of standard pyruvate |
|
| 图 3 乳酸的高效液相色谱图 Figure 3 HPLC spectra of standard lactic acid |
|
| 图 4 对照组(不添加乳酸钠)培养36 h时发酵液的高效液相色谱图 Figure 4 HPLC spectra from fermentation without sodium lactate at 36th hour |
|
| 图 5 实验组(添加乳酸钠)培养36 h时发酵液的高效液相色谱图 Figure 5 HPLC spectra from fermentation with sodium lactate at 36th hour |
法夫酵母生长的前体需求系数βi如表1所示。将图1中的各代谢反应列出,如表2所示,则可以根据反应平衡,结合细胞生长对各前体物质的需求系数,得到代谢通量的平衡方程式,见表3。
| 前体Precursor | G6P | Ru5P | G3P | PEP | PYR | AcCoA | α-KetoG | OAA |
| 需求系数βi Coefficient βi(mmol/g DCW) | 2.490 | 0.467 | 0.437 | 0.248 | 0.780 | 5.764 | 0.597 | 0.598 |
| 比速率 Specific rate | 反应式 Equation |
| r1 | Glucose=G6P |
| r2 | G6P=F6P |
| r3 | F6P=2G3P |
| r4 | G3P=PEP |
| r5 | PEP=PYR |
| r6 | PYR=AcCoA+CO2 |
| r7 | G6P=Ru5P+CO2 |
| r8 | Ru5P=(2/3) F6P+(1/3) G3P |
| r9 | LAC=PYR |
| r10 | PYR=PYR (分泌) |
| r11 | 24 AcCoA=Astaxanthin |
| r12 | OAA+AcCoA=α-KetoG+CO2 |
| r13 | α-KetoG=OAA+CO2 |
| r14 | PYR+CO2=OAA |
| r15 | CO2=CO2 (释放) |
| rx | β1G6P+β2Ru5P+β3G3P+β4PEP+β5PYR+β6AcCoA+β7α-KetoG+β8OAA=Biomass |
| 序号No. | 代谢物Metabolite | 通量方程式Flux equation |
| 1 | Glucose | x1=r1=ΔCGlucose/Δt/X |
| 2 | G6P | x2=(r1−r2)-(r7−β1rx) |
| 3 | F6P | x3=r2+(2/3)r8-r3 |
| 4 | G3P | x4=2r3+(1/3)r8-r4-β3rx |
| 5 | PEP | x5=r4-r5-β4rx |
| 6 | PYR (胞外) | x6=r5+r9-r6-r14-r10-β5rx |
| 7 | Ru5P | x7=r7-r8 -β2rx |
| 8 | AcCoA | x8=r6-r11-r12-β6rx |
| 9 | α-KetoG | x9=r12-r13-β7rx |
| 10 | OAA | x10=r13+r14-r12-β8rx |
| 11 | LAC | x11=r9=ΔCLAC/Δt/X |
| 12 | PYR (胞外) | x12=r10=ΔCPYR/Δt/X |
| 13 | Astaxanthin | x13=(1/24)r11=ΔCAsta/Δt/X |
| 14 | CO2 | x14=r7+r12+r13-r14=r15 |
由表1−3可以建立CO2的平衡方程式,并通过碳平衡计算其产生速率。此时,法夫酵母代谢通量模型中的反应速率为16个,平衡方程为10个,系统自由度为6。而实验中可以测定的值有葡萄糖的消耗速率、乳酸钠的消耗(或分泌)速率、丙酮酸消耗(或分泌)速率、细胞比生长速率、虾青素合成比速率。因此,通量方程可以得到唯一解。
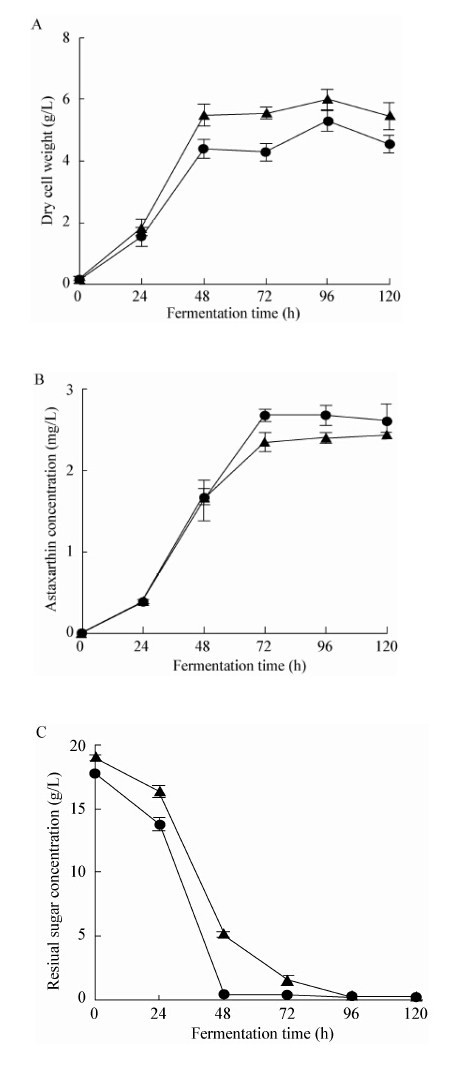
2.3 分批发酵培养条件下法夫酵母代谢通量分析在以20 g/L葡萄糖和2 g/L乳酸钠、18 g/L葡萄糖混合液作为碳源的两组摇瓶培养基中,分别以相同的接种量接入法夫酵母JMU-VDL668菌株进行培养,每隔24 h从两组摇瓶中各取3个平行,测定法夫酵母JMU-VDL668菌株生物量、虾青素产量、发酵液残糖含量的变化。其中添加乳酸钠和对照组的生物量和虾青素产量的变化情况如图6 所示。
对照图6得到的法夫酵母发酵曲线,分别在12−14 h和72−74 h两个时间段取样进行分析,测定的发酵参数见表4。
|
| 图 6 法夫酵母分批发酵曲线 Figure 6 The time course of Phaffia rhodozyma in batch culture Note: -▲-: contrast; -●-: add sodium lactate. |
| 发酵时间 Fermentation time | X(g/L) | Μ (mmol/ (g DCW·h)) | qAstaxanthin (mmol/ (g DCW·h)) | qGlucose (mmol/ (g DCW·h)) | qPyruvate (mmol/ (g DCW·h)) | qLactate (mmol/ (g DCW·h)) | qCO2 (mmol/ (g DCW·h)) | |
| 12−14 h | Contrast | 0.486 4 | 0.127 6 | 7.0×10−5 | 3.950 3 | 0.026 8 | 0.000 0 | 12.482 9 |
| Add sodium lactate | 0.458 7 | 0.137 2 | 1.1×10−4 | 6.712 4 | 0.119 6 | 6.851 2 | 37.450 3 | |
| 72−74 h | Contrast | 3.884 7 | 0.018 0 | 1.8×10−6 | 0.019 8 | 0.000 0 | 0.000 0 | 12.482 9 |
| Add sodium lactate | 2.943 3 | 0.006 1 | 1.3×10−6 | 0.012 5 | 0.000 0 | 0.000 0 | 17.450 3 | |
Note:X:Dry cell weight;q:The material specific growth rate.
由表4可知,乳酸钠的添加提高了法夫酵母对葡萄糖的消耗速率,发酵过程中添加乳酸钠的实验组比对照组发酵液pH下降更快,Hu等[20]研究表明,低pH更有利于虾青素的积累。可能由于发酵pH值能改变菌体细胞原生质膜的电荷,同时还会对菌体胞内酶活和菌体对底物的利用率造成一定的影响,从而影响了菌体的生长代谢和产物合成。而在发酵后期(72−74 h),添加乳酸钠的实验组发酵液pH为3.5,此时生物量合成缓慢,葡萄糖的消耗主要用于虾青素的合成,乳酸钠的加入提高了丙酮酸和乙酰CoA的通量,加快了虾青素的合成,从而消耗更多的葡萄糖。实验组中加入2 g/L乳酸钠,发酵至48 h基本消耗完。由图6B可知,发酵至48 h以后,实验组虾青素产量与对照组相比明显提高,乳酸钠的加入促进了虾青素的合成。
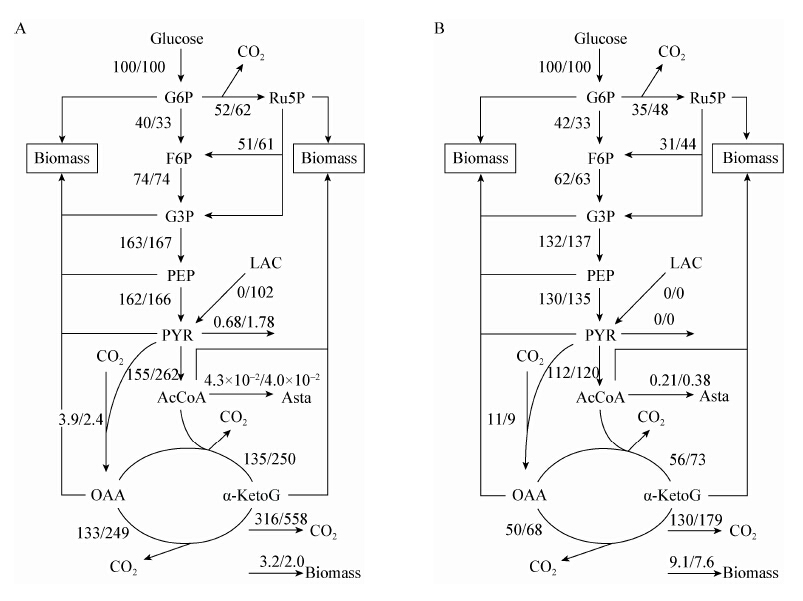
根据上述建立的法夫酵母生物合成虾青素的代谢网络,进行代谢通量分布计算,并以葡萄糖的消耗速率为100,对通量分布图进行归一化,得到图7。法夫酵母代谢网络中图7A数据来自对照组通量值,图7B数据为培养基中添加乳酸钠的实验组通量值。
|
| 图 7 分批发酵的代谢通量分布图 Figure 7 Metabolic flux distribution in batch culture Note: A: 12−14 h; B: 72−75h. |
发酵12−14 h阶段,在乳酸钠的作用下,细胞比生长速率为0.137 2,略高于对照组,但此时葡萄糖的消耗速率低于对照组。在培养基中加入乳酸钠后,法夫酵母细胞中的EMP途径减弱,而PP途径和TCA循环的通量均大于对照组。这可能是因为在乳酸脱氢酶的作用下,乳酸被转化为丙酮酸进入代谢网络,而丙酮酸作为丙酮酸激酶的别构抑制剂,当丙酮酸节点处的通量突然增大时,EMP途径受其反馈抑制。由于发酵初期细胞合成旺盛,对EMP途径中的各种中间代谢物需求较大,当EMP途径被抑制时,细胞生长将会受到限制。从图7A可以看出,在加入乳酸钠后,流向细胞合成的通量均明显低于对照组,合成细胞物质的通量仅占葡萄糖分解通量的2.0%。与对照组相比,添加乳酸钠后,随着丙酮酸节点处的通量突然增大,乙酰辅酶A的通量也随之增大,随之进入TCA循环转化为CO2。添加乳酸钠对虾青素合成途径的通量影响较小,与对照组相比并没有显著的变化。
与发酵12−14 h阶段相比,72−74 h阶段对葡萄糖的消耗非常少,此时培养基中的葡萄糖和乳酸钠都基本消耗完,从通量分布来看,在发酵初期加入的乳酸钠可能逐渐改变了法夫酵母代谢网络中某些节点的酶活力,因此虾青素合成支路的通量大于对照组。但由于此时培养基中匮乏碳源,虾青素的合成速率反而低于对照。而受到EMP途径的弱化,实验组中细胞物质的合成依然低于对照。
在发酵过程添加乳酸钠,减弱了对代谢网络上游的需求,在一定程度上抑制了EMP途径的代谢通量,并可以直接增强代谢网络的下游通量,使进入乙酰辅酶A节点继而进入TCA循环的通量增加。
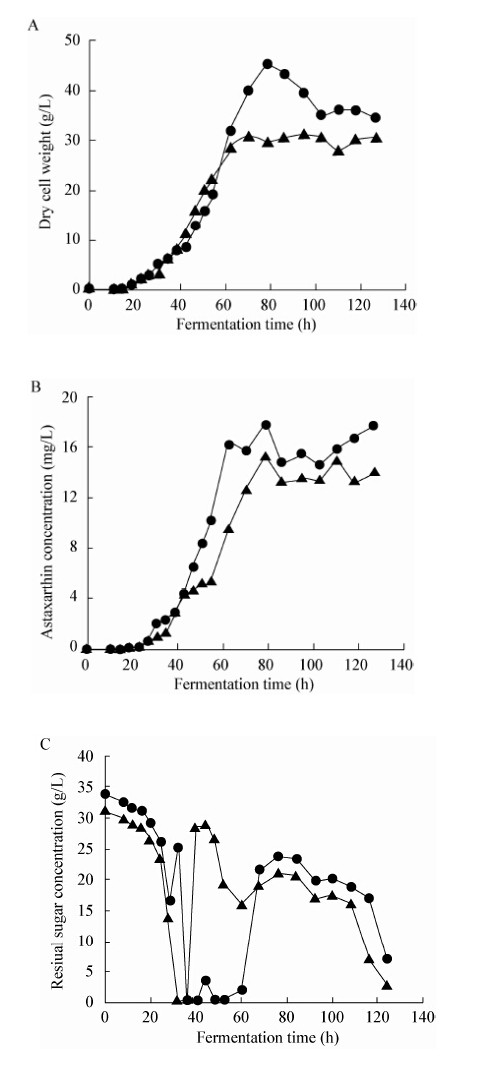
2.4 分批补料发酵培养条件下法夫酵母代谢通量分析在对分批发酵实验进行通量分析发现,在法夫酵母发酵前期(12−14 h),细胞内与菌体生长相关的各种酶的活性都比较高,而乳酸钠可以被迅速转化为丙酮酸进入代谢网络,由于丙酮酸对EMP途径产生了反馈抑制,限制了菌体生长所需的各种中间代谢物的供给,从而导致细胞合成的速率降低。由于虾青素的合成与细胞生长属于部分偶联的关系,此时胞内的虾青素合成作用还比较弱,细胞浓度也较低,因此碳代谢流进入TCA循环的通量虽然较多,产生的能量却可能有很大比例是以热能的形式损失了。而在分批发酵过程中,前期对葡萄糖的消耗过大也会导致发酵中后期碳源不足。因此,对发酵方式进行改变,当法夫酵母进入指数期积累了较高浓度的菌体以后,在虾青素开始积累的阶段加入乳酸钠,促进细胞为虾青素的合成提供更多的前体物质和能量。因此,采用7 L发酵罐进行下一步的实验,以30 g/L葡萄糖为初始碳源进行发酵,培养24 h后,加入适量乳酸钠,并且通过流加含有3%乳酸钠的葡萄糖溶液进行分批补料培养。分批补料发酵曲线如图8所示。
|
| 图 8 法夫酵母分批补料发酵曲线 Figure 8 The time course of Phaffia rhodozyma in fed-batch culture Note: -▲-: contrast; -●-: add sodium lactate. |
选取28−32 h、60−68 h以及84−92 h,分别对以葡萄糖为碳源的对照组和在培养基中加入乳酸钠的实验组取样,测定相关发酵参数,配合发酵过程中的补料情况,计算葡萄糖的消耗速率、乳酸钠和丙酮酸的消耗或分泌速率、细胞的比生成速率、虾青素合成比速率等数据,结果见表5。
| 发酵时间Fermentation time | X (g/L) | μ (mmol/ (g DCW·h)) | qAstaxanthin (mmol/ (g DCW·h)) | qGlucose (mmol/ (g DCW·h)) | qPyruvate (mmol/ (g DCW·h)) | qLactate (mmol/ (g DCW·h)) | qCO2(mmol/ (g DCW·h)) | |
| 28−32 h | Contrast | 6.9333 | 0.1298 | 5.9×10−6 | 2.7148 | 0.0957 | 0.0000 | 7.7086 |
| Add sodium lactate | 6.1333 | 0.0353 | 1.8×10−5 | 2.5196 | 0.0652 | 0.2163 | 9.8260 | |
| 60−68 h | Contrast | 28.4667 | 0.0152 | 2.5×10−6 | 2.4977 | −0.0181 | 0.0000 | 10.0395 |
| Add sodium lactate | 39.9333 | 0.0253 | 1.7×10−5 | 5.3142 | 0.0047 | 0.2511 | 22.1574 | |
| 84−92 h | Contrast | 31.2667 | 0.0024 | 3.8×10−6 | 0.7080 | 0.0083 | 0.0000 | 2.8775 |
| Add sodium lactate | 39.5333 | 0.0000 | 1.2×10−6 | 0.2238 | −0.0043 | 0.2194 | 1.3932 | |
Note:X:Dry cell weight; μ:Specific growth rate;q:The material specific growth rate.
根据表5得到的反应数据,分别计算28−32 h、60−68 h以及84−92 h 3个时间段的代谢通量分布,如图9所示。法夫酵母代谢网络中图9A的数据来自对照组通量值,图9B为培养基中添加乳酸钠的实验组通量值。
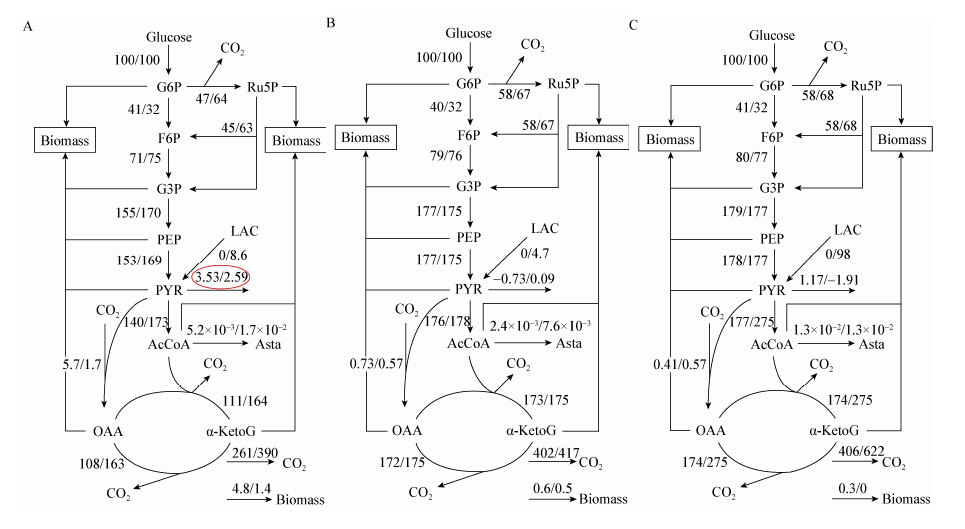
|
| 图 9 分批补料发酵的代谢通量分布图 Figure 9 Metabolic flux distribution in fed-batch culture Note: A: 28−32 h; B: 60−68 h; C: 84−92 h. |
从图9A可以看出,添加乳酸钠后,各中间产物流向细胞合成的速率均明显低于对照组,合成细胞物质的通量仅占葡萄糖分解通量的1.4%,不及对照组的1/3,且通过EMP途径、PP途径和TCA循环的通量均大于对照组。在乳酸脱氢酶的作用下,乳酸被转化为丙酮酸进入代谢网络。有报道称,在此节点处,由于丙酮酸脱氢酶的效率较低,会有部分丙酮酸无法被及时分解,被细胞分泌至发酵液中,但在图9A中,可以看到,随着乳酸钠的加入,丙酮酸的分泌通量由3.53降低至2.59,降幅达到36.3%,丙酮酸在代谢网络中进入下一级通量增大,这表明丙酮酸脱氢酶的活性有所增强,推测这可能是由于环境中的乳酸诱导细胞内开始合成代谢乳酸的相关酶系,从而在一定程度上增强了丙酮酸脱氢酶的活性。
随着丙酮酸节点的通量增大,流向乙酰辅酶A的通量也得到了加强。作为虾青素合成的重要前体物质,乙酰辅酶A的通量越大,越有利于虾青素的合成。由图9A可知,在乳酸钠的作用下,实验组中虾青素合成途径的通量达到对照组的264%。由图9B和图9C可以看出,与对照组相比,法夫酵母代谢网络中进入TCA循环的通量进一步增加,这主要是由于虾青素的合成需要大量能量,而TCA循环可以提供足够的能量。
比较图9B代谢网络的通量变化,加入乳酸钠后同样抑制了EMP途径的通量,而增加了HMP途径的通量。细胞物质合成减少的结果,提供了更多的前体物质和能量供给虾青素合成。进入稳定期后,细胞基本不再生长,比较84−92 h时间段对照组与实验组的代谢通量变化,可发现对照组中仅有0.3%左右的碳物质流向细胞物质,其绝大多数碳通量都向下经过丙酮酸流入TCA循环产能。而在实验组中,细胞中的碳物质同样以流入TCA循环为主,与之前时间段相比,此阶段对乳酸的利用比速率变化不大,但乳酸代谢生成丙酮酸的通量增加了一个数量级,同时,乳酸经过脱氢酶的作用进入代谢网络的下游,令合成乙酰辅酶A的通量增加了将近一半。在乙酰辅酶A至虾青素的反应途径中,对照组和实验组的通量值基本相等。
在法夫酵母产虾青素的代谢通量网络中,有两个相当关键的节点,即丙酮酸和乙酰辅酶A。乳酸钠通过乳酸脱氢酶的作用进入代谢网络,有利于增强丙酮酸在丙酮酸脱氢酶系的作用下经氧化脱羧反应形成乙酰辅酶A的通量。并且乳酸钠游离于发酵液中而不是积累于细胞内,因此不容易出现丙酮酸过度转化大量积累,丙酮酸脱氢酶系活性偏小导致丙酮酸被分泌至胞外的情况。
3 结论在7 L发酵罐和摇瓶发酵水平上,通过代谢通量的方法,分析了乳酸钠对法夫酵母JMU-VDL668发酵过程中细胞生长和虾青素合成的影响。实验结果表明,乳酸钠促进法夫酵母JMU-VDL668生产虾青素的机理为:乳酸钠在乳酸脱氢酶的作用下直接进入代谢网络的中部,绕开了上游的PP途径和EMP途径,并直接增强代谢网络的下游通量,使进入乙酰辅酶A节点继而进入TCA循环的通量增加。由于提供了更多的乙酰辅酶A等前体物质和能量供给,因此促进了虾青素的合成。
| [1] | Sandmann G. Carotenoid biosynthesis and biotechnological application[J]. Archives of Biochemistry and Biophysics, 2001, 385(1): 4-12 |
| [2] | Andrewes AG, Phaff HJ, Starr MP. Carotenoids of Phaffia rhodozyma, a red-pigmented fermenting yeast[J]. Phytochemistry, 1976, 15(6): 1003-1007 |
| [3] | Wang X, Willen R, Wadstrom T. Astaxanthin-rich algal meal and vitamin C inhibit Helicobacter pylori infection in BALB/cA mice[J]. Antimicrobial Agents and Chemotherapy, 2000, 44(9): 2452-2457 |
| [4] | Chan KC, Pen PJ, Yin MC. Anticoagulatory and antiinflammatory effects of astaxanthin in diabetic rats[J]. Journal of Food Science, 2012, 77(2): 76-80 |
| [5] | Naito Y, Uchiyama K, Aoi W. Prevention of diabetic nephropathy by treatment with astaxanthin in diabetic db/db mice[J]. Biofactors, 2004, 20(1): 49-59 |
| [6] | Yamashita E. Astaxanthin as a medical food[J]. Functional Foods in Health and Disease, 2013, 3(7): 254-258 |
| [7] | Dhankhar J, Kadian SS, Sharma A. Astaxanthin: a potential carotenoid[J]. International Journal of Pharmaceutical Sciences and Research, 2012, 3: 1246-1259 |
| [8] | Xiao AF, Hong QL, Cai HN, et al. Effects of assembly adding metabolic regulation agents on cell growth and astaxanthin prouction of Phaffia Rhodozyma[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(10): 57-65(in Chinese)肖安风,洪清林,蔡慧农,等.代谢调控剂对法夫酵母产虾青素组合的调控效果[J].中国食品学报, 2013, 13(10): 57-65 |
| [9] | Meyer P, Preez DU. Effect of acetic acid on astaxanthin production by Phaffia rhodozyma[J]. Biotechnology Letters, 1993, 15(9): 919-924 |
| [10] | Johnson EA, Lewis MJ. Astaxanthin formation by the yeast Phaffia rhodozyma[J]. Journal of General Microbiogogy, 1979, 115: 173-183 |
| [11] | Gu WL, An GH, Johnson EA. Ethanol increases carotenoid production in Phaffia rhodozyma[J]. Journal of Industrial Microbiology & Biotechnology, 1997, 19(2): 114-117 |
| [12] | Yamane Y, Higashida K, Nakashimada Y, et al. Astaxanthin production by Phaffia rhodozyma enhanced in fed-batch culture with glucose and ethanol feeding[J]. Biotechnology Letters, 1997, 19(11): 1109-1111 |
| [13] | Flores-Cotera LB, Martín R, Sánchez S. Citrate, a possible precurs or of astaxanthin in Phaffia rhodozyma: influence of varying levels of ammonium, phosphate and citrate in a chemically defined medium[J]. Applied Microbiology and Biotechnology, 2001, 55(3): 341-347 |
| [14] | Lin SL, Ni H, Xiao AF, et al. Effect of sodium lactate on production of astaxanthin of Phaffia rhodozyma[J]. Food and Fermentation Industries, 2010, 36(8): 106-111(in Chinese)林舒乐,倪辉,肖安风,等.乳酸钠对法夫酵母产虾青素的影响[J].食品与发酵工业, 2010, 36(8): 106-111 |
| [15] | Gregory NS, Aristos AA, Jens N. Metabolic engineering- Principles and methodologies[M]. Translated by Zhao XM, Bai DM, er al. Beijing: Chemical industry press, 2003(in Chinese)格雷戈里NS,阿里斯顿AA,延斯N.代谢工程--原理与方法[M].赵学明,白冬梅,等译.北京:化学工业出版社, 2003 |
| [16] | Wang JL, Nie GX, Li SZ, et al. Optimal wavelength for determining the content of reducing sugar by DNS method[J]. Journal of Henan Agricultural Sciences, 2010, 4(4): 115-118(in Chinese)王俊丽,聂国兴,李素贞,等. DNS法测定还原糖含量时最适波长的确定[J].河南农业科学, 2010, 4(4): 115-118 |
| [17] | Zhang LX, Zhang TF, Li LY, et al. Biochemistry experiment method and technology[M]. 2nd edition. Beijing: Higher education press, 1997, 1-3(in Chinese)张龙翔,张庭芳,李令嫒,等.生化实验方法和技术[M].第2版.北京:高等教育出版社, 1997, 1-3 |
| [18] | An GH, Cho MH, Johnson EA. Monocyclic carotenoid biosynthetic pathway in the yeast Phaffia rhodozyma (Xanthophyllomyces dendrorhous)[J]. Journal of Bioscience and Bioengineering, 1999, 88: 189-193 |
| [19] | Sun NX, Dong QL, Zhao XM. Breeding of astaxanthin-overproducing mutants of affia rhodozyma and metabolic flux analysis[J]. Chinese Journal of Bioprocess Engineering, 2006, 2(4): 54-60(in Chinese)孙乃霞,董庆霖,赵学明.高产虾青素法夫酵母的选育及代谢通量分析[J].生物加工过程, 2006, 2(4): 54-60 |
| [20] | Hu ZC, Zheng YG, Wang Z, et al. pH control strategy in astaxanthin fermentation bioprocess by Xanthophyllomyces dendrorhous[J]. Enzyme and microbial technology, 2006, 39(4): 586-590 |
 2015, Vol. 42
2015, Vol. 42




