扩展功能
文章信息
- 江艳华, 李风铃, 王联珠, 翟毓秀, 姚琳
- JIANG Yan-Hua, LI Feng-Ling, WANG Lian-Zhu, ZHAI Yu-Xiu, YAO Lin
- 一株沙门氏菌裂解性噬菌体的分离鉴定及生物学特性
- Isolation, identification and biological properties of a lytic phage against Salmonella
- 微生物学通报, 2015, 42(3): 534-542
- Microbiology China, 2015, 42(3): 534-542
- 10.13344/j.microbiol.china.140549
-
文章历史
- 收稿日期: 2014-06-17
- 接受日期: 2014-08-15
- 优先数字出版日期(www.cnki.net): 2014-08-19
沙门氏菌(Salmonella)是一类寄生于人类和动物肠道内、生化反应和抗原构造相似的革兰氏阴性杆菌,至今已发现该属细菌有2 000多种血清型。部分沙门氏菌如鼠伤寒沙门氏菌、肠沙门氏菌肠亚种(又称为猪霍乱沙门氏菌)、肠炎沙门氏菌等是重要的人畜共患病原菌,能引起人类食物中毒,导致肠胃炎,出现恶心、呕吐、腹泻、腹痛、发热等症状。沙门氏菌在环境中广泛存在,家禽、蛋、肉类、水产等是沙门氏菌的主要传播媒介,无论在发达国家还是发展中国家,由沙门氏菌引起的食源性疾病报道频繁。据美国疾病预防控制中心报道,美国平均每年有42 000例因感染沙门氏菌中毒的病例[1]。而在中国,由沙门氏菌引起的微生物暴发事件仅次于副溶血性弧菌,位居第二,但导致的发病人数 最多[2]。
噬菌体(Bacteriophage)作为细菌的一种病毒,能够专一性地裂解目标菌。将噬菌体用于致病菌的控制早在噬菌体被发现不久后就开始被提出和应 用[3],最近十几年其应用才扩展到食品安全领域。研究表明,噬菌体对动物和人体是安全的[4, 5]。噬菌体在临床或食品加工过程致病菌的控制方面具有优于抗生素及其他化学保鲜剂的良好应用前景。随着沙门氏菌感染事件的不断增加,对沙门氏菌的控制技术也成为当前的研究热点。噬菌体具有特异性、高效性、安全性及成本低廉等特点,可用于沙门氏菌的抑制和消除。本实验室从贝类样品中筛选到一株裂解性沙门氏菌噬菌体,能裂解肠沙门氏菌肠亚种和鼠伤寒沙门氏菌,对其生物学特性进行分析,为进一步的应用研究奠定基础。
1 材料与方法 1.1 菌株宿主菌为沙门氏菌(Salmonella enterica subsp. enterica) 1.1859,购自中国普通微生物菌种保藏管理中心(CGMCC)。其他标准菌株见表1,分别购自CGMCC、中国工业微生物菌种保藏管理中心(CICC)、美国典型微生物菌种保藏中心(ATCC)和中国医学微生物菌种保藏管理中心(CMCC)。所有涉及以上宿主菌的相关实验均在生物安全二级实验室中进行。
1.2 培养基与试剂营养肉汤(NB)、营养琼脂(NA)固体培养基,为北京陆桥生物技术有限公司生产;营养琼脂半固体培养基,为NB中添加0.75%琼脂配制而成。
SM缓冲液:氯化钠5.8 g,硫酸镁2.0 g,1 mol/L Tris-HCl (pH 7.5) 50 mL,2%明胶5 mL,加水至1 L,1×105 Pa高压灭菌20 min,4 °C保存。
1.3 噬菌体的分离纯化采用双层平板法进行噬菌体的分离纯化。将活化好的宿主菌接种于NB培养基中,36 °C振荡培养约4 h至对数生长早期。从青岛农贸市场采集贝类样品,匀浆后取10 g样品加入90 mL NB培养基中,同时加入5 mL宿主菌悬液,36 °C培养过夜,将培养液离心,收集上清液过0.22 µm的微孔滤膜,即得到噬菌体原液。
用SM缓冲液对噬菌体原液进行适当稀释,取适宜稀释度各100 µL与200 µL培养至对数生长期的宿主菌混合,加入5 mL NA半固体琼脂培养基,混匀后倒入预先制备好的NA固体琼脂平板上,待凝固后36 °C培养。观察平板上噬菌斑情况,挑取直径大、生长均匀的单斑于SM缓冲液中,适当稀释后按以上分离操作进行纯化,重复4次后即得到纯化的噬菌体,命名为SLMP1。
1.4 噬菌体的宿主范围测定取200 µL培养至对数早期的标准菌株加入营养琼脂半固体培养基中,混匀后倒入预先制备好的NA固体琼脂平板上,待凝固且表面干燥后,取 20 µL增殖至约109 PFU/mL的噬菌体SLMP1滴加至平板表面,待菌液吸收后置36 °C培养过夜,观察噬菌体对标准菌株的裂解情况。
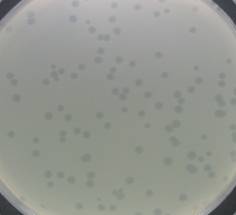
1.5 噬菌体的分类鉴定 1.5.1 噬菌体颗粒的浓缩:参考萨姆布鲁克《分子克隆实验指南》第3版的提取方法[6]。以最佳感染复数加入噬菌体液,培养至细菌完全裂解。加DNase I和RNase A至终浓度为l mg/L,室温温育30 min。按5.84 g/100 mL加入NaCl (终浓度为1 mol/L),搅拌使其溶解,冰浴1 h。4 °C、8 000 r/min离心15 min去除残留的细菌碎片,收集上清,量取上清体积,加入固体聚乙二醇(PEG 8000)至10% (质量体积比),慢慢搅拌溶解,冰浴1 h以上,使噬菌体沉淀。4 °C、8 000 r/min离心30 min,弃尽上清,水分晾干后将沉淀悬于4 mL SM溶液中。加入等体积的氯仿抽提噬菌体悬浮液中的PEG8000和细胞碎片,温和振荡30 s,4 °C、5 000×g离心15 min以分离有机相和亲水相,回收含噬菌体颗粒的亲水相。采用CsCl平衡梯度等密度离心,收集纯化的噬菌体颗粒透析后备用。 1.5.2 噬菌体的电镜观察:取铜网浸入纯化噬菌体悬液中,待其作用5 min,用滤纸吸去多余的液体,用2%的磷钨酸染色5 min,自然干燥后采用透射电镜(JEM-1200EX,日本JEOL公司)在100 kv下 观察。 1.5.3 噬菌体核酸的提取及鉴定:参考萨姆布鲁克《分子克隆实验指南》第3版的提取方法[6]。在纯化的噬菌体颗粒中加入DNase I至终浓度为 10 mg/L,RNase A至终浓度为5 mg/L,37 °C温育1 h,以降解残留的宿主菌来源的DNA及RNA。加入EDTA (p H 8.0)至终浓度20 mol/L,灭活DNase I。加蛋白酶K至终浓度50 mg/L,SDS至终浓度0.5%,混匀,56 °C温育1 h,然后冷却至室温。用等量平衡酚抽提,离心收集水相,用等量平衡酚: 氯仿: 异戊醇(25:24:1,体积比)抽提1次,收集水相,再用氯仿:异戊醇(24:1,体积比)抽提1次,取上层水相用2倍体积的无水乙醇沉淀噬菌体核酸,再用70% 乙醇洗涤沉淀2次。用TE溶解核酸沉淀,−20 °C保存备用。核酸用DNaseⅠ、RNase A、Mung Bean Nuclease以及Hind Ⅲ和Sal Ⅰ核酸内切酶进行常规消化,消化产物于0.8%琼脂糖凝胶电泳进行鉴定。 1.6 噬菌体的生物学特性分析 1.6.1 热稳定性实验:取效价约108 PFU/mL的噬菌体液1.0 mL于无菌EP管中,分别于30、40、50、60、70、80 °C的水浴中作用1 h,待作用时间结束后取出并立即置于冰浴中冷却,经过适当稀释后测定噬菌体的效价。对于效价变化较快的温度,测定该温度下每作用10 min后噬菌体的效价。 1.6.2 pH稳定性实验:取效价约109 PFU/mL的噬菌体液0.1 mL于无菌EP管中,分别加入0.9 mL pH不同的液体培养基,36 °C水浴作用1 h,取出后进行适当稀释,测定噬菌体的效价。 1.6.3 最佳感染复数(Multiplicity of infection,MOI)的测定:MOI是指初始感染时加入噬菌体的数量与宿主菌数量的比值,也称感染倍数。参考张琳等[7]的方法,将宿主菌培养至对数生长前期,调菌液麦氏浓度为0.5,相当于1×108 CFU/mL。按照感染复数分别为10、1、0.1、0.01、0.001、0.000 1的比例,加入噬菌体纯培养液和宿主菌,在36 °C摇床中 150 r/min培养3.5 h后,12 000 r/min离心10 min收集上清液,测定噬菌体的效价。以产生最高噬菌体效价的MOI为最佳感染复数。 1.6.4 一步生长曲线的测定:参考张琳等[7]的方法,将宿主菌培养至对数生长前期,加入噬菌体及宿主菌使MOI为10,混合后36 °C孵育15 min,然后12 000 r/min离心30 s,弃上清,用NB洗涤沉淀菌体2次,然后加入5 mL的36 °C预热NB悬浮沉淀并充分混匀,迅速置于36 °C振荡培养,同时开始计时,在0时刻和每隔10 min取样一次,12 000 r/min离心30 s,取上清测定噬菌体每一时间段的效价。以感染时间为横坐标,噬菌体的效价为纵坐标,绘制一步生长曲线。 1.6.5 裂菌实验:在NB中分别制备低浓度(约 100 CFU/mL)、中浓度(约1×104 CFU/mL)和高浓度(约1×108 CFU/mL)沙门氏菌菌悬液,加入1/10体积的噬菌体液至终浓度为1×108 PFU/mL,于4 °C放置8、24、48、72 h,36 °C放置1、2、4、6、8、24 h,分别取样涂布NA固体平板测定宿主菌数量的变化,以未添加噬菌体的各浓度宿主菌为对照。 2 结果与分析 2.1 沙门氏菌噬菌体的分离鉴定 2.1.1 噬菌体的分离及噬菌斑特征:将经过处理的贝类样品与沙门氏菌共培养后,分离到噬菌体SLMP1。SLMP1在双层平板上形成的噬菌斑明显,在36 °C培养至24 h后噬菌斑直径约2-3 mm,圆形,中间透明,边缘清晰,呈现出裂解性噬菌体的噬菌斑特征(图1)。
|
| 图1 噬菌体SLMP1的噬菌斑形态 Figure 1 Plaques of phage SLMP1 |
|
菌株名称 Name of strain |
菌株编号 Number of strain |
菌株来源 Source of strain |
裂解性 Lytic ability |
| 肠沙门氏菌肠亚种Salmonella enterica subsp. enterica | 1.1859 | CGMCC | ++++ |
| 肠沙门氏菌肠亚种Salmonella enterica subsp. enterica | 10467 | CICC | + |
| 鼠伤寒沙门氏菌Salmonella typhimurium | 10420 | CICC | ++ |
| 鼠伤寒沙门氏菌Salmonella typhimurium | 50115 | CMCC | ++++ |
| 肠炎沙门氏菌Salmonella enteritidis | 21482 | CICC | - |
| 甲型副伤寒沙门氏菌Salmonella paratyphi A | 21501 | CICC | - |
| 乙型副伤寒沙门氏菌Salmonella paratyphi B | 50094 | CMCC | - |
| 大肠埃希氏菌Escherichia coli | 25922 | ATCC | - |
| 21675 | CICC | - | |
| 大肠埃希氏菌O157 Escherichia coli O157 | 35150 | ATCC | - |
| 21530 | CICC | - | |
| 金黄色葡萄球菌Staphylococcus aureus | 25923 | ATCC | - |
| 1.1861 | CGMCC | - | |
| 单核细胞增生李斯特氏菌Listeria monocytogenes | 19116 | ATCC | - |
| 51772 | ATCC | - | |
| 痢疾志贺氏菌Shigella dysenteroae | 1.1869 | CGMCC | - |
| 福氏志贺氏菌Shigella flezneri | 1.1868 | CGMCC | - |
| 副溶血性弧菌Vibrio parahaemolyticus | 1.1615 | CGMCC | - |
| 1.1616 | CGMCC | - | |
| 1.1997 | CGMCC | - | |
| 注:++++:极强裂解性;++:弱裂解性;+:极弱裂解性;-:不裂解. Note: ++++: Very strong lytic ability; ++: Weak lytic ability; +: Very weak lytic ability; -: No lytic ability. | |||
|
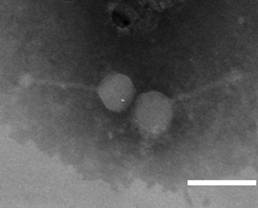
| 图2 噬菌体SLMP1的电镜照片 Figure 2 Electron micrograph of phage SLMP1 |
|
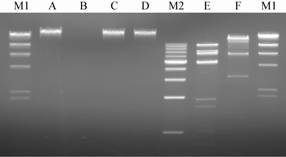
| 图3 噬菌体SLMP1的核酸类型 Figure 3 Nucleic acid type of phage SLMP1 M1:λ-Hind Ⅲ digest 分子量标准;A:噬菌体核酸;B:核酸经DNase I处理;C:核酸经RNase A处理;D:核酸经Mung Bean Nuclease处理;M2:1 kb DNA ladder分子量标准;E:核酸经Hind Ⅲ内切酶酶切;F:核酸经Sal I内切酶酶切. Note: M1: λ-Hind Ⅲ digest DNA marker; A: Nucleic acids of phage; B: Digestion of nucleic acids by DNase I; C: Digestion of nucleic acids by RNase A; D: Digestion of nucleic acids by Mung Bean Nuclease; M2: 1 kb DNA ladder; E: Digestion of nucleic acids by endonuclease Hind Ⅲ; F: Digestion of nucleic acids by endonuclease Sal I. |

|
| 图4 噬菌体SLMP1的热稳定性 Figure 4 Thermal stability of phage SLMP1 注:A:不同温度下作用1 h后噬菌体的效价;B:70 °C下噬菌体效价的变化情况. Note: A: Phage titer at different temperatures after 1 h; B: Change of phage titer at 70 °C. |

|
| 图5 噬菌体SLMP1的最适pH Figure 5 Optimal pH of phage SLMP1 |
| 序号 Number | 细菌数 Number of bacteria | 噬菌体数 Number of bacteriophages | 感染复数 MOI | 噬菌体效价 Phage titers (PFU/mL) |
| 1 | 108 | 109 | 10 | 1.1×1010±0.2×1010 |
| 2 | 108 | 108 | 1 | 1.7×1010±0.3×1010 |
| 3 | 108 | 107 | 0.1 | 3.2×1010±0.6×1010 |
| 4 | 108 | 106 | 0.01 | 3.2×1010±0.6×1010 |
| 5 | 108 | 105 | 0.001 | 5.3×1010±0.7×1010 |
| 6 | 108 | 104 | 0.000 1 | 4.5×1010±0.3×1010 |
|
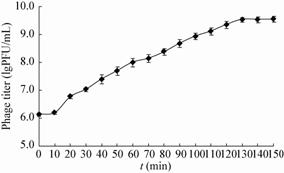
| 图6 噬菌体SLMP1的一步生长曲线 Figure 6 One-step growth curve of phage SLMP1 |
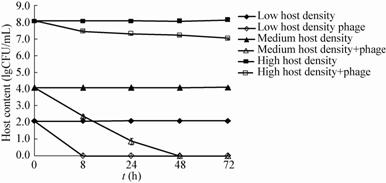
|
| 图7 噬菌体SLMP1在4 °C下的裂菌效果 Figure 7 Inactivation effects of phage SLMP1 on the growth of Salmonella at 4 °C |

|
| 图8 噬菌体SLMP1在36 °C下的裂菌效果 Figure 8 Inactivation effects of phage SLMP1 on the growth of Salmonella at 36 °C |
噬菌体在自然环境中广泛分布,据估计,噬菌体的丰度约为1031,为人类提供了一个丰富的资源库[9]。然而,迄今为止,已经被分离和利用的噬菌体十分有限。噬菌体分为温和性噬菌体和裂解性噬菌体,其中温和性噬菌体进入宿主细胞后,其核酸整合在宿主菌染色体上随之同步复制,不引起宿主细胞的裂解;而裂解性噬菌体能够引起宿主菌细胞的裂解而导致细菌死亡。因此,通常将裂解性噬菌体应用于致病菌的防控。本实验从贝类样品中分离到一株沙门氏菌裂解性噬菌体SLMP1,该噬菌体能裂解肠沙门氏菌肠亚种和鼠伤寒沙门氏菌,不能裂解其他种属细菌。虽然SLMP1只能裂解部分种类沙门氏菌,但由于肠沙门氏菌肠亚种和鼠伤寒沙门氏菌是沙门氏菌属中重要的人畜共患病原菌,对这两种致病菌具有杀灭作用,说明该噬菌体具有实际应用价值。
为了将噬菌体SLMP1用于沙门氏菌的防控,对该菌株进行了初步鉴定及生物学特性分析。噬菌体SLMP1头部呈二十面体立体结构,含非收缩性尾部,核酸为双链DNA,属于长尾病毒科,与已报道的沙门氏菌噬菌体大小有所不同[10, 11, 12, 13]。该噬菌体在60 °C以下稳定,pH为4.0−11.0时稳定,说明该噬菌体具有较宽的温度和酸碱度适用范围,比李萌等报道的[11]沙门氏菌噬菌体(50 °C以下稳定,pH 5.0−10.0维持较高活性)、Ahiwale等[13]报道的乙型副伤寒沙门氏菌噬菌体(50 °C以下、pH 4.0−9.0稳定)适用范围更广。SLMP1最佳感染复数为0.001,潜伏期短,为10 min,能实现噬菌体对宿主菌的快速感染及裂解;对宿主菌裂解量为51,高于包红朵等[10]报道的肠炎沙门氏菌噬菌体裂解量(22)和李萌等[11]报道的沙门氏菌噬菌体裂解量(20)。
利用噬菌体控制沙门氏菌已有报道,这些研究结果显示噬菌体可降低禽畜类及其他食品中沙门氏菌的数量[14, 15]。Bigwood等[14]用沙门氏菌人工污染生的和熟的牛肉,然后将噬菌体P7接种于污染的牛肉上,分别于5 °C和24 °C下培养24 h后,沙门氏菌均有一定程度的减少,感染复数越高,细菌的减少量越多。Spricigo等[15]报道的3种沙门氏菌噬菌体混合物可以降低猪皮、鸡胸肉、鸡蛋 和包装生菜中鼠伤寒沙门氏菌和肠炎沙门氏菌的数量。为将噬菌体SLMP1应用于食品中沙门氏菌的防控奠定基础,本论文初步探讨了SLMP1在液体培养基中的裂菌作用。结果显示,宿主菌在低温条件下,噬菌体能够逐渐降低宿主菌的数量;而在较高的培养温度下,在一定的培养时间内(2 h),噬菌体能降低宿主菌的数量,之后可能由于残留的宿主菌繁殖速度比噬菌体的裂解速度快,导致数量逐渐升高,但均低于对照组。实验结果表明,宿主菌浓度越低或MOI值越高,裂菌效果越好,这也与Bigwood等[14]的结论一致;当宿主菌在受到抑制的条件下,裂菌效果较好,提示该噬菌体在应用时可以通过调节温度或与其他抑菌剂结合使用,从而达到最佳的杀菌效果。以上结果表明,SLMP1是一株具有良好应用前景的菌株,可以作为一种生物抑菌剂用于沙门氏菌的防控。
| [1] | CDC. How common is Salmonellosis[N/OL]. http://www. cdc.gov/salmonella/general/index.html, 2014 |
| [2] | Mao XD, Hu JF, Liu XM. Estimation on disease burden of foodborne non-typhoid salmonellosis in China using literaturereview method[J]. Chinese Journal of Disease Control and Prevention, 2011, 15(7): 622-625 (in Chinese)毛雪丹, 胡俊峰, 刘秀梅. 用文献综述法估计我国食源性非伤寒沙门氏菌疾病负担[J]. 中华疾病控制杂志, 2011, 15(7): 622-625 |
| [3] | Summers WC. Cholera and plague in India: the bacteriophage inquiry of 1927-1936[J]. Journal of the History of Medicine and Allied Sciences, 1993, 48(3): 275-301 |
| [4] | Carlton RM, Noordman WH, Biswas B, et al. Bacteriophage P100 for control of Listeria monocytogenes in foods: genome sequence, bioinformatic analysis, oral toxicity study, and application[J]. Regulatory Toxicology and Pharmacology, 2005, 43(3): 301-312 |
| [5] | Bruttin A, Brüssow H. Human volunteers receiving Escherichia coli phage T4 orally: a safety test of phage therapy[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(7): 2874-2878 |
| [6] | Sambrook J, Russell DW. Molecular cloning: A Laboratory Manual[M]. Translated by Huang PT, et al. 3rd Edition. Beijing: Science Press, 2002: 185-197萨姆布鲁克J, 拉塞尔DW. 分子克隆实验指南[M]. 黄培堂, 等译. 第3版. 北京: 科学出版社, 2002: 185-197 |
| [7] | Zhang L, Le S, Lu SG, et al. Isolation and identification a novel Pseudomonas aeruginosa phage PaP4[J]. Microbiology China, 2013, 40(4): 609-616 (in Chinese)张琳, 乐率, 卢曙光, 等. 铜绿假单胞菌噬菌体PaP4的分离与鉴定[J]. 微生物学通报, 2013, 40(4): 609-616 |
| [8] | Feng SZ, Liu J, Sun Y. New classification and nomenclature of bacterial virus—phage[J]. Chinese Journal of Veterinary Science, 2007, 27(4): 604-608 (in Chinese)冯书章, 刘军, 孙洋. 细菌的病毒——噬菌体最新分类与命名[J]. 中国兽医学报, 2007, 27(4): 604-608 |
| [9] | Wommack KE, Colwell RR. Virioplankton: viruses in aquatic ecosystems[J]. Microbiology and Molecular Biology Reviews, 2000, 64(1): 69-114 |
| [10] | Bao HD, Zhang H, Wang R. Biological properties of a Salmonella enteritidis lytic phage with wide host range[J].Jiangsu Journal of Agricultural Sciences, 2011, 27(5): 1117-1121 (in Chinese)包红朵, 张辉, 王冉. 宽噬菌谱肠炎沙门氏菌噬菌体的生物学特性[J]. 江苏农业学报, 2011, 27(5): 1117-1121 |
| [11] | Li M, Han F, Lin H, et al. Isolation, identification and physiological characterization of lytic phage against bacterium Salmonella sp.[J]. Fisheries Science, 2013, 32(9): 531-535李萌, 韩峰, 林洪, 等. 一株沙门氏菌烈性噬菌体的分离纯化与生理特性研究[J]. 水产科学, 2013, 32(9): 531-535 |
| [12] | Zou SS, Xu JY, Weng YB, et al. Isolation and biological characteristics of a phage against Salmonella enteritidis from sawage water[J]. China Animal Husbandry and Veterinary Medicine, 2014, 41(3): 119-123 (in Chinese)邹尚书, 许家园, 翁亚彪, 等. 1株肠炎沙门氏菌噬菌体的污水分离及生物学特性研究[J]. 中国畜牧兽医, 2014, 41(3): 119-123 |
| [13] | Ahiwale SS, Bankar AV, Tagunde SN, et al. Isolation and characterization of a rare waterborne lytic phage of Salmonella enteric serovar Paratyphi B[J]. Canadian Journal of Microbiology, 2013, 59(5): 318-323 |
| [14] | Bigwood T, Hudson JA, Billington C, et al. Phage inactivation of foodborne pathogens on cooked and raw meat[J]. Food Microbiology, 2008, 25(2): 400-406 |
| [15] | Spricigo DA, Bardina C, Cprtés P, et al. Use of a bacteriophage cocktail to control Salmonella in food and the food industry[J]. International Journal of Food Microbiology, 2013, 165: 169-174 |
 2015, Vol. 42
2015, Vol. 42




