扩展功能
文章信息
- 孙秀娇, 朱素芹, 张彩丽, 曾名湧
- 凡纳滨对虾源不动杆菌群体感应信号分子分离鉴定及其调控
- Isolation,identification and regulation of quorum sensing signal molecules of Acinetobacter in Litopenaeus vannamei
- 微生物学通报, 2015, 42(2): 437-443
- Microbiology China, 2015, 42(2): 437-443
- 10.13344/j.microbiol.china.140490
-
文章历史
- 收稿日期: 2014-06-18
- 接受日期: 2014-07-29
- 优先数字出版日期(www.cnki.net): 2014-07-30
群体感应(quorum sensing,QS)[1]是细菌利用信号分子进行信息交流的一种方式。当细菌感受到自身或周围菌体密度变化或当环境条件发生改变时,细菌分泌一种被称为自体诱导物(Autoinducers,AIs)的信号分子到胞外。当信号分子达到一定阈值后,被特定受体识别,启动细菌目的基因的表达,进而调控细菌的群体行为[2]。目前的研究表明,革兰氏阴性菌主要以不同长度酰基侧链的高丝氨酸内酯(N-acyl homoserine lactone,AHLs)作为信号分子[3]。革兰氏阳性菌则采用被修饰过的寡肽类(autoinducing peptides,AIPs)为信号分子,由组氨酸激酶和应答调节蛋白构成的双组分传导系统[4]调控目的基因的表达[5]。除此之外,呋喃酰硼酸二酯类化合物(AI-2)是一种广泛存在于革兰氏阴性菌和革兰氏阳性菌中的信号分子,也有研究证明该物质为细菌代谢中三甲基循环中的副产物,目前对该种QS系统存有争议。QS作为细菌信息交流的一种方式,在调节细菌群体行为和生理功能方面发挥重要作用[6]。QS调控着细菌的生物发光[7]、生物膜的形成、Ti质粒的转化[8]、抗生素及色素的产生、毒力因子合成等性状[9]。
不动杆菌(Acinetobacter spp.)是一种不发酵、不能运动、氧化酶阴性的革兰氏阴性条件致病杆菌。不动杆菌广泛分布于在潮湿环境如水体和土壤中,能在人体皮肤表面存在。它可引起肺炎、皮肤和伤口感染、尿路感染,菌血症、脑膜炎和腹膜炎等疾病。不动杆菌在人群中感染率很高,仅次于金黄色葡萄球菌[10],有个别报道称不动杆菌的感染或已超过了铜绿假单胞菌[11]。目前已经有研究表明[12],不动杆菌生物膜的形成等致病性因素受群体感应调控,但是通过调控QS进而调控其致病性的研究并不多。所以研究不动杆菌QS系统及环境因素对其QS的调控对预防和控制由不动杆菌感染引起的相关疾病具有重要意义。
本实验以腐败凡纳滨对虾中分离出的一株有群体感应现象的不动杆菌作为研究对象,鉴定QS信号分子类型,并对其分泌AHLs的动力学以及环境因素(pH、NaCl浓度、温度)对该菌QS的调控进行了探究,为通过调控QS而整治不动杆菌致病性提供理论基础。
1 材料与方法 1.1 材料、菌株质粒和培养条件本实验使用的菌株质粒及相关特征如表 1所示。菌株以25%的甘油保存于−80 °C。在LB培养基中活化培养[13],培养条件为30 °C、160 r/min。根癌农杆菌(Agrobacterium tumefaciens A136)体系需加入50 mg/L壮观霉素(Sp)和4.5 mg/L四环素(Tc);紫色杆菌(Chromobacterium violaceum CV026)体系需加入20 mg/L卡那霉素(Km)。
|
菌株和质粒 Strains and plasmids |
特征 description |
来源 Source or references |
|
根癌农杆菌A136 (pCF218)(pCF372) Agrobacterium tumefaciens A136 (pCF218) (pCF372) |
含PtraI-lacZ融合基因,不含Ti质粒;不产生AHLs;C6-C14-HSL的生物感应器;抗Sp与Tc | 美国德克萨斯州立大学McLean教授惠赠 |
|
紫色杆菌CV026 Chromobacterium violaceum CV026 |
最小化Tn5突变株,不产生AHL;C4−C6-HSL的生物感应器;抗Km | 美国德克萨斯州立大学McLean教授惠赠 |
|
醋酸钙不动杆菌 Acinetobacter calcoaceticus |
分离于腐败凡纳滨对虾 | 实验室保存 |
壮观霉素、四环素、卡那霉素、AHLs标准品(C6-HSL、C8-HSL、N-3-oxo-C6-HSL、N-3-oxo-C8- HSL)等均购自Sigma公司(美国);X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)购自Solarbio公司;RP-C18 F254s反相薄层板购自Merck公司(德国)。
1.2 菌株M1的分离纯化及鉴定用平板划线法从腐败的虾中分离、纯化出具有群体感应现象的菌株M1。将M1过夜活化后,提取基因组DNA,−20 ºC保存备用。以菌株M1基因组DNA为模板,以27F (5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R (5′-ACGGCTACCTTGTTAC GACTT-3′)为引物。PCR扩增16S rRNA基因条件:95 ºC 5 min;95 ºC 30 s,56 ºC 30 s,72 ºC 1 min,30个循环;72 ºC 10 min。PCR产物在1.0%琼脂糖凝胶上进行电泳,结束后凝胶成像并观察结果。PCR扩增产物交由生工生物工程(上海)股份有限公司进行序列测定。
1.3 群体感应信号分子AHLs的检测1.3.1粗提液的制备:将待测菌株M1在LB液体培养基中30 °C、160 r/min振荡培养至一定的密度(OD600≈1.0),8 000 r/min离心5 min,取上清,用含0.5%甲酸的乙酸乙酯萃取3次,混合有机相旋蒸至干,溶于二甲亚砜,−20 °C保存备用。
1.3.2平板划线法检测AHLs:按照文献[14]的方法,M1分别与报告菌株CV026和A136在LB琼脂平板上平行划线,当用A136时,需涂布20 μL X-gal (20 g/L)。均以报告菌株本身作阴性对照,C6-HSL作阳性对照。30 °C培养过夜,观察颜色变化。
1.3.3 TLC-biosensor检测AHLs:根据文献[15]将AHLs提取物与信号分子标准品分别点样(2.5 μL)于C18反相薄层板上,以甲醇/水(3:2,体积比)为展开剂展开,无菌风吹干。将A136与含0.7%琼脂的LB混合均匀,低于42 °C铺于TLC板上,凝固。30 °C密闭容器中培养24−48 h,观察颜色变化。AHLs经薄层层析展开后,A136会在AHLs存在的区域水解X-gal呈现蓝色斑点。根据斑点Rf值以及形状,判断AHLs的类型。
1.4 生长动力学曲线测定及不同生长阶段AHLs分泌规律将菌株M1过夜活化12 h,按1:1 000比例接于LB液体培养基中,160 r/min、30 °C条件下振荡培养。每6 h取菌液100 mL,测OD600值并按照1.3.1方法提取信号分子,−20 °C保存备用。按照1.3.3方法制备报告平板,取灭菌滤纸片贴在平板中央,点样培养不同时间AHLs提取液2.5 μL,30 °C培养12 h,测量变色圈直径(mm)。
1.5 环境因素对M1的AHLs分泌的调控1.5.1 不同培养条件下AHLs粗提液的制备:菌株M1过夜活化,按1:100的比例分别接种于不同pH值(4.0、5.0、6.0、7.0、8.0、9.0)和含盐量(0.5%、0.7%、1.0%、2.0%、3.0%、4.0%、5.0%)的LB液体培养基中,30 °C、160 r/min摇床培养24 h,测定菌液OD600值。8 000 r/min离心,取上清,−20 °C保存备用。同时活化好的菌液按1:100比例接种于LB液体培养基中,在20、30、37、42 °C条件下培养至相同OD600值(OD600≈1.0)。将培养好的菌液8 000 r/min离心,取上清,−20 °C保存备用。
1.5.2报告平板打孔法检测不同培养条件下M1分泌AHLs规律:以A136作为报告菌,参照文献[15]方法制备报告平板,过夜,蒸发水分。在报告平板中央打适合大小的孔,加入菌液上清40 μL,30 °C培养24−48 h,测量变色圈大小。
2 结果与分析 2.1 rRNA基因序列及系统发育分析菌株M1经16S rRNA扩增的基因序列在GenBank的登录号为KM086708,通过NCBI进行Blast检索系统进行序列相同性检索,结果表明该菌为不动杆菌属(Acinetobater spp.)。系统发育学分析结果显示,该菌与醋酸钙不动杆菌亲缘关系最近,相似性达到99% (图 1)。判定M1为不动杆菌属的醋酸钙不动杆菌(A. calcoaceticus)。

|
|
图 1
M1基因序列进化树
Figure 1
16S rRNA-based phylogenetic tree of M1
注:0.01 代表进化距离单位;分支上的数值代表为自举1 000 次的结果;括号中序号为GenBank登录号. Note: Scale bar: 0.01 is sequence divergence; Nuerals on branches are the supporting percentage by 1 000 replicates; Serial numbers in parentheses are GenBank accession numbers. |
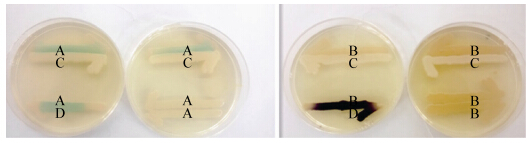
2.2.1 平板划线法检测AHLs:M1诱导根癌农杆菌A136水解X-gal产生特征性蓝色,但是不能诱导紫色杆菌CV026产生紫色色素(图 2),说明M1产生的信号分子很可能是长链或是酰基侧链C-3有羰基取代的AHLs。
|
| 图 2 利用根癌农杆菌A136和紫色杆菌CV026平行划线检测M1信号分子 Figure 2 The signaling molecules of M1 was assayed by biosensor strains (CV026 and A136) Note: A: A136; B: CV026; C: M1; D: C6-HSL. |
2.2.2 薄层层析(TLC-biosensor)法检测AHLs:TLC结果如图 3所示,C-3位含有羰基取代基的AHLs斑点有拖尾现象,烷酰基链的AHLs斑点呈现圆形。通过与标准信号分子Rf值比较,M1产生的主要AHLs为N-3-oxo-C6-HSL和N-3-oxo-C8- HSL。由于TLC检测灵敏度有限,可能还含有其他类型信号分子,可将粗提液纯化后采用高效液相色谱-质谱(HPLC-MS)进一步检测。

|
| 图 3 TLC法检测M1的AHLs种类 Figure 3 TLC analysis of AHLs secreted by M1 Note: 1: C6-HSL; 2: C8-HSL; 3: N-3-oxo-C6-HSL; 4: N-3-oxo-C8- HSL; 5: Strain M1 AHLs. |
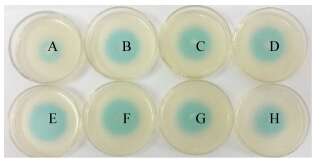
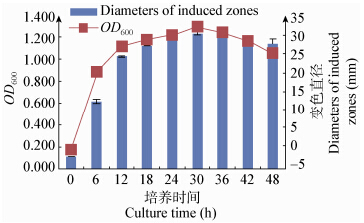
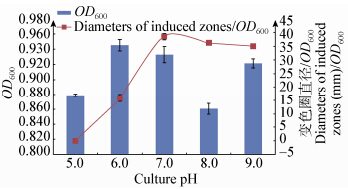
M1具有较强的分泌AHLs能力,12−42 h内分泌AHLs处于较高水平(图 4)。在延滞末期(6 h)开始分泌AHLs,并呈现密度依赖性。随着培养时间的延长,信号分子分泌量先增大后减小,在对数末期(30 h)达到最大值。M1诱导变色直径与细菌密度OD600呈现一致性(图 5)。
|
| 图 4 不同生长阶段M1分泌AHLs活性 Figure 4 AHLs activities of M1 at different growth stages Note: A: 6 h; B: 12 h; C: 18 h; D: 24 h; E: 32 h; F: 36 h; G: 42 h; H: 48 h. |
|
| 图 5 OD600与AHLs所诱导直径关系 Figure 5 Relationship between OD600 and diameters of induced zones |
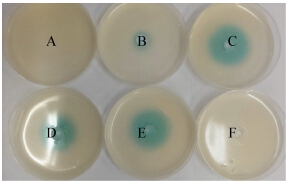
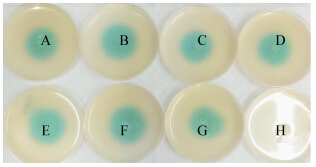
2.4.1 pH对M1分泌AHLs的影响:环境pH对M1分泌AHLs影响比较显著(图 6)。在酸性条件下检测不到AHLs或者分泌量较少,在pH 7.0时分泌量达到最高值。M1分泌AHLs的pH影响系数(变色圈直径/OD600)表明pH 7.0是菌M1分泌AHLs的最适pH,相对于酸性条件,碱性条件下M1分泌AHLs能力较强(图 7)。
|
| 图 6 pH值与M1分泌AHLs浓度关系 Figure 6 Relationship between pH values and concentrations of AHLs of strain M1 Note: A: pH 5.0; B: pH 6.0; C: pH 7.0; D: pH 8.0; E: pH 9.0; F: Negative control. |
|
| 图 7 M1分泌AHLs的pH影响系数 Figure 7 Influence coefficient between pH values and AHLs of strain M1 |
2.4.2 NaCl浓度对M1分泌AHLs的影响:NaCl含量对M1分泌AHLs浓度影响不明显(图 8),从图 9分析可知,在含盐量处于一定范围(0.5%−2.0%)时,虽然M1生长受到一定影响,但分泌AHLs的能力并无明显差异。当含盐量达到一定值(3.0%−5.0%)时,M1感知环境不利因素启动群体感应系统,个体分泌AHLs能力明显增强。
|
| 图 8 NaCl%与M1分泌AHLs浓度关系 Figure 8 Relationship between NaCl% and concentrations of AHLs secreted by strain M1 Note: A: 0.5%; B: 0.7%; C: 1.0%; D: 2.0%; E: 3.0%; F: 4.0%; G: 5.0%; H: Negative control. |

|
| 图 9 NaCl%对M1分泌AHLs影响系数 Figure 9 Influence coefficient between NaCl% and AHLs of strain M1 |
2.4.3 温度对M1分泌AHLs的影响:M1在不同温度培养达到相同OD600时,分泌AHLs能力不同(图 10),在30 °C时最强,过高或过低温度都会抑制M1分泌AHLs。37 °C比20 °C和42 °C分泌AHLs能力稍好,参照生长曲线(图 11)推测,可能是由于37 °C比20 °C和42 °C更适宜M1生长。

|
| 图 10 培养温度与M1分泌AHLs浓度关系 Figure 10 Relationship between culture temperature and concentrations of AHLs of strain M1 Note: A: 20 °C; B: 30 °C; C: 37 °C; D: 42 °C; E: Negative control. |

|
| 图 11 M1在不同温度下的生长曲线 Figure 11 Growth curves of strain M1 at different temperatures |
不动杆菌是比较常见的条件致病菌之一,以鲍曼不动杆菌、醋酸钙不动杆菌为代表的病原菌可引起人、陆生动物、水产养殖动物等产生相关疾病[16]。大多数不动杆菌具有群体感应机制。以AHLs介导的革兰氏阴性菌的群体感应机制(LuxI/LuxR)直至目前已被广泛研究。不动杆菌中具有与LuxI/R同源的AbaI/R调控基因[17]。不动杆菌在不利条件下能够生存,且耐干燥、易形成生物膜、具有广泛的抗药性等特征增加了该菌的治疗难度。目前通过抑制群体感应进而抑制不动杆菌致病性的研究已经变为一种新兴的治疗方法。Saroj等利用亚抑制浓度的链霉素(Streptomycin )使不动杆菌的调控基因AbaI (自体诱导物合成酶)和A1S-0112的表达量下降,抑制了群体感应同时抑制了该菌的运动性,降低了致病 性[18]。Stacy等[19]发现外源添加的非本源信号分子(OH-dDHL)可影响LuxR型基因的表达。本文从腐败的凡纳滨对虾中分离出的M1能诱导报告菌株A136启动QS系统。对M1分泌AHLs动力学分析表明菌体浓度与AHLs分泌量 呈正相关,表明群体感应具有密度依赖性。本文初步鉴定M1产生的AHLs类型为N-3-oxo-C6-HSL和N-3-oxo-C8-HSL。不动杆菌种类繁多,多数不动杆菌能产生一种以上的AHLs[20]。
本实验还研究了常见环境因素对醋酸钙不动杆菌M1群体感应的调控规律。研究发现,M1在相同生长条件下,AHLs的分泌呈现密度依赖性。不同环境下,AHLs分泌受菌体密度和环境因素的双重调控,且不动杆菌在极端条件下分泌AHLs能力较强。可能是不利环境促使M1机体提前感知了危机信号,启动AbaI基因,大量分泌信号分子AHLs,当AHLs增加至一定浓度后被细胞内AbaR感受到,启动相关基因表达,达到保护自身的目的。本文探究环境因素对M1分泌AHLs的影响,试图通过调节外部条件(盐度、 pH、环境温度)对M1群体感应产生抑制或调控的作用,进而调控其致病性。与其他途径相比,该方法具有经济、简便、易操作等优点。由于不动杆菌是腐败虾中的优势菌,它作为致病菌与虾的腐败菌关系如何,以及环境条件调控M1分泌AHLs的机制等还需要进一步研究。本实验通过改变食品的贮藏条件抑制QS,为抑制食品中致病菌的致病性提供了新思路。
| [1] | Miller MB,Bassler BL. Quorum sensing in bacteria[J]. Annual Reviews in Microbiology,2001,55(1): 165-199 |
| [2] | Sifri CD. Quorum sensing: bacteria talk sense[J]. Clinical Infectious Diseases,2008,47(8): 1070-1076 |
| [3] | Fuqua C,Parsek MR,Greenberg EP. Regulation of gene expression by cell-to-cell communication: acyl-homoserine lactone quorum sensing[J]. Annual Review of Genetics,2001,35: 439-468 |
| [4] | Sturme MHJ,Kleerebezem M,Nakayama J,et al. Cell to cell communication by autoinducing peptides in Gram-positive bacteria[J]. Antonie Van Leeuwenhoek,2002,81(1/4): 233-243 |
| [5] | McGuirk P,Higgins SC,Mills KHG. Regulatory cells and the control of respiratory infection[J]. Current Allergy and Asthma Reports,2005,5(1): 51-55 |
| [6] | Waters CM,Bassler BL. Quorum sensing: cell-to-cell communication in bacteria[J]. Annual Review of Cell and Developmental Biology,2005,21: 319-346 |
| [7] | Nealson KH,Platt T,Hastings JW. Cellular control of the synthesis and activity of the bacterial luminescent system[J]. Journal of Bacteriology,1970,104(1): 313-322 |
| [8] | Zhang HB,Zhang LH. Genetic control of quorum-sensing signal turnover in Agrobacterium tumefaciens[J]. Proceedings of the National Academy of Sciences,2002,99(7): 4638-4643 |
| [9] | Latifi A,Foglino M,Tanaka K,et a1. A hierarchical quorum-sensing cascade inPseudomonas aeruginosa links the transcriptional activators LasR and RhlR (VsmR) to expression of the stationary-phase sigma factor RpoS[J]. Molecular Microbiology,1996,21(6): 1137-1146 |
| [10] | Lopes JM,Goulart EM,Starling CE. Pediatric mortality due to nosocomial infection: a critical approach[J]. Brazilian Journal of Infectious Diseases,2007,11(5): 515-519 |
| [11] | Roussel-Delvallez M,Wallet F,Delpierre F,et al. In vitro bactericidal effect of a β-lactam+aminoglycoside combination against multiresistant Pseudomonas aeruginosa and Acinetobacter baumannii[J]. Journal of Chemotherapy,1996,8(5): 365-368 |
| [12] | Bhargava N,Sharma P,Capalash N. Quorum sensing in Acinetobacter: an emerging pathogen[J]. Critical Reviews in Microbiology,2010,36(4): 349-360 |
| [13] | Rice SA,Koh KS,Queck SY,et al. Biofilm formation and sloughing in Serratia marcescens are controlled by quorum sensing and nutrient cues[J]. Journal of Bacteriology,2005,187(10): 3477-3485 |
| [14] | Ravn L,Christensen AB,Molin S,et al. Methods for detecting acylated homoserine lactones produced by Gram-negative bacteria and their application in studies of AHL-production kinetics[J]. Journal of Microbiological Methods,2001,44(3): 239-251 |
| [15] | Shaw PD,Ping G,Daly SL,et al. Detecting and characterizing N-acyl-homoserine lactone signal molecules by thin-layer chromatography[J]. Proceedings of the National Academy of Sciences,1997,94(12): 6036-6041 |
| [16] | Xia F,Liang LG,Hong W,et al. Phenotypic and molecular characterization of Acinetobacter calcoaceticus in allogynogenetic Carassius auratus[J]. Oceanologia Et Limnologia Sinica,2013,44(3): 801-806 (in Chinese)夏飞,梁利国,顾伟,等. 异育银鲫(Carassius auratus)源醋酸钙不动杆菌表型及分子鉴定[J]. 海洋与湖沼,2013,44(3): 801-806 |
| [17] | Clemmer KM,Bonomo RA,Rather PN. Genetic analysis of surface motility in Acinetobacter baumannii[J]. Microbiology,2011,157: 2534-2544 |
| [18] | Saroj SD,Rather PN. Streptomycin inhibits quorum sensing in Acinetobacter baumannii[J]. Antimicrobial Agents and Chemotherapy,2013,57(4): 1926-1929 |
| [19] | Stacy DM,Welsh MA,Rather PN,et al. Attenuation of quorum sensing in the pathogen Acinetobacter baumannii using non-native N-Acyl homoserine lactones[J]. ACS chemical biology,2012,7(10): 1719-28 |
| [20] | González RH,Dijkshoorn L,Van den Barselaar M,et al. Quorum sensing signal profile of Acinetobacter strains from nosocomial and environmental sources[J]. Revista Argentina De Microbiologia,2009,41(2): 73-78 |
 2015, Vol. 42
2015, Vol. 42




