扩展功能
文章信息
- 郭慧玲, 邵玉宇, 孟和毕力格, 张和平
- 肠道菌群与疾病关系的研究进展
- Research on the relation between gastrointestinal microbiota and disease
- 微生物学通报, 2015, 42(2): 400-410
- Microbiology China, 2015, 42(2): 400-410
- 10.13344/j.microbiol.china.140474
-
文章历史
- 收稿日期: 2014-06-13
- 接受日期: 2014-11-13
- 优先数字出版日期(www.cnki.net): 2014-11-17
2013年12月,在“Science”杂志发表的十大科学进展中,肠道菌群与人体健康关系的研究被列入其中。该研究报告中指出,我国毒奶粉中三聚氰胺引发的婴幼儿肾衰竭与肠道菌群有密切关系,约1%的患病婴儿肠道中含克雷伯氏菌,克雷伯氏菌具有代谢含氮化合物的能力,能够在肠道内代谢三聚氰胺。该报道同时列举了肠道微生物中的梭杆菌属与大肠肿瘤以及普氏菌与类风湿性关节炎的关系等。肠道菌群对人类健康有着重要的影响,也成为近些年来研究的热点。肠道菌群与代谢疾病、免疫类疾病、胃肠道类疾病甚至精神类疾病相关联,本文将对国内外关于肠道菌群与疾病关系的研究现状,益生菌对调节肠道菌群的重要性以及研究肠道菌群的方法进行详细论述。
1 肠道菌群概述人体肠道内有1 000-1 150种约100万亿细菌,是人体细胞数量的10倍,每个人至少有160种优势菌群。在健康人体的胃肠道细菌中,拟杆菌门和厚壁菌门多于90%,包括拟杆菌属、普氏菌属、卟啉单胞菌属、梭状芽孢杆菌、柔嫩梭菌属、真杆菌属、瘤胃球菌属和乳杆菌属等。其他丰度较少的门类有放线菌门(双歧杆菌属和产气柯林斯菌属)、变形菌门(肠杆菌科细菌、幽门螺杆菌、华徳萨特菌)、疣微菌门和产甲烷古菌等[1]。
人体肠道是一个多元化和充满活力的微生物生态系统,其结构和功能是目前生命科学和医学研究的主要目标。无菌小鼠(germ-free mice,GM)实验揭示了微生物正常生长发育和维持健康的重要性。宿主为微生物提供栖息地和营养,而微生物帮助宿主代谢和营养吸收。新一代基因测序技术的发展以及强大的生物信息学分析工具的开发,为研究人体肠道菌群的组成和结构提供了新的思路[2]。Zackular等[3]研究发现,肠道菌群与肥胖、糖尿病、心脑血管疾病、炎症性肠炎、胃肠道癌症和自身免疫性疾病等具有一定的相关性。
1 肠道菌群与疾病的关系 2.1 心脑血管疾病心脑血管疾病是一种严重威胁人类,特别是50岁以上中老年人健康的常见病。目前,我国心脑血管疾病患者已经超过2.7亿人,每年近300万人死于心脑血管疾病,占我国每年总死亡病因的51%。已有研究证明人体肠道微生物代谢胆碱和磷酸酰胆碱产生三甲胺(TMA),进一步代谢产生氧化三甲胺(TMAO)可以导致动脉粥样硬化。肠道微生物同样可以代谢饮食中瘦肉所富含的左旋肉碱和三甲胺,产生TMAO并加速老鼠发生动脉粥样硬化。杂食性人类代谢产生的TMAO要多于素食者,人类粪便中特定菌群的存在与血浆中TMAO浓度和饮食状况有密切的关系。在小鼠慢性膳食中补充左旋肉碱改变盲肠微生物组成,合成的TMA和TMAO明显增强,并增加了发生动脉粥样硬化的几率;但是如果不改变盲肠微生物组成将不会增加动脉粥样硬化发生率。该研究结果表明,肠道微生物有助于改善食用红肉较多者心血管疾病的发病率[4]。另一研究发现肠道菌群可以代谢磷脂类和胆碱类产生胆碱、氧化三甲胺和甜菜碱,而这些代谢产物能够引发动脉粥样硬化[5]。由上述的研究发现,肠道菌群的组成对心脑血管疾病的发生有重要的作用,在测定血浆液中上述代谢产物含量的同时,可以适量补充益生菌增强肠道的功能,保持肠道的健康来预防心血管疾病。
2.2 肥胖肥胖已成为严重威胁人类健康的全球性疾病,据世界卫生组织统计,世界人口的12%患有肥胖,近几年肠道菌群与肥胖的关系备受关注。Ley等[6]首次证明肥胖与肠道微生物相关联,肥胖小鼠比同窝生的瘦型小鼠拟杆菌门少、硬壁菌门多。Fei等[7]报道,从肥胖病患者体内分离出了产内毒素的阴沟肠杆菌B29,接种到无菌小鼠体内一周后小鼠出现了严重的肥胖和胰岛素抵抗等症状,该菌被认为具有激活合成脂肪相关基因的功能。Zhang等[8]研究了分离自正常体重的人、病态肥胖患者和做过胃绕路手术患者的184 094个微生物。通过系统发育分析表明人体肠道中的细菌是高度多样化的,6个细菌门在3类试验成员中表现出明显不同,在正常体重和肥胖人中占主导地位的是厚壁菌门,而在做过胃绕道手术患者中含量较低,而γ-变形菌含量较高。肥胖者体内富含大量产H2的普雷沃氏菌,采用实时定量PCR检测到利用H2的产甲烷古细菌在肥胖者体内多于正常体重和做过胃绕道手术的人。Zhang等[9]报道由高脂肪饮食引起肠道微生物的破坏与肥胖的发生相关联。Ridaura等[10]从成人、女性和双胞胎(其中一个是肥胖)中采集粪便并分离其中的细菌,然后将这些细菌转移到无菌小鼠体内,以不同的饮食喂养小鼠,其中包括美国典型的不健康食物。结果显示,获得肥胖者微生物的小鼠要比获得较瘦者微生物的小鼠体重更重一些。Li等[11]报道,抗氧化药物Tempol能够降低高脂饮食诱导的小鼠体重,并发现Tempol试验组中小鼠肠道的乳酸杆菌数目减少,会导致肠道中牛黄β-鼠胆酸的浓度增加,该物质抑制了肠道参与体内脂肪和血糖代谢的FXR水平,FXR信号通道是降低肥胖程度的原因,而乳酸杆菌通过代谢胆汁酸可以影响FXR水平。该结果有望开发出用于预防和治疗肥胖、糖尿病的药物。Clarke等[12]报道通过对比饮食诱导的肥胖小鼠早期与晚期之间肠道微生物的组成差异,发现消化球菌科显著升高,而理研菌科和紫单胞菌科显著降低。Suzuki等[13]报道居住在北纬较冷地区的人们,其肠道菌群更容易促进机体产生肥胖。厚壁菌门对个体产生肥胖有一定影响,而生活在北方的人类机体肠道中存在较多的厚壁菌门。De Vadder等[14]报道肠道菌群可以分解不被人类直接消化吸收的发酵纤维,肠道菌群将其分解为短链脂肪酸(如丙酸盐和丁酸盐),这些短链脂肪酸可以被人体吸收利用。肠道菌群利用丙酸盐来产生葡萄糖,有机体对葡萄糖的代谢调控对肥胖症的发病起到一定的作用。Cotillard等[15]报道肥胖者和非肥胖者肠道菌群的差异,发现两者在微生物基因种类丰富程度上差异很大。微生物基因丰度较低的肥胖者比丰度较高的肥胖者的体重更容易增加。表明肥胖不仅与肠道菌群的数量和种类相关,与丰富程度也有一定联系。
肥胖的产生与饮食有着重要的联系,而饮食的种类又会直接影响到肠道内微生物组成,因此研究肠道内的微生物可以间接地说明某种细菌与肥胖的关系,同时警醒人们健康饮食的重要性。无菌小鼠的开发促进了肠道菌群和疾病关系的研究,成为目前医学领域重要的工具之一。
2.3 糖尿病根据世界卫生组织统计,全球约3.47亿多人饱受糖尿病痛的折磨,糖尿病已成为继肿瘤和心脑血管疾病之后,威胁人类生命健康的第三大杀手。仅中国就有糖尿病患者约9 240万人,约占全球糖尿病人的1/3。治疗糖尿病的手段也较多,其中分析糖尿病患者肠道菌群成为了热点。Qin等开发了一种宏基因组相关联方案(metagenome-wide association study,MGWAS),基于深度鸟枪法测序技术,将345名中国受试者的肠道微生物DNA进行两阶段MGWAS,其中有171名患有Ⅱ型糖尿病。MGWAS分析显示Ⅱ型糖尿病患者以中度肠道微生物菌群失调为特征,一些常见的产丁酸盐细菌丰度下降,而各种条件致病菌增加,其他微生物功能如还原硫酸盐和抗氧化应激能力增强[16]。Larsen等[17]研究发现Ⅱ型糖尿病与健康人群肠道菌群在门类和属类之间有显著地变化。糖尿病人与非糖尿病人相比,厚壁菌门相对丰度低,而拟杆菌门和变形菌门丰度高。大量研究证明,益生菌对改善血糖水平具有一定的作用。
2.4 营养不良营养不良是因能量或蛋白质不足引起的一种慢性营养缺乏性疾病,多见于2岁以下的婴儿,合理的营养干预和饮食都不能有效的治疗营养不良。Smith等[18]研究了从出生到3岁的马拉维的317对双胞胎,其中有一半双胞胎保持着良好的营养状态,而在其他的双胞胎中有43%表现营养不良,对患有该疾病的孩子以及他们的双胞胎采取了以花生为基础的食疗后,发现患有严重营养不良孩子的肠道微生物在接受治疗过程中日趋与营养状态良好的孩子相似。当治疗停止时,其微生物组成会恢复至初始状态。进而他们将每位健康和患病的双胞胎的粪便菌群转移到无菌小鼠的体内,这些小鼠会像有这种肠道菌群的人类一样出现营养不良的症状。Gupta等[19]采用宏基因组学的方法分析了营养不良儿童的肠道菌群的组成,发现在营养不良儿童的肠道内富集一种肠源病原体,这种病原体可以造成营养成分吸收障碍,并确定这些病原体影响儿童肠道菌群整体的代谢能力。
2.5 炎症性肠病(IBD)炎症性肠炎包括溃疡性结肠炎(UC)和克罗恩病(CD),炎症性肠病发病率的增加与世界各地社会经济发展和环境因素相关联,发达国家的生活方式可能会损害人体肠道微生物定殖的自然形态。肠道微生物与黏膜免疫之间的相互作用在肠道内对免疫反应的引导和调节起重要的作用。炎症性肠病患者黏膜发生病变是由于共生微生物过度和免疫的失调引起的。异常菌群降低了肠道微生物生态系统的复杂性,是克罗恩病和肠道功能溃疡性结肠炎患者的共同特点[20]。
脑肠轴(gut-brain axis)是将大脑和肠道的功能相连接互传信息的双向通讯系统,包括肠神经(ENS)、迷走神经、交感神经和脊神经等,包括细胞因子、荷尔蒙和神经肽等信号分子。其中,肠神经几乎控制了整个肠道的功能,是介于大脑和肠道最重要的物质。脑肠轴的研究为炎症性肠病(IBD)和肠易激综合症(IBS)等肠道功能失调病理方面提供了重要的理论。这其中最为重要的是肠道菌群在人体的互动参与了脑肠轴的功能反应,因此,肠道微生物对炎症性肠病的发生有重要的作用[21]。本实验室研究了不同年龄段的人口服Lactobacillus plantarum P-8后肠道菌群的变化,结果表明在3个不同年龄组中,服用益生菌后肠道中Atopobium菌株显著增加,Atopobium菌株对肠道炎症有积极的作用[22]。
2.6 肠易激综合症(IBS)肠易激综合症是一种胃肠功能紊乱疾病,其特征为腹痛、腹胀、便秘或腹泻。随着近年来人们生活节奏的加快、饮食结构的改变,肠易激综合症发病率呈上升趋势。Jeffery等采用焦磷酸测序分析了37名IBS患者和20名健康人群的粪便微生物组成,发现IBS患者肠道菌群较健康人群厚壁菌门和拟杆菌门显著增多[23]。Saulnier等[24]采用454测序和生物芯片技术分析健康儿童和IBS患儿的肠道微生物差异,发现γ-变形菌在IBS患儿肠道显著增多,更突出的是副流感嗜血杆菌显著增多。该研究还发现一种新型瘤胃球菌属与IBS有关,疼痛的发作频率与Alistipes细菌的丰度相关,说明肠道微生物与胃肠功能紊乱相关联。
2.7 胃肠道癌症Wang等[25]通过454焦磷酸测序技术检测16S rRNA基因的V3区基因序列,研究了46名结肠癌患者和56名健康人群粪便细菌的多样性,并通过主成分分析和克隆文库研究这两类人群的肠道微生物之间的差异,结果显示脆弱拟杆菌、肠杆菌、大肠杆菌、志贺氏菌、克雷伯氏菌、链球菌和消化链球菌在结肠癌患者肠道较丰富,罗氏菌属、产丁酸盐细菌和毛螺旋菌含量较少;而普通拟杆菌和单行拟杆菌在健康志愿者的肠道比较丰富。采用实时定量PCR测量丁酰辅酶A转移酶基因的拷贝数,进一步确定了在结肠癌患者肠道产丁酸菌数目减少。产丁酸菌的减少和致病菌的增多导致了结肠癌患者肠道微生物的组成结构失衡。Zackular等[26]采用肿瘤诱导法将一组小鼠诱导为大肠癌病鼠,收集这些荷瘤小鼠的粪便及饲养草垫,将其转移到无菌小鼠环境中,使无菌小鼠获得该肠道菌群,结果发现这些无菌小鼠发生结肠肿瘤的频率是拥有健康微生物种群小鼠的2倍以上。此结果表明,特定的微生物种群导致了肿瘤的形成,荷 瘤小鼠富集较多数量的拟杆菌属、Odoribacter和Akkermansia。然而普雷沃氏菌科和紫单胞菌科的细菌数量减少。环磷酰胺是临床上重要的治疗癌症的药物,Viaud等[27]在小鼠模型实验中,证明了环磷酰胺可以改变小肠内肠道菌群的组成并诱导特定的革兰氏阳性菌转移至二级淋巴器官。这些细菌刺激病原体pTh17有助于恢复环磷酰胺的疗效。
2.8 肝硬化肝硬化是临床常见的慢性进行性肝病,由一种或多种病因长期或反复作用形成的弥漫性肝损害。Ridlon等[28]报道在肝硬化患者肠道内梭菌属、肠杆菌科、紫单胞菌科较健康人明显增多。Chen等[29]采用454焦磷酸测序技术分析了肝硬化患者和健康对照组肠道菌群组成,发现肝硬化患者肠道拟杆菌门显著降低,然而蛋白菌、梭形杆菌显著增多。该研究还发现肠杆菌科、韦荣球菌科、链球菌科在肝硬化患者肠道升高,毛螺菌科降低。
2.9 慢性肾病随着我国人群饮食结构和生活习惯的改变,慢性肾病患者不断增加,且发病年龄主要集中在青壮年。Vaziri等[30]研究了尿毒症或饮食和药物干预慢性肾脏病对肠道微生物的改变,研究人员分别从12名终末期肾脏病患者和12名健康人的粪便中提取肠道微生物的宏基因组DNA,通过系统的微阵列分析,这两组之间有190种细菌的分类有显著差异,短状杆菌科、肉杆菌科、肠杆菌科、盐单胞菌科、莫拉菌科、涅斯捷连科氏菌属、多囊菌、假单胞菌属以及丝硫菌属在终末期肾脏病患者中均显著增加。通过小鼠实验,为了进一步确定分离个体间的变化、共病条件和饮食药物干预对尿毒症的影响,尿毒症小鼠和健康小鼠有175种细菌存在显著差异,最显著的是乳杆菌属和普雷沃氏菌科,有明显的下降趋势。这可能是由于富含氮的废弃物,尤其是尿液或者尿酸在患者体液中积累,导致大部分废弃物通过人体肠道来进行释放,使得利用其作为营养物质的微生物群落处于优势地位,使得患者肠道微生物菌群失调。Zheng等[31]报道三聚氰胺与肾脏中的氰尿酸发生化学反应,生成三聚氰酸,进而产生结晶具有肾毒性。然而肠道微生物克雷伯氏菌促进三聚氰胺形成肾结石。Anders等[32]报道了免疫调节对慢性肾脏病和终末期肾脏病患者肠道微生物的作用,解释了如何通过代谢改变尿毒症患者肠道病原体的过度生长。肾科学的研究在很大程度上忽视了肠道菌群与慢性肾脏病和终末期肾脏病相关的免疫紊乱、并发症的关系。在肾科学的研究中需要了解在肾脏病患者肠道致病菌的作用,评估和干预操纵肠道菌群,通过增加益生菌来减少致病菌,以及防止相关的并发症。
2.10 自身免疫性疾病自身免疫性疾病是机体对自身抗原发生免疫反应而导致自身组织损害所引起的疾病,它的产生与肠道微生物有一定联系。Wu等[33]发现肠道共生的微生物对自身免疫性疾病会产生影响,研究人员建立了自身免疫性强烈衰退的无菌K/BXN小鼠模型,引入一种分节丝状细菌,使无菌小鼠肠黏膜内Th17细胞亚群缺乏,产生自身抗体,迅速引发自体免疫性关节炎。Gomez等[34]报道,异常增多的肠道特定菌群能促进类风湿性关节炎等自身免疫疾病的发生,加快易感人群疾病进程的发展。研究人员使用强致类风湿性关节炎的基因改造小鼠,并把经具有强抗类风湿性关节炎作用的变异基因改造的小鼠作为对照组,结果显示在基因改造小鼠的肠道中富含Allobaculum sp.,而在对照组小鼠肠道中富含厌氧杆菌属。Kawamoto等[35]以免疫抑制性受体PD-1缺失的实验小鼠为对象,研究了其肠道内IgA和肠道菌群的构成,结果显示实验小鼠体内产生IgA的B淋巴细胞数量和正常小鼠基本相同,肠道内分泌的IgA数量也与正常实验小鼠的相同,但是PD-1受体缺失的实验小鼠体内产生的IgA与肠道结合能力就有所减弱,受此影响,肠道菌群的构成发生变化,益生菌双歧杆菌减少到几乎检测不到的程度,而通常较少数量的致病肠杆菌属却增加到原来的400倍左右。肠道内微生态环境紊乱可导致全身免疫系统过度活跃,进而有可能出现自身免疫性疾病。据此可以看出,疾病的发生改变着肠道菌群的组成,特别是一些益生菌的减少和致病菌的 增加。
2.11 艾滋病Vujkovic-Cvijin等[36]发现感染艾滋病的特点是肠道免疫屏障的失调,HIV感染者的肠道微生物与未感染者的肠道微生物是不尽相同的,尤其在感染者体内存在很多引发炎症的细菌,如铜绿假单胞菌、沙门氏菌和大肠埃希菌等。并且在HIV感染者机体内,一些细菌也会模拟某些酶的活性来发挥作用,患者体内免疫反应的高度激活和特殊的细菌群体相关。Moeller等[37]报道黑猩猩的猴免疫缺陷病毒SIVcpz是人类免疫缺陷病毒HIV-1的祖先,在黑猩猩中可以引起与艾滋病类似的症状。他们利用16S rRNA测序来分析被SIV感染的6只黑猩猩的肠道微生物组成,对其粪便微生物的测序数据分析发现在SIV感染前后,黑猩猩肠道菌群的组成发生了显著的变化,SIV感染破坏了之前稳定的肠道菌群,使潜在的病原体增加。因此,艾滋病等免疫性缺失疾病的发生对肠道菌群的组成有一定的影响。
2.12 过敏性湿疹过敏性湿疹是婴儿常见的一种皮肤病,近年来发病率逐步增加,6−12个月婴儿过敏性湿疹发生率约为75.5%。Nylund等[38]研究了患有湿疹的儿童肠道微生物,他们采集了15名患有湿疹病的婴儿和19名健康婴儿6个月和18个月的粪便样品,通过芯片图谱的辛普森多样性指数发现,6个月时,两组婴儿肠道菌群没有显著差异,然而到18个月时,健康婴儿肠道中富含拟杆菌,患病婴儿肠道中梭菌属的数量显著增加并接近成年人含量。结果表明,反常的微生物组成与湿疹有关,对于儿童患有湿疹的高危险因素中,儿童过早形成多样化的成人型微生物是一个潜在的危险因素,需要进一步加强婴儿早期肠道微生物的鉴定和膳食的合理搭配。
2.13 自闭症、抑郁症及老年痴呆等精神性疾病在生活中会产生各式各样情绪的变化,人们往往将其归因于发生在身边的事,而很少有人知道,肠道微生物也可以影响人的情绪。科学家发现情绪可以改变肠道菌群的组成,同时肠道菌群的改变也会影响人们的情绪。Baily和Coe[39]研究发现被施压力的猕猴肠道中乳杆菌减少,同时致病菌Camphlobacter jejuni增多。受到压力时,去甲肾上腺素的分泌促进了肠道内特定菌群生长和肠道内的定殖。还有研究显示益生菌的补充可明显改善压力引起的肠道功能的变化[40]。
人体健康和疾病的研究中,肠道微生物向大脑传达信息的能力可以改变人的行为方式,因其在脑肠轴发挥功能过程中起着十分重要的作用,影响着心理健康。Cryan等[41]研究发现罗伊氏乳杆菌的摄入可以改善患有IBS和身体匮乏的病人的心情,降低病人的担忧和紧张。Bested等[42]报道人体肠道微生物功能的完整性和种类有可能影响人的情绪(如抑郁)和行为障碍。由于小肠细菌的过度生长,伴随着脂多糖内毒素、D-乳酸和丙酸的产生,它们的产生与心理健康相关联。Hsiao等[43]对孕鼠采用母体免疫激活(maternal immune activation,MIA)的技术,诱导他们的后代出现自闭症的行为,研究发现自闭症小鼠与正常小鼠的肠道菌群有明显的不同,并通过给自闭症的小鼠喂食脆弱类拟杆菌改变肠道菌群的组成,改善了其交际、刻板以及焦虑和感觉运动行为的缺陷,益生菌疗法可以逆转小鼠的自闭症行为。现有研究报道服用双歧杆菌、乳酸菌调节肠道菌群微生态可以提高人的认知能力并降低老年痴呆症的发病率[44]。
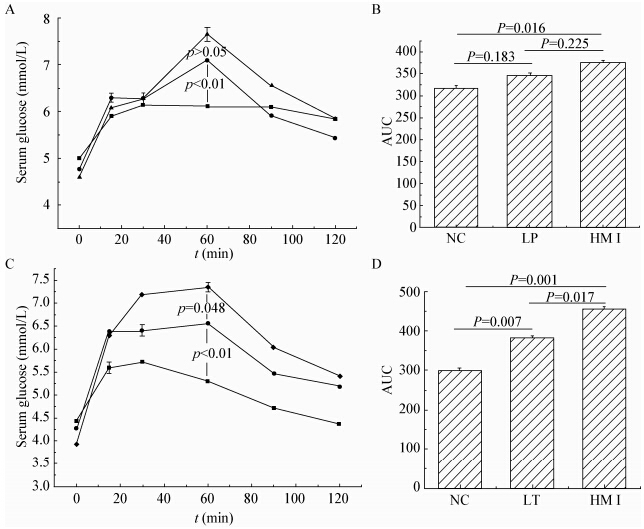
3 益生菌目前已有大量研究表明,服用益生菌胶囊或者发酵乳制品,可以直接对人体肠道微生物构成影响。本实验室研究了干酪乳杆菌Zhang对Ⅱ型糖尿病的预防保护作用。发现干酪乳杆菌Zhang可以很好地抑制高血糖的发生。因为高血糖的发生与Th1免疫应答、高血清胆酸水平和尿液氯离子丢失密切相关。然而干酪乳杆菌Zhang可以预防氯离子的丢失并上调氯离子相关基因的表达。同时盲肠微生物发生改变,尤其是胆汁酸7α羧化菌降低和粪便胆汁酸组成发生改变,这些变化都与氯离子的内流相一致。因此,干酪乳杆菌Zhang可以预防Ⅱ型糖尿病[45]。本实验室研究了益生菌Lactobacillus casei Zhang对Ⅱ型糖尿病大鼠的影响,由图 1可知,高胰岛素血症模型组Ⅰ(HMⅠ)、益生菌预防组(LP)和高胰岛素血症模型组Ⅱ(HMⅡ)、益生菌治疗组(LT)糖耐量曲线峰值明显高于正常对照组,表明HMⅠ组、LP组、HMⅡ组和LT组均表现出明显的糖耐量受损。HMⅠ组和LP组的糖耐量曲线峰值差异不显著,而LT组的糖耐量曲线峰值显著低于HMⅡ。结果表明,Lactobacillus casei Zhang对糖尿病大鼠的糖耐量曲线有明显的预防和改善作用,并对大鼠Ⅱ型糖尿病的形成也有很好的预防作用[46]。
|
|
图 1
益生菌L. casei Zhang对各组口服糖耐量水平的影响
Figure 1
Effect of L. casei Zhang on oral glucose tolerance in each group
注:A:第10周大鼠口服糖耐量曲线. ■: NC组;▲:HMⅠ组;●:LP组. B:第14周大鼠口服糖耐量曲线. ■:NC组;◆:HMⅡ组;●:LT组. C:第10周大鼠口服糖耐量曲线
AUC;D:第14周大鼠口服糖耐量曲线AUC. Note:A: Oral glucose tolerance of rats at 10th week. ■: NC group; ▲: HM I group; ●: LP group. B: Oral glucose tolerance of rats at 14th week. ■: NC group; ◆: HM II group; ●: LT group. C: AUC of OGTT among NC,LP,HM groups after 9-week high-fructose fed. D: AUC of OG TT among NC,LT,HM groups after 13-week high-fructose fed. |
本实验室对包括11名年轻人(平均年龄26岁)、12名中年人(平均年龄51岁)以及10名老年人(平均年龄76岁)等不同年龄段在内的33个志愿者进行了实验,志愿者每日口服活菌数为 6×1010 CFU/mL的Lactobacillus plantarum P-8,定期收集志愿者的粪便,并测定其中分泌型免疫球蛋白A (SIgA)的含量。结果如表 1所示,其中中年组和老年组的志愿者在服用2周后,粪便中SIgA的含量显著升高(p<0.05),说明益生菌Lactobacillus plantarum P-8对肠道中分泌型免疫球蛋白A含量的增加有重要的作用。分泌型免疫球蛋白A是有机体黏膜防御系统的重要组成,其通过附着于肠道表面抑制致病菌和病毒等繁殖,是预防致病菌入侵的重要屏障。由此可见,肠道微生物对机体自身免疫有着重要的意义[19]。
|
服用时间(周) Time (week) |
SIgA (µg/g) | ||
| Y (n=11) | M (n=12) | E (n=10) | |
| 注:Y、M和E分别表示青年组、中年组和老年组. 小写字母表示同一行的显著差异性,大写字母表示同一列的显著差异性(p<0.05). Note: Y,M and E signify the young,middle-aged and elderly groups. Significant differences mean within the same row are indicated by different small,whereas a different capitalized superscript letter denotes statistically significant variation within the same column (p<0.05). | |||
| 0 | 140.30±18.09A,a | 122.39±14.80B,a | 152.65±23.22B,a |
| 2 | 142.70±15.60A,b | 246.93±43.95A,a | 265.28±20.88A,a |
| 4 | 151.88±18.62A,a | 137.68±14.80B,a | 167.93±23.22B,a |
| 5 | 150.10±9.40A,a | 118.90±12.93B,a | 160.70±2.34B,a |
| 6 | 147.68±21.55A,a | 117.99±14.07B,a | 157.16±20.46B,a |
| 8 | 126.81±15.69A,a | 134.19±15.15B,a | 118.14±14.61B,a |
如表 2所示,降低的菌群大部分都是益生菌,因此,适量补充益生菌对人体的健康十分重要。
| 疾病 Disease |
生病个体肠道菌群的变化
changes of gastrointestinal microbiota in the sick |
|
| 升高的菌群 incremental microbiota | 降低的菌群 reduced microbiota | |
| Cardiovascular and cerebrovascular diseases | 幽门螺杆菌 | 植物乳杆菌 |
| Obesity | 硬壁菌门 | 拟杆菌门 |
| Diabetes | 拟杆菌门 | 双歧杆菌 |
| 变形菌 | 产丁酸菌 | |
| 硫酸盐还原菌 | 梭状芽孢杆菌 | |
| Malnutrition | 华德嗜胆菌 | − |
| Inflammatory bowel disease | 沙门氏菌 | 产丁酸菌 |
| 空肠弯曲杆菌 | 硬壁菌门 | |
| 大肠埃希菌 | 拟杆菌门 | |
| Irritable bowel syndrome | 硬壁菌门 | 乳杆菌 |
| 拟杆菌门 | 双歧杆菌 | |
| 副流感嗜血杆菌 | ||
| Gastrointestinal carcinoma | 拟杆菌门 | 产丁酸菌 |
| 普雷沃菌 | 产甲烷菌 | |
| Cirrhosis | 肠杆菌科 | 毛螺菌科 |
| 链球菌科 | 瘤胃菌科 | |
| 韦荣球菌科 | 约氏乳杆菌 | |
| Chronic kidney disease | 短状杆菌属 | 普雷沃菌 |
| 肠杆菌科 | 乳杆菌 | |
| Autoimmune disease | 沙门氏菌 | 双歧杆菌 |
| 耶尔森菌 | 普雷沃菌 | |
| 志贺菌属 | 球形梭菌属 | |
| 弯曲杆菌 | 脆弱拟杆菌 | |
| AIDS | 沙门氏菌 | 双歧杆菌 |
| 大肠埃希菌 | 乳杆菌 | |
| 铜绿假单胞菌 | ||
| Allergic eczema | 梭菌属 | 拟杆菌 |
| 大肠埃希菌 | ||
| Psychosis | 柠檬酸杆菌 | 婴儿双歧杆菌 |
| 破伤风梭菌 | 瑞氏乳杆菌 | |
| 空肠弯曲杆菌 | 罗伊氏乳杆菌 | |
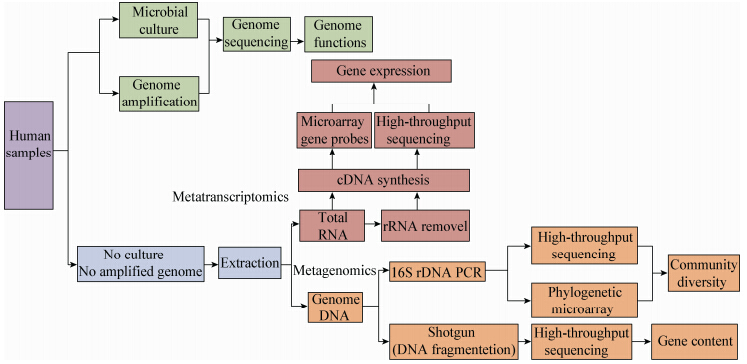
随着DGGE/TGGE、T-RFLP、ERIC-PCR指纹图谱、宏基因组学、宏转录组学、新一代测序技术、克隆文库技术、MALDI-TOF、荧光原位杂交法、基因芯片和无菌小鼠等技术的开发,肠道菌群的研究更为深入,克服了传统方法的局限性,能够比较全面的分析肠道菌群的结构组成(图 2)。肠道微生物菌群非常复杂,其粪便样品中大概有99%的微生物无法分离培养,仅有1%的微生物在实验室条件下可以分离培养。因此,传统的生化鉴定方法是无法反映真正的肠道菌群。然而,宏基因组学的研究对象是整个微生物群落,无需分离单个细菌,可以用来研究那些不能分离培养的微生物,从而扩大人们对肠道菌群基因的认识。本实验室采用了第2代测序仪Recho 454-焦磷酸测序平台对服用益生菌Lactobacillus casei Zhang不同时期志愿者的肠道微生物菌群进行分析,全面客观地揭示了该菌株干预下机体菌群的改变[47];还通过定量PCR研究了中国7个不同民族的314位志愿者的10种主要肠道优势菌,研究结果表明10种优势菌在不同民族肠道均普遍存在,但是数量存在显著差异[48]。
5 结论与展望肠道微生物在人体健康中发挥着重要作用,人们逐渐认识到维持肠道菌群平衡的重要性,并认识到人体的生理代谢不仅受其自身基因的控制,同时受到肠道微生物的调控。
随着肠道基因组学、代谢组学、蛋白组学的不断发展,肠道微生物越来越受到重视。但人们对肠道微生物的认识刚起步,对于百亿的菌群在肠道内究竟发挥着什么作用,细菌之间的关系以及它们对人体的健康发挥着怎样的作用,需要科学家进一步深入地研究和探索。逐步明确具体的微生物谱系与相关疾病的联系,确定各类疾病的特定菌群,可以通过检测肠道菌群的组成来确定个体是否患有某种疾病,这将是未来医学上的一个重大突破。近年来,作为医学领域重要的新技术——粪菌移植技术(Fecal microbiota transplantation,FMT)逐步成熟并健全[49],通过将健康人群粪便中的菌群(肠道菌群)转移到患者的体内,使得患者获得健康人群的肠道菌群来治疗相关的疾病,这种全新的采用肠道微生物直接治疗疾病的创新疗法逐渐被人们认同。目前该技术应用到治疗复发性难辨梭状芽孢杆菌感 染[50]、克罗恩病[51]等。
粪菌移植技术是在肠道微生物与疾病的相关研究理论基础上建立起来的全新疾病治疗技术,随着对肠道微生物中不同种属细菌在人体肠道中发挥作用的深入研究,可以有针对性的选择相关菌种对特定疾病进行治疗,这是治疗特定疾病的一种方法,该方法将有广阔的发展空间。
| [1] | Qin J,Li R,Raes J,et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature,2010,464(7285): 59-65 |
| [2] | Robles Alonso V,Guarner F. Linking the gut microbiota to human health[J]. British Journal of Nutrition,2013,109: S21-S26 |
| [3] | Zackular JP,Baxter NT,Iverson KD,et al. The gut microbiome modulates colon tumorigenesis[J]. mBio,2013,4(6): e00692-13 |
| [4] | Koeth RA,Wang Z,Levison BS,et al. Intestinal microbiota metabolism of l-carnitine,a nutrient in red meat,promotes atherosclerosis[J]. Nature Medicine,2013,19(5): 576-585 |
| [5] | Wang Z,Klipfell E,Bennett BJ,et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature,2011,472(7341): 57-63 |
| [6] | Ley RE,Backhed F,Turnbaugh P,et al. Obesity alters gut microbial ecology[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(31): 11070-11075 |
| [7] | Fei N,Zhao L. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice[J]. ISME Journal,2012,7(2013): 880-884 |
| [8] | Zhang H,DiBaise JK,Zuccolo A,et al. Human gut microbiota in obesity and after gastric bypass[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(7): 2365-2370 |
| [9] | Zhang C,Zhang M,Pang X,et al. Structural resilience of the gut microbiota in adult mice under high-fat dietary perturbations[J]. ISME Journal,2012,6(10): 1848-1857 |
| [10] | Ridaura VK,Faith JJ,Rey FE,et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice[J]. Science,2013,341(6150): 1-10 |
| [11] | Li F,Jiang C,Krausz KW,et al. Microbiome remodelling leads to inhibition of intestinal farnesoid X receptor signalling and decreased obesity[J]. Nature Communications,2013,4: 2384 |
| [12] | Clarke SF,Murphy EF,Sullivan O,et al. Targeting the microbiota to address diet-induced obesity: a time dependent challenge[J]. PLoS one,2013,8(6): e65790 |
| [13] | Suzuki TA,Worobey M. Geographical variation of human gut microbial composition[J]. Biology Letters,2014,10(2): 1-12 |
| [14] | De Vadder F,Kovatcheva-Datchary P,Goncalves D,et al. Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J]. Cell,2014,156(12): 84-96 |
| [15] | Cotillard A,Kennedy SP,Kong LC,et al. Dietary intervention impact on gut microbial gene richness[J]. Nature,2013,500(7464): 585-588 |
| [16] | Qin J,Li Y,Cai Z,et al. A metagenome-wide association study of gut microbiota in type 2 diabetes[J]. Nature,2012,490(7418): 55-60 |
| [17] | Larsen N,Vogensen FK,van den Berg FWJ,et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PloS One,2010,5(2): e9085 |
| [18] | Smith MI,Yatsunenko T,Manary MJ,et al. Gut microbiomes of Malawian twin pairs discordant for kwashiorkor[J]. Science,2013,339(6119): 548-554 |
| [19] | Gupta SS,Mohammed MH,Ghosh TS,et al. Metagenome of the gut of a malnourished child[J]. Gut Pathogens,2011,3(1): 7 |
| [20] | Manichanh C,Borruel N,Casellas F,et al. The gut microbiota in IBD[J]. Nature Reviews Gastroenterology and Hepatology,2012,9(10): 599-608 |
| [21] | Chen X,D’Souza R,Hong ST. The role of gut microbiota in the gut-brain axis: current challenges and perspectives[J]. Protein and cell,2013,4(6): 403-414 |
| [22] | Wang L,Zhang J,Guo Z,et al. The impact of oral consumption of the probiotic Lactobacillus plantarum P-8 on the faecal microbiota,SIgA,SCFAs and TBAs of subjects of different age[J]. Nutrition,2013,30(7/8): 776-783 |
| [23] | Jeffery IB,OToole PW,Ohman L,et al. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota[J]. Gut,2012,61(7): 997-1006 |
| [24] | Saulnier DM,Riehle K,Mistretta TA,et al. Gastrointestinal microbiome signatures of pediatric patients with irritable bowel syndrome[J]. Gastroenterology,2011,141(5): 1782-1791 |
| [25] | Wang T,Cai G,Qiu Y,et al. Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J]. ISME Journal,2011,6(2): 320-329 |
| [26] | Zackular JP,Baxter NT,Lverson KD,et al. The gut microbiome modulates colon tumorigenesis[J]. mBio,2013,4(6): 1-13 |
| [27] | Viaud S,Saccheri F,Mignot G,et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide[J]. Science,2013,342(6161): 971-976 |
| [28] | Ridlon JM,Alves JM,Hylemon PB,et al. Cirrhosis,bile acids and gut microbiota: unraveling a complex relationship[J]. Gut Microbes,2013,4(5): 382-387 |
| [29] | Chen Y,Yang F,Lu H,et al. Characterization of fecal microbial communities in patients with liver cirrhosis[J]. Hepatology,2011,54(2): 562-572 |
| [30] | Vaziri ND,Wong J,Pahl M,et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney International,2012,83(2): 308-315 |
| [31] | Zheng X,Zhao A,Xie G,et al. Melamine-induced renal toxicity is mediated by the gut microbiota[J]. Science Translational Medicine,2013,5(172): 172ra22 |
| [32] | Anders HJ,Andersen K,Stecher B. The intestinal microbiota,a leaky gut,and abnormal immunity in kidney disease[J]. Kidney International,2013,83(6): 1010-1016 |
| [33] | Wu HJ,Ivanov II,Darce J,et al. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells[J]. Immunity,2010,32(6): 815-827 |
| [34] | Gomez A,Luckey D,Yeoman CJ,et al. Loss of sex and age driven differences in the gut microbiome characterize arthritis-susceptible *0401 mice but not arthritis-resistant *0402 mice[J]. PloS One,2012,7(4): e36095 |
| [35] | Kawamoto S,Tran TH,Maruya M,et al. The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut[J]. Science,2012,336(6080): 485-489 |
| [36] | Vujkovic-Cvijin I,Dunham RM,Iwai S,et al. Dysbiosis of the gut microbiota is associated with HIV disease progression and tryptophan catabolism[J]. Science Translational Medicine,2013,5(193): 1-12 |
| [37] | Moeller AH,Shilts M,Li Y,et al. SIV-induced instability of the chimpanzee gut microbiome[J]. Cell Host and Microbe,2013,14(3): 340-345 |
| [38] | Nylund L,Satokari R,Nikkila J,et al. Microarray analysis reveals marked intestinal microbiota aberrancy in infants having eczema compared to healthy children in at-risk for atopic disease[J]. BMC Microbiology,2013,13(1): 12 |
| [39] | Bailey MT,Coe CL. Maternal separation disrupts the integrity of the intestinal microflora in infant rhesus monkeys[J]. Developmental Psychobiology,1999,35(2): 146-155 |
| [40] | Eutamene H,Bueno L. Role of probiotics in correcting abnormalities of colonic flora induced by stress[J]. Gut,2007,56(11): 1495-1497 |
| [41] | Cryan JF,O’Mahony SM. The microbiome-gut-brain axis: from bowel to behavior[J]. Neurogastroenterology and Motility,2011,23(3): 187-192 |
| [42] | Bested AC,Logan AC,Selhub EM. Intestinal microbiota,probiotics and mental health: from Metchnikoff to modern advances: Part II-contemporary contextual research[J]. Gut Pathogens,2013,5(3): 1-14 |
| [43] | Hsiao EY,McBride SW,Hsien S,et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders[J]. Cell,2013,155(7): 1451-1463 |
| [44] | Bhattacharjee S,Lukiw WJ. Alzheimer’s disease and the microbiome[J]. Frontiers in Cellular Neuroscience,2013,7(153): 1-4 |
| [45] | Zhang Y,Guo X,Guo JL,et al. Lactobacillus casei reduces susceptibility to type 2 diabetes via microbiota-mediated body chloride ion influx[J]. Scientific reports,2014,4: 5654 |
| [46] | Zhang Y. Ameliorative effect of probiotics Lactobacillus casei Zhang on rat with glucose tolerance and preventive effect on type 2 diabetes rat model[D]. Hohhot: Doctoral Dissertation of Inner Mongolia Agricultural University,2013 (in Chinese)张勇. 益生菌Lactobacillus casei Zhang对大鼠糖耐量受损改善作用和Ⅱ型糖尿病预防作用[D]. 呼和浩特: 内蒙古农业大学博士学位论文,2013 |
| [47] | Zhang JC,Wang LF,Guo Z,et al. 454 pyrosequencing reveals changes in the faecal microbiota of adults consuming Lactobacillus casei Zhang[J]. FEMS Microbiology Ecology,2014,88(3): 612-622 |
| [48] | Kwok LY,Zhang J,Guo Z,et al. Characterization of fecal microbiota across seven Chinese ethnic groups by quantitative polymerase chain reaction[J]. PLoS One,2014,9(4): e93631 |
| [49] | Zhang F,Luo W,Shi Y,et al. Should we standardize the 1700-year-old fecal microbiota transplantation[J]. The American journal of gastroenterology,2012,107(11): 1755 |
| [50] | Surawicz CM,Brandt LJ,Binion DG,et al. Guidelines for diagnosis,treatment,and prevention of Clostridium difficile infections[J]. The American journal of gastroenterology,2013,108(4): 478-498 |
| [51] | Zhang FM,Wang HG,Wang M,et al. Fecal microbiota transplantation for severe enterocolonic fistulizing Crohn’s disease[J]. World journal of gastroenterology: WJG,2013,19(41): 7213-7216 |
 2015, Vol. 42
2015, Vol. 42