扩展功能
文章信息
- 侯俊, 代珊珊, 王超, 王沛芳, 苗令占, 许伊
- 人工纳米材料与生物膜相互作用机制及影响因素研究进展
- Research progress in the interaction mechanism of manufactured nanomaterials and biofilms and its influencing factors
- 微生物学通报, 2015, 42(2): 384-392
- Microbiology China, 2015, 42(2): 384-392
- 10.13344/j.microbiol.china.140462
-
文章历史
- 收稿日期: 2014-06-10
- 接受日期: 2014-08-27
- 优先数字出版日期(www.cnki.net): 2014-09-11
2. 河海大学 环境学院 江苏 南京 210098
2. College of Environment,Hohai University,Nanjing,Jiangsu 210098,China
人工纳米材料(Manufactured nanomaterials,MNMs)是指以应用为目的被人工制造出来的、三维空间尺度至少有一维处于纳米量级(1-100 nm)的并且具有高度均匀性的材料。与常规尺寸材料相比,纳米材料有其独特的物理化学性质,如小尺寸效应、表面效应、宏观量子隧道效应等,因而被广泛应用于生产和生活的各个领域[1]。随着MNMs被大量和广泛应用于生产和生活的各个领域,其特殊的环境行为和生物安全性研究引起了相关领域内众多学者的关注和多个国家的重视[2, 3]。MNMs可通过生产—运输—使用—处理处置过程、污水处理尾水排放、地表径流、垃圾填埋渗滤等途径直接或间接地进入水环境,对水生生物和生态系统产生毒性胁迫,被认定属于潜在的新型污染物[4]。著名科学家Colvin教授指出:虽然目前MNMs在自然水体中的浓度还很低,但是由于其具有长期累积作用,且排放量有日益增加的趋势,因此应防范于未然,在它还未对环境造成危害时提早研究和预防[5]。
生物膜是自然水体中一种广泛存在的典型环境介质[6],有微生物存在的地方就会有生物膜的产生。在水环境中,微生物细胞几乎能在任何适宜的载体表面牢固地附着,并在其上生长和繁殖,由细胞内向外伸展的胞外聚合物使微生物细胞形成纤维状的缠结结构,称之为生物膜。自然水体生物膜普遍存在于河流、湖泊、湿地、河口以及海洋环境中水面下的各种表面上,如石块、植物茎叶、悬浮颗粒、表层沉积物等表面上,代表了一种稳定的由微生物细胞及非生物物质镶嵌在微生物分泌的有机聚合物基质中的复杂微生态系统[7]。生物膜作为初级生产力,结构和功能微观耦合对水生态系统的物质和能量循环具有重要作用[8, 9]。生物膜具有很大的表面积,有非常强的氧化能力,可大量吸附污染水体中呈多种状态的有机物,并通过生物膜的吸附、吸收及生物代谢作用而降解去除;生物膜中含有硝化菌、反硝化菌、聚磷菌以及反硝化聚磷菌等功能细菌,对富营养水体也具有一定的脱氮除磷作用;由于生物膜内高生物量和胞外聚合物(Extracellular polymeric substances,EPS)固定能力,通过生物吸附、生物积累和生物沉淀等作用,对去除环境中的重金属、放射性物质和人工纳米材料也具有良好的效果[10]。可见,生物膜在水生态系统平衡和水环境演变中扮演着非常重要的角色,其对自然水体的水质改善和生态修复具有重要作用,开展MNMs在水生态系统中的环境行为与生物安全科学研究,就必须首先科学认识MNMs在水-生物膜体系中的环境行为与生物效应[11]。
然而,人工纳米材料在水-生物膜体系中的环境行为与生物效应是一个比较复杂的过程。一方面,MNMs会通过纳米尺寸效应、自由基氧化损伤、溶出金属离子毒性效应等对生物膜产生毒性,抑制其活性和生态功能[12, 13];另一方面,生物膜可以通过吸附作用和EPS影响MNMs在水环境中的环境行为和生态效应,对自然水体中MNMs的去除具有重要作用[14, 15]。目前关于上述生物膜与MNMs之间相互作用及生态效应方面的研究和认知甚少[16]。例如,MNMs进入水-生物膜体系后有多少发生团聚、团聚体有多少会沉降、有多少吸附于生物膜上、有多少纳米材料会释放金属离子?生物膜的吸附作用和EPS会如何影响纳米颗粒物的表面特性、尺寸分布、团聚程度、沉浮状态、离子释放,进而对其水生生物毒性效应会造成怎样的影响?吸附在生物膜上的MNMs是分散还是团聚的,会对生物膜的活性造成怎样的影响,其毒性影响机制是怎样的?诸如此类问题,至今无人给出基于实验研究证据的明确结论,而在我国纳米材料潜在污染和生态风险日益突出的背景下,开展相关研究并清楚回答上述问题无疑是非常必要和迫切的。
1 人工纳米材料对生物膜的毒性效应目前MNMs对微生物的毒性效应研究多是针对特定菌种或活性污泥微生物群体,关于MNMs对自然水体生物膜活性的影响机理和毒性作用机制方面的研究报道还非常少,但MNMs对生物膜的抑制作用已受到不少科学家的关注,正逐渐成为研究热点。
1.1 人工纳米材料对生物膜细菌活性影响细菌是生物膜中的主体,目前许多研究表明,纳米材料具有胞内毒性,对细菌具有抑制杀灭作用。Adams等报道了nTiO2、nSiO2和nZnO三种纳米金属氧化物水悬浮液对枯草杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)的生态毒性实验,发现nZnO的灭菌作用相对最强[17];研究发现,当nZnO的浓度高于1.3×10−3 mol/L时就对大肠杆菌产生毒性作用[18]。Choi等研究表明短期暴露1 h后,Ag-NPs就可以穿透生物膜40 μm的厚度;结晶紫染色后用共聚焦激光扫描显微镜观察显示:当Ag-NPs浓度为50 mg/L时,部分细菌失活;而浓度达到100 mg/L时,细菌几乎全部死亡[13]。Zheng 等[19]用变性梯度凝光电泳技术和荧光原位杂交技术分析得出,长期(70 d)暴露于50 mg/L nTiO2中,活性污泥中的硝化细菌、氨氧化细菌的活性大大降低。通过使用呼吸运动计量法和自动微量荧光法发现,浓度为1 mg/L的Ag-NPs对自养型硝化细菌呼吸过程的抑制率可达86%±3%[20]。
笔者运用氧微电极研究了nZnO对于好氧污水生物膜中微生物O2呼吸活性的抑制作用[21],实验结果表明:时间分布上nZnO在开始的2 h内对生物膜呼吸产生抑制作用;空间分布上50 mg/L的nZnO仅对生物膜表层约200 μm的微生物活性具有抑制作用,而处在生物膜更深层部分的细菌表现的更加活跃。
1.2 人工纳米材料对生物膜中微生物群落结构的影响生物膜中微生物群落结构与生物多样性对其结构特征、物质代谢、净污活性起着举足轻重的作用,人工纳米材料在对生物膜中微生物生长产生抑制作用,导致生物膜的体积和生物量显著减少的同时,将使得生物膜中微生物群落结构发生变化。García等[22]在研究nCeO2、nTiO2、Ag-NPs和Au-NPs对废水处理中微生物群落活性的影响中发现nCeO2可以100%的抑制生物气体的产生,对其他的生物质也产生强烈的抑制作用;Ag-NPs只引起中等的抑制作用(约33%−50%);而Au-NPs和nTiO2对所有测试的生物质产生轻微的或基本无抑制作用。Fabrega等[23]研究Ag-NPs对生物膜形成和演替的影响时利用末端限制性片段长度多态性技术(T-RFLPs)分析生物膜中复杂的微生物群落结构,发现当Ag-NPs暴露接触于生物膜时,γ-变形菌的生长受到了抑制,蓝藻的数量却增加,但是生物膜中的主要群组并未被取代;高浓度的Ag-NPs会阻止新的细菌繁殖到生物膜上,随着长时间对生物膜生长的潜在影响也会改变生物膜群组的相对丰富度。Ag-NPs阻碍生物膜演替的原因可能是由于聚集到生物膜上的Ag-NPs影响了后续要增殖的浮游细胞的吸附和沉降,然而这些机理还需要进一步的研究。Cardinale等[24]在研究nTiO2对生物膜附着藻类的影响发现,通过对3种淡水藻类(衣藻、小球藻、栅藻)的生长速率、初级总生产力的代谢率及呼吸率的测定,nTiO2可抑制浮游藻类的生长;根据种属不同,群落生长率降低的范围为11%−27%,而且不同种属的生长率降低的机理也不同。
1.3 人工纳米材料对生物膜净污活性的影响生物膜中含有硝化菌、反硝化菌、聚磷菌以及反硝化聚磷菌等功能细菌,在污染水体的脱氮除磷中发挥着重要作用[25, 26]。人工纳米材料的毒性作用会抑制上述功能菌的生长,从而影响生物膜的净污活性,虽然还未见到该方面的研究报道,但已在活性污泥的研究中得到了证实。Zheng等[27]研究发现在厌氧-低溶解氧序批式反应器(SBR)中,nZnO对活性污泥中氮和磷的去除造成很大的影响,浓度分别为10、50 mg/L的nZnO使得氮的去除率从81.5%分别降到75.6%和70.8%,而相应的出水中磷的浓度从无法检测分别增加到10.3 mg/L和16.5 mg/L,远远高于进水中磷的浓度(9.8 mg/L)。
人工纳米材料还会影响控制有机物代谢过程的脱氢酶(DHA),控制生物脱氮过程的氨单加氧酶(AMO)、亚硝酸盐氧化还原酶(NOR)、硝酸根还原酶(NAR)、亚硝酸根还原酶(NIR),控制除磷过程的外切聚磷酸酶(PPX)、多磷酸盐激活酶(PPK)等关键功能酶,从而影响净污活性。Zheng等[27]进一步研究发现50 mg/L nTiO2抑制了AMO、NOR的活性,但是对PPX和PPK的活性却无显著影响。Chen 等[28]也发现长期暴露于50 mg/L nAl2O3颗粒后,活性污泥微生物中NAR和NIR的活性均显著下降,总氮的去除率也从80.4%下降到62.5%。综上研究表明,人工纳米材料对污水中氮和磷的去除与纳米材料本身及浓度相关,而且氮的去除程度相关性 较大。
2 人工纳米材料对生物膜毒性作用机制及其影响因素 2.1 人工纳米材料对生物膜毒性作用机制人工纳米材料对微生物和生物膜的毒性作用机制虽然有了一些研究,但目前还没有统一的结论。目前研究主要涉及对生物膜微生物细胞损伤、产生活性氧(ROS)和氧化胁迫、抑制生物膜内酶活性、诱导微生物细胞DNA的损伤等,如图 1所示。
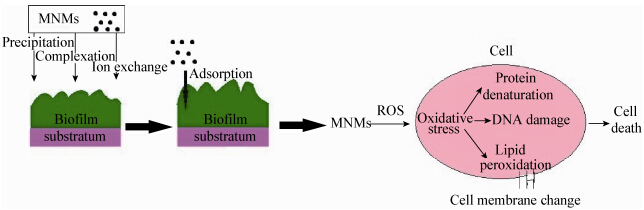
|
| 图 1 MNMs对生物膜细菌的影响机理图 Figure 1 The effect mechanism of MNMs on biofilm bacterial |
MNMs进入到水体中后可以通过沉淀、络合、离子交换等多种方式吸附在生物膜表面,吸附到生物膜上的MNMs由于其纳米尺度效应可以携带污染物通过跨膜运输进入生物膜内使得毒性更强,另一方面吸附于膜上不但影响膜的通透性而且影响生物膜内藻类的光合作用[29]。细菌的细胞壁上含有多种官能团,主要有羧基、咪唑、巯基、氨基、磷酸盐、硫酸盐、硫醚、酚、羰基、酰胺基和羟基,这些基团已被证实具有吸附功能[30]。MNMs吸附到细胞后很容易进入到细胞内部,当MNMs接触细胞后会对其产生氧化胁迫,一般认为MNMs对细胞的氧化胁迫是其重要的毒性作用机制[31]。部分具有高活性的MNMs能自发产生活性氧自由基(ROS),或者影响细胞间的相互作用而促进ROS的产生,ROS产生后氧化脂质使蛋白质变性、DNA受损、干扰信号网络功能和基因转录等,进而影响细胞内的正常新陈代谢作用,最终细胞死亡[32, 33]。
Bonnineau等[34]研究表明过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)这3种酶构成了生物膜内抗氧化酶(Antioxidant enzyme activities,AEA)系统,其在维持胞内氧化还原平衡和抵抗氧化胁迫中发挥重要作用;浓度为 150 µg/L的除草剂乙氧氟草醚缓慢接触成熟生物膜5周内,CAT的活性波动范围是102.2−197.1 (对照)和87.5−274.3 (接触) μmol H2O2 mg/(prot·min),APX的活性波动范围是0.369−1.120 (对照)和0.272−1.136 (接触) μmol 抗坏血酸 mg/(prot·min)以及GR的活性波动范围是124.4−265.9 (对照)和95.7−330.2 (接触) μmol NADPH mg/(prot·min);由乙氧氟草醚诱导的氧化应激导致的AEA活性显著增加,表明污染物可以诱导生物膜内AEA系统的活性。Bonet等[35]研究发现浓度为320 μg Zn/L的ZnCl2接触生物膜24 h后,APX活性第一个发生明显改变;接触3周后,CAT活性增强;上述研究表明AEA系统可以作为指示污染的水体生物膜的早期预警生物标志物,为生物膜受到氧化胁迫引起的早期应激提供有力证据。然而,NPs对生物膜的氧化胁迫方面研究目前还未见报道,可研究NPs对水体生物膜的抗氧化酶系统的影响,并通过综合生物标志物响应指数法(Integrated biomarker response index,IBR)评价NPs对生物膜的综合毒性效应。
纳米金属氧化物、纳米金属、量子点等纳米颗粒物在水体中能溶解释放出金属离子,对细胞及微生物造成毒害作用[36]。用Ag+与Ag-NPs进行对照实验表明Ag+毒性更强,更易进入细菌的细胞[12]。这一结果与Radzig等[37]的研究相似,Ag+在较低的浓度下就可以抑制浮游生物的生长和生物膜的形成。刘富存[38]认为Ag+具有非常强的杀菌能力,是因为它极易被还原,而且它和有机官能团(−Sh,−NH2,−COOH)的反应力很强;Park等[39]则得出了相反的结论,原因主要是实验使用的Ag-NPs粉末中Ag+含量非常低,而且Ag-NPs的尺寸偏大。笔者研究发现高浓度的nZnO (50 mg/L)对生物膜的呼吸抑制作用主要是因为nZnO溶解后释放的Zn2+所产生的[21],这与很多研究成果都一致[32, 33]。
2.2 人工纳米材料对生物膜毒性效应影响因素纳米颗粒物的粒径、比表面积、几何形状、晶体结构、表面电荷分布等自身材料特性对其毒性效应具有重要影响。Peulen和Wilkinson[40]指出想要理解MNMs的稳定性、团聚性以及对水体生物的毒性,必须关注MNMs的扩散性。而MNMs的扩散性与自身的尺寸、电位及生物膜内的多聚物和微生物有很大关系。研究普遍认为,纳米材料的小粒径和大的比表面积将会呈现显著的尺寸效应和表面效应,从而产生更强的毒性效应[41]。例如,Choi等[42]研究表明Ag-NPs中粒径小于5 nm的颗粒对抑菌性有很大的影响,颗粒越小,越容易进入细胞,产生的毒性越大,即Ag-NPs的毒性效应与它的尺寸有很大关系;Radniecki等[43]也表明20 nm和 80 nm两种尺寸的Ag-NPs都会引起亚硝化单胞菌的活性降低,但20 nm的Ag-NPs的毒性比80 nm的强。但是也有其他研究指出,人工纳米材料进入水体后由于会发生团聚和沉降,导致纳米材料在水生态系统中的毒性效应与其粒径、比表面积相关性并不显著[44]。Park等[39]认为用柠檬酸涂层的Ag-NPs会减少其与细菌的直接接触而降低其对细菌的抑制作用;而Dror-Ehre等[45]认为用分子聚合的Ag-NPs (Ag-MCNPs)可以增加接触生物膜的几率,很大程度上阻碍生物膜的生长,其抑制率高达60%以上。研究表明NPs表面修饰的方法不同对细菌的影响也不同。
水介质的pH、离子强度(IS)、天然有机质(NOM)等也会通过影响NPs的环境行为进而影响其对生物膜的毒性作用。pH和IS主要是通过影响NPs在水介质中的团聚与分散过程,改变其尺寸分布和在水体中的稳定性,进而影响其毒性。例如,一般情况下,NPs的尺寸随水介质pH的提高而逐渐减小;水介质中离子强度高于0.05 mol/L能够明显增大纳米晶体颗粒的尺寸。Zhang等[46]研究发现当二价离子(如Ca2+和Mg2+)存在时Ag-NPs的抗菌行为降低,因为Ca2+、Mg2+存在时Ag-NPs易团聚,尺寸变大,毒性减小。NOM则主要通过增强电子排斥、降低相互吸引的范德华力、产生空间位阻等方式阻碍NPs与细胞的相互作用,降低其对生物膜的毒性效应。
胞外聚合物(EPS)的组成主要是胞外多糖、蛋白质、脂质、少量核酸和其他生物聚合物,是生物膜的主要成分[47, 48],在生物膜抵御毒性胁迫中发挥着重要作用,具有完整EPS的生物膜表现出较高的耐受性[49]。Choi等[13]发现在含有相同细菌数量 (3×108 CFU/mL)的情况下,生物膜抵抗Ag-NPs的抑制作用是浮游细胞的4倍;Sheng等[12]也发现浓度为200 mg/L的Ag-NPs与完整的细菌生物膜接触24 h后,细菌的减少量没有多大变化;而当去除生物膜表面结合的EPS时,就会显著影响细菌的数量。这说明微生物分泌的EPS形成特殊的聚集体结构使生物膜表现出比浮游态微生物更强的耐受性。Hou等[50]认为EPS分为溶解性EPS (S-EPS)、表面松散结合的EPS (LB-EPS)以及紧密结合的EPS (TB-EPS),用扫描电镜(SEM)观察LB-EPS发现其表面粗糙且呈蜂窝空洞状,有利于吸附有毒有害物质,从而对生物膜中微生物起到保护屏障的作用。Hessler等[51]也认为浮游细菌和nTiO2接触时,EPS可以作为细胞膜的屏障来降低细胞膜受损害程度。Joshi等[52]研究发现EPS和相关的生物聚合物(如黄原胶)可以促进纳米颗粒团聚而降低它们的毒性。笔者通过电镜观察和乳酸脱氢酶(LDH)分析发现,由于EPS的物理性屏障保护作用及其导致的延缓运输效应,使得生物膜微生物细胞膜的完整性基本没有受到nZnO的影响;尽管nZnO可以吸附到生物膜表面或者进入内部,但由于EPS的存在,nZnO会发生明显团聚以致毒性降低。
3 生物膜对纳米材料的吸附作用及机理生物膜作为水生态系统中重要的环境介质,其对MNMs的吸附作用以及EPS对MNMs的影响近年来已经引起科学家们的兴趣。目前研究主要集中在生物膜对MNMs的吸附动力学、人工纳米材料表面特性和环境条件(天然有机质、表面活性剂、盐度等)对生物膜吸附的影响等方面[53, 54]。
Eduok等[55]认为一旦MNMs进入废水处理系统中会发生以下途径:(1) 团聚;(2) 被有机质、生物质和/或EPS吸附;(3) 与其他混合物或微生物转化物反应。Lawrence等[56]指出金属纳米材料进入水体中还会发生以下途径:(1) 溶解成离子态;(2) 转变成氧化态;(3) 被特定的微生物物种进行后续的吸附或吸收;(4) 作为营养转移到有机体上。可见,被生物质/EPS吸附是将人工纳米材料从水体中去除的重要途径。Kiser等[14]认为MNMs被吸附的机理包括两个方面,一是吸附到EPS或细菌的表面;二是被细胞吸收,此过程主要通过被动扩散、跨膜以及通过破损的细胞膜扩散这3种行为来完成。笔者通过序批式实验探究不同环境条件下(pH、NOM、EPS、温度)天然水体生物膜对nZnO的吸附动力学和吸附平衡,发现在中性及酸性条件下吸附较多;NOM吸附到生物膜的表面产生空间位阻会使生物膜对nZn的吸附减少;去除松散EPS的生物膜会增强吸附能力;吸附符合准一级动力学方程和Langmuir等温吸附曲线[57]。
Khan等[15]研究EPS吸附Ag-NPs时发现,pH和离子强度对吸附作用有很大的影响:当pH从4.0增加到9.0时,吸附强度急剧减少,EPS在所有的pH条件下都显示负的Zeta电位,Ag-NPs具有正的Zeta电位,但随着pH值的增加其电位逐渐降低,而且pH大于8.0后Ag-NPs则显示负的Zeta电位,此结果说明pH能直接的影响Zeta电位。当离子强度(NaCl)从0增加到0.1 mol/L时,250 mg/L EPS对Ag-NPs的吸附无明显变化;然而,当离子强度大于0.1 mol/L时,吸附作用快速降低,此结果说明离子浓度增大会引起Ag-NPs发生聚集,尺寸变大,被EPS吸附的表面积减少。Li等[58]研究发现饮用水处理厂(DWTPs)中砂介质过滤器含有生物膜会增加对NPs的吸附作用,但对聚合物包裹的NPs吸附却不显著;通过去离子水和DWTPs源水(含有主要的离子有Mg2+、K+、Na+、Ca2+)的对比试验表明,nZnO和 柠檬酸涂层的Ag-NPs在源水中团聚尺寸分别会增大2和9倍,说明水中含有二价离子存在时NPs很稳定,生物膜对其吸附能力下降。
Nevius[59]分别以胺、羧酸盐和硫酸盐改性的带电NPs为研究对象,硫酸盐修饰的NPs在高浓度溶液中被生物膜吸附的最多,相反羧酸盐修饰的NPs却吸附很少,这一结果表明生物膜对不同电性的NPs的吸附不同。Kiser等[14]研究发现掺杂异硫氰酸荧光素的SiO2 (二氧化硅-FITC)、非官能化富勒烯(aq-nC60和tol-nC60)、官能化富勒烯[nC60(OH)x和nC60-PVP]、nTiO2、Ag-NPs、功能性纳米银(F-nAg) 8种纳米材料中,Ag-NPs被生物质吸附的最多,高达97% Ag-NPs可被去除,被生物吸附去除的则达88%,而部分是由于Ag-NPs的团聚和沉降去除。Jing等[60]通过投射电子显微镜(TEM)观察到CeO2-NPs主要吸附在生物膜的空洞和沟壑结构表面。Lawrence等[56]通过X射线扫描投射显微镜(STXM)观察Cu-NPs主要被生物膜中的硅藻吸附,且分布在和硅藻相联系的富含脂质的胞外聚合物中,而细菌和蓝藻并未观测到吸附Cu-NPs。
4 本研究领域存在不足及未来发展方向(1) 人工纳米材料在水-生物膜体系中的分布和归趋。研究人工纳米材料进入水环境后在水-生物膜体系中的分布归趋及其对生物膜的暴露途径和暴露水平,生物膜对人工纳米材料的吸附特性,特别是生物膜不同胞外聚合物组成(溶解态EPS、松散结合态EPS和紧密结合态EPS)在生物膜吸附纳米材料过程中的作用机制,生物膜EPS对人工纳米材料在水体中稳定性的影响。
(2) 人工纳米材料对自然水体中生物膜净污活性影响和毒性作用机理。探明纳米材料如何通过对微生物呼吸活性抑制、细胞膜结构损伤、氧化胁迫等毒性作用,抑制生物膜中功能微生物、中间代谢产物的合成或分解过程、具有脱氮除磷生物催化活性关键酶活力,从而影响生物膜净污活性的过程和机制。
(3) 基于生物膜抗氧化酶活性的人工纳米材料污染IBR评价。筛选对纳米材料比较敏感的生物膜抗氧化酶活性,作为纳米材料污染早期生物监测评价的生物标志物,运用改进的综合生物标志物响应指数(IBR)方法,综合多种生物标志物的响应后,以标准指数来评价纳米材料污染的综合影响和直观反映污染状况,探索利用生物膜抗氧化酶活性对纳米材料污染进行生物监测和评价的方法。
(4) 运用材料科学分析、生物化学(酶学)分析、分子生物学、环境科学分析相结合的综合研究方法,采用先进的放射性同位素示踪法、高分辨电感耦合等离子体质谱法定量分析水环境中的人工纳米材料,通过生物膜细胞内关键功能酶活力表征其净污活性,运用抗氧化酶活性作为生物标志物反映生物膜对纳米材料氧化胁迫的响应。
| [1] | Zuo G,Kang S,Xiu P,et al. Interactions between proteins and carbon-based nanoparticles: exploring the origin of nanotoxicity at the molecular level[J]. Small,2013,9(9/10): 1546-1556 |
| [2] | Nel A,Xia T,Madler L,et a1. Toxic potential of materials at the nanolevel[J]. Science,2006,311(5761): 622-627 |
| [3] | Maynard A,Aitken RJ,Butz T,et al. Safe handling of nanotechnology[J]. Nature,2006,444(7117): 267 |
| [4] | Domingos RF,Baalousha MA,Ju-Nam Y,et al. Characterizing manufactured nanoparticles in the environment: multimethod determination of particle sizes[J]. Environmental science & technology,2009,43(19): 7277-7284 |
| [5] | Colvin VL. The potential environmental impact of engineered nanomaterial[J]. Nature Biotechnology,2003,21(10): 1166-1170 |
| [6] | Ram RJ,VerBerkmoes NC,Thelen MP,et al. Community proteomics of a natural microbial biofilm[J]. Science,2005,308(5730): 1915-1920 |
| [7] | Flemming HC,Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology,2010,8(9): 623-633 |
| [8] | Battin TJ,Kaplan LA,Newbold JD,et al. Contributions of microbial biofilms to ecosystem processes in stream mesocosms[J]. Nature,2003,426: 439-442 |
| [9] | Wang C,Miao L,Hou J,et al. The effect of flow velocity on the distribution and composition of extracellular polymeric substances in biofilms and the detachment mechanism of biofilms[J]. Water Science and Technology,2014,69(4): 825-832 |
| [10] | Headley JV,Gandrass J,Kuballa J,et al. Rates of sorption and partitioning of contaminants in river biofilm[J]. Environmental Science and Technology,1998,32(24): 3968-3973 |
| [11] | Battin TJ,Kammer FV,Weilhartner A,et al. Nanostructured TiO2: transport behavior and effects on aquatic microbial communities under environmental conditions[J]. Environmental Science and Technology,2009,43(21),8098-8104 |
| [12] | Sheng ZY,Liu Y. Effects of silver nanoparticles on wastewater biofilms[J]. Water Research,2011,45: 6039-6050 |
| [13] | Choi O,Yu CP,Fernández GE,et al. Interactions of nanosilver with Escherichia coli cells in planktonic and biofilm cultures[J]. Water Research,2010,44: 6095-6103 |
| [14] | Kiser MA,Ryu H,Jang HY,et al. Biosorption of nanoparticles to heterotrophic wastewater biomass[J]. Water Research,2010,44: 4105-4114 |
| [15] | Khan SS,Mukherjee A,Chandrasekaran N. Impact of exopolysaccharides on the stability of silver nanoparticles in water[J]. Water Research,2011,45: 5184-5190 |
| [16] | Brumfiel G. Nanotechnology: a little knowledge[J]. Nature,2003,424(6946): 246-248 |
| [17] | Adams LK,Lyon DY,Alvarez PJJ. Comparative ecotoxicity of nanoscale TiO2,SiO2,and ZnO water suspensions[J]. Water Research,2006,40(19): 3527-3532 |
| [18] | Bra Yner R,Ferrari Iliou R,Brivois N,et al. Toxicological impact studies based on Escherichia coli bacteria in ultrafine ZnO nanoparticles colloidal medium[J]. Nano Letters,2006,6(4): 866-870 |
| [19] | Zheng X,Wu R,Chen Y. Effects of ZnO nanoparticles on wastewater biological nitrogen and phosphorus removal[J]. Environmental science & technology,2011,45(7): 2826-2832 |
| [20] | Choi O,Deng KK,Kim NJ,et al. The inhibitory effects of silver nanoparticles,silver ions,and silver chloride colloids on microbial growth[J]. Water Research,2008,42(12): 3066-3074 |
| [21] | Hou J,Miao L,Wang C,et al. Inhibitory effects of ZnO nanoparticles on aerobic wastewater biofilms from oxygen concentration profiles determined by microelectrodes[J]. Journal of Hazardous Materials,2014,276: 164-170 |
| [22] | García A,Delgado L,Torà JA,et al. Effect of cerium dioxide,titanium dioxide,silver,and gold nanoparticles on the activity of microbial communities intended in wastewater treatment[J]. Journal of hazardous materials,2012,199: 64-72 |
| [23] | Fabrega J,Zhang R,Renshaw JC,et al. Impact of silver nanoparticles on natural marine biofilm bacteria[J]. Chemosphere,2011,85(6): 961-966 |
| [24] | Cardinale BJ,Bier R,Kwan C. Effects of TiO2 nanoparticles on the growth and metabolism of three species of freshwater algae[J]. Journal of Nanoparticle Research,2012,14(8): 1-8 |
| [25] | Liu YN,Yu SL,Zhao BJ,et al. Study on the role of extracellular exopolymers in biological phosphorus removal[J]. Jorunal of Harbin Institute of Technology,2005,37(5): 623-625 (in Chinese)刘亚男,于水利,赵冰洁,等. 胞外聚合物对生物除磷效果影响研究[J]. 哈尔滨工业大学学报,2005,37(5): 623-625 |
| [26] | Zhang LY,Xu CF,Ma C. Study on effect of extracellular polymeric substance on biological denitrification[J]. Journal of Harbin University of Commerce (Natural Science Edition),2012,28(2): 197-200 (in Chinese)张林燕,许传富,马聪. 胞外聚合物对生物脱氮效果的影响研究[J]. 哈尔滨商业大学学报: 自然科学版,2012,28(2): 197-200 |
| [27] | Zheng X,Chen Y,Wu R. Long-term effects of titanium dioxide nanoparticles on nitrogen and phosphorus removal from wastewater and bacterial community shift in activated sludge[J]. Environmental science & technology,2011,45(17): 7284-7290 |
| [28] | Chen Y,Su Y,Zheng X,et al. Alumina nanoparticles-induced effects on wastewater nitrogen and phosphorus removal after short-term and long-term exposure[J]. Water Research,2012,46(14): 4379-4386 |
| [29] | Doiron K,Pelletier E,Lemarchand K. Impact of polymer-coated silver nanoparticles on marine microbial communities: a microcosm study[J]. Aquatic Toxicology,2012,124: 22-27 |
| [30] | Javanbakht V,Alavi SA,Zilouei H. Mechanisms of heavy metal removal using microorganisms as biosorbent[J]. Water Science & Technology,2014,69(9): 1775-1787 |
| [31] | Lapresta-Fernández A,Fernández A,Blasco J. Nanoecotoxicity effects of engineered silver and gold nanoparticles in aquatic organisms[J]. TrAC Trends in Analytical Chemistry,2012,32: 40-59 |
| [32] | Xia T,Kovochich M,Liong M,et al. Comparison of the mechanism of toxicity of zinc oxide and cerium oxide nanoparticles based on dissolution and oxidative stress properties[J]. ACS nano,2008,2(10): 2121-2134 |
| [33] | Miller RJ,Lenihan HS,Muller EB,et al. Impacts of metal oxide nanoparticles on marine phytoplankton[J]. Environmental science & technology,2010,44(19): 7329-7334 |
| [34] | Bonnineau C,Tlili A,Faggiano L,et al. The use of antioxidant enzymes in freshwater biofilms: Temporal variability vs. toxicological responses[J]. Aquatic Toxicology,2013,136: 60-71 |
| [35] | Bonet B,Corcoll N,Guasch H. Antioxidant enzyme activities as biomarkers of Zn pollution in fluvial biofilms[J]. Ecotoxicology and environmental safety,2012,80: 172-178 |
| [36] | Brunner TJ,Wick P,Manser P,et al. In vitro cytotoxicity of oxide nanoparticles: comparison to asbestos,silica,and the effect of particle solubility[J]. Environmental science & technology,2006,40(14): 4374-4381 |
| [37] | Radzig MA,Nadtochenko VA,Koksharova OA,et al. Antibacterial effects of silver nanoparticles on gram-negative bacteria: influence on the growth and biofilms formation,mechanisms of action[J]. Colloids and Surfaces B: Biointerfaces,2013,102: 300-306 |
| [38] | Liu FC. Influence of Ag/HA Nanoparticels composite cacting on biofilm formation and its mechanism[D]. Shanghai: Doctoral Dissertation of Second Military Medical University,2010 (in Chinese)刘福存. Ag/HA纳米复合涂层对生物膜形成的影响及其作用机制[D]. 上海: 第二军医大学博士学位论文,2010 |
| [39] | Park HJ,Park S,Roh J,et al. Biofilm-inactivating activity of silver nanoparticles: a comparison with silver ions[J]. Journal of Industrial and Engineering Chemistry,2013,19(2): 614-619 |
| [40] | Peulen TO,Wilkinson KJ. Diffusion of nanoparticles in a biofilm[J]. Environmental science & technology,2011,45(8): 3367-3373 |
| [41] | Lee J,Cho M,Fortner JD,et al. Transformation of aggregated C60 in the aqueous phase by UV irradiation[J]. Environmental science & technology,2009,43(13): 4878-4883 |
| [42] | Choi O. Effect of silver nanoparticles on planktonic and biofilm cell growth[D]. Columbia: University of Missouri,2009 |
| [43] | Radniecki TS,Stankus DP,Neigh A,et al. Influence of liberated silver from silver nanoparticles on nitrification inhibition of Nitrosomonas europaea[J]. Chemosphere,2011,85(1): 43-49 |
| [44] | Lee J,Mackeyev Y,Cho M,et al. Photochemical and antimicrobial properties of novel C60 derivatives in aqueous systems[J]. Environmental science & technology,2009,43(17): 6604-6610 |
| [45] | Dror-Ehre A,Adin A,Markovich G,et al. Control of biofilm formation in water using molecularly capped silver nanoparticles[J]. Water research,2010,44(8): 2601-2609 |
| [46] | Zhang H,Smith JA,Oyanedel-Craver V. The effect of natural water conditions on the anti-bacterial performance and stability of silver nanoparticles capped with different polymers[J]. Water research,2012,46(3): 691-699 |
| [47] | Flemming H,Wingender J. Relevance of microbial extracellular polymeric substances (EPSs)-Part I: Structural and ecological aspects[J]. Water Science & Technology,2001,43(6): 1-8 |
| [48] | Flemming H,Wingender J. Relevance of microbial extracellular polymeric substances (EPSs)-Part II: Technical aspects[J]. Water Science & Technology,2001,43(6): 9-16 |
| [49] | Zhang P,Chen YP,Guo JS,et al. Adsorption behavior of tightly bound extracellular polymeric substances on model organic surfaces under different pH and cations with surface plasmon resonance[J]. Water research,2014,57: 31-39 |
| [50] | Hou W,Ma Z,Sun L,et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of hazardous materials,2013,261: 614-620 |
| [51] | Hessler CM,Wu MY,Xue Z,et al. The influence of capsular extracellular polymeric substances on the interaction between TiO2 nanoparticles and planktonic bacteria[J]. Water research,2012,46(15): 4687-4696 |
| [52] | Joshi N,Ngwenya BT,French CE. Enhanced resistance to nanoparticle toxicity is conferred by overproduction of extracellular polymeric substances[J]. Journal of hazardous materials,2012,241: 363-370 |
| [53] | Nevius BA,Chen Y,Ferry JL,et al. Surface- functionalization effects on uptake of fluorescent polystyrene nanoparticles by model biofilms[J]. Ecotoxicology,2012,21(8): 2205-2213 |
| [54] | Kang F,Alvarez PJ,Zhu D. Microbial extracellular polymeric substances reduce Ag+ to silver nanoparticles and antagonize bactericidal activity[J]. Environmental science & technology,2013,48(1): 316-322 |
| [55] | Eduok S,Martin B,Villa R,et al. Evaluation of engineered nanoparticle toxic effect on wastewater microorganisms: Current status and challenges[J]. Ecotoxicology and environmental safety,2013,95: 1-9 |
| [56] | Lawrence JR,Dynes JJ,Korber DR,et al. Monitoring the fate of copper nanoparticles in river biofilms using scanning transmission X-ray microscopy (STXM)[J]. Chemical Geology,2012,329: 18-25 |
| [57] | Miao L,Wang C,Hou J,et al. Kinetics and equilibrium biosorption of nano-ZnO particles on periphytic biofilm under different environmental conditions[J]. Journal of Environmental Informatics,2014,2(23): 1-9 |
| [58] | Li Z,Aly Hassan A,Sahle-Demessie E,et al. Transport of nanoparticles with dispersant through biofilm coated drinking water sand filters[J]. Water research,2013,47(17): 6457-6466 |
| [59] | Nevius BA. Sorption of charged nanoparticles to aquatic biofilm systems[D]. carolina: Master’s Thesis of University of south carolina,2009 |
| [60] | Jing H,Mezgebe B,Aly Hassan A,et al. Experimental and modeling studies of sorption of ceria nanoparticle on microbial biofilms[J]. Bioresource technology,2014,161: 109-117 |
 2015, Vol. 42
2015, Vol. 42




