扩展功能
文章信息
- 韩长志
- 植物病原丝状真菌G蛋白偶联受体的研究进展
- Advance in functional research of G protein-coupled receptors in phytopathogenic filamentous fungi
- 微生物学通报, 2015, 42(2): 374-383
- Microbiology China, 2015, 42(2): 374-383
- 10.13344/j.microbiol.china.140473
-
文章历史
- 收稿日期: 2014-06-12
- 接受日期: 2014-08-25
- 优先数字出版日期(www.cnki.net): 2014-08-28
丝状真菌作为一类重要的真菌,在植物病害以及人类、动物疾病方面具有重要的影响作用,同时也在工业、医药方面发挥着重要作用。目前,学术界关于丝状真菌的研究主要集中在细胞凋亡[1]、遗传转化[2, 3]、基因敲除技术[4]、基因功能[5]、小RNA[6]、启动子[7]等方面。G蛋白信号途径在植物与病原真菌互作过程中发挥重大作用,学术界对丝状真菌G蛋白信号途径展开了大量研究工作[8],而且对该信号途径上的G蛋白调节蛋白也展开了诸多工作[9, 10]。
G蛋白偶联受体(G protein-coupled receptors,GPCR)作为生物体内最大的一类跨膜蛋白受体家族,广泛存在于植物、动物、真菌以及人体。笔者利用CNKI数据库以及ScienceDirect数据库进行文献搜索,结果显示,无论是对国内期刊按照“篇名”、“主题”进行搜索,还是对国外期刊按照“GPCR”、“G protein-coupled receptors”进行检索,近十年间国内外期刊对于GPCR的研究报道呈上升趋势,最高年份出现在2012年,国内期刊报道有300篇,国外期刊报道有280篇。通过对上述文献内容进行梳理,发现前人对诸如酿酒酵母(Saccharomyces cerevisiae)、裂殖酵母(Schizosaccharomyces pombe)、粗糙脉孢霉(Neurospora crassa)、构巢曲霉(Aspergillus nidulans)、新型隐球酵母(Cryptococcus neoformans)等模式真菌[11]以及大豆疫霉(Phytophthora sojae)、橡树疫霉(Phytophthora ramorum)、致病疫霉(Phytophthora infestans)等卵菌GPCR的研究开展了较多工作[12],然而,对于稻瘟菌(Magnaporthe oryzae)、板栗疫病菌(Cryphonectria parasitica)等植物病原丝状真菌中的GPCR功能的研究缺乏较为深入的报道。本文基于已有的关于GPCR的研究报道,从其结构、分类以及功能等方面的研究现状进行综述、对比分析,并对植物病原丝状真菌中GPCR功能研究进行汇总分析,阐述GPCR研究中存在的问题,以期为深入开展这类植物病菌GPCR的研究提供重要的理论指导。
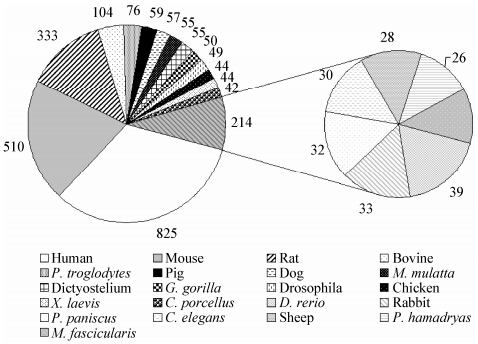
1 丝状真菌GPCR截止到2014年12月31日,已经报道了3 088个GPCR (http://www.uniprot.org/docs/7tmrlist)。其中,尤以人类(Human)中的GPCR数量居多,为825个;其次为小鼠(Mouse)、大鼠(Rat),所含GPCR分别为510、333个(图 1)。在已经报道的GPCR中,有关丝状真菌GPCR尚缺乏深入性研究。目前,M. oryzae至少有13个典型GPCRs以及150多个类似蛋白[13],其中,含有4个感受外界信号的类cAMP受体GPCR[14]。S. cerevisiae中含有4个GPCR,N. crassa中含有10个,A. nidulans中含有16个。笔者通过对禾谷炭疽菌(Colletotrichum graminicola)、希金斯炭疽菌(Colletotrichum higginsianum)全基因组进行BLASTp比对分析以及关键词搜索,均获得4个GPCR (韩长志等,另文发表)。与一些模式生物相比,丝状真菌所含的GPCR数量较少,产生该现象的原因尚不清楚,有待于今后进一步解析。
|
| 图 1 GPCR在不同物种中的分布情况 Figure 1 The distribution of the GPCR in different species |
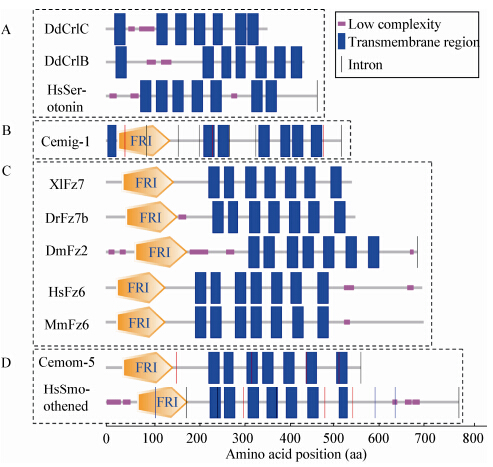
GPCR在氨基酸序列方面不具有较为保守的motif,而在蛋白质二级结构方面具有保守的七跨膜结构域[15]。通过对盘基网柄菌(Dictyostelium discoideum)、智人(Homo sapiens)、秀丽隐杆线虫(Caenorhabditis elegans)、小鼠(Mus musculus)、非洲蟾蜍(Xenopus laevis)、斑马鱼(Danio rerio)、果蝇(Drosophila melanogaster)等模式生物中的典型GPCR序列进行SMART[16]保守结构域分析发现,典型的GPCR二级结构均具有较为保守的七跨膜结构域,对其位置进行分析发现,D. discoideum DdCrlC、DdCrlB以及H. sapiens HsSerotonin仅含有单一的结构域且不含有内含子,而其余典型GPCR则含有FRI保守结构域(图 2A)。根据跨膜结构域位于FRI的位置,可以分为两类,一类为跨膜结构域位于FRI前方,如C. elegans Cemig-1 (图 2B);另一类为位于FRI后方,如X. laevis XlFz7、C. elegans Cemom-5等。同时,根据内含子的有无特点,可以将GPCR分为两类,不含有内含子的GPCR为:X. laevis XlFz7、D. rerio DrFz7b等(图 2C),含有内含子的GPCR为:C. elegans Cemom-5、H. sapiens HsSmoothened (图 2D)。通过对M. oryzae以及C. graminicola、C. higginsianum的研究发现,其所含的GPCR均具有典型的七跨膜结构域(韩长志等,另文发表)。
|
| 图 2 芦苇生态特征与水盐因子关系的冗余分析排序图 Figure 2 Biplot of the first two axes of the RDA (redundancy analysis) for water-salt indicators |
此外,一些真菌、卵菌中还存在诸如磷脂酰肌醇磷酸激酶(Phosphatidylinositol phosphate kinase,PIPK)、环核苷酸磷酸二酯酶(Cyclic nucleotide phosphodiesterases,PDE)、多磷酸肌醇磷酸化酶(Inositol polyphosphatep hosphatase,INPP)、G蛋白信号调控因子(Regulators of G-protein Signaling,RGS)、溶血素(Haemolysin,HLyIII)等特殊结构[11, 12, 17]。
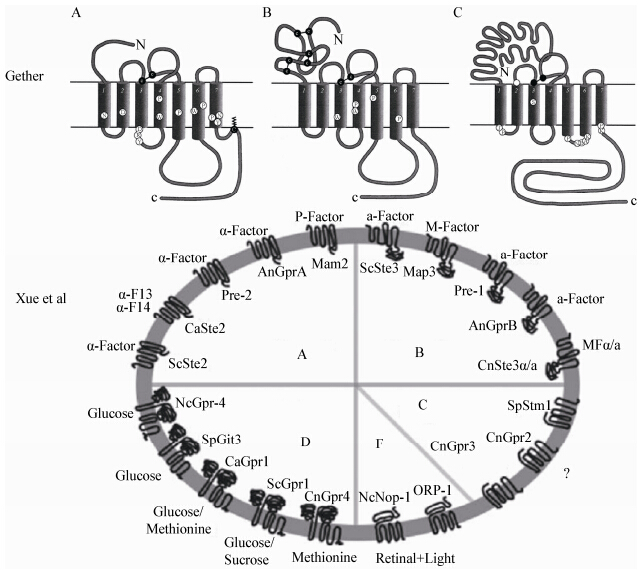
3 GPCR分类情况鉴于GPCR仅在二级结构方面具有典型的七跨膜结构域,同时在已报道的植物、动物、真菌以及人所含GPCR中氨基酸序列的同源方面较低,因此,对于其分类而言,诸多学者依据不同的分类标准得到不同的分类结果(表 1),如Gether[18]根据GPCR胞外环套的大小及胞外环套关键性的氨基酸和二硫键的形成情况,对1 000多个GPCR进行分析,明确分为A、B、C三大类(图 3)。近些年来,随着人们所发现的GPCR数量越来越多,诸多学者以“序列同源性及功能相似性”、“序列同源性及结合的配体感知情况”等作为新的分类标准,对不同物种的GPCR进行分类。同时,还出现一些综合分类方法,前期GPCR数据库(GPCRDB)认为GPCR可以分为A-E五大类,其中A-C为动物所有,对于D、E则为真菌所特有[19]。而目前,GPCRDB对GPCR家族进行了如下分类,即A类,视紫质蛋白类(Class A Rhodopsin like),B类,类分泌素受体蛋白(Class B Secretin like),C类,代谢型谷氨酸/激素受体(Class C Metabotropic glutamate/pheromone)以及犁鼻器受体(Vomeronasal receptors)。
| 学者Scholars | 分类依据Classification | 类群数量Numbers | 类群Species | |||||
| A | B | C | D | E | F | |||
| 注:−:该分类缺失. Note: −: The classification is missing. | ||||||||
| Gether[18] | 胞外环套的大小及胞外环套关键性的氨基酸和二硫键的形成 | 3 | 视紫质和b肾上腺受体 | 胰高血糖素、血管活性肠肽及降钙素等受体 | 味觉受体、代谢型谷氨酸受体、γ氨基丁酸受体和钙离子受体 | − | − | − |
| Attwood et al [25] kolakowski Jr LF[26] | 序列同源性及功能相似性 | 6 | 视紫质及视紫质类受体家族蛋白 | 分泌素受体家族 | 代谢型谷氨酸及激素受体家族 | 真菌的性激素受体家族 | 盘基网柄菌中感受腺苷酸环化酶的受体家族 | 果蝇中的卷曲/平滑受体家族 |
| Han et al[21] | 序列同源性及结合的配体感知情况 | 5 | 性激素受体Ste-2 | 性激素受体Ste-3 | 糖类受体Gpr1 | 营养受体Stm1 | 感受外源cAMP的受体 | − |
| Xue et al[24] | 综合前人研究成果 | 6 | Ste-2类激素受体 | Ste-3类激素受体 | Stm1类氮源感知受体 | 营养类受体 | 类cAMP受体 | 微生物视蛋白类受体 |
近年,随着诸多真菌全基因组序列的释放[20],真菌中所含GPCR在特征及功能方面不能全部归为上述所分类别,因此出现了对真菌中所特有的GPCR进行划分的分类情况,共分为5类[21];而后对构巢曲霉中16个GPCR进行的研究发现可划分至九大类[22],粗糙脉孢霉中10个GPCR则分为五大类[23];同时,对担子菌C. neoformans中鉴定出的非常庞大的七跨膜结构蛋白划分为五大类[24](表 2)。而接合菌门的米根霉(Rhizopus oryzae)中仅含有5个推测的氮源感知受体RO3G_03874、RO3G_15181、RO3G_13115、RO3G_13187、RO3G_10064,不含有其他类别的GPCR。此外,对于轮枝菌属(Verticillium)真菌中的大丽轮枝菌(V. dahliae)、黑白轮枝菌(V. albo-atrum)进行全基因组预测GPCR ,结果显示,前者含有22个GPCR,后者含有18个GPCR,上述GPCR可以分为12类,除包含原有的六大传统分类外,还包括与曲霉属同源的三类[22],涉及RGS、HLyIII以及与动物GPCR相似;还包括最新的GPCR类[17],涉及PTM1 GPCR、GPCR 89类受体以及Family C类GPCR (表 2)。
| 真菌Species | Ste-2类激素受体Ste2-like pheromone receptor | Ste-3类激素受体Ste3-like pheromone receptor | Stm1类碳源感知受体* Stm1-like carbon receptor | 营养类受体& Putative nutrient receptor | 类cAMP受体cAMP receptor-like | 微生物视蛋白类受体Microbial opsin |
| 注:*:推测的氮源感知受体;&:碳源感知受体;−:该分类缺失. Note: *: Putative carbon receptor; &: Putative nutrient receptor; −: The classification is missing. | ||||||
| 构巢曲霉 Aspergillus nidulans[27] | GprA(PreB) | GprB(PreA) | GprF, GprG, AN5720, GprJ | GprC, GprD, GprE | GprH, GprI, AN8262 | NopA |
| 稻瘟菌 Magnaporthe oryzae[28] | GprD,MGG_04711 | GprD,MGG_06452 | MGG_04698, MGG_02855 | MGG_08803 | Pre-1,MGG_06738 | MGG_09015 |
| 粗糙脉孢霉 Neurospora crassa[23, 29, 30] | Pre-1 | Pre-2 | Gpr-5, Gpr-6 | Gpr-4 | Gpr-1, Gpr-2, Gpr-3 | Nop-1, Orp-1 |
| 新型隐球酵母 Cryptococcus neoformans[31] | − | Ste3a/Ste3a、Cpr2 | Gpr2, Gpr3 | Gpr4 | Gpr4, Gpr5 | CNAG_03572,Ops1 |
| 米根霉 Rhizopus oryzae[24] | − | − | RO3G_03874, RO3G_15181, RO3G_13115, RO3G_13187, RO3G_10064 | − | − | − |
| 玉米黑粉菌 Ustilago maydis[24] | − | Pra1, Pra2 | − | UM06006,UM01546 | UM03423 | UM02629,UM04125 |
| 灰盖鬼伞菌 Coprinopsis cinerea[24] | − | Rcb1, Rcb2, Rcb3,CC1G_02129 | − | CC1G_07132,CC1G_04180 | CC1G_02288、CC1G_02310 | − |
| 大丽轮枝菌 Verticillium dahliae[17] | VDAG_05622 | VDAG_06338 | VDAG_02461、VDAG_05794 | VDAG_00060,VDAG_07964,VDAG_05120,VDAG_04720 | VDAG_04611,VDAG_02846,VDAG_09140 | VDAG_02933,VDAG_06764 |
| 黑白轮枝菌 Verticillium albo-atrum[17] | VDBG_04312 | VDBG_08677 | VDBG_02002 | VDBG_00450,VDBG_09485 | VDBG_09374,VDBG_02375 | VDBG_02458,VDBG_07121 |
尽管如此,对于不同物种中存在的GPCR归类情况尚存在着较多的争论,如在D. discoideum中发现含有1个GPCR-PIPK结构的蛋白DdRpkA,而在P. sojae、P. ramorum中则含有12个GPCR-PIPK结构,推测上述蛋白具有双信使功能[12],这些蛋白如何进行归类,尚不清楚。因此,对于GPCR的结构研究还应进一步得到加强,当前乃至于今后一段时间有待于建立一套以序列同源 性、结构相似性、功能相似性为打分项的综合打分系统,从而较好地实现学术上对GPCR的分类,有助于进一步深入研究该蛋白的功能。
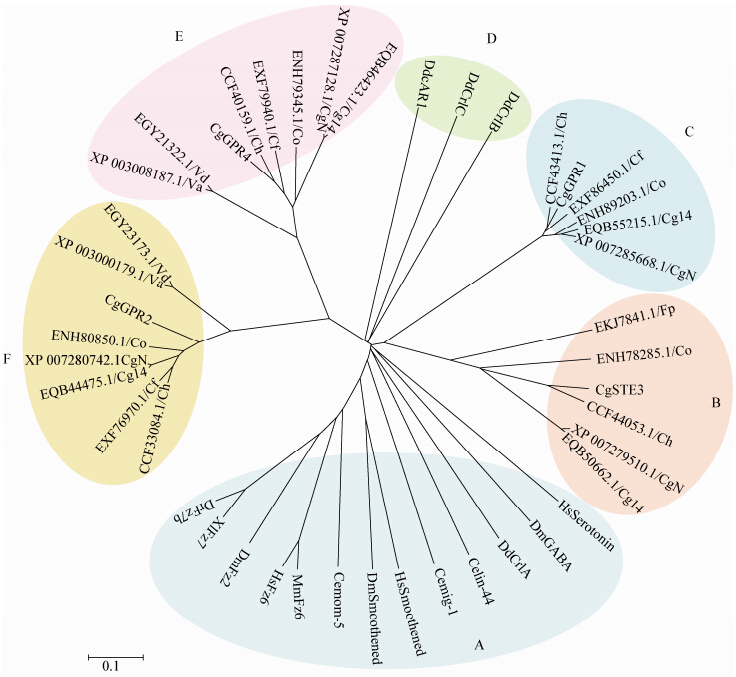
研究者通过对模式生物与大豆疫霉中所含GPCR进行遗传关系分析,结果发现,具有GPCR-PIPK结构的蛋白聚为一类,而其他不含有该结构的蛋白可以聚为一类[12]。尽管如此,对于丝状真菌中GPCR所存在的遗传关系尚不清楚,笔者通过对来自于D. discoideum、C. elegans、M. musculus、X. laevis、D. rerio、H. sapiens、D. melanogaster等模式生物的GPCR以及来自于禾谷炭疽菌、希金斯炭疽菌、胶孢炭疽菌、西瓜炭疽菌、大丽轮枝菌等丝状真菌中的GPCR进行遗传关系分析,发现模式生物与丝状真菌GPCR大致可以分为两大类,模式生物中的GPCR非常明显地聚成一类(图 4A),而其他丝状真菌则以不同类型GPCR进行聚类,具体而言,禾谷炭疽菌中存在的4个GPCR分别为CgSTE3、CgGPR1、CgGPR4以及CgGPR2,其他与禾谷炭疽菌GPCR同源的丝状真菌GPCR较好地聚在一起(图 4B-F)。上述分析结果也说明,对于GPCR的分类不能单一依赖于物种、结构等单独因素进行,而应该充分考虑物种、结构、序列等综合因素进行类别划分。
|
| 图 4 模式生物与丝状真菌中GPCR之间的遗传关系对比分析 Figure 4 Genetic relationships between model organisms and filamentous fungi GPCR Note: The name of the model organism and GPCR ID Number: Cemom-5,AAC47750; HsSmoothened,AAH09989; MmFz6,AAH26150; XlFz7,AAH42228; DrFz7b,AAH49397; HsFz6,AAH60836; HsSerotonin,AAH69356; Celin-44,AAK85460; DdCrlC,AAQ63680; DdCrlB,AAQ63681; DdcAR1,AAS59250; Cemig-1,CCD71747.1; DmGABA,P25123; DmSmoothened,P91682; DmFz2,Q9VVX3; DdCrlA,Q54U75.1. CgN Colletotrichum gloeosporioides Nara gc5; Cg14 Colletotrichum gloeosporioides Cg-14; CoColletotrichum orbiculare MAFF 240422; CfColletotrichum fioriniae PJ7; VaVerticillium alfalfae VaMs.102; VdVerticillium dahliae VdLs.17; Fp Fusarium pseudograminearum CS3096. |
GPCR作为人、动物、植物以及真菌等生物中分布最广、参与诸多功能的七跨膜表面受体,目前对该蛋白功能的研究多集中于与人类疾病(糖尿病、心脏病、肿瘤、免疫和感染性疾病、神经与精神疾病等)相关药物靶标受体而开展有关工作,据统计,已开发的药剂中有50%以上均是以该蛋白为作用靶标[32]。最初认为GPCR作为一种“分子开关”来对G蛋白进行调控,从而影响后续信号的传递,目前认为该蛋白作为一个“微型处理器”,除了接受外界信号外,还对信号传递、下游效应器发挥其重要的影响。GPCR作为重要的G蛋白细胞信号途径传递过程中的受体蛋白,与G蛋白偶合发生生物学特性,广泛参与外界信号感知、内部信号传递从而完成多种涉及生长、发育、细胞增殖和凋亡过程等多种生理生化以及病理反应[33]。
然而,在NCBI中,通过对已完成测序的植物病原真菌的“属名+GPCR”关键词进行搜索,结果并未发现在已知全基因组测序的丝状真菌Sclerotinia、Cochliobolus、Mycosphaerella、Ustilago、Sporisorium、Melampsora、Fusarium、Colletotrichum、Stagonospora、Botrytis等属中有关GPCR的研究报道,对于植物病原丝状真菌GPCR研究尚不够深入,直接导致目前农药开发未能进一步发展,有待于进一步开展相关研究。
构巢曲霉中含有9个GPCR (GprA-I)[34],其发挥的功能各不相同,但总体而言与S. pombe中诸多GPCR具有较大的同源性。随着诸多丝状真菌全基因组序列的公开,发现M. oryzae中包括大量的类GPCR基因,包括之前尚未报道的61个基因[35];同时,也发现了诸多具有不同新型结构的GPCR,如羧基末端的CFEM结构(Conserved fungal-specifi extracellular membrane-spanning)[36]。A. nidulans中仅含有2个上述结构蛋白、N. crassa仅含有1个。而在一些非丝状真菌白色念球菌(Candida albicans)、卡氏肺孢子虫(Pneumocystis carinii)中则完全缺失,或是在一些担子菌中的C. neoformans、玉米黑粉菌(Ustilago maydis)、黄孢原毛平革菌(Phanerochaete chrysosporium)中也不存在上述结 构[35],这些含有CFEM结构的蛋白在丝状真菌中具有何种功能,有待于进一步开展相关研究。此外,该特殊结构对于进一步开展不同类别的丝状真菌的研究分类工作具有重要的可借鉴价值。新的GP CR蛋白家族不断出现[37],对于其功能的认识也在不断加深,为进一步解析以该蛋白为靶标的药剂开发提供重要的理论基础。
M. oryzae中还具有一些新型结构的GPCR,如对附着胞形成表面识别的受体PTH11[13],以及其他真菌中也含有其他类型的GPCR,如V. dahliae、V. albo-atrum均存在具有RGS结构域、HLyIII结构域等新型GPCR以及与动物GPCR相似、类PTM1 GPCR、GPCR 89类受体、Family C类GPCR等类型[17](表 3)。尽管如此,A. nidulans中的GprM、GprN作为新型的GPCR,尚不清楚归为哪一类,有待于今后进一步研究明确。
| 真菌Species | 含有RGS结构域 RGS domain GPCR | 含有HLyIII结构域 HLyIII domain GPCR | 与动物GPCR相似 Similar to animal GPCR | 类PTM1 GPCR PTM1-like GPCR | GPCR 89类受体 GPCR 89 like receptors | Family C类GPCR Family C-like GPCR |
| 构巢曲霉Aspergillus nidulans | GprK | GprO,GprP | − | − | − | − |
| 大丽轮枝菌Verticillium dahliae | VDAG_08194, VDAG_09977 | VDAG_03447, VDAG_00450, VDAG_03172 | VDAG_03157 | VDAG_06634 | VDAG_10279 | VDAG_00541 |
| 黑白轮枝菌Verticillium albo-atrum | VDBG_08528, VDBG_03371 | VDBG_06292, VDBG_00835, VDBG_06012 | VDBG_06000 | VDBG_06989 | VDBG_06942 | VDBG_00931 |
关于生物中GPCR的研究还在不断地深入,随着新型GPCR的出现,该蛋白二级结构上所具有的传统典型七跨膜结构特征正在受到挑战,一些卵菌中新发现的GPCR含有5-9个跨膜结构域[11]。同样,在卵菌GPCR中的羧基端还含有一些如RGS、PIPK、PDE、INPP等特殊的结构,上述特殊结构有待于进一步在丝状真菌中开展结构、功能等方面的相关研究,而对于这些含有不同结构GPCR之间的关系如何,各自特殊结构所具有的功能又是如何,均有待于今后开展更加深入的研究。
5.1 卵菌与丝状真菌GPCR数量之间差异卵菌中的大豆疫霉、橡树疫霉以及致病疫霉,其形态如丝状真菌,最初归为真菌。然而,对其全基因组序列进行深入解析,发现上述病菌与真菌亲缘关系较远,而与藻类以及植物关系较近[39]。全基因组生物信息学分析表明,大豆疫霉、致病疫霉和橡树疫霉所含候选GPCR编码基因数量分别为59、67和56个[11],说明卵菌所含有的GPCR数量与丝状真菌所含GPCR数量之间存在较大的差异,这种差别是由于生物信息学分析所造成的,还是物种之间真正存在的差异有待进一步通过生物学试验进行验证。
5.2 不同类别丝状真菌之间GPCR数量差异就目前丝状真菌中所含GPCR而言,属于不同类别(分类系统)中丝状真菌GPCR数量方面存在着较大的差异,担子菌门中的C. neoformans与接合菌门中的R. oryzae在所含GPCR数量方面为什么会产生如此大的差异,是个别现象还是普通存在不同分类单元中的规律,以及其他真菌中的GPCR在物种进化过程中发挥着何种作用均有待于今后进行深入研究。
5.3 模式生物与丝状真菌GPCR研究方面的差异鉴于模式生物在开展其他物种研究方面具有便利性及可借鉴性的特点,学术界对模式生物中GPCR的研究取得了大量的成果,相对而言,植物病原丝状真菌中GPCR的研究就逊色许多,如何更好地借鉴模式生物中所取得的成果,较好地借鉴生物信息学分析方法以及结合一定的遗传转化、基因工程等技术开展丝状真菌GPCR的研究成为今后研究的重要方向。
5.4 蛋白相关效应酶与GPCR研究方面的差异G蛋白细胞信号转导系统涉及RGS以及G蛋白下游效应酶,目前对RGS的研究取得了较多成 果[10]。然而,对于GPCR的研究尚缺乏有效的技术手段,特别是对该蛋白结构的解析仍然是困扰蛋白质科学研究的难题之一,也是揭示外界信号跨膜转导机制的重要组成部分。未来能否成功突破GPCR结构解析瓶颈,不仅有助于解决涉及G蛋白信号转导过程中信号传递的问题,也有助于推动用于预防和治疗人类疾病、动物疾病、植物病害的新型医药、兽药、农药的开发和利用。
| [1] | Li XD,Lu JP,Li HJ,et al. Apoptosis in filamentous fungi[J]. Microbiology China,2011,38(2): 242-249 (in Chinese)厉晓东,卢建平,李海娇,等. 丝状真菌的细胞凋亡[J]. 微生物学通报,2011,38(2): 242-249 |
| [2] | Li J,Yang JK,Liang LM,et al. Advance in the research on genetic transformation system of filamentous fungi[J]. Acta Agriculturae Universitatis Jiangxiensis,2006,28(4): 516-520 (in Chinese)李娟,杨金奎,梁连铭,等. 丝状真菌遗传转化系统研究进展[J]. 江西农业大学学报,2006,28(4): 516-520 |
| [3] | Zhang T,Tang KX. Progress on genetic engineering of filamentous fungi[J]. Journal of Shanghai Jiao Tong University (Agricultural Science Edition),2010,28(5): 480-486 (in Chinese)张田,唐克轩. 丝状真菌的遗传工程研究进展[J]. 上海交通大学学报: 农业科学版,2010,28(5): 480-486 |
| [4] | Xu Y,Tu Z. Application and progress of filamentous fungi gene targeting[J]. Journal of Food Science and Biotechnology,2007,26(1): 120-126 (in Chinese)许杨,涂追. 丝状真菌基因敲除技术研究进展[J]. 食品与生物技术学报,2007,26(1): 120-126 |
| [5] | Li CH,Li ZF,Feng ZL,et al. Applications of gene knockout by ATMT in filamentous fungus functional genomics[J]. Cotton Science,2013,25(3): 262-268 (in Chinese)李彩红,李志芳,冯自力,等. 农杆菌介导的基因敲除技术在丝状真菌基因功能研究中的应用[J]. 棉花学报,2013,25(3): 262-268 |
| [6] | Liu J,Li ZY,Wang JE,et al. Research progress of sporulation mechanism and related genes in filamentous fungi[J]. Guizhou Agricultural Sciences,2009,37(4): 81-83 (in Chinese)刘静,李中元,王军娥,等. 丝状真菌产孢机制及其相关基因研究进展[J]. 贵州农业科学,2009,37(4): 81-83 |
| [7] | Lin T,Huang JZ. Research advance on promoters for heterologous gene expression in filamentous fungi[J]. Journal of Anhui Agricultural Science,2013,41(7): 2862-2863,2865 (in Chinese)林涛,黄建忠. 丝状真菌启动子研究进展[J]. 安徽农业科学,2013,41(7): 2862-2863,2865 |
| [8] | Li L,Chen S,Mao T,et al. Heterotrimeric G-protein signaling in filamentous fungi: a review[J]. Microbiology China,2013,40(8): 1493-1507 (in Chinese)李利,陈莎,毛涛,等. 丝状真菌G蛋白信号途径的研究进展[J]. 微生物学通报,2013,40(8): 1493-1507 |
| [9] | Han CZ. Bioinformatics analysis on regulators of G-protein signaling in Colletotrichum graminicola[J]. Microbiology China,2014,41(8): 1582-1594 (in Chinese)韩长志. 禾谷炭疽菌RGS蛋白生物信息学分析[J]. 微生物学通报,2014,41(8): 1582-1594 |
| [10] | Zhao Y,Wang YC,Jiang DW,et al. Advances in functional research of RGS proteins in fungi[J]. Microbiology China,2014,41(4): 712-718 (in Chinese)赵勇,王云川,蒋德伟,等. 真菌G蛋白信号调控蛋白的功能研究进展[J]. 微生物学通报,2014,41(4): 712-718 |
| [11] | Zhao W. Function analysis of GPCR-PIPKs family and PsYKT6 in Phytophthora sojae[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University,2010 (in Chinese)赵伟. 大豆疫霉GPCR-PIPKs基因家族及PsYKT6功能分析[D]. 南京: 南京农业大学博士学位论文,2010 |
| [12] | Bakthavatsalam D,Meijer HJ,Noegel AA,et al. Novel phosphatidylinositol phosphate kinases with a G-protein coupled receptor signature are shared by Dictyostelium and Phytophthora[J]. Trends in Microbiology,2006,14(9): 378-382 |
| [13] | Kulkarni RD,Thon MR,Pan H,et al. Novel G-protein- coupled receptor-like proteins in the plant pathogenic fungus Magnaporthe grisea[J]. Genome Biology,2005,6(3): R24 |
| [14] | Fang KH,Liu WD,Wang AR,et al. Bioinformatic analysis of cAMP receptor-like GPCRs in Magnaporthe grisea[J]. Chinese Agricultural Science Bulletin,2009,25(7): 42-46 (in Chinese)方坤海,刘文德,王爱荣,等. 稻瘟病菌cAMP受体类GPCR的生物信息学分析[J]. 中国农学通报,2009,25(7): 42-46 |
| [15] | Sun DY,Cui SJ,Sun Y. Signal Transduction: The Basics[M]. 4th ed. Beijing: Science Press,2010 (in Chinese)孙大业,崔素娟,孙颖. 细胞信号转导——基础篇[M]. 第4版. 北京: 科学出版社,2010 |
| [16] | Letunic I,Doerks T,Bork P. SMART 7: recent updates to the protein domain annotation resource[J]. Nucleic Acids Research,2012,40(D1): D302-D305 |
| [17] | Zheng H,Zhou L,Dou T,et al. Genome-wide prediction of G protein-coupled receptors in Verticillium spp.[J]. Fungal Biology,2010,114(4): 359-368 |
| [18] | Gether U. Uncovering molecular mechanisms involved in activation of G protein-coupled receptors[J]. Endocrine Reviews,2000,21(1): 90-113 |
| [19] | Horn F,Bettler E,Oliveira L,et al. GPCRDB information system for G protein-coupled receptors[J]. Nucleic Acids Research,2003,31(1): 294-297 |
| [20] | Fu BZ,Liu L,Wu JR. Progress of genome sequencing of plant pathogens[J]. Biotechnology Bulletin,2010(9): 8-15 (in Chinese)傅本重,刘丽,伍建榕. 植物病原生物基因组测序进展[J]. 生物技术通报,2010(9): 8-15 |
| [21] | Han KH,Seo JA,Yu JH. A putative G protein-coupled receptor negatively controls sexual development in Aspergillus nidulans[J]. Molecular Microbiology,2004,51(5): 1333-1345 |
| [22] | Lafon A,Han KH,Seo JA,et al. G-protein and cAMP- mediated signaling in aspergilli: a genomic perspective[J]. Fungal Genetic Biology,2006,43(7): 490-502 |
| [23] | Borkovich KA,Alex LA,Yarden O,et al. Lessons from the genome sequence of Neurospora crassa: tracing the path from genomic blueprint to multicellular organism[J]. Microbiology and Molecular Biology Reviews: MMBR,2004,68(1): 1-108 |
| [24] | Xue CY,Hsueh YP,Heitman J. Magnificent seven: roles of G protein-coupled receptors in extracellular sensing in fungi[J]. FEMS Microbiology Reviews,2008,32(6): 1010-1032 |
| [25] | Attwood T,Findlay J. Fingerprinting G-protein-coupled receptors[J]. Protein Engineering,1994,7(2): 195-203 |
| [26] | Kolakowski Jr LF. GCRDb: a G-protein-coupled receptor database[J]. Receptors & Channels,1994,2(1): 1 |
| [27] | Xue Y,Batlle M,Hirsch JP. GPR1 encodes a putative G protein-coupled receptor that associates with the Gpa2p Galpha subunit and functions in a Ras-independent pathway[J]. EMBO Journal,1998,17(7): 1996-2007 |
| [28] | Xu JR,Peng YL,Dickman MB,et al. The dawn of fungal pathogen genomics[J]. Annual Review Phytopathology,2006,44: 337-366 |
| [29] | Li L,Borkovich KA. GPR-4 is a predicted G-protein-coupled receptor required for carbon source-dependent asexual growth and development in Neurospora crassa[J]. Eukaryot Cell,2006,5(8): 1287-1300 |
| [30] | Galagan JE,Calvo SE,Borkovich KA,et al. The genome sequence of the filamentous fungus Neurospora crassa[J]. Nature,2003,422(6934): 859-868 |
| [31] | Xue C,Bahn YS,Cox GM,et al. G protein-coupled receptor Gpr4 senses amino acids and activates the cAMP-PKA pathway in Cryptococcus neoformans[J]. Molecular Biology Cell,2006,17(2): 667-679 |
| [32] | Drews J. Drug discovery: a historical perspective[J]. Science,2000,287(5460): 1960-1964 |
| [33] | Xu YJ,Wang S,Liang QM. Relation between G protein-coupled receptor and development of tumour[J]. Chinese Journal of Cancer Prevention and Treatment,2013,20(9): 712-716 (in Chinese)许云吉,王松,梁庆模. G蛋白偶联受体与肿瘤发生发展相关性研究现状[J]. 中华肿瘤防治杂志,2013,20(9): 712-716 |
| [34] | Yu J. Heterotrimeric G protein signaling and RGSs in Aspergillus nidulans[J]. Journal of Microbiology,2006,44(2): 145 |
| [35] | Dean RA,Talbot NJ,Ebbole DJ,et al. The genome sequence of the rice blast fungus Magnaporthe grisea[J]. Nature,2005,434(7036): 980-986 |
| [36] | Kulkarni RD,Kelkar HS,Dean RA. An eight-cysteine- containing CFEM domain unique to a group of fungal membrane proteins[J]. Trends in Biochemical Sciences,2003,28(3): 118-121 |
| [37] | Park SH,Das BB,Casagrande F,et al. Structure of the chemokine receptor CXCR1 in phospholipid bilayers[J]. Nature,2012,491(7426): 779-783 |
| [38] | DeZwaan TM,Carroll AM,Valent B,et al. Magnaporthe grisea pth11p is a novel plasma membrane protein that mediates appressorium differentiation in response to inductive substrate cues[J]. Plant Cell,1999,11(10): 2013-2030 |
| [39] | Tyler BM,Tripathy S,Zhang X,et al. Phytophthora genome sequences uncover evolutionary origins and mechanisms of pathogenesis[J]. Science,2006,313(5791): 1261-1266 |
 2015, Vol. 42
2015, Vol. 42