扩展功能
文章信息
- 张枫, 张蕾, 张重阳, 赵胜明, 蔡晨, 张燕, 殷红
- 一株产 T-2 毒素镰孢菌的分离、鉴定及其产毒条件的研究
- Isolation and identification of a T-2 toxin-producing Fusarium poae strain and studies on its culture conditions
- 微生物学通报, 2015, 42(2): 340-348
- Microbiology China, 2015, 42(2): 340-348
- 10.13344/j.microbiol.china.140500
-
文章历史
- 收稿日期: 2014-06-23
- 接受日期: 2014-11-14
- 优先数字出版日期(www.cnki.net): 2014-11-21
T-2毒素是镰孢菌在一定条件下产生的一种倍半萜烯类化合物,其分子式为C24H34O9,相对分子量为466.22,其化学名为4β-15-二乙酰氧基-3α-羟基-8α-(3-甲基丁酰氧)-12,13-环氧单端孢霉-9-烯,它是一种毒性很强的真菌毒素。由于镰孢菌广泛分布在各种粮食作物(如小麦、大米、玉米、大麦和燕麦等)及其半成品(如啤酒和麦芽等)中,所以T-2毒素也被联合国粮农组织(FAO)和世界卫生组织(WHO)列为天然存在的最危险的食品污染源之一。T-2毒素几乎对所有的真核生物,包括植物、动物及人类均具有一定的毒性[1]。研究表明:T-2毒素能引起人和动物多个系统的毒性效应。主要危害动物的造血组织和免疫器官,引起一些出血综合症,出现白细胞减少、贫血,使胃肠道功能受损等[2, 3]。T-2毒素可能还与我国某些地区食管癌、克山病和大骨节病的高发病率有关[4, 5]。
镰孢菌属是T-2毒素主要产生菌,如串珠镰孢菌(Fusarium moniliforme)、尖孢镰孢菌(F. oxysporum)、拟枝孢镰孢菌(F. sporotrichioides)等均能产生T-2毒素。镰孢菌毒素的产生往往与镰孢菌的生长及其对外界环境的反应等因素密切相关[6, 7]。目前,关于镰孢菌产毒条件的研究很少,本研究利用从大骨节病病区乳熟期小麦麦粒分离筛选出的内生镰孢菌,对可能影响其产毒的条件进行了研究,为进一步研究T-2毒素的产生机制和真菌毒素污染的防治提供依据。
1 材料与方法 1.1 材料青海大骨节病病区乳熟期小麦麦穗。红酵母由西北大学微生物实验室提供。T-2毒素标准品为以色列Fermenter公司所产。其他试剂均为国产分析纯或色谱纯。
1.2 培养基真菌分离所用培养基为马铃薯固体培养基(PDA)。真菌产毒固体培养基:分别称取50 g玉米粉、大米和麦仁,各加40 mL自来水,用封口膜扎好于1×105 Pa灭菌20 min,即分别为玉米、大米和小麦培养基。真菌产毒液体培养基:分别称取40 g麦仁、绿豆、马铃薯煮沸30 min,过滤后向滤液中各加4 g蔗糖,用自来水定容到100 mL,调节pH,1×105 Pa灭菌20 min,即分别为小麦、绿豆和马铃薯液体培养基。
1.3 小麦内生真菌的分离小麦内生菌的分离按常规微生物学方法进 行[8]。消毒效果检验:将表面消毒过的小麦粒滚过平板,同时用最后一次冲洗的无菌水涂布平板,培养箱中培养,观察是否有菌落生长。
1.4 产毒菌株的初筛把依据形态特征初步认定的各镰孢菌菌株(12株)分别接种于小麦液体培养基中,培养7 d后,将发酵液用旋转蒸发仪蒸发到20−30 mL,加入20 mL无水乙醇使其中的蛋白沉淀[9],抽滤,滤液减压蒸发以除去乙醇。将除去乙醇的滤液转至分液漏斗中,用20−30 mL甲醇清洗旋转蒸发瓶,同样转至分液漏斗中,再加入30 mL正己烷,振荡后静置分层,弃去上液。加氯仿萃取,然后合并氯仿层蒸干,加5 mL乙腈使其完全混合溶解粘于瓶壁的毒素。然后,用该提取液进行种子胚芽抑制试验和抑菌试验[10, 11],筛选具有产毒能力的菌株。
1.5 产T-2毒素菌株的复筛 1.5.1 薄层层析(TLC):参照吴文达等[12]的方法,将1.4初筛得到的产毒菌株提取物分别进行薄层层析,在365 nm紫外灯下检测荧光。将与T-2毒素标准品相同的位置标记出来,刮取标记处的硅胶粉末溶于乙腈中,离心后取上清,减压浓缩定容至1 mL。 1.5.2 高效液相色谱(HPLC):将1.5.1所得样品用HPLC进行检测,所用HPLC检测设备为Agilent Technologies 1200 series,Welchrom C18柱。检测波长200 nm,进样量20 μl,流动相为 乙腈:水=48:52 (体积比),流速1.0 mL/min。 1.6 菌株鉴定 1.6.1 形态学鉴定:将1.5筛选出的具有产T-2毒素能力的菌株接种到PDA平板,25 °C培养观察菌落特征。参照《真菌鉴定手册》[13]和《镰刀菌》[14]对菌株进行形态学鉴定。 1.6.2 ITS序列扩增与分析:菌株ITS序列测序工作由生工生物工程(上海)股份有限公司完成。用CTAB方法提取所测菌株的基因组DNA[15]。采用真菌通用引物对ITS1和ITS4,ITS1:5′-TCCGTAG GTGAACTTGCGG-3′;ITS4:5′-TCCTCCGCTTAT TCT-3′。PCR反应体系:基因组DNA (20−50 ng/l) 0.5 μl、10×PCR buffer (含Mg2+) 2.5 μl、dNTPs (各2.5 mmol/L) 1 μl、Taq聚合酶0.2 μl、Primer-F (10 μmol/L) 0.5 μl、Primer-R (10 μmol/L) 0.5 μl,ddH2O补足至25 μl。PCR扩增条件为:94 °C 4 min;94 °C 45 s,55 °C 45 s,72 °C 1 min,共30个循环;72 °C 10 min。反应产物纯化后进行测序。 1.7 产毒素培养条件的优化 1.7.1 温度对固体培养菌株产毒的影响:菌株接种于小麦固体培养基后置于培养箱中培养,恒温组分别设温度为19、21、23、25、27、29 °C,连续培养25 d后用HPLC检测毒素的产量。变温组前10天温度与恒温组一致,10 d之后白天保持原来的温度12 h,夜晚温度改为15 °C,然后对各个样品进行处理和检测。 1.7.2 时间对固体培养菌株产毒的影响:菌株接种于小麦固体培养基后置培养箱中培养,开始温度设置为25 °C持续10 d,然后采用变温模式培养至17、19、21、23、25、27、29 d时分别取出培养物进行样品处理和检测。 1.7.3 固体培养条件正交优化:选取L9(33)正交表设计正交实验(表 1),以T-2毒素产量为指标,选择较优的培养条件组合。| 水平 Level | 温度 Temperature (°C) | 光照 Lumination | 培养基 Medium |
| 1 | 23/15 | 连续光照 | 玉米 |
| 2 | 25/15 | 光暗交替 | 大米 |
| 3 | 27/15 | 连续黑暗 | 小麦 |
| 水平 Level | pH | 光照 Lumination | 培养基 Medium |
| 1 | 5 | 连续光照 | 小麦 |
| 2 | 6 | 光暗交替 | 绿豆 |
| 3 | 7 | 连续黑暗 | 马铃薯 |
将固体培养物研磨成粉末,按本实验室筛选出的条件用乙腈:水(84:16,体积比)超声振荡提取 1 h,抽滤除去固体杂质。将滤液于65 °C旋转减压蒸发到20−30 mL,向残液中加入等体积的正己烷摇匀后静置,弃去正己烷层,再加入氯仿萃取4次。将4次萃取液合并,于旋转蒸发仪上减压蒸干,加入3 mL乙腈,充分溶解后于离心管中保存, 10 000 r/min超速离心5 min,取上清液4 °C保存待用。液体培养物处理与1.3条件相同,之后样品都经TLC纯化后用HPLC检测。
2 结果与分析 2.1 内生菌的分离从小麦麦穗样品中共分离纯化得到内生真菌21株,依据形态特征初步鉴定结果表明,这些内生真菌主要为镰孢菌属(Fusarium)、链格孢属(Alternaria)和聚孢霉属(Glomerularia)等。
2.2 产毒素镰孢菌的筛选种子胚芽抑制试验发现,所有实验菌株粗提物均能抑制红豆胚芽的生长,但是有6株菌的粗提物并不能对红酵母产生抑制作用(表 3),综合两项实验结果,发现菌株5-5m-1产毒能力最强。因此,后续产毒条件研究均以5-5m-1为实验菌株。
| 菌株 Strains | 胚芽抑制率 Embryonic bud inhibition rate (%) | 抑菌圈直径 Fungistatic zone diameter (mm) |
| 5-5m-0 | 17.16±2.14 | 12.1±1.2 |
| 5-5m-1 | 65.78±1.98 | 20.0±0.9 |
| 5-5m-2 | 46.17±2.01 | 18.3±1.5 |
| 5-5m-3 | 62.48±1.87 | 0 |
| 5-5m-4 | 23.34±1.59 | 18.1±0.9 |
| 5-5m-5 | 43.07±2.36 | 0 |
| 5-5m-6 | 48.91±2.25 | 0 |
| 5-5m-7 | 52.25±1.85 | 1.2±0.5 |
| 5-F-1 | 59.95±2.43 | 0 |
| 5-F-2 | 57.10±2.88 | 0 |
| 5-F-3 | 48.31±3.01 | 0 |
| 5-F-4 | 37.13±1.77 | 2.3±0.9 |
5-5m-1菌株在PDA上菌落呈圆形,正面白色至淡粉红色,中间凸起;背部中央呈淡酒红色。气生菌丝较长且浓密。25 °C培养4 d菌落直径为6.0 cm左右。菌丝光滑,有分枝,有隔。分生孢子梗细长,有分枝,无隔。大型分生孢子镰刀状,有2−3隔,大小(20−25) µm×(2−4) µm。小型分生孢子卵圆形,单胞,生于孢子梗,(5−7) µm×(1−3) µm (图 1)。

|
| 图 1 5-5m-1 菌落及孢子显微形态(400×) Figure 1 Phenomenon of colony and conidia of the strain 5-5m-1 (400×) 注:A:菌落正面;B:分生孢子. Note: A: The front of colony; B: Conidia. |
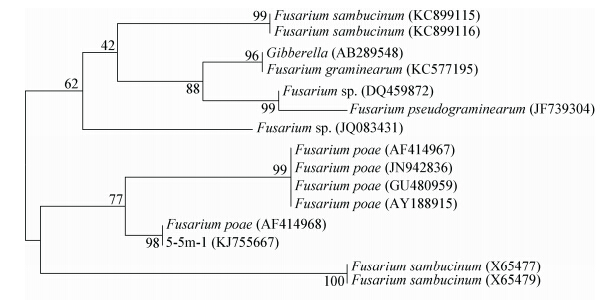
测序结果得到一条515 bp的序列,将所得序列通过BLAST程序在NCBI的GenBank中进行相似性序列检索分析,选取同源性较高的菌株进行系统发育树的构建。先利用ClustalX进行多序列之间比对和人工校正,然后采用MEGA 5.1软件中的Neighbor-Joining法构建进化树[16]。由图 2可以看出,T-2毒素产生菌5-5m-1与梨孢镰孢菌Fusarium poae (AF414968)聚为一支,Bootstrapt验证分值为98,表现出非常近的亲缘关系。结合真菌形态,将其鉴定为梨孢镰孢菌Fusarium poae,GenBank登录号为KJ755667。
|
| 图 2 基于 ITS 基因序列构建的邻接树 Figure 2 A Neighbor-Joining phylogenetic tree based on ITS sequence 注:括号中的序号代表菌株的GenBank登录号;分支点上的数字代表计算1 000次聚类到一起的几率;标尺刻度代表 0.5%的序列差异. Note: The sequence number in the bracket means the GenBank accession number of the strain. The number at the node means the percentage of occurrence in 1 000 boot-straped trees. The scale bar means 0.5% sequence difference. |
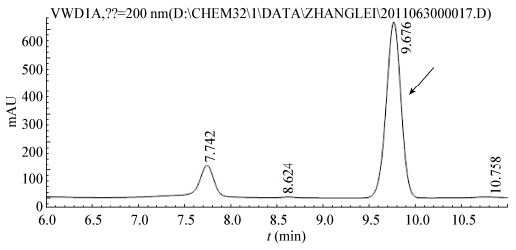
在实验色谱条件下,T-2毒素标准品出峰时间为9.767 min (图 3),5-5m-1粗提物中有一峰的出峰时间为9.497 min (图 4),二者很接近,说明5-5m-1产物中应该含有T-2毒素,该菌株为产T-2毒素的镰孢菌。
|
| 图 3 T-2 毒素标准品的 HPLC 图谱 Figure 3 HPLC chromatogram of T-2 toxin standard |

|
| 图 4 镰孢菌 5-5m-1 粗提物的 HPLC 图谱 Figure 4 HPLC chromatogram of the extract of 5-5m-1 strain |
|
| 图 5 培养温度对 T-2 毒素产量的影响 Figure 5 The effect of culture temperatures on the yield of T-2 toxin |
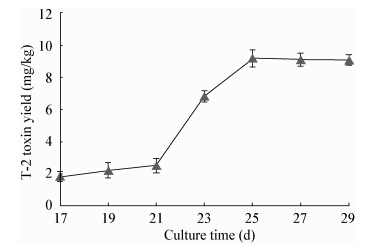
|
| 图 6 培养时间对 T-2 毒素产量的影响 Figure 6 The effect of the culture time on the yield of T-2 toxin |
| 处理号 Treatment number | 因素 Factor | |||
| A 温度 Temperature (°C) | B 光照 Lumination | C 培养基 Medium | 毒素产量 Yield of T-2 toxin (mg/kg) | |
| 注:K1表示各因素的第1水平3次试验结果的平均数,K2、K3依次类推. R:各因素的最好水平与最差水平之差. Note: K1 means the average of 3 test results at level 1 of each factor. K2, K3 and so on. R: the difference between the best and worst levels of each factor (the same as follows). | ||||
| 1 | 1 | 1 | 3 | 8.167 2±0.324 6 |
| 2 | 2 | 1 | 2 | 14.519 5±0.561 2 |
| 3 | 3 | 1 | 1 | 9.211 6±0.423 6 |
| 4 | 1 | 2 | 2 | 7.203 8±0.403 6 |
| 5 | 2 | 2 | 3 | 10.422 1±0.224 6 |
| 6 | 3 | 2 | 1 | 16.892 5±0.241 7 |
| 7 | 1 | 3 | 1 | 10.106 2±0.301 9 |
| 8 | 2 | 3 | 2 | 9.262 0±0.285 2 |
| 9 | 3 | 3 | 3 | 7.601 8±0.339 7 |
| K1 | 8.492 4 | 10.632 8 | 12.070 1 | |
| K2 | 11.401 2 | 11.506 1 | 10.328 4 | |
| K3 | 11.235 3 | 8.990 0 | 8.730 4 | |
| R | 2.899 8 | 2.606 1 | 3.339 7 | RC>RA>RB |
|
| 图 7 摇床转速对 T-2 毒素产量和菌株生物量的影响 Figure 7 The effect of rotational speeds on the yield of T-2 toxin and biomass |

|
| 图 8 培养基初始 pH 对 T-2 毒素产量和菌株生物量的 Figure 8 The effect of initial pH of fermentation medium on the yield of T-2 toxin and biomass |
| 处理号 Treatment number | 因素 Factor | |||
| A pH | B光照 Lumination | C 培养基 Medium | 毒素产量 Yield of T-2 toxin (mg/L) | |
| 1 | 1 | 1 | 3 | 1.417 2±0.021 1 |
| 2 | 1 | 2 | 1 | 4.681 2±0.032 6 |
| 3 | 1 | 3 | 2 | 0.959 0±0.013 6 |
| 4 | 2 | 1 | 2 | 0.464 5±0.025 3 |
| 5 | 2 | 2 | 3 | 0.051 1±0.010 2 |
| 6 | 2 | 3 | 1 | 0.550 7±0.030 1 |
| 7 | 3 | 1 | 1 | 0.081 2±0.015 2 |
| 8 | 3 | 2 | 2 | 0.160 1±0.016 6 |
| 9 | 3 | 3 | 3 | 0.273 6±0.021 9 |
| K1 | 2.352 5 | 0.654 3 | 1.771 0 | |
| K2 | 0.355 4 | 1.630 8 | 0.527 9 | |
| K3 | 0.171 7 | 0.594 4 | 0.580 6 | |
| R | 2.180 8 | 1.036 4 | 1.243 1 | RA>RC>RB |
镰孢菌是全球范围内农作物生产中常见的污染真菌,其产生的真菌毒素更是作为一种严重的污染源受到人们的重视。一百多年来的研究表明,镰孢菌属可以产生多种毒素,其中主要是玉米赤霉烯酮、单端孢霉毒素和伏马菌素等。单端孢霉毒素分为A和B两类,单端孢霉毒素A包括T-2毒素、HT-2毒素;单端孢霉毒素B包括脱氧雪腐镰刀菌烯醇(DON)和雪腐镰刀菌烯醇(NIV)等[17, 18]。镰孢菌毒素对人畜健康危害严重,常导致各种急慢性中毒的发生,还有多种致癌、致突变的潜在危害[19]。镰孢菌毒素的产生主要受营养成分、环境条件和各种复杂代谢调节机制的影响。一些研究认为低温有利于镰孢菌产毒。有报道枝孢镰孢菌的最适产毒条件为湿度40%−50%,温度3−7 °C[20]。匡开元等[21]发现三线镰孢菌在相对湿度80%−100%、温度7 °C条件下宜产T-2毒素,且在5−20 °C时产毒能力随温度上升而下降。然而田学亮等[22]的研究表明,串珠镰孢菌的最佳产生毒素条件为:马铃薯葡萄糖培养
液、pH 9.0、12 h光暗交替、25 °C、培养10 d。李群伟等[23]报道,碱性条件(pH>7.0)明显抑制一株从玉米中分离的镰孢菌菌株的生长和毒素的产生,低温尤其是在变温的条件下,镰孢菌易产T-2毒素。代喆等[24]确定了一株梨孢镰孢菌的最佳产毒培养条件为8−25 °C间隔12 h变温、前期光照后期黑暗、前期振荡后期静止静置的培养条件下培养28 d。谢莹等[25]发现青海大骨节病区的小麦与面粉中存在T-2毒素超常聚集的现象,认为当地高原冷热交替的气候构成T-2毒素污染的环境条件。本研究发现在pH 5.0及变温条件都有利于梨孢镰孢菌菌株5-5m-1产生T-2毒素。由此可见不同镰孢菌产毒素的条件不尽相同,同种镰孢菌产不同毒素的最适条件也可能存在差异。至于菌株5-5m-1在液体培养条件下的毒素产量明显少于固体培养的,这可能是因为固体培养时,镰孢菌更接近它在自然条件中存在于粮食作物中的状态。本研究的菌株是从小麦中分离出来的,但在固体培养时发现菌株在玉米培养基上的毒素产量最高。赵君等[26]也从发霉的玉米中鉴定出有较强产T-2毒素能力的三线镰孢菌,说明玉米培养基可能更有利于镰孢菌产生T-2毒素。因此,对玉米这类易受产毒真菌污染的粮食作物,更要注重其加工和储存条件。
4 结论本研究从大骨节病病区小麦中分离鉴定出一株产T-2毒素的内生梨孢镰孢菌,对其产毒条件进行了初步研究,实验结果为深入研究镰孢菌产毒素机制提供了一定依据,对探讨控制由真菌毒素污染粮食带来的危害提供了参考。
| [1] | Sato N, Ueno Y, Enomoto M. Toxicological approaches to the toxic metabolites of Fusaria.VIII. Acute and subacute toxicities of T-2 toxin in cats[J]. Japanese Journal of Pharmacology, 1975, 25(3): 263-270 |
| [2] | Li M, Cuff CF, Pestka JJ. T-2 toxin impairment of enteric reovirus clearance in the mouse associated with suppressed immunoglobulin and IFN-γ responses[J]. Toxicology and Applied Pharmacology, 2006, 214(3): 318-325 |
| [3] | Bu LM, Liu N. The detection of DNA damage of rat organs caused by T-2 toxin with SCGE[J]. Chinese Journal of Endemiology, 2001, 20(5): 45-51 (in Chinese) 卜黎明, 刘宁. T-2毒素对大鼠心肝肾及外周血淋巴细胞DNA损伤的试验观察[J]. 中国地方病学杂志, 2001, 20(5): 45-51 |
| [4] | Zhao ZJ, Li Q. Research advance on cartilage damage of KBD induced by T-2 toxin[J]. Chinese Journal of Endemiology, 2005, 20(1): 23-25 (in Chinese) 赵志军, 李强. T-2毒素致大骨节病软骨损伤的研究进展[J]. 中国地方病学杂志, 2005, 20(1): 23-25 |
| [5] | Fischer G, Dott W. Relevance of airborne fungi and their secondary metabolites for environmental, occupational and indoor hygiene[J]. Archives of Microbiology, 2003, 179(2): 75-82 |
| [6] | Kim H, Woloshuk CP. Role of AREA, a regulator of nitrogen metabolism, during colonization of maize kernels and fumonisin biosynthesis in Fusarium verticillioides[J]. Fungal Genetics and Biology, 2008, 45(6): 947-953 |
| [7] | Jimeneza M, Mateoa JJ, Hinojo MJ, et al. Sugars and amino acids as factors affecting the synthesis of fumonisins in liquid cultures by isolates of the Gibberella fujikuroi complex[J]. International Journal of Food Microbiology, 2003, 89(2): 185-193 |
| [8] | Barbara S, Christine JCB, Thomas NS. Microbial Root Endophytes[M]. Berlin and Heidelberg: Springer, 2006: 299-307 |
| [9] | Cao YH, Wang SP, Hui Y, et al. Biosynthesis and assay of crude T-2 toxin[J]. Chinese Journal of Endemiology, 2008, 27(5): 552-554 (in Chinese) 曹艳红, 王绍萍, 惠洋, 等. T-2粗毒素的生物合成及检定[J]. 中国地方病学杂志, 2008, 27(5): 552-554 |
| [10] | LI XM, Stefan M, Raymond C, et al. A sensitive bioassay for the mycotoxin aflatoxin B1, which also responds to themycotoxins aflatoxin G1 and T-2 toxin, using engineered baker’s yeast[J]. Journal of Microbiological Methods, 2009, 77(3): 285-291 |
| [11] | Zhou YL, Wang HM, Zhang J, et al. Fungistatic test for detecting T-2 toxin[J]. Microbiology China, 1990, 17(3): 144-145 (in Chinese) 周与良, 王红梅, 张军, 等. 抑菌试验用于测定T-2毒素[J]. 微生物学通报, 1990, 17(3): 144-145 |
| [12] | Wu WD, Wang BJ, Cai LF, et al. Detection of zearalenone by thin layer choromatography combined with high performance liquid chromatography[J]. Animal Husbandry & Veterinary Medicine Vet Med, 2010, 42(7): 17-21 (in Chinese) 吴文达, 王宝杰, 蔡兰芬, 等. 薄层色谱和高效液相色谱联合检测玉米赤霉烯酮的方法研究[J]. 畜牧与兽医, 2010, 42(7): 17-21 |
| [13] | Wei JC. Manual Identification of Fungi[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1979: 613-617 (in Chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 613-617 |
| [14] | LYL AN, GELK MB. Fusarium[M]. Beijing: Science Press, 1979: 40-45 (in Chinese) 拉依落AN, 高尔连科MB. 镰刀菌[M]. 北京: 科学出版社, 1979: 40-45 |
| [15] | Pryor BM, Gilbertson RL. Molecular phylogenetic relationships amongst Alternaria species and related fungi based upon analysis of nuclear ITS and mt SSU rDNA sequences[J]. Mycological Research, 2000, 104(11): 1312-1321 |
| [16] | Kumar S, Tamur K, Nei M. MEGA3: integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Breifings in Bioinformatics, 2004, 5(2): 150-163 |
| [17] | Peng J, Wu XP, Huang HQ, et al. Research Development of Fusarium Toxins[J]. Chinese Agricultural Science Bulletin, 2009, 25(2): 25-27 (in Chinese) 彭杰, 吴晓鹏, 黄惠琴, 等. 镰刀菌毒素研究进展[J]. 中国农学通报, 2009, 25(2): 25-27 |
| [18] | Chen S, Chen LN, Zhou HL, et al. Research advance on the major toxins of Fusarium[J]. Chinese Horticulture Abstracts, 2011, 3(5): 31-41 (in Chinese) 陈石, 陈丽娜, 周红玲, 等. 镰刀菌分泌的主要毒素研究进展[J]. 中国园艺文摘, 2011, 3(5): 31-41 |
| [19] | Xiao QQ, Diao ZM, Zhang C, et al. Fusarium and its toxin[J]. Anhui Agricultural Science Bulletin, 2008, 14(9): 164-166 (in Chinese) 肖前青, 刁治民, 张程, 等. 镰刀菌及其毒素[J]. 安徽农学通报, 2008, 14(9): 164-166 |
| [20] | Rukhyada VV. Environmental effects on T-2 toxin biosythesis by Fusarium sporotrichiella bilai[J]. Mycol Phytopathol, 1989, 23(2): 151-156 |
| [21] | Kuang KY, Lu SH, Shi SY, et al. Effect of fluctuation temperature and media on toxigenicity of Fusarium Tricinctum M-20[J]. Acta Agriculturae Shanghai, 1986(2): 67-70 (in Chinese) 匡开元, 陆仕华, 史士英, 等. 变温培养和培养基对三线镰刀菌M-20产毒性的影响[J]. 上海农业学报, 1986(2): 67-70 |
| [22] | Tian XL, Chen XL, Wang HL. Toxin-producing condition of Fusarium moniliforme[J]. Journal of Microbiology, 2006, 26(6): 45-47 (in Chinese) 田学亮, 陈锡岭, 王红亮. 串珠镰刀菌产生毒素条件研究[J]. 微生物学杂志, 2006, 26(6): 45-47 |
| [23] | Li QW, Li DA, Meng XQ, et al. Experimental studies on elementary factors of Fusarium’s growth and toxin prodution[J]. Chinese Journal of Endemiology, 1998, 11(17): 32-36 (in Chinese) 李群伟, 李德安, 孟宪清, 等. 影响镰刀菌生长与产毒的基本因素的研究[J]. 中国地方病学杂志, 1998, 11(17): 32-36 |
| [24] | Dai Z, Wang YL, Sun LJ, et al. Cultivation condition and extraction method to prepare T-2 toxin using Fusarium poae[J]. Journal of Microbiology, 2011, 9(31): 40-44 (in Chinese) 代喆, 王雅玲, 孙立军, 等. 利用Fusarium poae制备T-2毒素的培养条件和提取方法[J]. 微生物学杂志, 2011, 9(31): 40-44 |
| [25] | Xie Y, Sun GJ, Xong CL, et al. Determination of T-2 toxin content in staple food from KBD famillies in Xinghai county, Qinhai Province[J]. Chinese Journal of Food Hygiene, 2005, 17(2): 157-159 (in Chinese) 谢莹, 孙桂菊, 熊传龙, 等. 青海省兴海县大骨节病病户主食中T-2毒素的检测[J]. 中国食品卫生杂志, 2005, 17(2): 157-159 |
| [26] | Zhao J, Yuan HJ, Yang JS, et al. The bioassay, extraction and toxicity of T-2 toxin[J]. Bulletin of Veterinary of PLA, 1991(11): 152-157 (in Chinese) 赵君, 袁鸿锦, 杨进生, 等. T-2毒素的生物鉴定、提取及对动物的毒性[J]. 兽医大学学报, 1991(11): 152-157 |
 2015, Vol. 42
2015, Vol. 42




