扩展功能
文章信息
- 李清, 王英, 刘小莉, 董明盛, 周剑忠
- 一株广谱抑菌活性乳酸菌的筛选及特性研究
- Isolation of a broad-spectrum antibacterial lactic acid bacterium and evaluation of probiotic properties
- 微生物学通报, 2015, 42(2): 332-339
- Microbiology China, 2015, 42(2): 332-339
- 10.13344/j.microbiol.china.140373
-
文章历史
- 收稿日期: 2014-05-03
- 接受日期: 2014-06-26
- 优先数字出版日期(www.cnki.net): 2014-07-08
2. 江苏省农业科学院农产品加工研究所 江苏 南京 210014
2. The Research Institute of Agricultural Product Processing, Jiangsu Academy of Agricultural Sciences, Nanjing, Jiangsu 210014, China
当今社会,随着人们生活水平的逐渐提高,对饮食关注程度的日益增加,对健康食品的要求也逐步提高。益生菌作为发酵食品和功能性食品药品的主力军,已受到国内外众多研究者的青睐。益生菌是指能够以一定数量存活并定殖于宿主肠道内,通过调节肠道菌群平衡,对宿主健康发挥有益作用的活性有益微生物的总称[1,2,3]。传统自然发酵豆酱主要是利用黄豆表面附着的微生物进行发酵而制成,加入食盐主要是利用高渗作用抑制大部分杂菌的生长。其中乳酸菌是促成豆酱风味物质形成的重要微生物[4],是发酵大豆食品中重要的天然菌群[5]。乳酸菌在发酵食品加工过程中产生的代谢物(如乳酸和乳酸菌素等)不仅影响产品的风味、色泽和品质,而且能抑制腐败微生物的生长,从而延长产品保质期[6]。同时,某些具有益生作用的菌株,对人体具有一定的保健功能[7]。因此,能抑制引起肠道疾病的腐败菌的生长,并能顺利通过胃肠道并在肠道环境中很好定殖是益生菌的重要筛选标志。本实验从传统自然发酵豆酱中分离筛选具有广谱抑菌功能的乳酸菌,并通过人工胃肠液耐受性、耐胆盐、耐渗透压实验来研究乳酸菌的特性。
1 材料与方法 1.1 样品和菌种自然发酵豆酱:取自贵州剑河农贸市场。
致病菌:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella sp.)、志贺氏菌(Shigella sp.)、铜绿假单胞菌(Pseudomonas aeruginosa)由南京市食品质量监督与检测院提供。
MRS培养基制备参见文献[8]。LB培养基制备参见文献[9]。
1.2 主要试剂和仪器 1.2.1 试剂:胃蛋白酶(酶活力1:10 000)、胰蛋白酶(酶活力250 NFu/mg)、牛胆盐、牛肉膏、蛋白胨、酵母粉、琼脂粉均为生化试剂;乙酸钠、氢氧化钠、氯化钠、盐酸、磷酸氢二钾、氯化钠、七水硫酸镁、四水硫酸锰、柠檬酸二铵均为分析纯;吐温80为化学纯,以上试剂购自生工生物工程(上海)股份有限公司。 1.2.2 仪器:YXQ-LS-50SⅡ/75S Ⅱ立式压力蒸气灭菌器,购自海博迅实业有限公司医疗设备厂;PHS-25型数显pH计,购自上海精密科学仪器有限公司;净化工作台,购自上海新苗医疗器械制造有限公司;DNP-9272型生化培养箱,购自上海精宏实验设备有限公司;101-1型电热鼓风干燥箱,购自江苏省东台电器厂;PHS-2F型紫外-可见分光光度计,购自上海光谱仪器有限公司。 1.3 乳酸菌的分离纯化取自然发酵豆酱5 g于45 mL灭菌的生理盐水中,混匀后,梯度稀释,选取1×10-3、1×10-4、1×10-5三个梯度进行试验。每个梯度取200 μL涂布在MRS固体培养基(加碳酸钙)平板上,37 °C培养24–48 h,在溶钙圈中根据菌落的大小、颜色、光泽及透明度挑取不同形态的单菌落,进行革兰氏染色和接触酶试验。凡是属于革兰氏阳性、接触酶为阴性的菌落,继续在MRS平板上划线纯化,重复多次,直到为纯培养物。
1.4 抑菌试验将分离所得乳酸菌接种于MRS液体培养基上活化后,以2%的接种量接种于10 mL MRS液体培养基中,37 °C培养24 h。培养液以1 000 r/min离心15 min,得无细胞发酵上清液。
将指示菌:大肠杆菌、沙门氏菌、金黄色葡萄球菌、志贺氏菌和铜绿假单胞菌活化2次后,2%接种于LB液体培养基中,在LB琼脂培养基上,采用牛津杯法 [10]检测所得乳酸菌的抑菌活性。
1.5 人工胃肠液中耐受性试验将在MRS液体培养基中活化2次后的乳酸菌按10%接种量,分别接种于不同pH值(1.5、2.5、3.5、4.5)的预设人工胃液中以及预设人工肠液中,人工胃液和肠液按照参考文献[11]的方法配制。充分混匀后,37 °C培养,分别于0、1、2、3 h取样,以无菌生理盐水按1:10梯度稀释,进行乳酸菌活菌计数 [12]。
1.6 耐胆盐试验在配制的MRS液体培养基中加入不同质量的牛胆盐 [13],使其质量浓度分别为0、0.03、0.10、0.20、0.30、0.50 g/100 mL,1×10 5Pa高压蒸气灭菌20 min后,冷却至37 °C以下备用,将活化后的菌液以5%的接种量接种到上述的MRS培养基中,37 °C培养 24 h后,进行乳酸菌活菌计数[12]。
1.7 耐渗透压试验在配制的MRS液体培养基中加入不同质量NaCl固体,使其质量浓度分别为2、4、6、8、 10 g/100 mL,1×105Pa高压蒸气灭菌20 min后,冷却至37 °C以下备用,将活化后的菌液以5%的接种量接种到上述MRS培养基中,37 °C培养24 h后,进行乳酸菌活菌计数 [12],以上试验均采用3个平行。
1.8 筛选菌株鉴定 1.8.1 菌落形态、细胞形态及生理生化试验:革兰氏染色后显微镜下观察细胞形态。生理生化试验 [14]包括:产H 2S试验、精氨酸产氨试验、淀粉水解试验、明胶液化试验、糖醇发酵试验。 1.8.2 16S rRNA序列扩增及其系统发育分析:按照参考文献[15]的方法对所分离的乳酸菌进行DNA提取和16S rRNA PCR扩增,并将扩增产物委托上海生工生物工程有限公司进行测序。登陆NCBI (www.ncbi.nih.gov/blast/),将所得序列与中已知序列进行比对。同时将所测得的序列与从GenBank中获得的相关种和属的16S rRNA基因序列,采用MEGA 3.1软件进行比对分析和系统发育分析。 1.9 数据处理每组试验重复3次,结果表示为平均数\[\bar{x}\]±s来表示。运用SAS 8.1软件,采用独立样本t检验进行差异性分析,以P<0.05为差异显著。
2 结果与分析 2.1 广谱抑菌活性乳酸菌的筛选采用1.3的方法从自然发酵豆酱中分离出4株乳酸菌:DJ-01、DJ-03、DJ-04和DJ-06,按1.4的方法进行抑菌试验,结果如 表1所示。
| 注:抑菌圈直径(mm): +++: 19–24; ++: 15–18; +: 10–15; –:无抑菌效果. Note: Inhibition zone (mm): +++: 19–24; ++: 15–18; +: 10–15; –: No antibacterial activity. | |||||
| 供试菌株 Tested strain | 大肠杆菌 Escherichia coli | 沙门氏菌 Salmonella sp. | 金黄色葡萄球菌 Staphylococcus aureus | 志贺氏菌 Shigella sp. | 铜绿假单胞菌 Pseudomonas aeruginosa |
| DJ-01 | – | – | – | + | – |
| DJ-03 | + | ++ | – | – | + |
| DJ-04 | ++ | +++ | ++ | ++ | ++ |
| DJ-06 | – | – | – | + | – |
由 表1可以看出,自然发酵豆酱中分离所得的乳酸菌DJ-01和DJ-06只对志贺氏菌有抑菌作用,菌株DJ-03只对大肠杆菌,沙门氏菌和铜绿假单胞菌杆菌有抑菌作用,只有DJ-04对5种致病菌均有良好的抑菌效果,且对沙门氏菌抑菌效果程度最高。抑制致病菌的生长是乳酸菌作为益生菌改善人体肠道功能,调节肠道菌群的重要指标之一。由 表1可知,DJ-04菌株有较广的抑菌效果,选取DJ-04作为研究对象,对其特性进行深入的研究。
2.2 人工胃肠液中耐受性试验按照1.5的方法进行人工胃肠液耐受性试验的研究,菌株DJ-04在不同pH的人工胃液中处理不同时间后,所检测到的活菌数见 表2。菌株DJ-04在pH 1.5的人工胃液中,耐受性较差,3 h后活菌数远小于初始时活菌数,这可能是因为pH值过低,导致乳酸菌无法维持自身细胞内pH的稳定,从而导致乳酸菌生长停滞,甚至死亡 [16]。在pH值为2.5、3.5和4.5的人工胃液中均能保持很好的存活率。在pH为2.5的人工胃液中处理3 h,活菌数接近 10 8CFU/mL,存活率达到31.62%,在pH为3.5和4.5的人工胃液中处理3 h,活菌数达到10 8CFU/mL以上,存活率均达到79.43%,说明菌株DJ-04具有良好的人工胃液耐受性。
| 注:AI:人工肠液;A、B、C和D表示不同处理下乳酸菌活菌数方差分析(P<0.05)的t检验结果. Note: AI: Artificialintestinal juice; A, B, C, and Drepresent the significance of analysis of variance (P<0.05). | ||||
| pH | Time (h) | |||
| 0 | 1 | 2 | 3 | |
| 1.5 | 8.42±0.22 A | 3.24±0.24 B | 2.12±0.26 C | 1.46±0.24 D |
| 2.5 | 8.42±0.22 A | 8.13±0.20 AB | 7.98±0.32 AB | 7.92±0.24 B |
| 3.5 | 8.42±0.22 A | 8.41±0.40 A | 8.36±0.50 A | 8.32±0.32 A |
| 4.5 | 8.42±0.22 A | 8.41±0.18 A | 8.34±0.42 A | 8.32±0.40 A |
| AI | 8.42±0.22 A | 8.36±0.22 A | 8.32±0.26 A | 8.31±0.16 A |
菌株DJ-04经过人工肠液作用不同时间后,检测到的活菌数见 表2,作用3 h后活菌数仍达到8.31×10 8CFU/mL,存活率达到77.62%,说明菌株DJ-04对人工肠液具有良好的耐受性。
2.3 耐胆盐试验按照1.6的方法对菌株DJ-04进行胆盐耐受性的研究,实验结果如 图1所示。菌株DJ-04培养 24 h后活菌数随牛胆盐质量浓度的增加而降低,菌体在含质量浓度为0.2 g/100 mL的牛胆盐培养基中生长良好,活菌数高于10 7CFU/mL,在0.3–0.5 g/100 mL的牛胆盐中活菌数明显下降,耐受性降低,但是在0.3 g/100 mL的牛胆盐环境中培养24 h后活菌数仍然接近10 5CFU/mL,且在0.5 g/100 mL的牛胆盐环境中生长24 h后仍有乳酸菌活菌数的存在,说明菌株DJ-04对胆盐具有良好的耐受能力。

|
| 图 1 DJ-04对不同浓度牛胆盐的耐受力 Figure 1 Survival of DJ-04 in the presence of bile salt |
对菌株DJ-04按照1.7的方法进行渗透压耐受性的研究,结果见 图2。由 图2可知,经过24 h培养后,活菌数随NaCl质量浓度的增加先增加然后降低,质量浓度为2 g/100 mL和4 g/100 mL时的活菌数高于0 g/100 mL时的活菌数,说明一定低浓度的NaCl不影响乳酸菌的生长,这可能是因为一定浓度的盐溶液中,乳酸菌会通过自身调节作用,恢复胞内渗透压平衡[[17],从而适应环境并继续生长。不同微生物对渗透压的抵抗力是有一定限度的,超过一定限度则使微生物生长受到抑制,甚至引起微生物的死亡。 图2说明随着NaCl质量浓度的继续升高,乳酸菌DJ-04活菌数开始下降,说明高浓度的渗透压会抑制其生长,但是在10 g/100 mL时活菌数仍在10 7CFU/mL以上,说明菌株DJ-04具有良好的高渗透压耐受性。

|
| 图 2 DJ-04对不同浓度NaCl的耐受力 Figure 2 Survival of DJ-04 in the presence of salt |
|
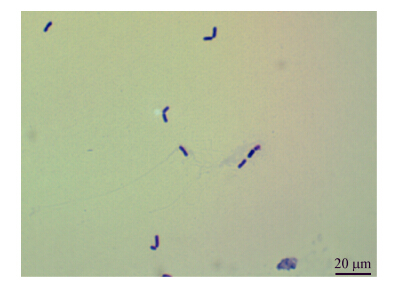
| 图 3 乳酸菌DJ-04菌体特征 Figure 3 The shape character of strain DJ-04 |
| 注: +:阳性; –:阴性. Note: +: Positive; –: Negative. | |||
| 试验项目 Experiment items | 结果 Results | 试验项目 Experiment items | 结果 Results |
| 产硫化氢试验Hydrogen sulfide production test | – | 葡萄糖Glucose | + |
| 精氨酸产氨试验Arginine test | – | 木糖Xylose | + |
| 淀粉水解试验Starch hydrolysis test | – | 麦芽糖Maltose | + |
| 明胶液化试验Gelatin liquidized test | – | 果糖Fructose | + |
| 甘露糖Mannose | + | 蔗糖Sucrose | + |
| 乳糖Lactose | + | 核糖Ribose | + |
| 半乳糖Galactose | + | 山梨醇Sorbitol | + |
| 鼠李糖Rhamnose | – | 纤维二糖Cellobiose | + |
| 阿拉伯糖Pectinose | – | 七叶苷Aesculin | + |
| 棉籽糖Raffinose | + | 水杨苷Salicin | + |
从菌株的形态以及生理生化特性看,本实验中分离筛选的菌株DJ-04与《伯杰氏细菌鉴定手册》(第8版)中描述的植物乳杆菌(Lactobacillus plantarum)基本相同,因此将DJ-04初步鉴定为植物乳杆菌(Lactobacillus plantarum)。
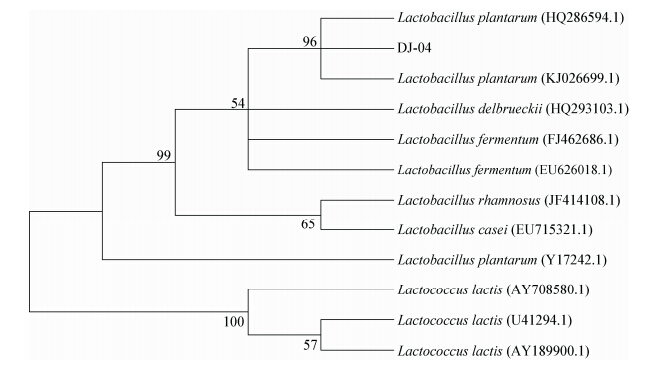
2.5.2 菌株的16S rRNA序列分析:为了进一步确定DJ-04的种属,菌株扩增的16S rRNA序列在GenBank中比对后,与之相似度达99%的菌株90%为植物乳杆菌。 图4是根据DJ-04的16S rRNA序列与相关种属16S rRNA序列构建的系统发育树。由 图4可见,DJ-04与Lactobacillus plantarum自然聚为一支,经过同源性比对发现菌株DJ-04与Lactobacillus plantarum的16S rRNA序列一致性达到99%。因此,结合形态及生理生化特征,DJ-04鉴定为植物乳杆菌(Lactobacillus plantarum)。
|
| 图 4 基于16S rRNA序列的系统发育树 Figure 4 Phylogenetic tree based on 16S rRNA sequences |
中国传统发酵食品生产历史悠久,风味独特,深受人们喜爱。现代科学研究表明:发酵食品不仅具有较高的营养价值和独特的风味,而且具有一定的保健功能。这些功能与发酵中的微生物密不可分,如各种乳酸菌、酵母菌、霉菌、醋酸菌及其他细菌等,其中乳酸菌是最为重要的一类微生物 [ 18]。乳酸菌具有改善肠道微生态平衡、增强机体生物屏障、抑制有害微生物生长、提高免疫力的功能。发酵食品中的乳酸菌是通过口服到达肠道并发挥功效,因此乳酸菌必须能通过消化道,并在肠道内保持一定数量的活菌才能发挥其功效。这就要求乳酸菌能够耐受胃酸、胃蛋白酶以及肠道中胆盐和胰蛋白酶及较高渗透压的影响。本文从传统发酵豆酱中筛选得到具有广谱抑菌效果的乳酸菌DJ-04,对其进行人工胃肠液、胆盐、高渗透压耐受性的研究并对其进行鉴定,判定为植物乳杆菌。
胃液是阻止大多数微生物进入肠道的天然屏障,胃液pH的大小根据饮食结构不同而波动很大,通常pH为3.0左右,空腹或食用酸性食品可达1.5,食用碱性食品可达4.0-5.0 [13]。小肠的环境偏碱性,其pH值约为7.6,食物在小肠中的停留时间一般为 1-4 h。乳酸菌发挥其益生功能,必须首先以活菌状态通过胃,进而有可能在肠道存活并定殖。本研究对前期筛选分离的植物乳杆菌DJ-04进行人工胃肠液的耐受性研究。虽然pH为1.5的人工胃液对DJ-04具有一定程度的抑制作用,但人体胃液的pH值通常在3.0左右,且食物通过胃的时间一般为 1-2 h。植物乳杆菌DJ-04在pH为2.5和3.5的人工胃液中处理3 h后,活菌数仍维持在10 7和 10 8CFU/mL以上。据报道,摄入含有1×10 6CFU/mL或以上的活性乳杆菌就能发挥其益生作用 [19],表明植物乳杆菌DJ-04对低pH环境和胃蛋白酶均有很强的耐受能力,能保持较高浓度的活菌数通过胃到达肠道。但由于pH 1.5的人工胃液对植物乳杆菌DJ-04的存活有明显的抑制,3 h处理后,仅有少量存活,所以应注意不要空腹摄取,以免胃酸过强,影响益生菌的功效。益生菌发挥其改善人体肠道的功能,必须在肠道内定殖并保持一定数量的活菌数,因此要对肠液具有一定的耐受性。本研究中植物乳杆菌DJ-04对人工肠液有很好的耐受性,经过3 h处理后活菌数仍维持在10 8CFU/mL以上。由此可见,植物乳杆菌DJ-04能良好耐受人体胃肠液,这有利于其在人体肠道内定殖并保持一定的存活量,进而改善人体肠道功能,具有肠道益生菌的 潜能。
对胆盐的耐受能力也是筛选优良益生菌的重要标准之一。人体小肠中胆盐的质量浓度在0.03-0.30 g/100 mL的范围内波动 [20],益生菌要在小肠中发挥益生调节功能,必须耐受一定浓度的胆盐作用 [21]。本文研究发现,植物乳杆菌DJ-04对不同浓度的胆盐均有良好的耐受性,在0.30 g/100 mL的牛胆盐环境中培养24 h后活菌数仍然接近 10 5CFU/mL,因此DJ-04能良好耐受胆盐环境并大量存活。熊涛等 [13]研究植物乳杆菌耐受性时,也发现植物乳杆菌能良好耐受0.30 g/100 mL的牛胆盐。
由于食糖或食盐等物质作用使人体胃肠道内存在一定渗透压,人体胃肠道中NaCl质量浓度在1.00-6.00 g/100 mL的范围波动,因此要求乳酸菌具有一定耐渗透压能力,才能在肠道保持活力并发挥有益作用。所以乳酸菌是否具有一定的耐渗透压能力也是评定其菌种优良的一个重要指标。卜永士等 [22]研究认为干酪乳杆菌BDⅡ能够耐受6.5%的NaCl;吕兵等 [23]研究表明嗜酸乳杆菌耐受6.0%的NaCl,本文所选植物乳杆菌DJ-04在10.00 g/100 mL的NaCl中培养24 h后活菌数仍在10 7CFU/mL,表明DJ-04具有很强的耐渗透压能力,这对DJ-04在人体肠道定殖,进而改善人体肠道功能以及应用于工业生产提供了良好前景。因此,本文从传统发酵豆酱中分离筛选的植物乳杆菌DJ-04不仅具有广谱抑菌活性,可以有效抑制肠道致病菌的生长;并且能够耐受人工胃肠液、胆盐以及高渗透压,在肠道内能够大量存活,增加肠道内益生菌的数量,起到调节肠内菌群平衡、改善人体肠道功能、增强人体免疫力的作用。已有研究结果表明植物乳杆菌具有较强的胃肠液和胆盐耐受性 [13, 24, 25],但同时具有高渗透压耐受能力的植物乳杆菌还很少。因此,本研究筛选的植物乳杆菌DJ-04具有良好的肠道益生功能,在功能性食品开发及发酵食品生产方面具有应用潜力,其在发酵功能性食品等方面的应用也需要进一步的研究。
| [1] | RasicJL, Kurmann JA. Bifidobacteria and Their role: Microbiological Nutritional-physiologicaland Technological Aspects and Bibliography[M]. Boston: Besel, 1983(2): 44-50 |
| [2] | WuSQ, Wang SY, Tan K, et al. Studying progress of Bifidobacteria[J]. Journal ofChangchun University, 2007, 17(4): 57-61 (in Chinese) 吴淑清, 王顺余, 谭克, 等. 双歧杆菌的研究现状[J]. 长春大学学报, 2007, 17(4): 57-61 |
| [3] | ChenSY, Li ZZ, Chen F. The current status on the physiological function and safetyresearch of human intestinal probiotics[J]. Chinese Journal of Microecology, 2007,19(4): 397-398 (in Chinese) 陈思羽, 李祯祯, 陈芳. 人体肠道益生菌的生理功能和安全性研究现状[J]. 中国微生态学杂志, 2007, 19(4): 397-398 |
| [4] | LiangHY, Ma YC, Cheng JJ, et al. Isolation, identification and screening ofhalophilic lactic acid bacteria from naturally fermented soybean paste[J].China Brewing, 2006, 161(8): 24-27 (in Chinese) 梁恒宇, 马莺拙, 程建军, 等. 自然发酵黄豆酱中嗜盐乳酸菌的分离、鉴定与筛选[J]. 中国酿造, 2006(8): 24-27 |
| [5] | LiangHY, Deng LK, Lin HL. Distribution, functions and applications of lactic acid bacteriaintraditional fermented soybean foods[J]. Food Science, 2013, 34(19): 381-385 (inChinese) 梁恒宇, 邓立康, 林海龙. 传统发酵大豆食品中乳酸菌的分布、功能和应用[J]. 食品科学, 2013, 34(19): 381-385 |
| [6] | RheeSJ, Lee JE, Lee CH. Importance oflactic acid bacteria in Asian fermented foods[J]. Microbial Cell Factories,2011, 10(1): 1-13 |
| [7] | FanJF, Li LT, Zhang YY, et al. Biofunctional activity of traditional fermentedsoybean foods[J]. Food Science, 2005, 26(1): 250-254 (in Chinese) 范俊峰, 李里特, 张艳艳, 等. 传统大豆发酵食品的生理功能[J]. 食品科学, 2005, 26(1): 250-254 |
| [8] | D’AimmoMR, Modesto M, Biavati B. Antibiotic resistance of lactic acid bacteria and Bifidobacteriumspp. isolated from dairy and pharmaceutical products[J]. InternationalJournal of Food Microbiology, 2007,115(1): 35-42 |
| [9] | LiPL. Theory and Technology of Food Microbiology[M]. Beijing: China AgriculturePress, 2001(2): 163-164 (in Chinese) 李平兰. 食品微生物学实验原理与技术[M]. 北京: 中国农业出版社, 2001(2): 163-164 |
| [10] | DongCW, Mao DB, Bai YH, et al. Screening and identification of lactic acidbacterium producing bacteriocin with broad spectrum[J]. Science and Technologyof Food Industry, 2009(4): 129-133 (in Chinese) 董彩文, 毛多斌, 白燕红, 等. 产广谱细菌素口乳杆菌菌株的筛选和鉴定[J]. 食品工业科技, 2009(4): 129-133 |
| [11] | XinL, Guo BH, Wu ZJ. Studies on the survival properties of three Lactobacillusstrains in imitative gastroenteric environments[J]. China Dairy Industry, 2005,33(5): 15-17 (in Chinese) 辛羚, 郭本恒, 吴正钧. 3株乳杆菌在模拟消化环境中存活性能的研究[J]. 中国乳品工业, 2005, 33(5): 15-17 |
| [12] | XiongT, Wang J, Zeng ZJ, et al. An improved method on determining the quick count ofviable Lactobacillus[J]. Food and Fermentation Industries, 2009, 35(10):132-134 (in Chinese) 熊涛, 王韵, 曾哲灵, 等. 一种改良的乳酸菌活菌数快速测定方法[J]. 食品与发酵工业, 2009, 35(10): 132-134 |
| [13] | XiongT, Song SH, Huang JQ, et al. Tolerance of Lactobacillus plantarum NCUll6in stimulated digestive environments[J]. Food Science, 2011, 32(11): 114-117(in Chinese) 熊涛, 宋苏华, 黄锦卿, 等. 植物乳杆菌NCU116在模拟人体消化环境中的耐受力[J]. 食品科学, 2011, 32(11): 114-117 |
| [14] | ZhangG. Foundation, technology andApplication of Lactic acid bacteria[M]. Beijing: Chemical IndustryPress, 2006(2): 92-93,434-435 (in Chinese) 张刚. 乳酸细菌-基础、技术和应用[M]. 北京: 化学工业出版社, 2006(2): 92-93,434-435 |
| [15] | WangY, Zhou JZ, Huang KH, et al. Isolation and identification of one Lactobacillusplantarum strain from pickles[J]. Jiangsu Journal of Agriculture andScience, 2010, 26(1): 219-221 (in Chinese) 王英, 周剑忠, 黄开红, 等. 泡菜中一株植物乳杆菌的分离筛选及鉴定[J]. 江苏农业学报, 2010, 26(1): 219-221 |
| [16] | ZhangYG, Tian L. The mechanism of acid tolerance of lactic acid bacteria[J]. FeedIndustry, 2007, 28(4): 62-64 (in Chinese) 张艳国, 田雷. 乳酸菌的耐酸性机制[J]. 饲料工业, 2007, 28(4): 62-64 |
| [17] | ChenW, Zhao SS, Zhang QX. The mechanism of LAB to salt stress[J]. Journal ofChinese Institute of Food Science and Technology, 2010, 13(10): 1-7 (inChinese) 陈卫, 赵山山, 张秋香. 乳酸菌的耐盐机制[J]. 中国食品学报, 2013, 13(10): 1-7 |
| [18] | LiQQ, Chen QH, He GQ, et al. Diversity and identification of lactic acid bacteriain Chinese traditional foods[J]. Food Science, 2009, 30(23): 516-520 (inChinese) 李青青, 陈启和, 何国庆, 等. 我国传统食品中乳酸菌资源的开发[J]. 食品科学, 2009, 30(23): 516-520 |
| [19] | GillilandSE. Health and nutritional benefits from lactic acid bacteria[J]. FEMSMicrobiology Letters, 1990, 87(1): 175-188 |
| [20] | WangJC, Guo Z, Yan LY, et al. Comparison of transit tolerance and fermentationproperties of probiotic Lactobacillus casei Zhang with commercialprobiotic strains[J]. Journal of Chinese Institute of Food Science andTechnology, 2009, 9(5): 14-23 (in Chinese) 王记成, 郭壮, 闫丽雅, 等. 益生菌 Lactobacilluscasei Zhang与商业益生菌对胃肠转运耐受性及发酵特性的比较[J]. 中国食品学报, 2009, 9(5): 14-23 |
| [21] | PanXD, Chen FQ, Wu TX, et al. The acid, bile tolerance and antimicrobial propertyof Lactobacillus acidophilus NIT[J]. Food Control, 2009, 20(6): 598-602 |
| [22] | BuYS, Guo BH. Studies on the biological properties of Lactobacillus casei[J].Journal of Dairy Science and Technology, 2004(2): 49-51 (in Chinese) 卜永士, 郭本恒. 一株干酪乳杆菌的生物学特性研究[J]. 乳业科学与技术, 2004(2): 49-51 |
| [23] | Lv B,Zhang GN. Studies on the biological properties of Lactobacillus acidophilusand its fermented milk[J]. China Dairy Industry, 2002, 30(5): 37-39 (inChinese) 吕兵, 张国农. 嗜酸乳杆菌生物学特性及其发酵乳的研究[J]. 中国乳品工业, 2002, 30(5): 37-39 |
| [24] | DeVries MC, Vaughan EE, Kleerebezem M, et al. Lactobacillus plantarum-survival,functional and potential probiotic properties in the human intestinal tract[J].International Dairy Journal, 2006, 16(9): 1018-1028 |
| [25] | LiuY, Cao Y, Liu Bo, et al. Tolerance of lactic acid bacteria strains forphytoprotein yoghurt fermentation to simulated gastrointestinal environments[J].Fujian Journal of Agricultural Sciences, 2013, 28(7):709-713 (in Chinese) 刘芸, 曹宜, 刘波, 等. 植物蛋白发酵乳酸菌对模拟胃肠道环境的耐受性研究[J]. 福建农业学报, 2013, 28(7): 709-713 |
 2015, Vol. 42
2015, Vol. 42




