扩展功能
文章信息
- 阙新桥, 林艺辉, 胡育龙, 肖剑萍, 洪文荣
- 一株产 G418 单组分工程菌的构建
- Construction of an engineering strain to produce G418 single component
- 微生物学通报, 2015, 42(2): 307-314
- Microbiology China, 2015, 42(2): 307-314
- 10.13344/j.microbiol.china.140449
-
文章历史
- 收稿日期: 2014-06-02
- 接受日期: 2014-08-25
- 优先数字出版日期(www.cnki.net): 2014-11-03
氨基糖苷类抗生素,如庆大霉素、妥布霉素等,不仅是良好的抗菌药物,而且还具有潜在的治疗人体免疫缺陷[1]和消除抗药性质粒功能[2, 3]。G418是庆大霉素生物合成的中间体,可作用于真核生物的80S核糖体亚基上,有效抑制寄生虫和原生动物的生长;在分子生物学实验中,G418通常作为细胞转染的筛选标记材料[4]。但作为中间体是含量很少,分离提取困难;产G418的小单孢菌(Micromonospora rhodorangea NRRL 5326)代谢产物也是多组分,分离提取复杂[5],价格昂贵。因此,如果能工程化庆大霉素产生菌绛红小单孢菌G1008,获得积累单组分G418的工程菌,不仅可以完善庆大霉素生物合成途径的研究,而且还有重要的产业化意义。
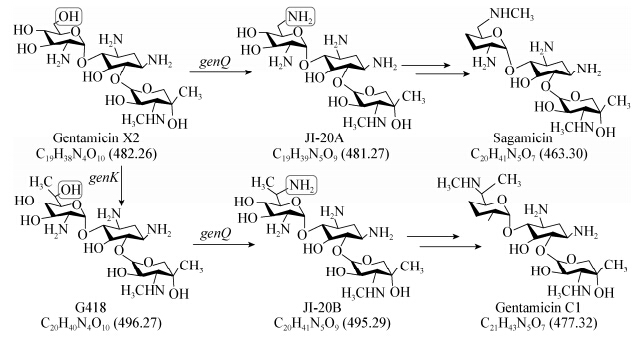
自庆大霉素问世以来,对其生物合成过程进行了广泛的探索。通过对阻断突变株喂养中间产物,或突变株之间的共合成,以及使用14C-、13C-甲硫氨酸进行研究,提出了庆大霉素生物合成途径的轮廓[6, 7, 8],如图 1所示。随后分子生物学技术在氨基糖苷类抗生素研究中的广泛应用,为从分子遗传水平阐明生物合成过程奠定了技术基础,如丁酰苷菌素已经从酶催化水平解析了生物合成的全过程。庆大霉素的生物合成过程也逐步取得突破,GenBank数据库中,先后公布了棘孢小单孢菌中庆大霉素的生物合成基因簇gnt (登录号:AJ524043)、gtm (登录号:AJ575934)和gen (登录号:AJ628149),长度分别为38146、32 666和84222 bp。通过生物信息学分析,推测各个基因的功能,结合预测的生物合成代谢途径,形成了完整的庆大霉素代谢网络[9]。Park等[10]通过在委内瑞拉链霉菌中异源表达确认了由6-磷酸葡萄糖至庆大霉素A2的最小生物合成基因模块。2012年,通过接合转移方法将质粒成功导入绛红小单孢菌,并敲除genK基因,构建了C1a产生菌,间接证明其甲基化功能[11]。同时,Kim等[12]证明GenK是一个钴胺素依赖的S-腺苷-甲硫氨酸激酶,在体外实现了庆大霉素X2转变为G418的催化活性,验证了前者的推测。2014年,Guo等[13]阐明了庆大霉素生物合成分支点处催化酶的专一性和交叉性,GenQ为双功能酶,同时作用于庆大霉素X2和G418;GenB1为C-6′位主要的转氨酶,GenB2为C2a与C2的差向异构化酶,而GenB3和GenB4参与了C-3′,4′的双脱羟基作用,其中GenB2、GenB3和GenB4也具有C-6′位转氨作用。
|
| 图 1 庆大霉素的部分生物合成途径 Figure 1 Thepartial biosynthesis pathway of gentamicin |
综上所述,利用分子遗传学方法进行定向改造绛红小单孢菌是可行的。2012年洪文荣等公布了绛红色小单孢菌G1008的庆大霉素生物合成基因簇(登录号:JQ975418),其中基因genQ*与棘孢小单孢菌中genQ为同源基因,本研究通过敲除M. purpurea G1008中genQ*阻断庆大霉素的生物合成代谢流,构建一株具有工业应用潜质的G418单组分工程菌,同时验证GenQ在绛红小单孢菌中的双功能催化作用及是否有可替代酶。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒:绛红小单孢菌G1008为庆大霉素产生菌,大肠杆菌E. coli Top10为质粒克隆宿主,大肠杆菌E. coli ET12567 (pUZ8002)为接合转移供体菌,pKC1139 (aac(3)IV,oriT)为大肠杆菌-链霉菌穿梭质粒,以上均为本实验室保藏。克隆载体pMD19-T购自日本TaKaRa公司。 1.1.2 培养基和抗生素:绛红小单孢菌G1008固体培养基、种子培养基、发酵培养基及预萌发培养基均参照文献[11]。绛红小单孢菌菌丝体生长培养基和大肠杆菌生长培养基分别为YEME培养基[14]和LB培养基。本研究中使用的抗生素及其终浓度分别为:氨苄青霉素100 mg/L、安普霉素100mg/L、氯霉素25 mg/L、卡那霉素50 mg/L、萘啶酸25 mg/L。 1.1.3 主要试剂:限制性内切酶、Taq DNA聚合酶和T4DNA连接酶购自日本TaKaRa公司;溶菌酶、RNase A酶、Proteinase K和DNA凝胶回收试剂盒购自生工生物工程(上海)有限公司;其他化学试剂均为国产分析纯或色谱纯。732型阳离子树脂购自上海华震科技有限公司。 1.2 方法 1.2.1 引物设计:根据庆大霉素的生物合成基因簇(登录号:JQ975418),使用VectorNTI软件设计genQ*的同源交换臂引物:P1/P2扩增上游交换臂B1,P3/P4扩增下游交换臂B2。根据同源重组原理设计一对筛选与鉴定突变株引物:P5/P6。以pKC1139质粒为模板,设计安普霉素抗性基因筛选引物:P7/P8。引物序列及其限制酶见表 1。| 引物Primer | 序列 Sequence (5′→3′) | 限制酶 Restriction enzyme |
| P1 | GAATTCAGGAGGTGCTCACCGACG | EcoR I |
| P2 | AAGCTTAGAACCGGGTGTCCCTCG | Hind III |
| P3 | AAGCTTTTCCGTTCGAAGGCGACC | Hind III |
| P4 | TCTAGAAACGGCTCGGTGAACTCGTG | Xba I |
| P5 | CATTCTTCGCATCCCGCCTCTG | |
| P6 | TCAGCGGTGGAGTGCAATGTCG | |
| P7 | TACGACGACTCACGCCAGGTCA | |
| P8 | TGGATCCCTGGGTGAGCTACGA |
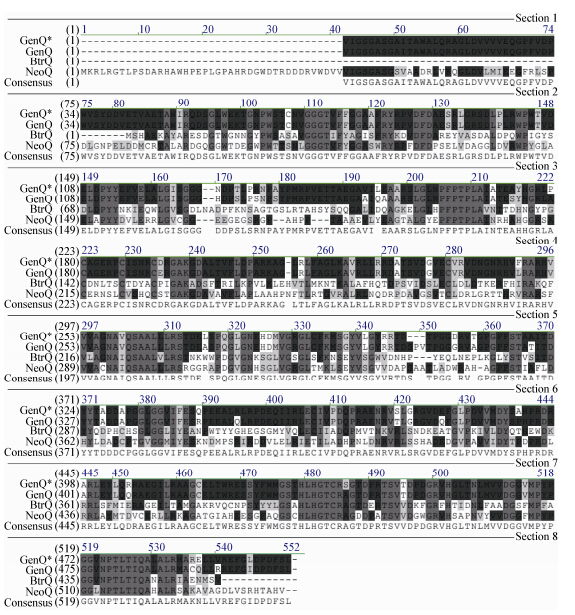
采用VectorNTI软件,将绛红小单孢菌基因genQ* (登录号:JQ975418)、棘孢小单孢菌基因genQ (登录号:AJ628149)、丁酰苷菌素生物合成过程的C-6′脱氢酶基因btrQ(登录号:AJ629247.1)和新霉素生物合成过程中C-6′和C-6′′′脱氢酶基因neoQ (登录号:AB066276) 4个基因DNA序列转译成氨基酸序列,进行氨基酸多序列比对,结果如图 2所示,深灰色代表保守序列,中灰色代表相同氨基酸,浅灰色则代表相似氨基酸。其中,GenQ*与GenQ的相似度为95.5%,而4个基因的氨基酸序列相似度高达90.8%。同时,通过在线软件SWISS- MODEL (http://www.ebi.ac.uk/interpro/entry/)分析GenQ*蛋白的结构域,存在一个FAD依赖的氧化还原结构域和两个GMC (Glucose-methanol-choline)氧化还原结构域,推测基因genQ*为绛红小单孢菌G1008中庆大霉素生物合成的脱氢酶基因。
|
| 图 2 GenQ*、 GenQ、 NeoQ 和 BtrQ 的氨基酸序列比对 Figure 2 Amino acid sequence alignment of GenQ*, GenQ, NeoQ and BtrQ |
参照方法1.2.1,扩增genQ*的上游交换臂B1(1 995 bp)和下游交换臂B2 (1 917 bp),分别克隆至pMD-19T上,得到中间质粒pQB301和pQB302,经酶切验证正确。质粒pQB301经Hind III/EcoR I双酶切,回收B1片段;质粒pQB302经Hind III/ Xba I双酶切,回收QB2片段;与此同时,pKC1139经EcoR I/Xba I双酶切,回收6 477 bp片段,与交换臂B1、B2混合酶连,克隆得到重组质粒pQB303。重组质粒图谱(图 3A)中存在6个Sac I酶切位点,可以将质粒切割成6 214、1 606、1 217、751、531和82 bp6个线性片段,其中82 bp因太小,电泳检测未能清楚观察到;2个Hind III限制酶酶切位点,可以切割成8 457和1 944 bp两个片段;而经EcoR I/XbaI双酶切,则可以切割成 6 477和3 924 bp两个片段。重组质粒pQB303经过以上3种方式酶切验证,电泳检测结果如图 3B所示,电泳条带大小与理论分析一致,并经测序证明得到目的质粒正确,可用于后续的接合 转移。

|
| 图 3 质粒 pQB303 的物理图谱和验证 Figure 3 The feature map of pQB303 and verification Note: A: Map showing composition of the recombinant plasmidpQB303; B: Verification of pQB303 by restriction enzyme. 1:pQB303/(EcoR I/Xba I); 2: pQB303/Hind III; 3: pQB303/SacI; M: Marker (λ-EcoT14). |
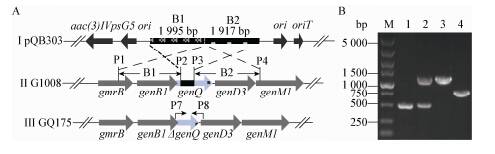
genQ*大小为1 515bp,根据同源重组模型,如图 4A所示,敲除基因621bp (412-1 032 bp),并被限制酶Hind III (AAGCTT)序列替代。设计双交换筛选引物P5/P6,单交换菌株可以扩增出561和1 183 bp,genQ*阻断突变株可以扩增出561 bp,而回复突变或亲株G1008则只能扩增出1 183 bp。同时,设计安普霉素抗性基因扩增引物(P7/P8),引物序列见表 1。
|
| 图 4 绛红小单孢菌 G1008 中 genQ*的敲除 Figure 4 Disruption of the genQ* in M. purpurea G1008 Note: A: Schematic diagram showing the homologousrecombination; B: The PCR verification of the mutants. M: DL5000; 1: GQ175/(P7/P8);2: GQ1/(P7/P8); 3: G1008/(P7/P8); 4: GQ1/(P5/P6). |
参照方法1.2.3,将同源重组质粒pQB303导入到绛红小单孢菌G1008中。质粒pQB303携带链霉菌温敏型复制起始位点psG5 ori,只有温度低于34 °C时,才能在绛红小单孢菌G1008中游离存在。因此在37 °C及安普霉素和萘啶酸两种抗生素筛选下,只有质粒pQB303整合到G1008基因组中,能在固体平板上生长,即为单交换菌株。选择其中一株长势较好的,命名为绛红小单孢菌GQ1,用于双交换菌株的筛选。GQ1转点至含有安普霉素 100 mg/L和萘啶酸25 mg/L的固体平板中,培养3代,彻底清除可能夹杂的大肠杆菌和G1008。再提取GQ1基因组为模板,用筛选引物P5/P6和安普霉素抗性引物P7/P8进行PCR扩增,PCR产物电泳如图 4B所示,与理论一致,进一步证明GQ1为目的单交换菌株。
单交换菌株具有遗传不稳定性,在没有筛选压力下,容易在同源交换臂上发生第二次重组,依据这一特性即可筛选得到阻断突变株。单交换菌株GQ1经松弛培养3代后,开始分离单菌落直至第8代,单菌落影印至含有阿泊拉霉素平板和无抗平板上,得到11株安普霉素敏感菌株,这些菌落可能为阻断突变菌株,也可能为回复突变菌株。经孢子PCR初步检测,有两株可能为阻断突变株。对两株进行斜面培养,观察其生长形态和孢子丰厚度,并进行发酵和生物效价测定,选择生长状态好及生物效价高的一株,提取其基因组DNA,采用引物(P5/P6)进行PCR扩增,PCR产物电泳结果如图 4B,与理论大小561bp一致,经DNA测序,结果准确,最终得到了目标菌株,即genQ*基因缺失工程菌,命名为绛红小单孢GQ175。
工程菌GQ175经斜面培养3代,其形态特征没有发生明显变化,生长良好,产孢丰富,说明其遗传性状稳定。对GQ175进行摇瓶发酵,并以亲株G1008作对照,发酵完成后,对GQ175和G1008两者发酵液进行预处理,检测生物效价。结果显示,GQ175的生物效价为828 mg/L,与亲株G1008的930mg/L相当,说明其产抗能力没有因为genQ*缺失而受到影响。
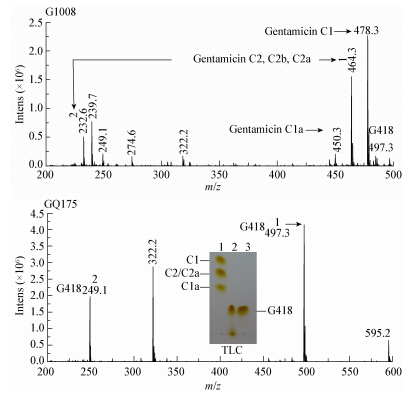
2.4 绛红小单孢菌 GQ175 的代谢产物分析将预处理的发酵液经732氨型树脂吸附,洗脱后再用乙醇沉淀,得到粗制样品。粗制样品通过TLC和MS检测,GQ175的代谢产物与亲株G1008进行比较,分析基因genQ*缺失对庆大霉素代谢流的影响。TLC检测结果如图 5所示,GQ175不再合成庆大霉素C族组分,只产生了一种与G418标准品迁移率一样的物质,初步判定为G418。经MS进一步分析,G1008代谢产物质谱图有3个主峰:分子量为450.3 (C1a)、464.3 (C2、C2a、C2b)和478.3 (C1),而497.3 (G418)分子强度峰极低;而GQ175代谢产物的质谱图主峰为497.3,与G418的分子量吻合,322.2的峰为碎片峰,249.1的为双电荷峰。因此,阻断突变株GQ175不再合成庆大霉素C族组分,只合成G418单一组分。
|
| 图 5 突变株 GQ175 与亲株 G1008 发酵代谢产物 TLC 和 MS 分析 Figure 5 Disruptionof the genQ* in M. purpurea G1008 Note: TLC: 1: Gentamicin standard; 2: Products from M.purpurea GQ175; 3: G418 standard. |
氨基糖苷类抗生素具有抗菌谱广、杀菌完全等特征,是临床上应用广泛的抗感染药物。获得单组分高产菌株是从根源上降低其工业生产成本的主要措施,但不管是传统的育种还是基因工程定向育种都难以取得良好的效果。如Hong等[17]敲除了黑暗链霉菌Tt-49中aprH-M基因模块,得到了一株氨甲酰妥布霉素单组分产生菌,但可能是由于破坏的菌株基因模块太大,其整体的产抗能力不如 亲株。
绛红小单孢菌G1008中庆大霉素生物合成基因genQ*,与棘孢小单孢菌中庆大霉素C-6′脱氢酶GenQ氨基酸序列相似高达95.5%,其长度则相差3 个氨基酸。本研究通过破坏绛红小单孢菌G1008中genQ*的功能,构建G418单组工程菌。为了尽量避免对菌株的损伤以及影响genQ*上下游基因的表达,选择敲除genQ* 1/3 (621 bp)的中间序列,得到一株G418单组分工程菌M. purpureaGQ175 (CGMCC No. 8543),不积累庆大霉素X2及其他庆大霉素组分。生物效价测定,GQ175的发酵单位为828 mg/L,与亲株G1008的930 mg/L相当,说明工程菌保持了亲株的产抗能力。然而G418的抑菌效率比C族复合物低得多,因此工程菌产G418的物质量已经超过了亲株产C族复合物的物质量。可能是由于庆大霉素生物合成中左支路物质流量也流向了G418的合成,或者庆大霉素C族终产物抑制效应的解除。此外,工程菌GQ175和亲株G1008代谢产物MS分析中,其分子峰强度可以粗略反映物质的含量,其中G418分子峰的强度已经高于庆大霉素C族复合物;单从G418来比较,工程菌已经高于亲株约200倍。
敲除棘孢小单孢菌ATCC15835中基因genQ序列1 494bp (全序列1 524 bp)获得一株突变菌 ΔgenQ,主产G418 (比野生菌高100倍)并积累少量庆大霉素X2[13]。与突变株ΔgenQ相比,工程菌GQ175除去了庆大霉素X2这一杂质组分,并且产G418增长倍数也比较高。产生这种区别的原因可能是敲基因序列的量不一样,也有可能是棘孢小单孢菌与绛红小单孢菌菌株的区别。此外,结果证明绛红小单孢菌中庆大霉素C-6′脱氢酶基因只有genQ*,不存在其他可替代基因,与棘孢小单孢菌一样,说明不同菌种间存在保守性。
| [1] | EnnifarE, Aslam MW, Strasser P, et al. Structure-guided discoveryof a novel aminoglycoside conjugate targeting HIV-1 RNA viral genome[J]. ACSChemical Biology,2013(8): 2509-2517 |
| [2] | DeNapJC, Thomas JR, Musk DJ, et al. Combating drug-resistant bacteria: smallmolecule mimics of plasmid incompatibility as antiplasmid compounds[J].American Chemical Society, 2004(126): 15402-15404 |
| [3] | ThomasJR, Hergenrother PJ. Targeting RNA with small molecules[J]. Chemical SocietyReviews, 2008, 108(4): 1171-1224 |
| [4] | VicensQ, Westhof E. Crystal structure of geneticin bound to a bacterial 16S ribosomalRNA A site oligonucleotide[J]. Journal of Molecular Biology, 2003, 326:1175-1188 |
| [5] | WaitzJA, Sabatelli F, Menzel F, et al. Biological activity of antibiotic G-418, a new Micromonospora-producedaminoglycoside with activity against Protozoa and Helminths[J]. AntimicrobalAgents and Chemotherapy,1974, 6(5): 579-581 |
| [6] | TestaRT, Tilley BC. Biotransformation, a new approach to aminoglycosidebiosynthesis: II. Gentamicin[J]. The Journal of Antibiotics, 1976, 29(2):140-146 |
| [7] | TestaRT, Tilley BC. Biosynthesis of sisomicin and gentamicin[J]. The JapaneseJournal of Antibiotics, 1979, 32: S47-S59 |
| [8] | KaseH, Odakura Y, Nakayama K. Sagamicin and the related aminoglycosides:fermentation and biosynthesis. I. biosynthetic studies with the blocked mutantsof Micromonospora sagamiensis[J]. The Journal of Antibiotics, 1982,35(1): 1-9 |
| [9] | KudoF, Eguchi T. Biosynthetic genes for aminoglycoside antibiotics[J]. The Journalof Antibiotics, 2009(62): 471-481 |
| [10] | ParkJW, Hong JS, Parjiuli N, et al. Genetic dissection of the biosynthetic route togentamicin A2 by heterologous expression of its minimal gene set[J].Proceedings of the National Academy of Sciences, 2008, 105(5): 8399-8404 |
| [11] | HongWR, Yan LB. Identification of gntK, a gene required for the methylationof purpurosamine C-6′ in gentamicin biosynthesis[J]. The Journal of General andApplied Microbiology, 2012, 58(5): 349-356 |
| [12] | KimHJ, McCarty MR, Ogasawara Y, et al. GenK-catalyzed C-6′ methylation in thebiosynthesis of gentamicin: isolation and characterization of acobalamin-dependent radical SAM enzyme[J]. Journal of the American ChemicalSociety, 2013, 135(22): 8093-8096 |
| [13] | GuoJH, Huang FL, Huang C, et al. Specificity and promiscuity at the branch pointin gentamicin biosynthesis[J]. Chemistry & Biology, 2014, 21(5): 608-618 |
| [14] | KieserT, Bibb MJ, Mark J, et al. Practical StreptomycesGenetics[M].Norwich, England: The John Innes Foundation, 2000: 162-170 |
| [15] | SambrookJF, Russell DW. Molecular Cloning: a Laboratory Manual[M]. 3rd Edition. ColdSpring Harbor Laboratory Press, 2001: 27-99 |
| [16] | ChinesePharmacopoeia Commission. Chinese Pharmacopoeia: Part 2[S]. Beijing: ChinaMedical Science Press, 2010: Appendix 93-98 (in Chinese)国家药典委员会. 中华人民共和国药典[S]. 第2部. 北京: 中国医药科技出版社, 2010: 附录93-98 |
| [17] | HongWR, Yan SD. Engineering Streptomyces tenebrarius to synthesize singlecomponent[J]. Letters in Applied Microbiology, 2012, 55(1): 33-39 |
 2015, Vol. 42
2015, Vol. 42




