扩展功能
文章信息
- 康慧颖, 王伟, 刘佳莉, 程园园, 郭长虹, 郭东林
- 两株具促生作用的苜蓿内生菌的分离纯化与鉴定
- Isolation and identification of two plant-growth promoting endophytes from alfalfa
- 微生物学通报, 2015, 42(2): 280-288
- Microbiology China, 2015, 42(2): 280-288
- 10.13344/j.microbiol.china.140483
-
文章历史
- 收稿日期: 2014-06-16
- 接受日期: 2014-09-30
- 优先数字出版日期(www.cnki.net): 2014-11-27
内生细菌被定义为能定殖于植物组织内部,而对宿主植物不引起可见损伤或负面影响的细菌[1]。植物体内存在内生菌是一种普遍现象,内生菌定殖于植物组织内部,能够适应这特殊的生态位,对植物产生有益的效应[2]。一方面植物体为内生菌提供其生长必需的能量和营养;另一方面,内生菌又可通过自身的代谢产物或借助于信号传导作用对植物体产生影响[2]。有益内生菌能够促进植物生长、固氮,或者增强对病原菌的抗性。这些细菌接种应用于植物,能起到促进植物生长或生物防治的作 用[3],具有良好的开发利用前景。
目前在很多植物中已经筛选出具有促生作用的内生菌,如枫杨[4]、辣椒[5]、番茄[6]、铁皮石斛[7]、马铃薯等[8]。田宏先等[8]从马铃薯块茎中分离出两株内生菌,分别为芽孢杆菌和荧光假单胞菌,在连续3年的大田试验中,这两株内生菌可显著提高马铃薯株高、茎粗、地下茎块及大薯率等各项指标。蔡学清等[5]从辣椒内分离出内生枯草芽孢杆菌BS-2 (Bacillus subtilis),该菌株处理的辣椒鲜重和干重分别比对照增加168.70%和181.25%;该菌株可诱导辣椒体内吲哚乙酸等促进植物生长激素含量的提高,并降低抑制植物生长激素的形成,如脱落酸等。由此可见,研究植物内生细菌具有重要理论意义和较高的商业应用价值。
苜蓿(Medicago sativa)是豆科苜蓿属多年生草本植物,作为优良牧草在世界范围内被广泛栽培和利用。具有抗旱、耐寒、耐风沙、耐盐碱、抗病虫害,耐刈割、持久性好、产量高等优质特性,被誉为“牧草之王”、“饲料皇后”。由于其耐贫瘠,在盐碱土、栗钙土和黑钙土中均能良好生长,也可以作为一种重要的农田生物改良剂。同其他豆科牧草一样,苜蓿能与土壤的根瘤菌形成固氮共生体来固定空气中游离态的氮气,增加土壤肥力[9]。
当前已有对苜蓿内生细菌的研究报道。祁娟[10]从不同品种、不同产地、不同贮藏年限的苜蓿种子中分离获得22株种子内生根瘤菌,菌株回接均能显著提高苜蓿苗的结瘤率、结瘤量、根瘤重量和生物量。Katarina等[11]研究了苜蓿中华根瘤菌接种对植物生长的促进。李剑峰等对内生根瘤菌在不同生育期苜蓿中的分布和数量变化进行了研究[12]。而苜蓿非根瘤内生细菌的研究相对较少。Valdenegro 等[13]研究了植物促生菌(PGPR)对木本苜蓿Medicago arborea生长的影响。Olivera等[14]评估了15株紫花苜蓿非根瘤菌内生菌对紫花苜蓿生长的影响。Lorena等[15]进行了苜蓿根际细菌表征并评估了单一或混合接种生物固氮作用的效果。汪玲玲 等[16]从中国新疆、内蒙古和墨西哥等地分离筛选到8株具有N酰基高丝氨酸内酯降解活性的苜蓿内生菌。林世利等发现内生细菌的种类在苜蓿中的分布规律依次为根>叶>茎>花>种子[17]。
本文以哈尔滨师范大学试验田生长的新鲜苜蓿为材料,从其组织内分离出两株内生菌ASR16和ALR33。经16S rRNA基因和生理生化检测,ASR16鉴定为成团泛菌(Pantoea vagans),ALR33鉴定为短小芽孢杆菌(Bacillus pumilus),并对这两株内生菌对苜蓿的促生性能进行了初步检测。
1 材料与方法 1.1 材料龙牧803紫花苜蓿(Medicago sativa)种子,购自黑龙江省农业科学院草业研究所,种植于哈尔滨师范大学农园。2012年8月采集植株样本。
1.2 培养基及主要试剂DF培养基(g/L):KH2PO4 4.0,Na2HPO4 6.0,MgSO4·7H2O 0.2,葡萄糖2.0,葡萄糖酸钠2.0,柠檬酸2.0,(NH4)2SO4 2.0,微量元素(FeSO4·7H2O 0.001,H3BO3 0.01,MnSO4·H2O 0.011 2,ZnSO4·7H2O 0.124 6,CuSO4·5H2O 0.078 2,MoO3 10 μg),pH 7.5[18]。
PKO培养基(g/L):葡萄糖 10.0,(NH4)2SO4 0.5,MgSO4·7H2O 0.3,NaCl 0.3,KCl 0.3,FeSO4·7H2O 0.036,MnSO4·7H2O 0.03,Ca3(PO4)3 2.0,pH 7.0。
CAS检测液(mmol/L):FeCl3 0.01,HCl 0.10,CAS 0.10,HDTMA 0.40,PIPES 0.15,pH 5.6。
1.3 苜蓿内生菌的分离纯化采集苜蓿的叶、茎、根,将其表面清洗干净,进行表面消毒:无菌操作台中用75%乙醇消毒 5 min,1% NaClO溶液消毒4 min,无菌水冲洗8次,无菌滤纸片吸干水分,放入无菌的研钵内研碎,梯度浓度稀释,涂布于LB固体培养基,在LB固体培养基上划线纯化至第6代,将最后一次冲洗苜蓿组织的无菌水设做空白对照[19]。根据菌落形态,挑选LB平板上生长的单菌落,划线分离,纯化菌株,草酸铵结晶紫染色显微观察,用30%无菌甘油制成甘油菌,−80 °C保存。
1.4 苜蓿内生菌的16S rRNA基因序列分析采用CTAB/NaCl方法提取细菌DNA,原核生物16S rRNA基因保守序列通用引物F8 (5′-AGAGTTTGATCCTGGCTCAG-3′)和R1541 (5′-AAGGAGGTGATCCAGCCGCA-3′)[20]进行PCR扩增,50 μL反应体系50 μL反应体系:模板DNA 5 μL, 10×PCR buffer 5 μL, 2.5 mmol/L dNTP mix 5 μL, 引物2 μL Taq DNA聚合酶0.5 μL, 加ddH2O至50 μL。扩增程序为:94 °C 3 min;94 °C 30 s,55 °C 30 s,72 °C 1.5 min,共30个循环;72 °C 10 min。获得的16S rRNA基因序列提交到NCBI的GenBank基因库,BLAST比对,与数据库中的已知序列进行同源性分析,运用MEGA 4软件生成NJ进化树。
1.5 生理生化鉴定对筛选的内生菌菌株进行接触酶、甲基红测定、V-P测定、淀粉水解、吲哚产生、葡萄糖发酵、乳糖发酵、甘露醇发酵、蔗糖发酵和柠檬酸利用检测,试验测定方法及初步鉴定方法参考《常见细菌系统鉴定手册》[21]。
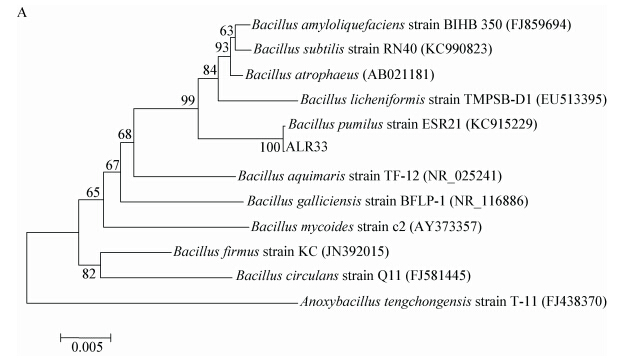
1.6 促生性质检测 1.6.1 吲哚乙酸IAA含量测定:供试菌株先在DF培养基中培养2 d,再取1 mL转入添加不同浓度色氨酸(L-Trp)的DF培养基(含0、200和500 mg/L L-Trp)中继续培养2 d,每个菌株重复3次。取样测菌液OD600值,其余培养基在室温下10 000 r/min离心,取500 µL上清液,添加2 mL Salkowski试剂,室温培养20 min后,在535 nm测吸光值(OD535)。将5 mmol/L的IAA母液稀释为系列浓度,与测样品相同方法测定吸光值,绘制标准曲线。参考标准曲线确定IAA含量[22]。 1.6.2 嗜铁素合成含量测定:参照Schwyn和Neilands的方法[23],将供试菌株的培养上清液过滤后,与铬天青S (CAS chromeazurol S)检测液等体积混合,充分反应后,测OD630,得吸光值A;以去离子水与CAS检测液等体积混合测得的Ar为对照。A/Ar值代表样品中嗜铁素的相对含量。 1.6.3 溶解磷活性的测定:利用钼锑抗比色法,将试供菌株在PKO培养基内活化,按1%的量接入PKO液体培养基中,28 °C、150 r/min培养3 d,每菌重复3次,接1%无菌水作对照。菌液10 000 r/min离心,取上清液100 μL,加5 mL钼睇抗显色液,定容至50 mL,反应30 min,测OD700值[24]。将 5 mg/L磷(K2HPO4)标准溶液稀释为系列浓度,与测样品相同的方法测定吸光值。绘制标准曲线,参考标准曲线确定可溶性磷的含量。 1.6.4 菌株的促生效果测定:促生实验在哈尔滨师范大学植物土培室中进行,采用浸种法接种。将ASR16和ALR33菌株接入LB培养基,28 °C、 150 r/min摇床培养12 h,收集菌体制成OD600为0.50±0.02的菌悬液备用。将挑选的苜蓿种子用清水冲洗后用70%的酒精5 min,1%次氯酸钠4 min进行表面灭菌,然后用无菌水冲洗8次后,摆放入装有用待测菌悬液的处理的无菌滤纸的平皿内,菌液浸种处理3d,发芽后挑选发芽势一致的苜蓿籽苗移入装有农田土的花盆中(农田土取于哈尔滨师范大学试验田,经过1×105 Pa、30 min连续3次灭菌)。每盆移入10颗苜蓿籽苗,每处理播种3盆,于培养室内(25 °C)培养。待生长30 d后测量株高、根长、干重和鲜重。SPSS 16.0软件进行单因素方差分析(one-way ANOVA)。 2 结果与分析 2.1 菌株鉴定 2.1.1 生理生化特征鉴定结果:ASR16细胞呈直杆状,菌落圆形,黄色,边缘整齐,光滑;ALR33菌体细杆状(图 1),菌落白色,不透明,扁平。两株苜蓿内生菌的生理生化鉴定结果见表 1。ASR16能利用的碳源为葡萄糖、蔗糖、甘露醇,甲基红、V-P、柠檬酸盐、接触酶反应均为阳性,不能产生吲哚、能水解淀粉。与成团泛菌(Pantoea vagans)特征相符。ALR33能利用碳源葡萄糖与甘露醇,接触酶阳性,能够产生吲哚,甲基红反应阴性,V-P、柠檬酸盐、反应为阳性,不能水解淀粉。与短小芽孢杆菌(Bacillus pumilus)特征相符。初步认为这两株菌株的特性分别符合成团泛菌(Pantoea vagans)和短小芽孢杆菌(Bacillus pumilus)。
|
| 图 1 菌株 ASR16 和 ALR33 显微照片 Figure 1 Microscopy images of ASR16 and ALR33 Note: A: ASR16; B: ALR33. |
| 菌株 Strain | 葡萄糖发酵 Glucose fermentation | 乳糖发酵 Lactose fermentation | 蔗糖发酵 Sucrose fermentation | 甘露醇发酵 Mannitol fermentation | 吲哚产生 Indole production | 甲基红测定 M. R test | V-P测定 V-P test | 柠檬酸盐实验Citrate test | 淀粉水解Hydrolysis of starch | 接触酶Catalase |
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. | ||||||||||
| AS16 | + | − | + | + | − | + | + | + | − | + |
| AL33 | + | − | − | + | + | − | + | + | − | + |
|
| 图 2 16S rRNA基因序列系统发育树 Figure 2 Phylogenetic tree derived from 16S rRNA gene sequence of ASR16 and ALR33 注:A:菌株ASR16系统发育树;B:菌株ALR33系统发育树. 分支支持强度(Bootstrap values)<50的未显示. 括号内为菌株序列号,分支上的数字为自展支持率,标尺为进化距离. Note: A: The Phylogenetic tree of ASR16; B: The Phylogenetic tree of ALR33. Only bootstrap values ≥50 are shown above nodes. The number on the branch is bootstrap. Scale for evolutionary distance. |
|
| 图 3 内生菌 ASR16 和 ALR33 的 IAA 合成量 Figure 3 IAA-equivalent synthesis of ASR16 and ALR33 |
|
| 图 4 内生菌 ASR16 和 ALR33 的嗜铁素合成量 Figure 4 Siderophore production of ASR16 and ALR33 |
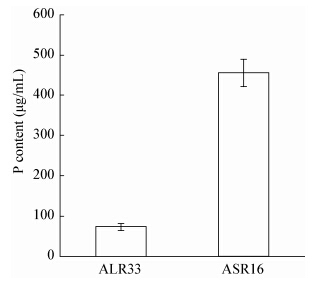
|
| 图 5 内生菌 ASR16 和 ALR33 的溶磷能力 Figure 5 Soluble phosphorus ability of ASR16 and ALR33 |

|
| 图 6 ASR16 和 ALR33 对苜蓿的促生作用 Figure 6 The plant-growth promoting effect on alfafa by strain ASR16 and ALR33 注:A、B:ASR16对苜蓿的促生作用;C、D:ALR33对苜蓿的促生作用. Note: A, B: The plant growth-promotion by ASR16; C, D: The plant growth-promotion by ALR33. |
| 菌株编号 Strain code | 单株高 Plant height (cm) | 植株鲜重 Fresh plant weight (g) | 根长 Root length (cm) | 根鲜重 Fresh root weight (g) | 植株干重 Dry plant weight (cm) | 根干重 Dry root weight (g) |
| 注:a、b、c、d:字母相同为不显著,字母不同为差异显著(p<0.05). Note: a, b, c, d: Different letters shows no significant difference, same letters shows significant difference. | ||||||
| CK | 19.07±2.80 a | 0.40±0.12 a | 11.47±1.23 a | 0.11±0.05 a | 0.07±0.02 a | 0.05±0.02 a |
| ASR16 | 25.05±3.28 b | 0.72±0.17 c | 15.54±1.43 c | 0.37±0.11 c | 0.16±0.03 c | 0.11±0.04 b |
| ALR33 | 23.61±2.50 b | 0.57±0.16 b | 12.99±1.56 b | 0.23±0.07 b | 0.10±0.03 b | 0.10±0.02 b |
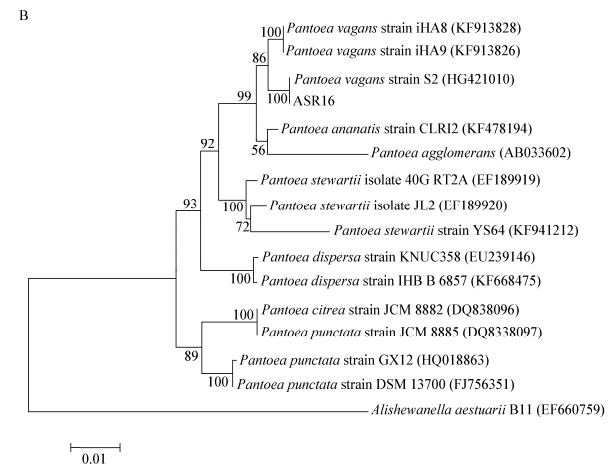
生理生化测定是通过菌株的特有表现反映其本质特征,从而将不同类群的微生物分开。16S rRNA基因序列同源性分析与生理生化试验相结合是一种比较快速准确进行细菌分类的方法。本研究中16S rRNA基因序列分析的系统发育学与表型特征的相关性较好。
16S rRNA基因序列分析表明菌株ASR16与成团泛菌(HG421010)位于同一分支,亲缘关系最近,鉴定菌株ASR16属于成团泛菌属。成团泛菌是泛菌属的代表菌株。已经发现的成团泛菌具有多种生物功能,在医学、农业及遗传学上都具有重要的作用。成团泛菌对植物也具有促生作用,如从水稻中分离得到的成团泛菌YS19,能够分泌生长素、细胞脱落酸、赤霉素和细胞分裂素4种植物激素[25]。成团泛菌还具有溶解磷素,生物固氮和合成ACC脱氨酶等一系列的重要功能[26, 27, 28]。成团泛菌J49,有溶磷、嗜铁素活性,能够促进花生的生长[28]。成团泛菌还可作为生防菌,从玉米根际土壤分离到的成团肠杆菌对土著致病真菌(Fusarium moniliforme)具有抑制作用,对在水果上由解淀粉欧文氏菌(Erwinia amylovora)引起的火疫病具有一定的防治效果[27]。
16S rRNA基因系统进化分析表明菌株ALR33与短小芽孢杆菌(KC915229)的进化距离最近,鉴定菌株ALR33属于短小芽孢杆菌属。据报道短小芽孢杆菌兼具防病和促生作用,具有生物固氮活性。有研究表明,分离自桤木的短小芽孢杆菌,有强烈的促生活性[29]。由多效唑引起的桤木籽苗矮小可以由接种细菌培养基的提取物或赤霉素有效改善;气相色谱分析显示细菌培养基提取物中存在赤霉素,该菌分泌的赤霉素可促进桤木伸长。
3.2 菌株的促生特性豆科植物的根瘤菌固氮能力强,还具有溶磷和分泌植物生长激素能力,对植物的生长和氮素提供起重要作用。接种后的根瘤具有固氮酶活性,能提高苜蓿苗的结瘤率、结瘤量、根瘤重量和生物量,已经有苜蓿根瘤菌制剂用于生产。Valdenegro等[13]发现PGPR接种木本苜蓿效果与特殊的菌根、内生菌之间的互作有关。根瘤内部可以克隆出与根瘤菌共生固氮无关的多种细菌类,包括芽胞杆菌属、假单胞菌属、肠杆菌属和克雷伯氏杆菌属等内生细菌从根瘤中分离出来。Olivera等[14]共接种试验表明所有非根瘤菌菌株提高了苜蓿的根瘤数量,但对增长没有显著影响,表明非根瘤菌菌株具备促进植物生长的潜力。
以往的研究结果也表明植物内生菌对苜蓿的生长具有促进作用,Lorena等[15]分离到对苜蓿生长有益的假单胞菌FM7d和芽孢杆菌sp M7c。虽然存在的部位、数量可能有所不同,不具有结瘤能力,植物内的促生细菌对宿主具有广泛的有益生物学作用。与根瘤菌相同,改善植物生长的能力可能与分泌生长激素能力、溶磷、分泌铁载体、产生酶类有关。本研究分离得到的内生菌来自于植物的根及茎叶内部,旨在考察非根瘤内生菌对苜蓿的促生 作用。
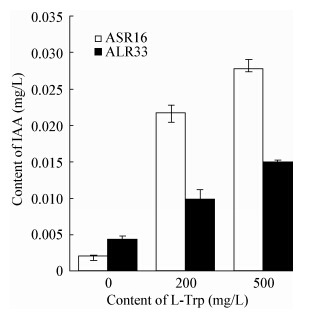
植物生长激素是一类具有生理活性的微量有机化学物质,在较低浓度下就能对植物生长产生显著影响。IAA能够促进细胞伸长生长,是最早发现的植物生长激素之一[30]。研究表明植物促生菌能产生植物激素,其促生机理与植物激素密切相关,其中研究最多的是IAA。沈德龙等[25]的研究证实,水稻内生成团泛菌YS19能分泌4种不同的植物生长激素,它们共同调节水稻的生命活动,能影响水稻乳熟期光合产物的分布。已有研究表明,IAA能够促进植物的生长并提高植物的抗逆能力,如接种高产IAA的苜蓿中华根瘤菌(Sinorhizobium meliloti)可以增强宿主的抗盐性;成团泛菌NBRISR菌株具有产IAA能力,能促进玉米及鹰嘴豆的生长[31]。现已得到的植物促生菌大多具有较高的IAA合成能力,本研究中ASR16和ALR33均具有合成IAA的能力,且随色氨酸(L-Trp)添加浓度的增大而增大。可以推测ASR16和ALR33具有潜在的植物促生能力。
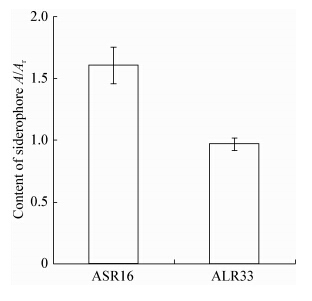
铁对所有生物体来说都是一种必要的生长元素。在铁有限制的条件下,植物促生菌可以产生称作嗜铁素的低分子量化合物,从而竞争获得铁离 子[32]。促生菌也可以通过促进宿主植物对营养元素的吸收而达到促生作用,碱蓬促生菌株TW1发酵液中嗜铁素的相对含量高达97.25%。在铁缺乏的条件下,促生菌可能通过嗜铁素竞争获得铁离子,从而消除铁缺乏对植物生长带来的不利影响。本研究中ASR16和ALR33均可合成嗜铁素,ALR33合成嗜铁素的能力高于ASR16,在缺铁条件下可以优先考虑利用ALR33。
磷参与了构成生物膜及碳水化合物,含氮物质和脂肪的合成、分解和运转等代谢过程,是作物生长发育必不可少的养分。对豆科植物合理施用磷肥,能明显提高鲜草产量,及作物抗旱、抗寒等抗逆性。土壤中的溶磷细菌(PSB)可将难溶的磷素转化为可利用的磷素,用PSB接种于小麦和豆类作物,可以提高植物对磷素的吸收。Hilda等[33]报道,磷溶解细菌能够增加宿主植物对磷的吸收并促进植物生长。假单胞菌、芽孢杆菌、根瘤菌都是溶解磷的菌种。成团泛菌NBRISR菌株具有溶磷活性,能够促进宿主植物对P的积累与吸收[31]。小麦的根际土壤中分离的成团肠杆菌HAUM1具有很高的解磷能力,在提高水稻磷含量方面也具有显著优势[26]。研究表明有机酸在溶磷中起着重要作用,但也可能有其他的因素参与。本实验中,ASR16和ALR33都具有溶解磷的能力,相对于ALR33,ASR16的溶磷活性更高,符合其与溶磷菌相近的进化分支地位。ASR16的IAA合成活性显著高于ALR33;ASR16的溶磷活性显著高于ALR33。ALR33的合成嗜铁素的能力显著高于ASR16;通过实验结果初步推测,ASR16的促生活性与其较高的IAA合成含量和溶磷活性有关,而ALR33的促生活性则可能与其较高的嗜铁素合成能力相关。两株苜蓿内生菌ASR16和ALR33可能的促生机制有所不同,有待进一步研究。
在盆栽试验中,菌株ASR16和ALR33对紫花苜蓿的促生作用均明显。植株鲜重、根长、根鲜重、植株干重、根干重增长显著,且叶色浓绿,叶片大。其中ASR16促生作用最佳。ASR16和ALR33对紫花苜蓿的促生作用表明其具有重要的应用潜力。促生菌对宿主植物生长的促进作用,不仅与植物激素、噬铁素、解磷作用有关,而且也与其固氮能力,对植物细胞色素的合成影响,与宿主互作的结构密切相关。本试验只对菌株ASR16和ALR33对苜蓿生长的影响做了一些初步的测定,其相关促生作用机制有待进一步研究。将菌株重新引入复杂的自然生境,是否能适应并有效定殖及促生作用也需要进一步探讨。综上所述,菌株ASR16和ALR33在IAA合成、合成嗜铁素及溶磷方面都表现出较好的特性,对紫花苜蓿的促生作用明显,对该菌的基础研究为菌肥的研制提供科学依据,下一步将开展该菌株作为微生物肥料的研发,并进行大田促生试验 研究。
4 结论(1) 从苜蓿组织内分离得到两株内生菌株ASR16和ALR33,通过16S rRNA基因和生理生化检测鉴定,ASR16为成团泛菌(Pantoea vagans),ALR33为短小芽孢杆菌(Bacillus pumilus)。
(2) 两菌株ASR16和ALR33均能够产生植物生长激素IAA,溶解磷,并能产生嗜铁素,可有效地促进苜蓿的生长。
| [1] | Holliday P. A Dictionary of Plant Pathology[M]. Cambridge: Cambridge University Press, 1989 |
| [2] | Jesús MB, Pilar P. Bacterial endophytes and root hairs[J]. Plant and Soil, 2012, 361(1): 301-306 |
| [3] | Pitchai P, Puneet SC, Venkatakrishnan SS, et al. Isolation and characterization of plant growth promoting endophytic bacterial isolates from root nodule of Lespedeza sp.[J]. Biology and Fertility of Soils, 2010, 46(8): 807-816 |
| [4] | Zhou XX. Primary research into inhibition effect and accelerant of endophytic bacteria and endophytic fungi of Pterocarya steonoptera[D]. Dalian: Master’s Thesis of Liaoning Normal University, 2008 (in Chinese) 周旋旋. 枫杨内生菌抑菌与促生作用初探[D]. 大连: 辽宁师范大学硕士学位论文, 2008 |
| [5] | Cai XQ, He H, Hu FP. The effects of endophytic BS-2 (Bacillus subtilis) on growth and internalphytohormone of capsicum[J]. Subtropical Agriculture Research, 2005, 1(4): 13-14 (in Chinese) 蔡学清, 何红, 胡方平. 内生菌BS-2对辣椒苗的促生作用及对内源激素的影响[J]. 亚热带农业研究, 2005, 1(4): 13-14 |
| [6] | Ye XM, Chang ZZ, Ji GJ, et al. Study on the growth-promoting effect of endophtic bacteria strain 102 isolated from tomato plant[J]. Chinese Soil and Fertilizer, 2005(5): 11 (in Chinese) 叶小梅, 常志州, 季国军, 等. 番茄内生菌102菌株的促生作用研究[J]. 中国土壤与肥料, 2005(5): 11 |
| [7] | Yu J, Zhao KP, Dong F, et al. Separation and growth-promoting study of endophyte in wild dendrobium candidum[J]. Modern Agricultural Science and Technology, 2010(9): 96-97 (in Chinese) 俞婕, 赵凯鹏, 董飞, 等. 野生铁皮石斛内生菌的分离及促生作用研究[J]. 现代农业科技, 2010(9): 96-97 |
| [8] | Tian HX, Cui L, Wang XY. Growth promoting activity of endophytic bacterial isolated from potato[J]. Shanxi Agricultural Sciences, 2003, 31(1): 28-30 (in Chinese) 田宏先, 崔林, 王秀英. 马铃薯内生促生菌的促生长作用[J]. 山西农业科学, 2003, 31(1): 28-30 |
| [9] | Chen LY, Zhang LJ, Zhou ZY. Research of salt tolerable rhizobia inoculation effects on Medicago sativa[J]. Grass Industry Journal, 2008, 17(5): 42-44 (in Chinese) 陈利云, 张丽静, 周志宇. 耐盐根瘤菌对紫花苜蓿接种效果的研究[J]. 草业学报, 2008, 17(5): 42-44 |
| [10] | Qi J. Screeming endogenous rhizobia seeds and their promoting alfalfa seedlings growth preperty[D]. Lanzhou: Master’s Thesis of Gansu Agricultural University, 2006 (in Chinese) 祁娟. 苜蓿种子内生根瘤菌筛选及其促生能力研究[D]. 兰州: 甘肃农业大学硕士学位论文, 2006 |
| [11] | Katarina HB, Kristina S, Brigitte H, et al. Influence of different sinorhizobium meliloti inocula on abundance of genes involved in nitrogen transformations in the rhizosphere of alfalfa (Medicago sativa L.)[J]. Environmental Microbiology, 2008, 10(11): 2922-2930 |
| [12] | Li JF, Zhang SQ, Shi SL, et al. Position and quantity of endogensis rhizobia in alfalfa plant[J]. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1200-1205 (in Chinese) 李剑峰, 张淑卿, 师尚礼, 等. 苜蓿内生根瘤菌分布部位与数量变化动态[J]. 中国生态农业学报, 2009, 17(6): 1200-1205 |
| [13] | Valdenegro M, Barea JM, Azcón R. Influence of arbuscular-mycorrhizal fungi, rhizobium meliloti strains and PGPR inoculation on the growth of medicago arborea used as model legume for re-vegetation and biological reactivation in a semi-arid mediterranean area[J]. Plant Growth Regulation, 2001, 34(2): 233-240 |
| [14] | Olivera S, Sofie DM, Bogić M, et al. Isolation and characterization of endophytic non-rhizobial bacteria from root nodules of alfalfa (Medicago sativa L.)[J]. Botanica Serbica, 2009, 33(1): 107-114 |
| [15] | Lorena BG, Javier AA, María FDP, et al. Response of alfalfa (Medicago sativa L.) to single and mixed inoculation with phosphate-solubilizing bacteria and sinorhizobium meliloti[J]. Biology and Fertility of Soils, 2010, 46(2): 185-190 |
| [16] | Wang LL, Gong WL, Liu AS. Screening and identification of AHL-degrading bacteria from alfalfa entophytes[J]. South China Agricultural University, 2010, 31(2): 68-71 (in Chinese) 汪玲玲, 龚伟伦, 刘霭莎. 苜蓿内生菌中高效AHL降解菌的筛选和鉴定[J]. 华南农业大学学报, 2010, 31(2): 68-71 |
| [17] | Lin SL, Li Z, Ma YH, et al. Study on the population dynamics of endophytic bacteria in leguminous plants in alar region[J]. Journal of Anhui Agri, 2007, 35(33): 10822-10823,10827 (in Chinese) 林世利, 李真, 马玉红, 等. 阿拉尔地区几种豆科植物内生细菌种群动态研究[J]. 安徽农业科学, 2007, 35(33): 10822-10823,10827 |
| [18] | Donna MP, Bernard RG. Methods for isolating and characterizing ACC deaminase-containing plant growth- promoting rhizobacteria[J]. Physilogia Plantarum, 2003, 118(1): 10-15 |
| [19] | Han J, Xia D, Li L, et al. Diversity of culturable bacteria isolated from root domains of moso bamboo (Phyllostachys edulis)[J]. Microbial Ecology, 2009, 58(2): 363-373 |
| [20] | Liu JL, Fang F, Shi XH, et al. Isolation and characterization of PGPR from the rhizosphere of Avena sativa in saline-alkali soil[J]. Grass Industry Journal, 2013, 22(2): 132-139 (in Chinese) 刘佳莉, 方芳, 史煦涵, 等. 2株盐碱地燕麦根际促生菌的筛选及其促生作用研究[J]. 草业学报, 2013, 22(2): 132-139 |
| [21] | Dong XZ, Cai MY. Common Bacterial Identification System Hand[M]. Beijing: Science Press, 2001: 267-295 (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 267-295 |
| [22] | Li ZD, Chen XR, Li P, et al. Identification of Polygonum viviparumendophytic bacteria Z5 and determination of the capacity to secrete IAA and antagonistic capacity towards pathogenic fungi [J]. Grass Industry Journal, 2010, 19(2): 61-68 (in Chinese) 李振东, 陈秀蓉, 李鹏, 等. 珠芽蓼内生菌Z5产IAA和抑菌能力测定及其鉴定[J]. 草业学报, 2010, 19(2): 61-68 |
| [23] | Schwyn B, Neilands JB. Universal chemical assay for the detection and determination of siderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56 |
| [24] | Zhang XS. Analysis of the Factors Affecting the available P content in the fermentation liquid of P bacteria determined by Mo-Sb colorimetry [J]. Anhui Agricultural Sciences, 2008, 36(12): 4822-4823 (in Chinese) 张祥胜. 钼锑抗比色法测定磷细菌发酵液中有效磷含量测定值的影响因素分析[J]. 安徽农业科学, 2008, 36(12): 4822-4823 |
| [25] | Shen DL, Feng YJ, Song M. Influence of endogenous conglobation generic bacteria YS19 on photosynthesis Production distribution in flag leaf and grain of rice ratooning buds[J]. Progress in Natural Science, 2002, 8(12): 863-865 (in Chinese) 沈德龙, 冯永君, 宋未. 内生成团泛菌YS19对水稻乳熟期光合产物在旗叶、穗分配中的影响[J]. 自然科学进展, 2002, 8(12): 863-865 |
| [26] | Liu J, Ling H, Zhao B. Colonization and growth-promoting properties of endophytic bacteria pantoea agglomerans strain HAUM1 to host rice[J]. Hubei Agricultural Sciences, 2011, 23(50): 4820-4824 (in Chinese) 刘佳, 林会, 赵斌. 内生成团泛菌HAUM1对宿主水稻的定殖及促生作用[J]. 湖北农业科学, 2011, 23(50): 4820-4824 |
| [27] | Yin CY, Lu HZ. Progress of enterobacter agglomerans[J]. Chinese Medicine, 2004, 4(2): 231-233 (in Chinese) 尹春煜, 卢洪洲. 成团肠杆菌研究进展[J]. 中华医药杂志, 2004, 4(2): 231-233 |
| [28] | Tania T, María SA, Jorge GA. Phosphate-solubilizing peanut associated bacteria: screening for plant growth-promoting activities[J]. Plant and Soil, 2010, 329(1): 421-431 |
| [29] | Francisco J, Gutiérrez M, Beatriz RS, et al. The plant-growth-promoting rhizobacteria bacillus pumilus and Bacillus licheniformis produce high amounts of physiologically active gibberellins[J]. Physiologia Plantarum, 2001, 111(2): 206-211 |
| [30] | Yuan BH, Liao XR, Zheng XJ. Metabolism and function of 1AA in plant cell[J]. Biological Bulletin, 2005, 40(4): 21-22 (in Chinese) 苑博华, 廖祥儒, 郑晓洁. 吲哚乙酸在植物细胞中的代谢及其作用[J]. 生物学通报, 2005, 40(4): 21-22 |
| [31] | Aradhana M, Puneet SC, Vasvi C, et al. Rhizosphere competent pantoea agglomerans enhances maize (Zea mays) and chickpea (Cicer arietinum L.) growth, without altering the rhizosphere functional diversity[J]. Antonie van Leeuwenhoek, 2011, 100(3): 405-413 |
| [32] | Whipps JM. Microbial interactions and biocontrol in the rhizosphere[J]. Journal of Experimental Botany, 2001, 52: 487-511 |
| [33] | Hilda R, Reynaldo F. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances, 1999, 17(4/5): 319-336 |
 2015, Vol. 42
2015, Vol. 42




