扩展功能
文章信息
- 高风正, 赵元晖, 赵剑光, 曾名湧
- GAO Feng-Zheng, ZHAO Yuan-Hui, ZHAO Jian-Guang, ZENG Ming-Yong
- 聚球藻 7002 嗜铁素的检测与分离
- Detection and separation of the siderophores from Synechococcus sp. PCC 7002
- 微生物学通报, 2015, 42(2): 231-237
- Microbiology China, 2015, 42(2): 231-237
- 10.13344/j.microbiol.china.140441
-
文章历史
- 收稿日期: 2014-05-28
- 接受日期: 2014-07-25
- 优先数字出版日期(www.cnki.net): 2014-08-19
嗜铁素(Siderophore)是一类由禾本科植物、细菌、真菌以及蓝细菌分泌的,用来对抗环境中铁元素缺乏状况的次级代谢产物,其分子量一般较小(1−2 kD)[1]。它们通常含有能螯合Fe3+的去质子化的异羟肟酸功能基团和儿茶酚残基的配位基团[2]。迄今为止已有500多种化合物被定义为嗜铁素。嗜铁素从分子结构上可以分为三类:邻苯二酚类、羟肟酸类和α-羟基羧化物类嗜铁素[3]。含有两类及以上螯合基团的嗜铁素被称为混合型嗜铁素,如假单胞菌能产生一种复合缩氨酸并具有紫外荧光特性的嗜铁素Pyoverdine[4]。海洋嗜铁素是海洋原核细菌对抗铁缺乏环境的一种策略[5],蓝藻嗜铁素的研究较少,目前报道的仅有聚球藻7002和蓝细菌7120等,缺铁环境中蓝藻会产生多种嗜铁素[6]。Ito等[7]从2.5 L聚球藻发酵液中分离得到7.5 mg Synechobactin A、1.5 mg Synechobactin B和0.3mg Synechobactin C三种嗜铁素。董妍玲等也报道了蓝细菌7120的铁吸收机制[8]。
嗜铁素的应用潜力巨大,Schneider等从一株诺卡氏菌中分离得到两种嗜铁素,并确定它具有在低浓度下抑制胃腺癌、胸腺癌和肝癌细胞活性的作 用[9]。此外,嗜铁素在生物防治、致毒、植物营养学、载体等领域也有相关应用[10]。嗜铁素的结构复杂,因此人工化学合成的步骤多、产率低,成本难以下降。生物发酵生产嗜铁素的研究国内外已经开始起步,Sarma等也报道了通过优化荧光假单胞菌发酵条件来生产嗜铁素[11]。聚球藻7002(Synechococcus sp. PCC 7002)是一株高光适应性和广盐性的海洋聚球藻,其细胞倍增时间是目前发现的蓝细菌中最短的,其全基因组序列也已得到破译,是一个非常理想的“工程微藻”构建平台[12]。
嗜铁素的分离方法有多种,大孔树脂分离是比较迅速、便捷的一种方法;IMAC是根据蛋白质表面氨基酸与固定化金属离子亲和力不同进行分离的一项比较新颖的技术。Braich等[13]建议用镍离子亲和层析来纯化嗜铁素,得到的嗜铁素纯度相对 较高。
本试验研究了聚球藻7002嗜铁素的不同定性检测方法。嗜铁素采用大孔树脂XAD-2和IMAC进行快速分离,并用CAS蓝色液体检测液检测相应洗脱组分的嗜铁素活性。试验中发现了聚球藻7002嗜铁素的紫外荧光特性,为聚球藻7002嗜铁素结构和性质的进一步研究提供了科学依据。
1 材料与方法 1.1 材料 1.1.1 试验藻株:聚球藻7002 (Synechococcus sp.PCC 7002)由北京大学生命科学学院赵进东院士 惠赠。 1.1.2 培养基和培养条件:聚球藻7002在32 °C培养于Medium A[14]中,培养基pH7.5,以照明日光灯作为光源,光强100 µE/(m2·s)。液体采用摇瓶培养,装瓶量不高于最大容量的40%,摇速150r/min;固体培养,Medium A添加终浓度为1.2%的琼脂粉。 1.1.3 主要试剂和仪器:铬天青S(CAS)、十六烷基三甲基溴化铵(HDTMA)、Sepharose-6B、大孔树脂XAD-2购自Sigma公司;亚氨基二乙酸(IDA)、咪唑、PIPES购自生工生物工程(上海)有限公司;无水哌嗪购自国药集团化学试剂有限公司。 1.2 聚球藻7002缺铁培养Medium A中不添加含铁组分,接种处于对数期的聚球藻7002进行培养,培养至少10 d。
1.3 聚球藻7002嗜铁素的平板检测 1.3.1 双层平板法检测:双层平板的制作参考文 献[15]。平板下层按照每100 mL 1.2%的琼脂添加5 mL CAS蓝色检测液的比例,将过0.22 μm无菌滤膜的CAS蓝色检测液与冷却到65 °C的琼脂混合均匀。下层琼脂凝固后,在上层倾倒含1.2%琼脂的MediumA。双层平板在30 °C环境中隔夜放置后,接种缺铁培养的聚球藻7002进行检测。 1.3.2 混合平板法检测:按每100 mL固体MediumA添加5 mL CAS蓝色检测液的比例,将过0.22 μm无菌滤膜的CAS蓝色检测液直接与冷却到65 °C的MediumA混合均匀,倒板,同样30 °C环境中隔夜放置后,接种缺铁培养的聚球藻7002进行检测。 1.3.3 传统平板法检测:参照1987年Schwyn等[16]的方法,制作传统的CAS检测平板,为保证聚球藻7002的生长,调整培养基的NaCl浓度与Medium A一致,相同条件下接种进行检测。 1.4 聚球藻7002嗜铁素相对含量的测定CAS蓝色液体检测液的配制方法参考文 献[16]。聚球藻7002藻悬液10000 r/min离心 15 min,取3 mL上清液与等体积的CAS蓝色液体检测液混合均匀,暗处放置1 h,检测630 nm处的吸光值记为A。取3 mL空白培养基与等体积CAS蓝色液体检测液混合均匀,相同条件下测630 nm处的吸光值记为Ar,嗜铁素的相对含量为:(Ar−A)/Ar×100%[17]。
1.5 聚球藻7002嗜铁素大孔树脂XAD-2分离本试验采用离心上清液过膜后直接上样和调整pH后再上样两种上样条件。聚球藻7002藻悬液10 000 r/min离心15 min,离心液过0.22μm的滤膜,过膜后直接上样到经双蒸水冲洗充分的大孔树脂层析柱中,先用两个柱体积的双蒸水洗脱,再分别用60%和100%的甲醇洗脱。测定280 nm处的吸光值,进行相应峰组分的收集。
聚球藻7002藻悬液经离心、过膜后,用1 mol/L H2SO4调pH为2.0后上样,相同条件下进行洗脱。
1.6 检测平板和不同分离峰组分的荧光检测将检测平板和不同峰组分的浓缩液、未经任何处理的上样液放置在254 nm紫外中,观察荧光现象,定性研究其是否具有荧光特性[4]。
1.7 聚球藻7002嗜铁素IMAC分离 1.7.1 竞争性洗脱:Sepharose-6B经活化、IDA交联[18, 19]后,装柱,充入Ni2+,制备镍离子层析柱[20]。平衡Buffer为20mmol/L pH 8.0的PBS缓冲液,洗脱Buffer为平衡Buffer加入150mmol/L的咪唑。先用平衡Buffer平衡2个柱体积,上样后平衡Buffer平衡至少5个柱体积,然后洗脱Buffer洗脱至少5个柱体积,收集280 nm下洗脱出来的峰组分。 1.7.2 降低pH洗脱:平衡Buffer为20mmol/L pH 8.0的PBS缓冲液,洗脱Buffer为20 mmol/L pH 5.7的PBS缓冲液。同样条件下进行洗脱,收集280 nm下洗脱出来的峰组分。 2 结果与分析 2.1 不同平板方法的检测结果双层平板法、混合平板法、传统CAS平板法检测聚球藻7002嗜铁素晕圈结果如图 1所示。形成图中比较清晰的晕圈,双层平板法、传统CAS平板法所需时间为14d,而混合平板法仅需3d。双层平板法由于显色层在底层,晕圈形成时间较长,晕圈不明显;混合平板法,检测初期晕圈边缘颜色加深,晕圈清晰可辨,且晕圈形成时间短;传统的CAS检测方法,平板制作较为复杂,矿物质离子含量相对较少,聚球藻生长较慢,晕圈形成时间较长。以上结果证明混合平板法更快速、高效、便捷,是定性检测聚球藻7002嗜铁素的最优平板检测方法。
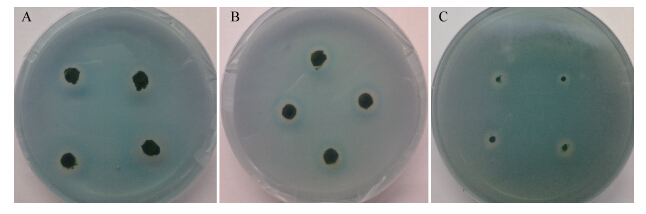
|
| 图 1 3种检测方法比较 Figure 1 Thecomparation of three detection methods 注:a:双层平板法;b:混合平板法;c:传统CAS平板法. Note: a:Two-layer plate; b: Mixtureplate; c: Traditional chromazurolS plate. |
嗜铁素可以使CAS蓝色液体检测液由蓝色变为橙黄色,不同浓度的嗜铁素使其变色程度不一样,如图 2所示。聚球藻7002培养初期不产生嗜铁素,培养时间越长,藻密度越大,嗜铁素的分泌量越多。图 2中,第1、2组聚球藻7002分别培养14和12 d,聚球藻发酵液中嗜铁素的相对含量分别达到43.67%和33.26%,第3、4组培养20 d,嗜铁素的相对含量高达93.50%,第5组为加入空白培养基的对照组。

|
| 图 2 嗜铁素的定量检测 Figure 2 TQuantitative detection ofsiderophores 注:1:培养14 d;2:培养12 d;3、4:培养20 d;5:对照组. Note: 1: 14 days cultured; 2: 12 days cultured; 3,4: 20days cultured; 5: Control group. |
直接上样和调pH上样的洗脱谱图如图 3所示,上样液为嗜铁素相对含量低于50%的聚球藻7002过膜液,分别得到3个峰,依次为双蒸水、60%甲醇和100%甲醇的洗脱峰。收集相应峰组分,浓缩检测嗜铁素活性,结果如图 4所示。试验结果显示,峰3′是分离开来的活性峰。试验表明,调整上样液的pH更有利于嗜铁素的吸附,不调整pH,大量嗜铁素在双蒸水洗脱的峰1中随杂质一块流出。调整pH,峰3′组分嗜铁素的相对含量为90.15%,而不调pH,峰3组分嗜铁素相对含量低于20%,而含杂质的峰1具有较强的嗜铁素活性。大孔树脂在不同梯度洗脱液中的溶胀体积不同,洗脱过程中均出现了正常的基线漂移现象。
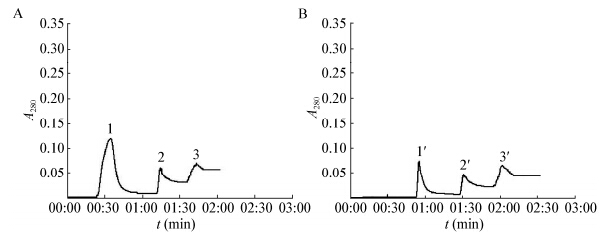
|
| 图 3 嗜铁素大孔树脂XAD-2洗脱谱图 Figure 3 Amberlite XAD-2 resin elution profileof siderophores 注:a:上样液不调pH;b:上样液pH调为2.0. Note: a: Thesample pH without being adjusted; b:The sample pH was adjusted to 2.0. |

|
|
图 4
大孔树脂分离各峰组分的嗜铁素活性检测
Figure 4
Siderophores detection of each peak from Amberlite XAD-2 resin
注:0:初始上样液;1:峰1;2:峰2;3:峰3;1′:峰1′;2′:峰2′;3′:峰3′. Note: 0: The originalsamples; 1: Peak 1; 2: Peak 2; 3: Peak 3; 1′: Peak 1′; 2′: Peak 2′; 3′: Peak 3′. |
将检测10 d的混合法平板和大孔树脂分离得到的峰组分直接放在254 nm紫外中观察,可以看到非常明显的荧光现象,如图 5所示。结果表明,初始上样液具有一定的荧光性,活性峰3′组分具有强烈荧光,不调pH,首先出现的峰1组分也具有强烈荧光,说明嗜铁素随杂质流失严重。混合法检测平板晕圈部分有强烈荧光。
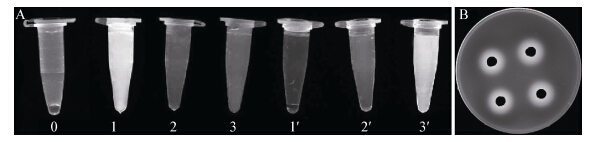
|
| 图 5 254nm紫外下荧光检测 Figure 5 The fluorescence of siderphores at 254 nm 注:a:各洗脱峰荧光现象;0:初始上样液;1:峰1;2:峰2;3:峰3;1′:峰1′;2′:峰2′;3′:峰3′. b:混合法检测平板荧光现象. Note: a: The fluorescence of each peak; 0: The original samples; 1: Peak 1; 2: Peak 2; 3:Peak 3; 1′: Peak 1′; 2′: Peak 2′; 3′: Peak 3′. b: The fluorescence of siderophores inmixture plate. |
IMAC分离,竞争性洗脱和降低pH洗脱的洗脱谱图如图 6所示。IMAC分离,特异性较好,分离纯度高,两种洗脱方式均出现2个峰,分别为平衡Buffer和洗脱Buffer的洗脱峰。浓缩的PBS对CAS蓝色液体检测液存在干扰,IMAC洗脱液不能进行浓缩,直接进行嗜铁素相对含量的检测。峰1和峰1′没有嗜铁素活性,为平衡Buffer冲洗出的杂质峰,峰2和峰2′为活性峰,不浓缩的情况下,嗜铁素的相对含量均在30%以上。竞争性洗脱的效率更高,洗脱出的嗜铁素的量更多。试验表明,IMAC是一种分离效率更高、纯化效果更好的分离方式。

|
| 图 6 嗜铁素IMAC洗脱谱图 Figure 6 Immobilized metal-chelating affinity chromatography elution profile ofsiderophores 注:a:竞争性洗脱;b:降低pH洗脱. Note: a:Competitive elution; b: pHreduced elution. |
本试验以聚球藻7002为研究对象,利用双层平板法、混合平板法、传统CAS平板法3种方法均检测到了嗜铁素。试验结果显示,混合平板法是定性检测聚球藻7002嗜铁素的最优方法。检测前期,晕圈边缘的颜色明显加深,辨识度很高,晕圈有一定的透明度,符合海洋嗜铁素的特征。缺铁条件下聚球藻密度较大的发酵液中,嗜铁素的相对含量很高,为聚球藻7002嗜铁素的进一步研究提供了科学依据。
利用蓝藻进行嗜铁素工程化生产的潜力巨大,高产蓝藻的诱导及条件优化可以保证嗜铁素的产量,有待进一步研究。聚球藻7002嗜铁素的产生需要缺铁环境的刺激,铁含量充足的环境中,聚球藻几乎不产生嗜铁素。试验中Medium A不添加含铁组分,有利于聚球藻7002嗜铁素的快速产生。聚球藻经滤纸片吸附培养后的检测效果也会明显提高,是一种可以尝试的研究方法。
本试验研究了大孔树脂和IMAC两种分离聚球藻7002嗜铁素的方法。大孔树脂分离,嗜铁素的纯度不高,可以用高效液相色谱法进行纯化,但是大孔树脂分离方法简单,填料成本低,且洗脱液为甲醇,易于分离,便于进行性质研究。IMAC与嗜铁素的结合能力强,结合容量大,可以改装各种金属离子。本试验中,IMAC洗脱液为PBS,峰组分中含有大量的盐,进一步研究需要脱盐;竞争性洗脱时,峰组分含咪唑,有毒性,需要通过透析等方法除去。试验发现,高浓度的磷酸根离子会干扰CAS检测体系的稳定性,PBS洗脱液不能进行浓缩,应该直接进行活性检测。本试验结果表明,快速制备嗜铁素粗品,可以选择将上样液的pH调为2.0,用大孔树脂XAD-2进行分离,收集100%甲醇洗脱出的组分,进行浓缩,4°C保存备用;制备纯度相对较高的嗜铁素用于后续分析,可以考虑采用IMAC分离。
聚球藻7002嗜铁素在254nm紫外下的荧光现象,说明其含有紫外发光的相关基团。目前仅有假单胞菌嗜铁素等少数嗜铁素被报道具有紫外荧光特性,海洋嗜铁素紫外发光的现象还未见报道。该发现为聚球藻嗜铁素结构和功能的进一步研究提供了参考,有待进一步探索和研究。聚球藻7002嗜铁素的检测和分离研究,为海洋嗜铁素的研究提供了理论支持,为微藻功能物质研究提供了新方向。
致谢:感谢北京大学生命科学学院赵进东院士、董春霞老师、刘贤伟老师等在藻种提供、培养等方面的帮助和指导!| [1] | Payne SM. Detection, isolation andcharacterization of siderophores[J]. Methods in Enzymology, 1994, 235:329-344 |
| [2] | Neilands JB. Microbial ironcompounds[J]. Annual Review of Biochemistry, 1981, 50: 715-731 |
| [3] | HiderRC, Kong X. Chemistry and biology of siderophores[J]. Natural Products Report,2010, 27(5): 637-657 |
| [4] | CornelisP, Matthijs S. Diversity ofsiderphore-mediated iron uptake systems in fluorescent Pseudomonads: notonly pyoverdines[J]. Environmental Microbiology, 2002, 4(12): 787-798 |
| [5] | ButlerA, Theisen RM. Iron(III)-siderophorecoordination chemistry: Reactivity of marine siderophores[J]. CoordinationChemistry Reviews, 2010, 254(3/4): 288-296 |
| [6] | WilhelmSW, Trick CG. Iron-limited growth of cyanobacteria: multiple siderophoreproduction is a common response[J]. Limnology and Oceanography, 1994, 39(8):1979-1984 |
| [7] | ItoY, Butler A. Structure of synechobactins, new siderophores of the marinecyanobacterium Synechococcus sp. PCC 7002[J]. Limnology &Oceanography, 2005, 50(6): 1918-1923 |
| [8] | DongYL, Pan XW. Iron uptake by Anabaena sp. strain PCC 7120[J]. China Biotechnology,2012, 32(9): 107-112 (in Chinese) |
| [9] | SchneiderK, Rose I, Vikineswary S. Nocardichelins A and B, siderophores from Nocardia strain acta 3026[J]. Journal of Natural Products,2007, 70(6): 932-935 |
| [10] | LiangJG, Hao ZN, Wang LP, et al. Research progress on the function of siderophore[J].Chinese Agricultural Science Bulletin, 2011, 27(5): 284-287 (in Chinese) |
| [11] | Sarma MVRK, Sahai V,Bisaria VS. Geneticalgorithm-based medium optimization for enhanced production of fluorescent PseudomonadR81 and siderophore[J]. Biochemical Engineering Journal, 2009, 47(1/3):100-108 |
| [12] | LudwigM, Bryant DA. Transcription profiling of the modelcyanobacterium Synechococcus sp. strain PCC 7002 by Next-Gen(SOLiD™) sequencing of cDNA[J]. Frontiers Microbiology, 2011, 2(41): 1-23 |
| [13] | BraichN, Codd R. Immobilised metal affinity chromatography for the capture ofhydroxamate-containing siderophores and other Fe(III)-blinding metabolitesdirectly from bacterial culture supernatants[J]. Analyst, 2008, 133(7): 877-880 |
| [14] | CasteholzRW. Culturing methods for cyanobacteria[J]. Methods ofEnzymology, 1988, 167: 68-93 |
| [15] | ChenSX, Zhao X, Xie ZX. Detection of siderophore from halophilic archaea withtwo-layer plate[J]. Microbiology China, 2008, 35(1): 142-144 (in Chinese) 陈绍兴, 赵翔, 谢志雄. 双层平板法检测嗜盐古菌铁载体[J]. 微生物学通报, 2008, 35(1): 142-144 |
| [16] | SchwynB, Neiland JB. Universal chemical assay for the detection and determination ofsiderophores[J]. Analytical Biochemistry, 1987, 160(1): 47-56 |
| [17] | MachucaA, Milagres AM. Use of CAS-agarplate modified to study the effect of different variables on the siderophoreproduction by Aspergillus[J]. Letters in Applied Microbiology, 2003,36(3): 177-187 |
| [18] | MatsumotoI, Mizuno Y, Seno N. Activation of sepharose with epichlorohydrin andsubsequent immobilization of ligand for affinity adsorbent[J]. Journal ofBiochemistry, 1979, 85(5): 1091-1098 |
| [19] | Kim JH,Hwang WS, Kim IH. Simple preparation of immobilized-metal affinitychromatography media[J]. Korean Journal of Chemical Engineering, 2009, 26(6):1693-1695 |
| [20] | XiaHF, Zhang X, Jin XH, et al. Preparation of Ni affinity chromatographicadsorbent and its application on purification of His-tagged protein[J]. Journalof Jiangnan University (Natural Science Edition), 2010, 9(6): 685-689 (inChinese)夏海锋, 张显, 金雄华, 等. 镍离子亲和层析介质的制备及其用于组氨酸标记蛋白质的纯化[J]. 江南大学学报: 自然科学版, 2010, 9(6): 685-689 |
 2015, Vol. 42
2015, Vol. 42




