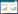收稿日期: 2015-03-11; 接受日期: 2015-05-14; 优先数字出版日期(www.cnki.net): 2015-06-02
基金项目: 国家自然科学基金项目(No. 31170553); 国家林业局948 项目.
Isolation andcharacterization a bacterium strain can synthesized magnetic nano-particles
Northeast Forestry University, Harbin, Heilongjiang 150040. China
纳米材料由于其具有独特的尺寸、形貌、光电性质、化学性质及力学性质而被广泛研究[1],其中纳米磁性材料具有的独特性质而广受科学家的青睐[2, 3]。传统化学方法合成纳米磁性材料成本高、产率低,限制了这一领域的发展和应用研究[3]。自1975年科学家首次发现趋磁细菌以来,科学家们有意识地利用微生物进行纳米磁性材料的生物合成和应用研究[3, 4, 5, 6, 7]。细菌合成的纳米磁性颗粒具有尺寸分布窄、稳定性高、生物相容性好、产率高和成本低等优点[6, 7, 8, 9, 10],在纳米生物技术、医药和催化等领域具有广泛的应用潜力[11, 12, 13, 14]。同时细菌可以在室温和近中性pH的温和条件下合成无机纳米粒子,是一种清洁、无毒和无污染的绿色合成方法[6, 7, 8]。迄今为止科学家们用不同的方法从不同的环境中分离近30株(包括纯化的、未纯化的及不能培养的)趋磁细菌,这些趋磁细菌模式菌株多数属于Proteobacteria的Alpha-亚纲[4, 5, 6]。此外,研究者分离出的Actinobacter sp.[9]、Desulfovibrio magenticus RS-1[10]等菌株也可以合成纳米磁性颗粒。本文报告从山东省聊城东昌湖水样分离纯化一株高产纳米磁性颗粒的菌株,并对其进行形态学和分子生物学鉴定,提取该菌株合成的纳米磁性颗粒并对其进行表征分析。
1 材料与方法
1.1 样品采集
实验所用水样为聊城东昌湖南岸泥水交界处水样。
1.2 培养基[5]
KH2PO40.68 g,NaAc 0.05 g,NaNO3 0.12 g,丁二酸0.74 g,巯基乙酸钠0.05 g,刃天青2 mg,Wolfe’s维生素混合液10 mL,Wolfe’s矿物质混合液5 mL,0.1 mol/L柠檬酸铁溶液5.0 mL,蒸馏水1 L,用10 mol/L的NaOH调节pH至6.7,半固体培养基另加0.5%的琼脂,固体培养基另加2%的琼脂。
1.3 实验方法
1.3.1菌种分离纯化: 将样品与培养基按照1:1的比例混合置于密封的棕色广口瓶中,在广口瓶外壁的中部放置一块40 mm×25 mm×5 mm规格的N48稀土钕铁硼强力磁铁,将广口瓶放置于28 °C恒温培养箱中,避光静置培养30 d。无菌条件下取出1 mL磁铁处培养物,将其梯度稀释为10
−1、10
−2、10
−3、10
−4、10
−5、10
−6和10
−7 7个浓度,分别取100 μL与冷却到40 °C的30 mL半固体分离培养基均匀混合,倒平板,将平板置于厌氧箱里维持氧分压在0.5%,28 °C避光培养。每天观察,将长出的单菌落接种到固体培养基,放置于厌氧箱里维持氧分压在0.5%,28 °C避光培养,多次分离纯化得到纯培养。将得到的纯培养物接种到装瓶量为75%液体生长培养基的厌氧瓶中,密封,28 °C、140 r/min培养。将培养物分别在4 000 r/min条件下离心,经3次灭菌去离子水清洗,取相同
OD600条件下的相同量菌悬浮物进行细胞破碎,将合成磁性颗粒最多的菌种TZ-1作为研究对象并保存菌种。
1.3.2 纳米磁性颗粒的提取纯化:将培养7 d的培养物4 000 r/min离心,弃上清,无菌水清洗菌体,4 000 r/min离心,清洗3次。将清洗之后的培养物用适量无菌水悬浮,用超声波细胞破碎仪破壁,设置参数为:功率80%,破碎15 s,间隔5 s,破碎60个循环。磁铁吸附纳米磁性粒子,弃掉上清液,破碎10−15次。
1.3.3 纳米磁性颗粒XRD:日本理学D/Max-2500 X射线衍射仪,扫描电压为50 kV,扫描电流为100 mA,辐射源为Cu靶,
λ=0.154 056 nm,扫描速度0.06°/s,扫描范围为5−60°。
1.3.4 纳米磁性颗粒磁滞回线测定:室温下使用Lake shore磁滞回线测量系统测定纳米磁性颗粒的磁滞回线曲线。
1.3.5 菌种鉴定:EasyPure Genomic DNA Kit提取菌种总DNA,PCR扩增16S rRNA基因序列。50 μL PCR反应体系:l0×PCR buffer 5 μL、10 mmol/L dNTPs 1 μL、10 μmol/L引物27F和10 μmol/L引物1492R各1 μL、5 U/mL
Taq酶0.5 μL、DNA模板1 μL,去离子水40.5μL。PCR反应条件:94 °C 3 min;94 °C 30 s,56 °C 30 s,72 °C 2 min,35个循环;72 °C 10 min;4 °C保存。pMD18-T Vector连接PCR产物,连接体系为:1 μL T载体,4 μL PCR产物,5 μL Solution I,室温放置16 h。热激转化到大肠杆菌TOP10感受态中,将转化后的感受态菌液于37 °C、200 r/min摇床培养1 h,取50 μL培养物涂布到氨苄终浓度为50 mg/L的LB固体培养基上,37 °C培养12 h,挑取单菌落接种于LB液体培养基37 °C、200 r/min摇床培养6 h,使用pMD18-T Vector特定引物M13F(47)、M13R(48)进行菌体PCR检测。将转导成功的培养物50%甘油1:1比例混匀保存,送由华大基因公司测序,用NCBI、Biology Workbench和MEGA等软件进行序列分析。
2 结果与分析
2.1 富集培养物特征
富集培养7 d后,表面和底部均生长出棕色菌;第2周后,培养物变黑色;第3周后,培养基变为无色,菌膜为棕色,磁铁处有明显菌体;继续培养一周后磁铁附近菌体增多,证明了采用超强力磁铁可以提高富集的回收率,得到了较多可以合成磁性颗粒的细胞,以便于下步实验中更好地筛选出菌种。取出磁铁附近培养物,滴加到载玻片上制成临时装片,在盖玻片一边放置N48稀土钕铁硼强力磁铁,在油镜下面观察发现有菌体可以沿磁力线向磁铁S极游动。
2.2 菌种分离纯化
在半固体培养基平板上,3 d后可以看到菌液稀释度为10−6的平板上有明显单菌落,在培养基内部和表面均有单菌落分布,多数为白色。培养到7 d时,菌落变成黄绿色、棕色或黑色,经6次划线培养后得到纯培养。经液体培养后,对不同单菌落的液体培养物进行菌体收集,破碎菌体,其中TZ-1菌株在相同OD600、菌液量的条件下合成的磁性颗粒最多,且该菌株较其他菌株生长较快。
实验研究发现TZ-1菌株合成磁性颗粒的最主要因素是氧分压。培养基中含有氧指示剂刃天青,培养1 d后培养物颜色变浅,第3天时变为无色。培养3 d之内的培养物无法提取出磁性颗粒。对照试验使用摇瓶好氧培养,其培养物中也无法提取磁性颗粒。由此推测,TZ-1在低氧分压条件下才能合成磁性颗粒。文献[5, 6, 8]报道,趋磁细菌在氧分压超过1%条件下不能合成磁小体,与本实验得出的结论类似。氧分压影响趋磁细菌合成磁小体的机制尚没有定论,目前较一致的观点是,氧作为呼吸链的终端电子受体,产生能量供磁小体的合成[12, 13, 14]。
2.3 菌株TZ-1的形态特征及磁性颗粒的表征分析
2.3.1 菌落形态:直径约为3−5 mm,呈圆形,边缘不规则,菌落湿润呈黄绿色,半透明(
图 1)。
2.3.2 菌体TEM结果:如
图 2-
4所示,菌体为杆状,有鞭毛,有荚膜,菌体分散,菌体长约为2−4 μm,宽约为0.5−1.5 μm。菌体内部有两种电子致密颗粒,较小颗粒分布在菌体细胞膜附近,近似多边形,大小约为60 nm,较大颗粒分布在菌体内部,大小约为180 nm。TZ-1在不加柠檬酸铁的生长培养基中培养后,TEM下观察到菌体内部和细胞膜边缘均没有电子致密颗粒结构,菌体无趋磁性,且无法提取出纳米磁性颗粒。
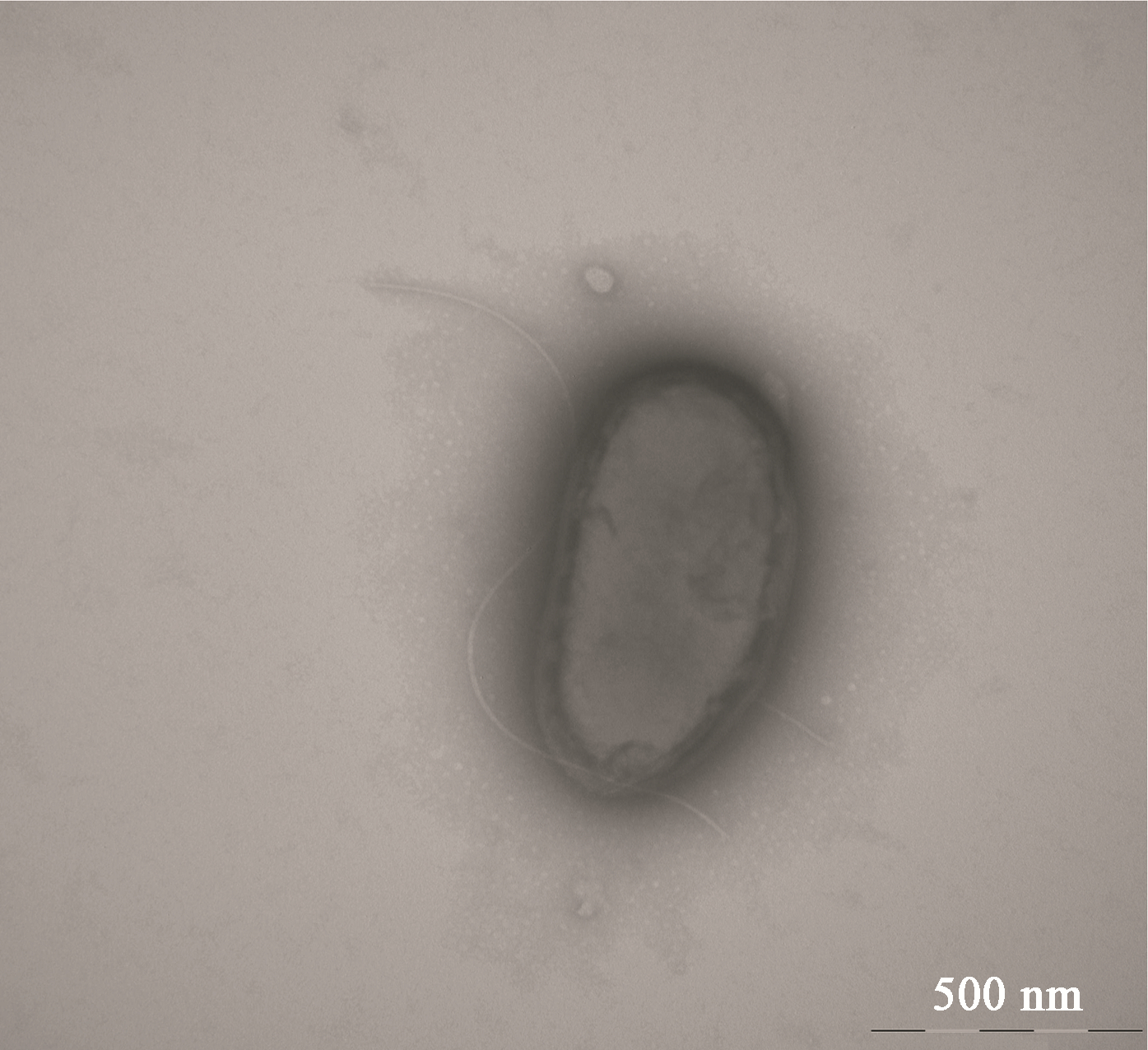
2.3.3 菌体及纳米磁性颗粒SEM结果:如
图 5所示,菌体为杆状,菌体长约为2−4 μm,宽约为0.5−1.5 μm,与TEM测量结果一致。纳米磁性颗粒EDAX分析主要成分为Fe、O、P,其中金元素来源于样品处理时的喷金,其他各元素都来源于培养基成分中被菌体利用的部分(
图 6,
表 1)。
表 1 纳米磁性颗粒扫描电镜的EDAX分析
Table 1 EDAX spectrum for the magnetic nano-particle on scanning electron micrograph
| 元素 Element | 质量比 Wt (%) | 原子数比 At (%) |
| O | 33.75 | 60.61 |
| P | 13.09 | 12.12 |
| Fe | 63.16 | 27.27 |
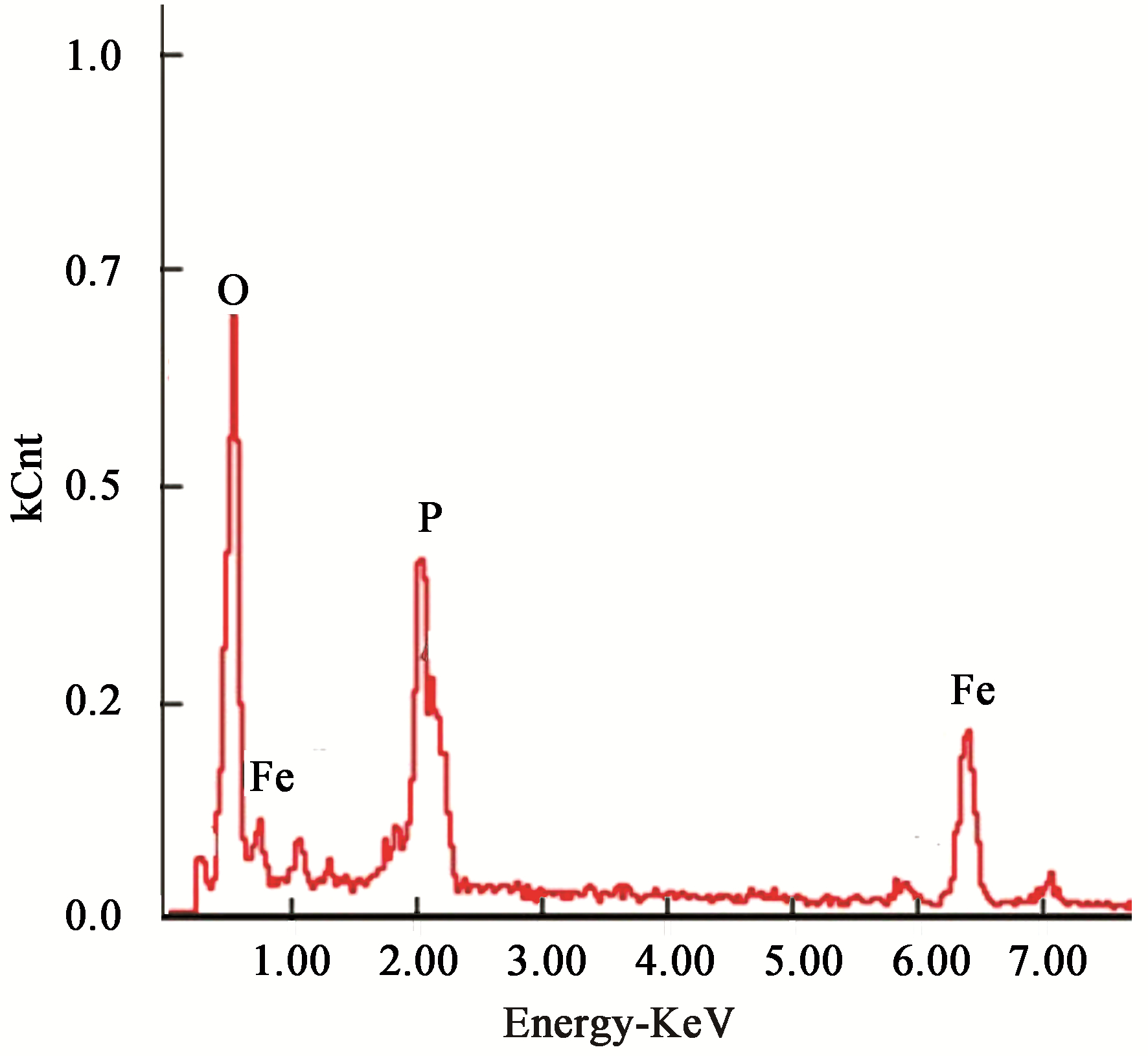
2.3.4 纳米磁性颗粒XRD结果分析:如
图 7所示,2
θ=13.2°时出现主峰,TZ-1所合成的磁性颗粒为单斜晶系结构。对应的各晶面间距
d值与Fe
3(PO
4)
2·8H
2O标准衍射卡PDF75-1186比对,与Fe
3(PO
4)
2·8H
2O特征峰11.2 (110)、13.2 (020)、18.1 (200)、19.6 (001)、23.1 (201)、27.8 (131)、30.2 (311)、32.9(221)、38.4 (401)基本一致。对应各晶面间距
d值与Fe
3O
4标准衍射卡PDF19-0629比对,与Fe
3O
4特征峰18.3 (111)、30.1 (220)、35.4 (311)、37.0 (222)、43.0 (400)、54.1 (116)、70.1 (620)基本一致。
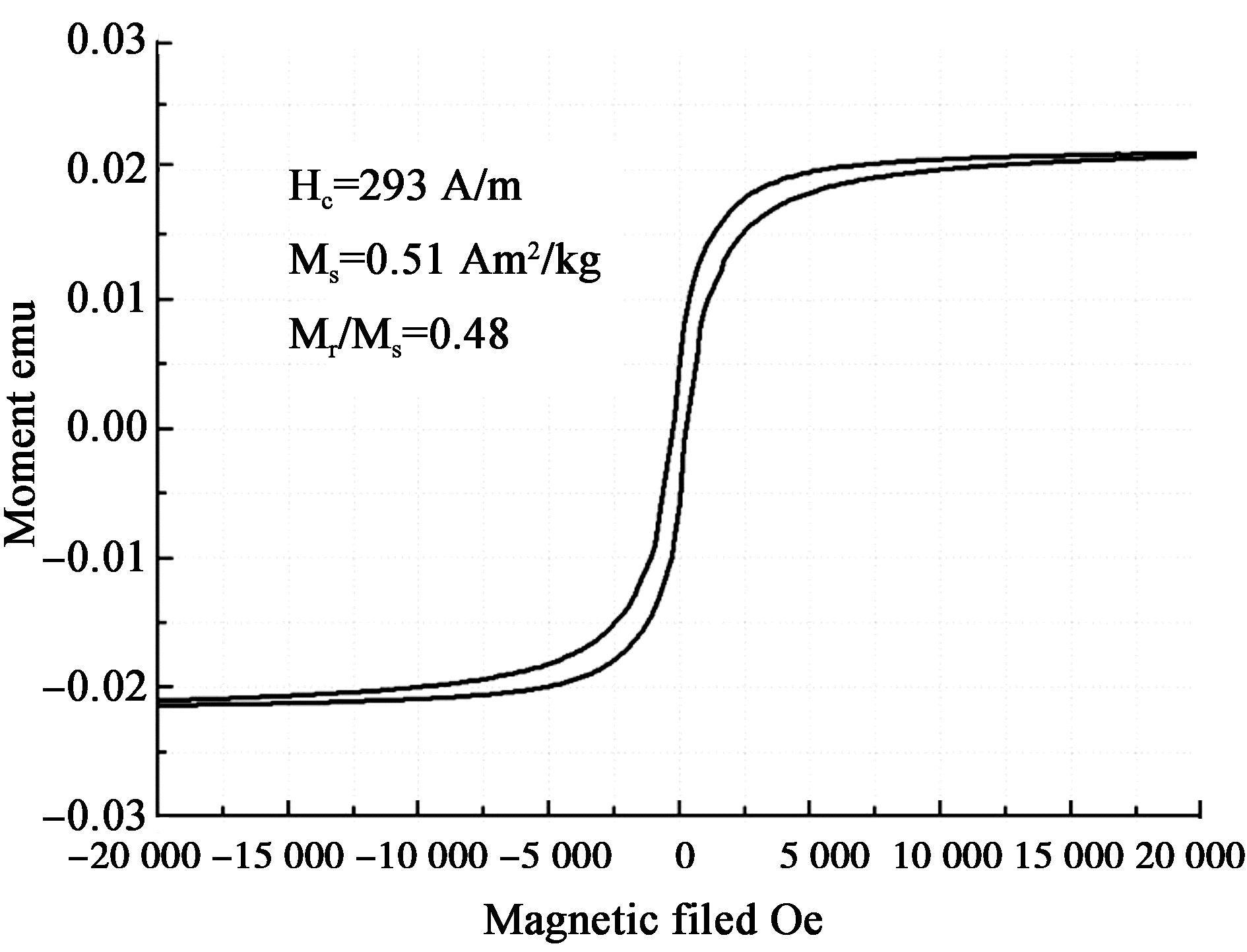
2.3.5 磁滞回线分析:如
图 8所示,TZ-1合成的纳米磁性颗粒具有较高的矫顽力
Hc=239 A/m,磁饱和强度为0.51 Am
2/kg,
Mr/
Ms=0.48接近自由聚集的单磁畴颗粒的理论值0.5,磁性较弱,主要原因是Fe
3(PO
4)
2·8H
2O为非磁性物质,TZ-1合成的纳米磁性颗粒为硬磁性材料。
2.3.6 菌株16SrRNA基因分子鉴定:测序得到一条1 556 bp的序列,将序列提交到NCBI数据库,获得序列登录号1B3EEPNA014,Blast比对结果为洋葱伯克霍尔德氏菌(
Burkholderiacepacia),属于Proteobacteria的β
-亚纲,命名为
Burkholderia cepacia TZ-1(
图 9)。使用MEGA软件做出进化树,
Burkholderia cepacia TZ-1菌株与趋磁细菌模式菌株MSR亲缘关系较远。这是首次发现伯克霍尔德菌属(
Burkholderia sp.)菌株可以合成纳米磁性颗粒。
3 结论
从聊城东昌湖湖水中分离纯化出一株高产磁性颗粒的菌株Burkholderia cepacia TZ-1。本课题组首次发现伯克霍尔德氏菌(Burkholderiasp.)中有合成纳米磁性颗粒的菌株。与趋磁细菌模式菌株相比较,菌株更易培养,且生长速度快,相同条件下合成磁性颗粒更多,但是也有不足之处,TZ-1合成的磁性颗粒含有较多的Fe3(PO4)2·8H2O成分,磁性相对较弱,长时间放置容易聚集成大颗粒,进行性质及应用方面的研究前需要重新通过超声法将其分散。
本实验的创新之处是根据Burkholderia cepacia TZ-1菌株的特性,采用厌氧摇瓶培养的方式。伯克霍尔德氏菌属(Burkholderiasp.)中菌株均为好氧菌,TZ-1在有氧条件下可以快速生长,但是氧分压超过1%时TZ-1不能合成磁性颗粒。由此将菌种接种于氧分压为5%的微好氧条件,密封,28 °C、140 r/min摇床培养,该培养方式下菌体在对数期消耗密封环境中的O2,菌体大量繁殖,根据培养物颜色变化(刃天青的指示作用)判断菌体生长情况,培养约36 h,培养物变为无色状态,培养约7 d菌体可合成出大量磁性颗粒。
平板上菌落直径约为3−5 mm,呈圆形,边缘不规则,菌落湿润呈黄绿色,半透明。在TEM和SEM下观察,菌体为杆菌,长约为2−4 μm,宽约为0.5−1.5 μm,易聚集,有明显的单生鞭毛,有荚膜,胞内有电子致密颗粒。4000 r/min离心培养物方法收集菌体,使用无菌水清洗菌体,细胞破碎方法收集到磁性颗粒。SEM下EDAX分析元素分析纳米磁性颗粒主要成分为Fe、P、O。磁性颗粒XRD结果表明,纳米磁性颗粒具有单斜晶系结构,其主要成分为Fe3(PO4)2·8H2O和Fe3O4。由于Fe3(PO4)2·8H2O为非磁性物质,Burkholderia cepacia TZ-1合成的纳米磁性颗粒的磁性较弱,矫顽力Hc=239 A/m,磁饱和强度为0.51 Am2/kg,Mr/Ms=0.48。





 2015, Vol. 42
2015, Vol. 42