扩展功能
文章信息
- 吴鹏飞, 周亮, 刘俊麟, 崔志峰
- WU Peng-Fei, ZHOU Liang, LIU Jun-Lin, CUI Zhi-Feng
- 一株产钙调磷酸酶抑制剂链霉菌CZW-15的筛选鉴定及发酵条件研究
- Screening,identification and fermentation conditions optimization of StreptomycesCZW-15 with inhibitory activities on calcineurin
- 微生物学通报, 2015, 42(12): 2417-2425
- Microbiology China, 2015, 42(12): 2417-2425
- 10.13344/j.microbiol.china.150153
-
文章历史
- 收稿日期: 2015-02-26
- 接受日期: 2015-04-16
- 优先数字出版日期(www.cnki.net): 2015-05-14
钙调磷酸酶(Calcineurin,CN)是一种在真核生物中高度保守的受Ca2+/钙调素(CaM)调节的丝/苏氨酸蛋白磷酸酶。在人体中,钙调磷酸酶作为Ca2+信号途径调节的信号酶,在免疫调节、学习记忆、细胞信号转导和肌肉量调节等方面起重要作用[1, 2, 3]。钙调磷酸酶抑制剂如他克莫司(FK506)和环孢素A (CosA)是目前临床上使用最广泛的免疫抑制剂[4]。但这些药物仍具有较大的毒副作用,如肾毒性、高血糖等多种不良反应[5, 6, 7],急需开发低毒高效的新型钙调磷酸酶抑制剂。
近年来,Prescott等报道从消炎镇痛类中药材石蚕香科(Teucriumchamaedrys)和假荆芥属(Nepetacataria)中分离得到的咖啡酸苯乙醇苷(Teucrioside)、毛蕊花糖苷(Verbascoside)和苯丙素苷(Lamiuside A)不需任何的亲免蛋白,能直接抑制钙调磷酸酶活性[8]。Wang等从中草药中发现山奈酚(Kaempferol)和槲皮素(Quercetin)在体外或Jurkat细胞中均能通过与钙调磷酸酶的催化亚基结合,非竞争性直接抑制钙调磷酸酶[9, 10]。陈东生等发现中草药菝葜提取物具有抑制钙调磷酸酶的活性,可有效抑制T细胞活化核因子(NFAT)脱磷酸化反应,阻止IL-2等基因转录[11]。从天然物质筛选钙调磷酸酶抑制剂已成为新的研究热点[12, 13]。
放线菌作为天然生物活性物质的宝库,从中筛选钙调磷酸酶抑制剂是一条行之有效的途径。临床上广泛使用的他克莫司(FK506)和环孢素A (CosA)均来源于微生物[14, 15]。本研究从杭州的土壤中筛选到一株产高活性的钙调磷酸酶抑制物质的放线菌,并对其进行了菌种鉴定和发酵条件优化,可能具有较好的开发应用前景。
1 材料与方法 1.1 材料 1.1.1实验菌株及质粒:酵母菌株Saccharomyces cerevisiaeWHU2d (Mata trp1Δ,ade2Δ,leu2Δ,ura3Δ,his3Δ)由日本广岛大学宫川都吉教授惠赠。质粒pAMS366 (pLG178-4X-CDRE::Cyc1::LacZ)由美国斯坦福大学Cyert教授惠赠。酵母报告基因(CDRE::LacZ)菌株CHW-1由本实验室将质粒pAMS366导入WHU2d菌株后获得和保存。 1.1.2 样品采集:样品采集时间为2013年10月下旬,在杭州市植物园、小和山、西溪湿地等地随机布点采样30份土样。 1.1.3 主要试剂和仪器:FK506(他克莫司)购自Sigma公司;ONPG (邻硝基苯β-D-半乳吡喃糖苷)、Taps (三羟甲基甲胺基丙磺酸)、Lysozyme (溶菌酶)、dNTPs、Taq酶等购自上海生工生物工程技术服务有限公司;人体钙调磷酸酶试剂盒购自Enzolife sciences公司;PCR仪购自德国Biometra公司;酶标仪购自美国Bio-Rad公司。 1.1.4 主要培养基:高氏合成培养基(g/L):淀粉20.0,KNO31.0,MgSO40.5,K2HPO40.5,NaCl0.5,FeSO40.01,pH7.5。YNB合成培养基(g/L):酵母氮碱6.70,葡萄糖5.00,省却混合物0.80[16],腺嘌呤0.04,色氨酸0.04,亮氨酸0.10,pH 5.5。
种子培养基(g/L):淀粉20.0,KNO3 1.0,MgSO4 0.5,K2HPO40.5,NaCl0.5,FeSO40.01,葡萄糖1.0,蛋白胨1.0,酵母提取物0.5,牛肉膏0.5,pH 7.5。
初始发酵培养基:以高氏合成培养基为初始发酵培养基。
1.2 放线菌分离纯化称取5 g土壤于无菌平皿中自然风干,再将其放到45 mL无菌生理盐水中,200 r/min混匀20 min,最后以10−3、10−4、10−5梯度稀释涂布于高氏培养基平板上,30 °C培养5 d后,挑取形态不一样的单菌落重新划线接种在高氏培养基平板上,反复多次,待菌落形态稳定后,编号保存。
1.3 酵母报告基因高通量筛选方法挑取单菌落至装有5 mL高氏培养基的试管中30 °C、200r/min培养4 d,离心取发酵上清液备用。以酵母报告基因菌株CHW-1为指示菌,依据Margassery等[12]的方法进行高通量筛选:取25μL处于对数期(OD600为0.8)的酵母菌悬液与25 μL待测样品(发酵上清液)混合在96微孔板中30 °C孵育0.5h,加25μL Taps (pH 8.1) 30 °C孵育1 h,加入75 μL Z-buffer和75 μL裂解液30 °C孵育0.5 h后,加入25 μL 4 g/L的LacZ底物ONPG 30 °C反应20 min,最后加入60 μL 1 mol/L的Na2CO3终止反应,测定420 nm处吸光值,即为LacZ表达量。LacZ相对表达量则是以负对照的LacZ表达量的值为1计算得到。LacZ相对表达量抑制率=(OD正对照/OD负对照−OD实验组/OD负对照)/(OD正对照/OD负对照−OD负对照/OD负对照)x100%。实验以加Taps组为正对照,不加Taps组为负对照,FK506为药物对照。如果25 μL待测样品(发酵上清液)的相对抑制率已接近100%,则减少发酵上清液样品量后重新测定,以准确测定其抑制活性。每个样品设置3个平行,实验重复3次(检测结果以每次设置的正负对照为基准)。
1.4 发酵粗提物制备对酵母报告基因高通量筛选得到的具有明显抑制酵母钙调磷酸酶活性的菌株,进一步做50mL摇瓶培养和发酵粗提物的制备。即将100μL菌悬液接种在50 mL液体种子培养基/250 mL摇瓶中,30 °C、200r/min振荡培养2 d,制成种子液。将种子液以4%的接种量接入50 mL发酵培养基/250 mL摇瓶中,30 °C、200r/min振荡培养4d后,12000 r/min离心,收集发酵上清液。分别用正丁醇、乙酸乙酯、二氯甲烷(抽提剂:发酵液=1:1,体积比)对发酵上清液进行抽提,抽提物经50 °C旋转蒸发干燥后,溶解于适量的ddH2O中得到发酵粗提物,作为人体钙调磷酸酶试剂盒检测用样品。
1.5 人体钙调磷酸酶试剂盒检测为了检测高通量筛选到的菌株是否对人体钙调磷酸酶也具有抑制活性,按照人体钙调磷酸酶试剂盒的方法对其发酵粗提物的钙调磷酸酶抑制活性进行检测,以ddH2O为空白对照,样品设置3个平行,实验重复3次。
1.6 菌种鉴定 1.6.1 形态学特征:将高氏培养基平板上30 °C培养8 d的放线菌菌落分别在光学显微镜和扫描电镜下观察菌丝形态。 1.6.2 培养特征及生理生化特征:参照《放线菌快速鉴定与系统分类》推荐的培养基和方法[17]。 1.6.3 系统发育树特征:以待测菌株基因组DNA为模板,用细菌16S rRNA基因通用引物27F [5′-AGAGTTTGATC(A/C)TGGCTCAG-3′]和1492R [5′-TACGG(C/T)TACCTTGTTACGACTT-3′]进行PCR扩增。PCR反应体系为50 μL,包括10×PCR buffer5.0 μL,基因组2.0μL,27F(10 μmol/L) 2.0 μL,1492R (10 μmol/L) 2.0 μL,2.5 mmol/L dNTPs 4 μL,5 U/μL rTaq酶0.5 μL,ddH2O 34.5 μL。PCR反应条件为:95 °C 5 min;94 °C 1 min,55 °C 1 min,72 °C 2 min,共30个循环;72 °C 10 min。PCR扩增片段测序后通过NCBI数据库BLAST比对,选取相似度最高且有效发表的菌株,先用Clustal X进行序列比对,再用MEGA 4.0中的Neighbor-Joining法构建系统发育树,确定其分类地位[18]。 1.7 发酵条件优化 1.7.1 不同碳源、氮源对发酵液活性的影响:以高氏培养基为对照,在培养条件不变的情况下,碳源:以2%(质量体积比)的比例,分别用玉米粉、全麦粉、麦芽糖、蔗糖、葡萄糖代替高氏培养基中的淀粉。氮源:以0.1%(质量体积比)的比例分别用硫酸铵、硝酸钠、酵母粉、黄豆饼粉、蛋白胨代替高氏培养基中的硝酸钾。不同碳源、氮源对发酵液活性的影响按酵母报告基因高通量方法进行测定,实验重复3次,最后得到最佳碳源和氮源。 1.7.2 培养基成分正交实验:选择最佳碳源(玉米粉)和氮源(酵母粉)以及无机盐K2HPO4和MgSO4共4个因素,设置3个水平,利用正交实验表L9(34)进行正交实验(表 1),每个实验组设置3个重复,实验重复3次后得到确定培养基配方。通过酵母报告基因高通量方法测定,以LacZ相对表达量抑制率为评判标准。对菌株CZW-15发酵培养基各营养组分正交实验所得数据进行极差分析,得到最佳培养基组成。| 因素 Factors | 水平 Levels (g/L) | ||
| Corn flour (A) | 18 | 20 | 22 |
| Yeast extract (B) | 0.9 | 1.0 | 1.1 |
| MgSO4 (C) | 0.4 | 0.5 | 0.6 |
| K2HPO4 (D) | 0.4 | 0.5 | 0.6 |
用酵母报告基因(CDRE::LacZ)高通量筛选模型对320株放线菌菌株进行初筛,分别取发酵上清液25 μL,以酵母CHW-1为指示菌测定LacZ表达活性,结果得到一株具有强抑制作用的放线菌CZW-15,其相对抑制率达到104% (图 1A)。为了排除饱和效应引起的测定数据不准确,对不同剂量的该发酵上清液的抑制活性进行了检测,结果显示该发酵上清液的IC50为7.4 mL/L,而对照药物FK506的IC50为65 μg/L (图 1B和C)。

|
|
图 1
CZW-15发酵上清液对酵母钙调磷酸酶依赖基因(CDRE::LacZ)表达的抑制作用
Figure 1
Inhibition of yeastcalcineurin-depedent gene expression (CDRE::LacZ) by thefermentation supernatant of CZW-15
注:A:高通量筛选结果,除了负对照外,其余样品组均添加Taps (pH 8.1). -Taps:负对照;Taps:正性对照;FK506:25 μL (7 mg/L);I:25 μL CZW-28;II:25 μL CZW-46;III:25 μL CZW-15;IV:25 μL CZW-74;V:25 μL CZW-102. B:不同剂量的FK506对依赖酵母钙调磷酸酶的报告基因(CDRE::LacZ)表达的抑制活性曲线,并通过设置未经诱导的酵母实验组排除背景的吸光度干扰. C:不同剂量的发酵上清液对依赖酵母钙调磷酸酶的报告基因(CDRE::LacZ)表达的抑制活性曲线,并通过设置未经诱导的酵母实验组排除背景的吸光度干扰. Note: A: Results of high throughputscreening, with the exception of negative control, all treatments includedstimulation by addition of Taps (pH 8.1). -Taps: Negative control; Taps:Positive control; FK506: 25 μL (7 mg/L); I: 25 μL ofCZW-28; II: 25 μL of CZW-46; III: 25 μL of CZW-15; IV: 25 μL of CZW-74; V: 25μL of CZW-102. B: Inhibition of yeast calcineurin-dependent gene expression (CDRE::LacZ)by different doses of FK506, the control containing un-stimulated yeast wasused to subtract background absorbance. C: Inhibition of yeast calcineurindepedent gene expression (CDRE::LacZ) by different doses offermentation supernatant of CZW-15, the control containing un-stimulated yeastwas used to subtract background absorbance. |
为了排除发酵上清液中的磷酸根离子对人体钙调磷酸酶试剂盒方法的影响,对CZW-15发酵上清液分别用正丁醇、乙酸乙酯和二氯甲烷进行等体积抽提,发现正丁醇可以很好地抽提发酵液中活性物质(结果待发表)。CZW-15发酵上清液的正丁醇抽提物经旋转蒸发干燥后,溶解于少量水中得到CZW-15发酵粗提物(0.7 g/L)。
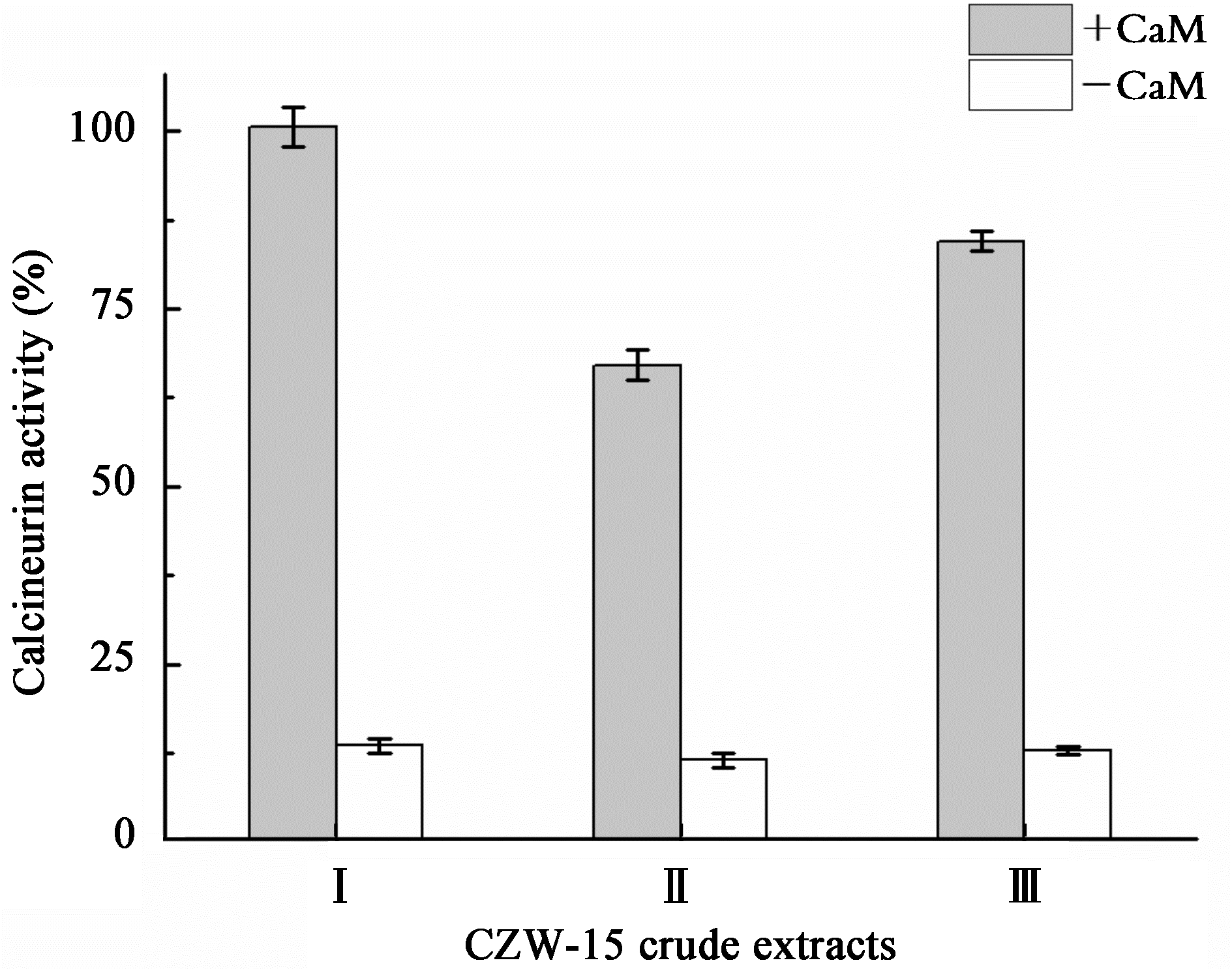
如图 2所示,用人体钙调磷酸酶试剂盒方法对该发酵粗提物的钙调磷酸酶抑制活性进行检测,发现其对钙调素依赖性人体钙调磷酸酶也具有抑制效果,10μL (7 μg)的发酵粗提物使钙调素依赖性人体钙调磷酸酶的活性下降到67%(抑制率33%),表明CZW-15发酵上清液不仅对酵母钙调磷酸酶具有明显抑制作用,而且对人体钙调磷酸酶也有抑制活性。
|
| 图 2 2CZW-15粗提物对人体钙调磷酸酶的抑制活性 Figure 2 Inhibition of CZW-15 crude extracts on human calcineurin Note: I: Control; II:7 μg; III: 3.5 μg. |
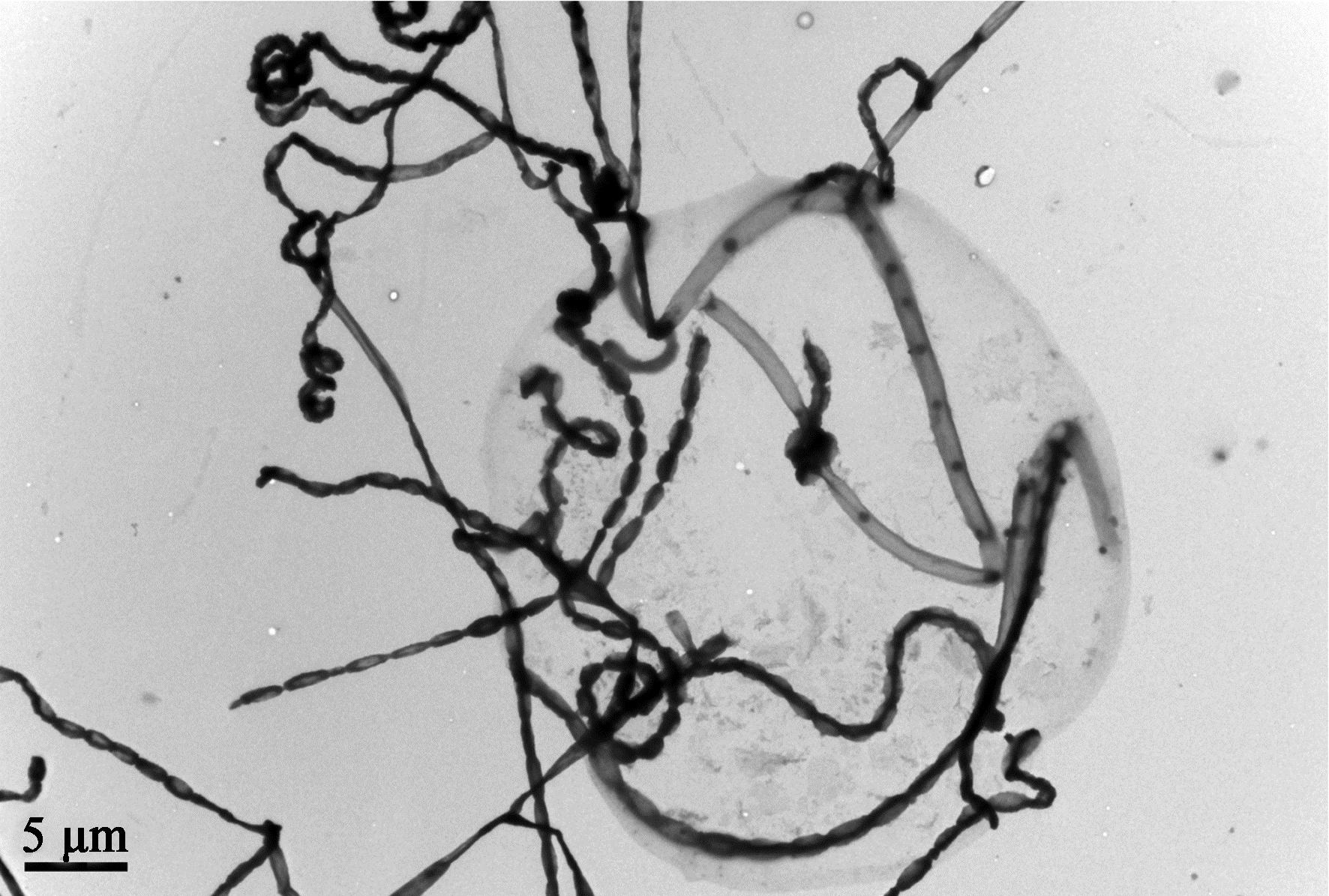
在高氏培养基培养8 d后的CZW-15的电镜照片见图 3。根据《放线菌快速鉴定与系统分类》中的8种供试培养基对菌株CZW-15的培养特征进行检测的结果见表 2。在高氏培养基上,菌株CZW-15气生菌丝呈淡粉红,基内菌丝呈玉米黄,无可溶性色素产生(表 2)。生理生化实验表明菌株CZW-15 能使明胶液化,硝酸盐还原,产黑色素和硫化氢,牛奶不凝固但可胨化,淀粉水解且能利用淀粉,降解纤维素但不能利用纤维素,产脂肪酶,不产脲酶。碳源利用实验表明,菌株CZW-15可以利用葡萄糖、蔗糖、麦芽糖、肌醇、甘露醇、L-鼠李糖和L-阿拉伯糖(表 3)。
|
| 图 3 CZW-15电镜照片 Figure 3 Scanning electron microscope (SEM) photographs of CZW-15 |
| 培养基 Medium | 气生菌丝 Aerial mycelium | 营养菌丝 Vegetative mycelium | 可溶性色素 Soluble pigment |
| ISP-1 | Pure white | Gream | None |
| ISP-2 | Light pink | Dafford yellow | None |
| ISP-3 | Antique pink | Signal orange | None |
| ISP-4 | Antique pink | Gream | None |
| ISP-5 | Pure white | Pasted orange | None |
| ISP-6 | Oyster white | Signal brown | Red brown |
| ISP-7 | Light pink | Copper brown | Clay brown |
| GS | Light pink | Maize yellow | None |
| 实验内容 Term | 实验结果 Result | 实验内容 Term | 实验结果 Result |
| Gelatin liquefaction | + | Urease | − |
| Hydrolysis of starch | + | Glucose | + |
| Lipase | + | L-arabinose | ± |
| H2S production | + | D-fructose | ± |
| Melanoid pigment | + | Inositol | + |
| Cellucose decomposition | + | D-mannitol | + |
| Cellucose utilization | − | Sucrose | + |
| Nitrate reduction | + | L-rhamnose | ± |
| Coagulation of milk | − | Maltose | + |
| Peptonization of milk | + | Lactose | + |
Note: +: Representpositive result; ±: Worse result; −: Negative result.
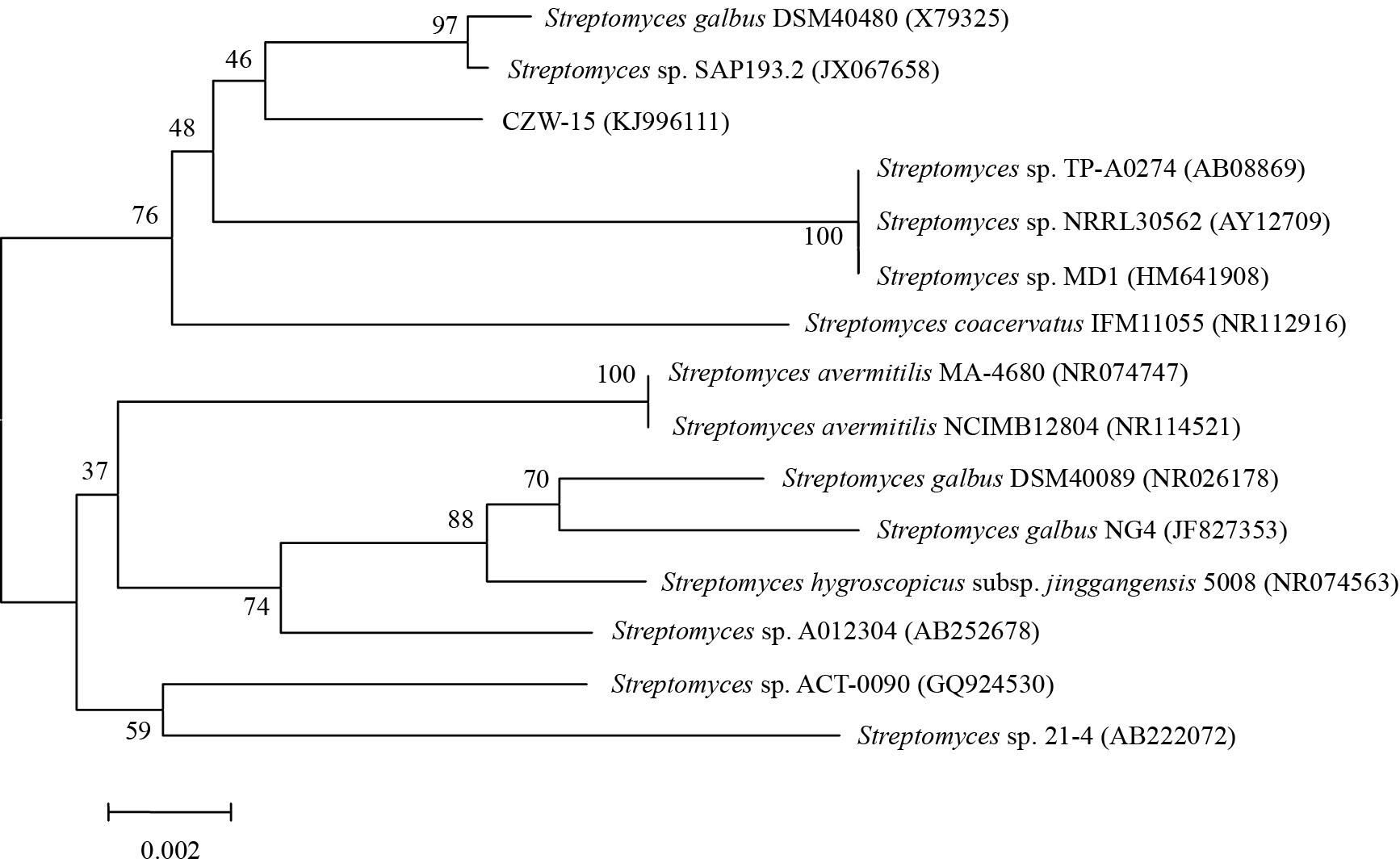
将菌株CZW-15的16S rRNA基因序列扩增得到1 500 bp左右大小的条带,经测序得到1 490 bp的序列并已上传至GenBank,获得登录号为KJ996111。通过在NCBI上BLAST比对,选取与其同源性最高且有效发表菌株的相关序列,利用MEGA 4.0中的Neighbor-Joining法构建系统发育树(图 4),结果表明CZW-15与Streptomycesgalbus DSM40480 (相似率为99.3%)、Streptomyces sp. SAP193.2 (相似率为99.2%)最为相似。
2.4 菌株CZW-15发酵条件优化
|
|
图 4
菌株CZW-15与其相关菌株的系统发育树
Figure 4
Phylogenetic tree of strain CZW-15 and otherrelated strains download from GenBank
注:分支点数据为自聚值;标尺为0.002,表示相似性百分比;括号中为菌株序列注册号. Note: Number at nodesindicated levels of bootstrap support (%) based on 1 000 resample datasets.Bar: 0.2% sequence divergence. Numbers in parentheses represent the sequenceaccession number in GenBank. |
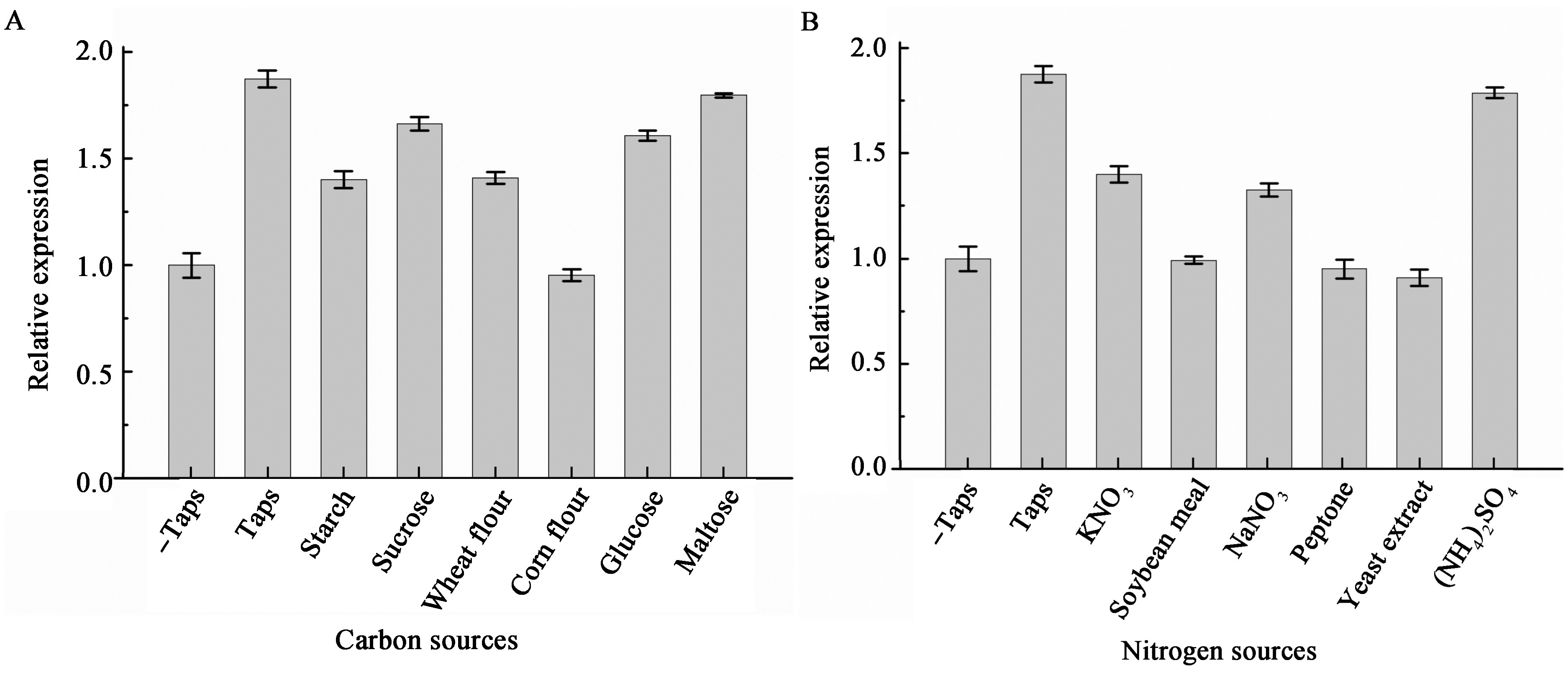
|
| 图 5 不同碳氮源对菌株CZW-15发酵液活性的影响 Figure 5 Effects of different carbon and nitrogensources on inhibition activity of fermentation supernatant from CZW-15 Note: -Taps:Negative control, Taps: Positive control. |
| 编号 No. | A | B | C | D | 相对抑制活性 Relative expression inhibition (%) |
| 1 | 1 | 1 | 1 | 1 | 77.5 |
| 2 | 1 | 2 | 2 | 2 | 58.5 |
| 3 | 1 | 3 | 3 | 3 | 66.0 |
| 4 | 2 | 1 | 2 | 3 | 55.0 |
| 5 | 2 | 2 | 3 | 1 | 113.5 |
| 6 | 2 | 3 | 1 | 2 | 94.0 |
| 7 | 3 | 1 | 3 | 2 | 49.5 |
| 8 | 3 | 2 | 1 | 3 | 102.5 |
| 9 | 3 | 3 | 2 | 1 | 74.0 |
| K1 | 67.3 | 60.7 | 91.3 | 88.3 | |
| K2 | 87.5 | 91.5 | 62.5 | 67.3 | |
| K3 | 75.3 | 78.0 | 76.3 | 74.5 | |
| R | 20.2 | 30.8 | 28.2 | 21.0 |
在确定发酵培养基组成配比的情况下,对发酵培养条件包括起始pH、温度、转速、培养天数、装液量、种子液接种量进行优化。结果表明,种子液接种量4%,起始pH 7.5,发酵培养基装液量50 mL/250 mL,180 r/min、28 °C恒温培养4 d时的发酵液活性最高(结果待发表)。实验选定此条件为最佳发酵培养条件。取1.5μL发酵液用酵母报告基因(CDRE::LacZ)高通量模型测定钙调磷酸酶的抑制活性,结果表明经优化后,1.5μL CZW-15发酵液的相对抑制活性达到117%,是优化前发酵液的相对抑制活性(26%)的4.5倍(图 6)。

|
|
图 6
发酵条件优化结果
Figure 6
Optimization of fermentation conditions
注:-Taps:负对照;Taps:正对照;FK506:25 μL (7 mg/L);I:1.5 μL优化后发酵上清液;II:1.5 μL优化前发酵上清液. Note: -Taps:Negative control; Taps: Positive control; FK506: 25 μL (7mg/L); I: 1.5 μL of fermentation supernatant after optimization; II: 1.5 μL of fermentation supernatant before optimization. |
本研究通过酵母报告基因高通量模型从土壤中筛选到一株产高活性钙调磷酸酶抑制物的放线菌CZW-15,其发酵上清液稀释了10倍后对酵母钙调磷酸酶仍有50%的抑制活性,即其IC50为7.4 mL/L发酵上清液,而对照药物FK506的IC50为65 μg/L (图 1)。为了检测该发酵上清液是否对人体钙调磷酸酶也具有抑制活性,先进行了正丁醇抽提并制成发酵粗提物,再用人体钙调磷酸酶试剂盒检测,结果表明该发酵粗提物对人体钙调磷酸酶确有抑制活性,10 μL (7 μg)的发酵粗提物使人体钙调磷酸酶的活性下降到67% (抑制率33%)(图 2)。但与酵母细胞中测定的对酵母钙调磷酸酶抑制活性(IC50为7.4 mL/L发酵上清液)相比较,用试剂盒测定的对人体钙调磷酸酶抑制活性明显降低。这可能与人体钙调磷酸酶试剂盒检测是体外实验缺少免疫亲和素等细胞成分有关。由此推测,CZW-15发酵上清液中的主要活性物质可能也同FK506和CosA一样,需与免疫亲和素结合形成复合体后起作用,而不能直接抑制人体钙调磷酸酶的活性[19],其具体作用机制还有待进一步研究。
利用传统分类学和16S rRNA方法对菌株鉴定结果表明CZW-15属于链霉菌属(Stretopmyces),且同菌株Streptomyces galbus DSM40480、Streptomyces sp.SAP193.2最为相近(图 4)。菌株CZW-15同Streptomycesgalbus DSM40480均可产生黑色素和H2S,使明胶液化、牛奶胨化等,但也有不同之处,如在SP4培养基上,菌株CZW-15气生菌丝和基内菌丝分别呈古粉红色和奶白色,而菌株Streptomycesgalbus DSM40480气生菌丝分别呈淡黄色和黄色[20]。菌株Streptomyces sp. SAP193.2的信息目前仍不全,故无法作具体比较。
通过单因素实验和正交实验得到该菌的最佳摇瓶发酵配方(%)为:玉米粉2.0、酵母粉0.1、K2HPO40.04、MgSO40.04、NaCl0.05,FeSO40.001,发酵条件为:起始pH 7.5,温度28 °C,转速180r/min,装液量50mL/250 mL,接种量4%,培养时间4 d。优化后CZW-15发酵上清液的酵母钙调磷酸酶抑制活性比优化前提高了4.5倍。在此基础上,进一步对培养基组分和发酵条件进行优化,其抑制活性还可能大幅度提高。
CZW-15产生的高活性钙调磷酸酶抑制物可能具有较好的开发应用前景。下一步将会对该活性物进行分离纯化和结构鉴定,并结合动物细胞和小鼠活体实验探究其作用机理和临床应用价值。
| [1] | Rusnak F, Mertz P. Calcineurin: form and function[J]. Physiological Reviews, 2000, 80(4): 1483-1521 |
| [2] | Reese LC, Taglialatela G. A role for calcineurin in Alzheimer’s disease[J]. Current Neuropharmacology, 2011, 9(4): 685-692 |
| [3] | Hudson MB, Price SR. Calcineurin: a poorly understood regulator of muscle mass[J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(10): 2173-2178 |
| [4] | Williams CR, Gooch JL. Calcineurin inhibitors and immunosuppression-a tale of two isoforms[J]. Expert Reviews in Molecular Medicine, 2012, 14: e14 |
| [5] | Rezzani R. Exploring cyclosporine A-side effects and the protective role-played by antioxidants: the morphological and immunohistochemical studies[J]. Histology and Histopathol, 2006, 21(3): 301-316 |
| [6] | Kessler M, Jay N, Molle R, et al. Excess risk of cancer in renal transplant patients[J]. Transplant International, 2006, 19(11): 908-914 |
| [7] | Guitard J, Rostaing L, Kamar N. New-onset diabetes and nephropathy after renal transplantation[J]. Diabetes and the Kidney, 2011, 170: 247-255 |
| [8] | Prescott TAK, Veitch NC, Simmonds MSJ. Direct inhibition of calcineurin by caffeoyl phenylethanoid glycosides from Teucrium chamaedrys and Nepeta cataria[J]. Journal of Ethnopharmacology, 2011, 137(3): 1306-1310 |
| [9] | Wang H, Zhou CL, Lei H, et al. Kaempferol: a new immunosuppressant of calcineurin[J]. IUBMB Life, 2008, 60(8): 549-554 |
| [10] | Wang H, Zhou CL, Lei H, et al. Inhibition of calcineurin by quercetin in vitro and in Jurkat cells[J]. Journal of Biochemistry, 2010, 147(2): 185-190 |
| [11] | Chen DS, Hua XL, Yu LX. Research on calcineurin activity inhibition of extracts of Smilax china L.[J]. Journal of Chinese Medicinal Material, 2007, 30(11): 1436-1439 (in Chinese)陈东生, 华小黎, 于丽秀. 菝葜不同溶剂提取物抑制钙调磷酸酶活性作用的研究[J]. 中药材, 2007, 30(11): 1436-1439 |
| [12] | Margassery LM, Kennedy J, O’Gara F, et al. A high-throughput screen to identify novel calcineurin inhibitors[J]. Journal of Microbiological Methods, 2012, 88(1): 63-66 |
| [13] | Prescott TAK, Panaretou B, Veitch NC, et al. A yeast chemical genetics approach identifies the compound 3,4,5-trimethoxybenzyl isothiocyanate as a calcineurin inhibitor[J]. FEBS Letters, 2014, 588(3): 455-458 |
| [14] | Kino T, Hatanaka H, Hashimoto M, et al. FK506, a novel immunosuppressant isolated from a Streptomyces. I. Fermentation, isolation, and physico-chemical and biological characteristics[J]. The Journal of Antibiotics, 1987, 40(9): 1249-1255 |
| [15] | Svarstad H, Bugge HC, Dhillion SS. From Norway to Novartis: cyclosporin from Tolypocladium inflatum in an open access bioprospecting regime[J]. Biodiversity and Conservation, 2000, 9(11): 1521-1541 |
| [16] | Adams A, Kaiser CA, Gottschling DE, et al. Methods in Yeast Genetics: A Cold Spring Harbor Laboratory Course Manual[M]. Translated by Liu ZD. Beijing: Science Press, 2000: 110-112 (in Chinese)亚当斯 A, 凯泽CA, 戈特施林 DE, 等. 酵母遗传学方法实验指南[M]. 刘子铎译. 北京: 科学出版社, 2000: 110-112 |
| [17] | Ruan JS, Huang Y. Rapid Identification and Systematics of Actinobacteria[M]. Beijing: Science Press, 2011: 69-77 (in Chinese)阮继生, 黄英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011: 69-77 |
| [18] | Brunel B, Givaudan A, Lanois A, et al. Fast and accurate identification of Xenorhabdus and Photorhabdus species by restriction analysis of PCR-amplified 16S rRNA genes[J]. Applied and Environmental Microbiology, 1997, 63(2): 574-580 |
| [19] | Ke HM, Huai Q. Structures of calcineurin and its complexes with immunophilins-immunosuppressants[J]. Biochemical and Biophysical Research Communications, 2003, 311(4): 1095-1102 |
| [20] | Mehling A, Wehmeier UF, Piepersberg W. Nucleotide sequences of streptomycete 16S ribosomal DNA: towards a specific identification system for streptomycetes using PCR[J]. Microbiology, 1995, 141(9): 2139-2147 |
 2015, Vol. 42
2015, Vol. 42