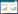扩展功能
文章信息
- 王国正, 吴群, 徐岩
- WANG Guo-Zheng, WU Qun, XU Yan
- 低产高级醇酿酒酵母突变菌株的差异蛋白组分析及高级醇合成相关蛋白的差异表达
- Comparative intracellular proteomics analysis of alow higher alcohols producing Saccharomyces cerevisiae mutant anddifferent expression of higher alcohols synthesis related proteins
- 微生物学通报, 2015, 42(12): 2407-2416
- Microbiology China, 2015, 42(12): 2407-2416
- 10.13344/j.microbiol.china.150135
-
文章历史
- 收稿日期: 2015-02-10
- 接受日期: 2015-04-23
- 优先数字出版日期(www.cnki.net): 2015-05-08
高级醇是白酒微量香气成分中的重要组成部分,是白酒3大主要类型风味物质醇、酸、酯的重要组分。适当的高级醇含量不仅提供丰富饱满的口感,更是形成某些酯的基础物质,形成酯类特有的香气。但是高级醇含量过高会使酒生冲爆辣、刺激性强,而且味苦[1]。并且,高级醇是对人体有害的物质,毒害性与麻醉作用都比乙醇强[1]。白酒中的高级醇主要是在酒精发酵过程由酵母产生的[2],因此对酿酒酵母高级醇合成相关蛋白的研究具有很重要的意义。
对于酿酒酵母的高级醇合成途径的研究已经很清楚了,主要为氨基酸分解代谢途径(Ehrlich途径)[3,4]和糖代谢合成途径(Harris途径)[5,6]。目前许多学者已经对参与Ehrlich途径和糖代谢合成途径的许多酶进行了研究,Yoshimoto等[7]、Verstrepen等[8]、Lilly等[9,10]、Styger等[11,12]的研究发现 ATF1、IAH1、BAT1基因的表达对高级醇合成有促进作用,而BAT2、EHT1、ADH3、THI3基因的表达对高级醇合成有抑制作用,并且Zhang等[13]和Zhang等[14]分别进行了ATF1与IAH1和ATF1与BAT2基因的调控构建了低产高级醇的酵母菌株。关于高级醇代谢的研究还主要集中于高级醇合成途径中各反应酶的编码基因的研究,然而高级醇合成途径比较复杂,Ehrlich途径和Harris途径有许多分支,如由乙酰乳酸合成双乙酰、乙偶姻和2,3-丁二醇等分支途径,从基因水平对整个代谢网络进行高级醇合成相关蛋白的研究不仅很耗时费力,而且会有一定局限性。而蛋白组学是从蛋白质水平研究生命活动,能够反映研究对象全部蛋白质的表达模式及功能模式,这是基因组和转录组不具有的优势。采用大规模、高通量、高灵敏度的基于质谱分析技术的蛋白质组学技术手段,通过比较分析蛋白组差异,可以找到表型差异相关功能蛋白,这对于高级醇合成相关蛋白的研究是一个新的探索。
酿酒酵母CF4菌株是本实验室筛选得到的一株低产高级醇酿酒酵母,通过常温常压等离子体诱变和筛选得到一株高级醇产量降低了20%的酿酒酵母菌株ARTP5,通过进行ARTP5菌株与原始菌株CF4的胞内蛋白组差异比较,分析与其高级醇产量降低有关的蛋白,就有可能发现对高级醇合成有重要影响的蛋白和基因。
1 材料与方法 1.1 材料和试剂 1.1.1 菌株:原始菌株CF4:本实验室从酒曲中筛选得到的酵母菌株。诱变菌株ARTP5:CF4经常温常压等离子诱变后筛选得到的低产高级醇酵母菌株。 1.1.2 试剂:IPG胶条(pH 3.0−10.0,18 cm,线性)、两性电解质IPG 缓冲液、两性电解质Bio-Lyte (pH 3.0−10.0)为美国GE公司产品。矿物油为Bio-Rad公司产品。非干扰性蛋白浓度测定试剂盒2-DQuant Kit、二硫苏糖醇(DTT)、溴酚蓝、N,N,N',N'-四甲基乙二胺(TEMED)、硫脲、碳酸氢铵(NH4HCO3)、α-氰基-4-羟基肉桂酸(HCCA)、胰蛋白酶、乙腈(CAN),乙醇、异戊醇、异丁醇、2-辛醇(色谱纯),购自Sigma公司。低熔点琼脂糖、尿素、三氟乙酸(TFA)、蛋白酶抑制剂、甲叉双丙烯酰胺、过硫酸铵(APS)、十二烷基硫酸钠(SDS)、丙烯酰胺、3-[3-胆固醇氨丙基)二甲氨基]-1-丙磺酸(CHAPS)、碘乙酰胺(IAA)、考马斯亮蓝G-250为生工生物工程(上海)股份有限公司产品。其他试剂均为分析纯试剂,国药集团试剂公司。 1.1.3 培养基:YPD培养基(%):葡萄糖2,蛋白胨 2,酵母提取物 1。发酵培养基:称取500 g糯米,30 °C浸泡2 d后蒸熟,依次加水1 L,糖化酶(50000 U/L),液化酶(20000 U/L),酸性蛋白酶(10000 U/L)各200μL,60 °C水浴,间歇搅拌,保温10h (第5 h左右再加上述3种酶各200 μL),将米饭糖化液纱布过滤后离心(5000 r/min,5min),除去沉淀,上清液用去离子水将糖度调节至为10° Bx后1×105Pa灭菌30min作为发酵培养基使用。 1.2 方法 1.2.1 菌株培养:从斜面挑一环健康的酵母菌株CF4或ARTP5,接种到装有50 mL YPD培养基的三角瓶中进行培养,30 °C、200r/min培养16h,之后将种子液以相同的接种量(1×106CFU/mL)接入装有100mL发酵培养基的250mL三角瓶中,然后装用浓硫酸封闭的发酵栓并称重,置于30 °C培养箱中静置恒温培养,每隔12h取出,摇匀称重并记录失重,当12h失重<0.2 g时,停止培养。 1.2.2 乙醇含量测定:乙醇采用液相色谱法测定,色谱条件为:分离柱Bio-Rad 87H色谱柱,示差折光检测器,流动相0.05 mmol/L H2SO4,流速为0.6 mL/min,进样量为10 μL,柱温60 °C,波长为215nm,保留时间为25min。 1.2.3 高级醇测定:将发酵菌悬液离心取上清,采用GC法测高级醇[15]。 1.2.4 蛋白质提取:发酵至48 h取100 mL酵母培养液离心(6 300 r/min,15 min),弃上清。用100 mL超纯水悬浮洗涤菌体,离心(6 300 r/min,15 min),重复3次得菌体沉淀。用2 mL细胞裂解液(7 mol/L尿素、2 mol/L硫脲、质量分数4% CHAPS)悬浮酵母细胞,加入20 μL蛋白酶抑制剂。冰浴超声破碎(3 s/2 s) 30 min,尽量低温,完毕后离心(12 000 r/min,30 min,4 °C)。TCA-丙酮沉淀:将上清液转移到50mL离心管中,加入10倍体积TCA-丙酮溶液沉淀蛋白,−20 °C放置过夜,离心(12 000 r/min,30 min,4 °C)。用−20 °C预冷丙酮悬浮洗涤沉淀,将沉淀颗粒打散,使溶液成乳浊液形态存在,−20 °C放置1 h,离心(12 000 r/min,30 min,4 °C),重复3次,得蛋白质沉淀。将得到的沉淀敞口置于−20 °C,使沉淀中残留的丙酮挥发干净。将蛋白质沉淀溶于1 mL上样水化缓冲液(7 mol/L尿素、2 mol/L硫脲、质量分数4% CHAPS、65 mmol/L DTT、质量分数1% pH 3.0−10.0的IPG缓冲液)中,振荡使蛋白溶解后离心(12 000 r/min,30 min),取上清,Bradford法测定蛋白浓度[16],−20 °C冷冻待用。 1.2.5 双向电泳:按照GE公司的《双向电泳操作手册》进行水化上样、等电聚焦、平衡,以及第二向SDS-PAGE电泳。简要步骤如下:按800μg蛋白的上样量,测定出蛋白质浓度,计算出需要的稀释体积。干胶条在含有蛋白质样品的上样水化液中水化过夜。水化过夜后的胶条转移到等电聚焦仪器,设定程序进行等电聚焦,结束后立即进行平衡。采用两步平衡法,IPG胶条先后在平衡液I和平衡液II中平衡。进行第二向电泳,当溴酚蓝条带移至凝胶底部时结束。采用改良胶体考马斯亮蓝G-250染色法对蛋白质进行染色[7]。脱色后的双向电泳凝胶用GE公司的凝胶电泳图像分析系统ImageMasterLabScan对其进行扫描分析。利用GE公司Image Master2D Platinum 7软件进行图像分析处理,选取诱变菌株ARTP5与原始菌株CF4表达量差异≥2且P<0.05的蛋白点进行质谱鉴定(P值用来反应诱变菌株ARTP5与原始菌株CF4对应蛋白点表达量差异显著性),P<0.05保证了蛋白点表达量差异的统计学可靠性。 1.2.6 蛋白鉴定与分析:选取的蛋白质点经切点、酶解、肽段回收、点靶等步骤,采用AutoflexspeedTM MALDI-TOF-TOF质谱仪(Bruker Dalton)进行质谱分析,UV波长355 nm,重复速率200 Hz,加速电压20 000 V,最优质量分辨率1 500 Da。扫描质量范围为700−3 200 Da,收集信号。胰酶自切峰为质谱仪校正内标。实验样品质谱图以默认模式获得。数据库检索:利用Biotools(Bruker Dalton)软件搜索Mascot数据库,寻找相匹配的蛋白质;利用UniProt数据库进行蛋白功能查询。 2 结果与分析 2.1 低产高级醇的诱变菌株与原始菌株发酵性能的差异比较了两株酵母的生长曲线发现诱变菌株ARTP5与原始菌株CF4的生长趋势比较一致(图1),均在24h进入了稳定期,然后菌体量保持在1.5×108CFU/mL。以CO2失重表征发酵力,120 h发酵基本结束(图1)。诱变菌株ARTP5与原始菌株CF4高级醇合成趋势也比较一致,正丙醇、异丁醇、异戊醇一直在累积,主要是在0−72h内合成。发酵到48h,两株酵母的正丙醇、异丁醇、异戊醇合成速率都比较高,在此时提取两株酵母的胞内蛋白进行差异蛋白组分析更可能发现高级醇合成相关蛋白。
|
| 图 1 诱变菌株ARTP5与原始菌株CF4生长曲线和CO2失重变化曲线 Figure 1 The growth curve and CO2 weightloss curve of the mutant strain ARTP5 and the origin strain CF4 |
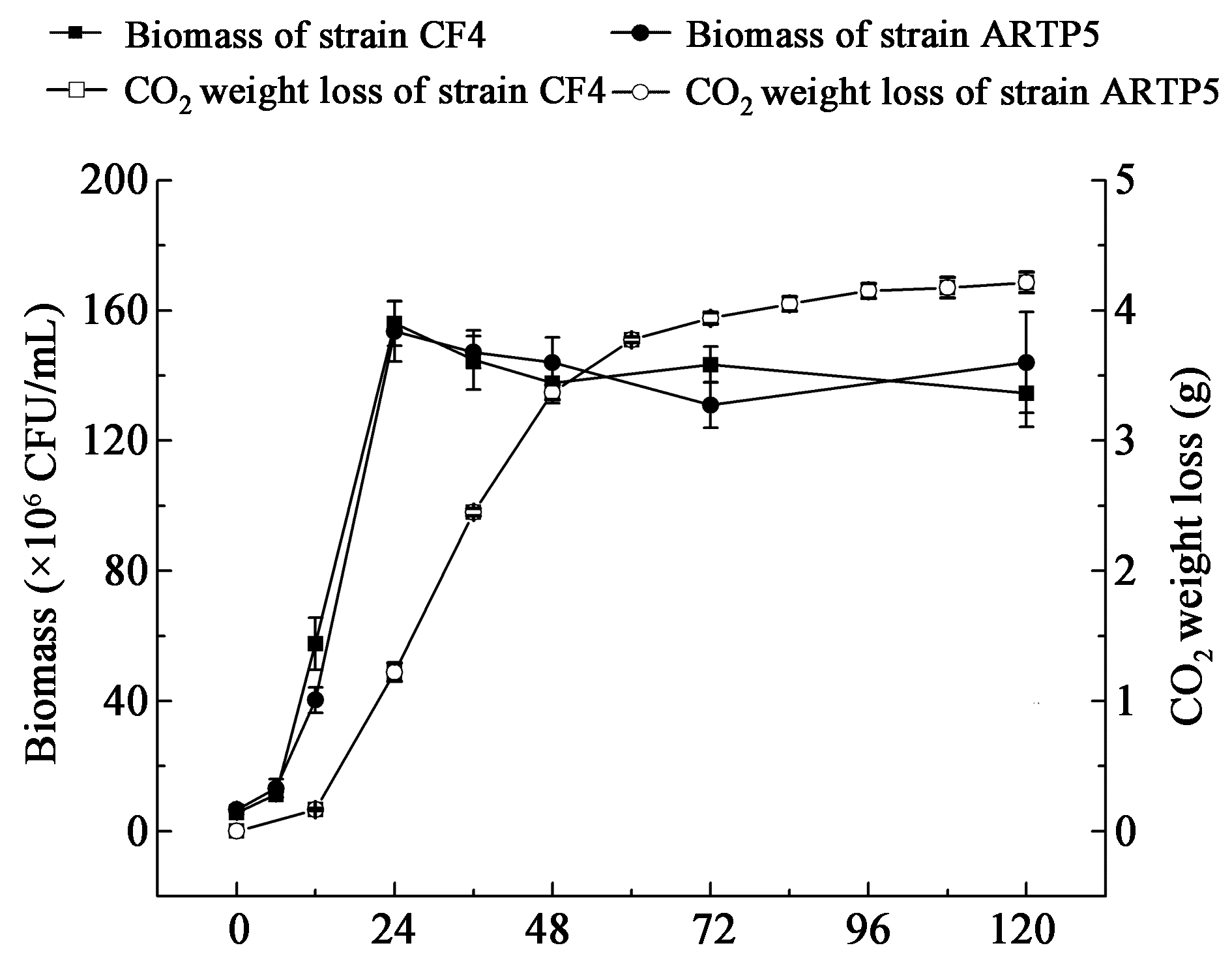
乙醇是酿酒酵母一个重要发酵性能指标,而正丙醇、异丁醇、异戊醇是酿酒酵母酒精发酵过程产生的主要高级醇,进行诱变菌株ARTP5与原始菌株CF4发酵产乙醇、正丙醇、异丁醇、异戊醇性能的比较。如图2所示,诱变菌株ARTP5正丙醇、异丁醇、异戊醇产量在发酵结束时分别是7.27、14.14和44.99 mg/L,分别比原始菌株CF4降低了20%、19.4%和21.5%,并且乙醇产量升高了4.4%,这说明诱变菌株ARTP5是一株发酵性能优良的酿酒酵母。
|
| 图 2 诱变菌株ARTP5与原始菌株CF4正丙醇、异丁醇和异戊醇产量 Figure 2 Producion of propanol, isobutanol andisoamylol by the mutant strain ARTP5 and the origin strain CF4 |
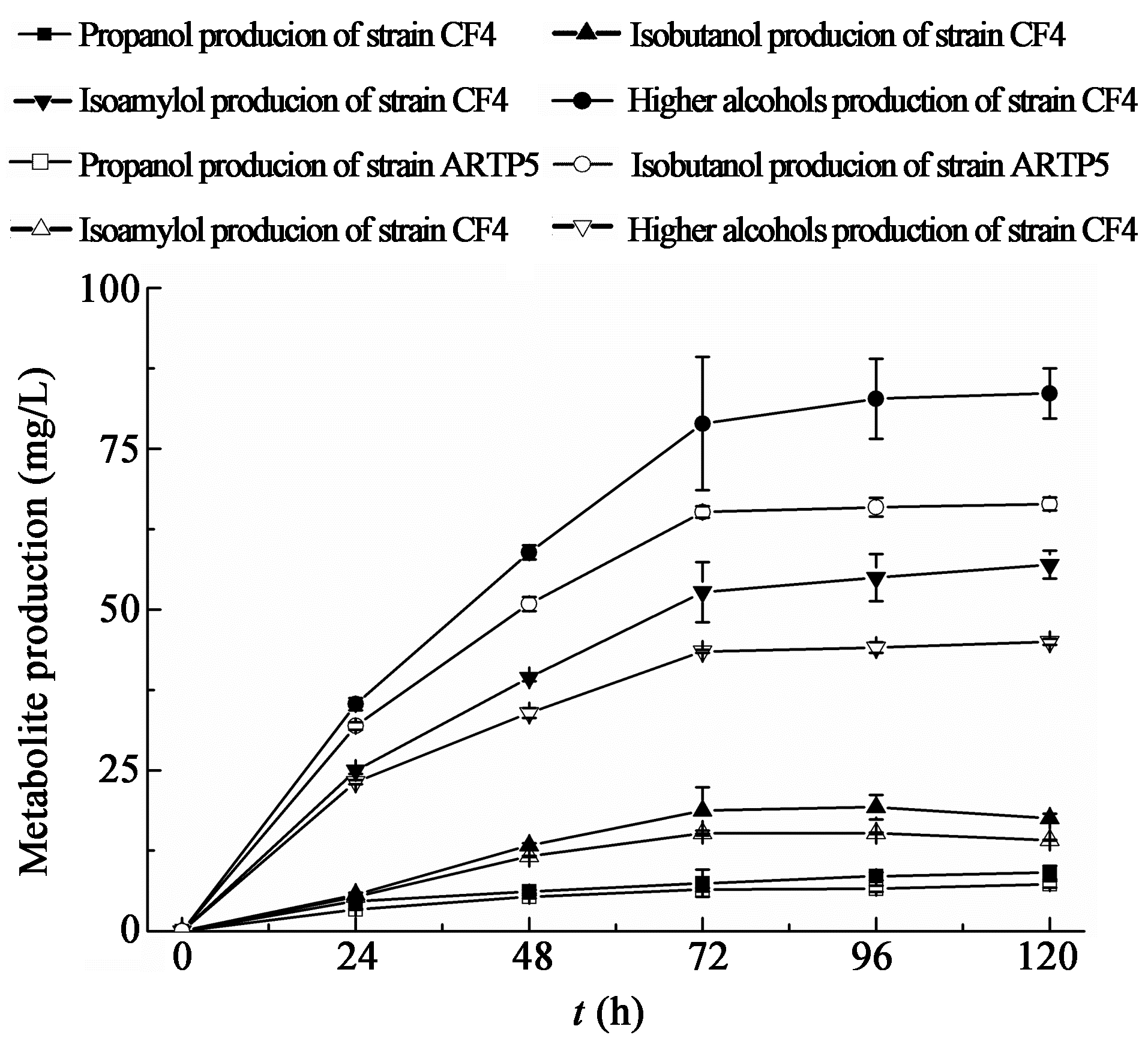
在发酵到48 h时提取诱变菌株ARTP5与原始菌株CF4的胞内蛋白,进行二维电泳分析两株酵母胞内蛋白组差异。通过比较两株酵母胞内蛋白的二维电泳图谱发现,两株酵母胞内蛋白的表达具有一定的差异,表达量差异≥2且P<0.05的蛋白共有45个(图3),其中在ARTP5菌株中表达被上调的蛋白有33个,表达被下调的有12个。
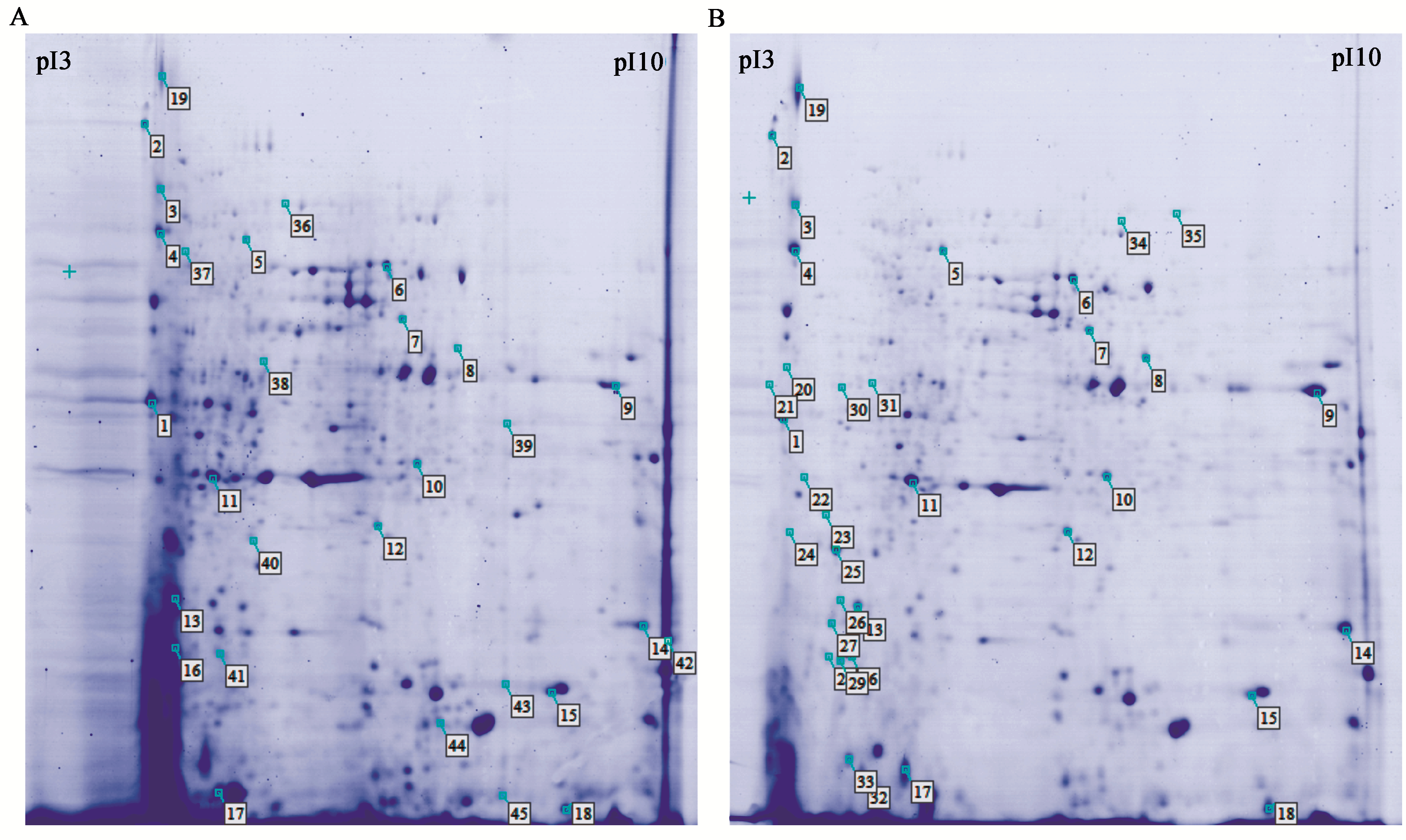
|
|
图 3
诱变菌株ARTP5和原始菌株CF4胞内蛋白的二维电泳图谱
Figure 3
2-D electrophoresis images of the mutantstrain ARTP5’s and the origin strain CF4’s intracellular proteome
注:A:原始菌株CF4;B:诱变菌株ARTP5. 原始菌株CF4与诱变菌株ARTP5表达量差异≥2的胞内蛋白用数字标出. Note: A: Theorigin strain CF4; B: The mutant strain ARTP5. The intracellular proteins whoseexpression difference is more than or equal to 2 times between the mutantstrain ARTP5 and the parent strain CF4 are marked by numbers. |
通过结合二维电泳技术结合Image Master 2D Platinum 7软件进行分析发现,诱变菌株ARTP5与原始菌株CF4表达量差异≥2的胞内蛋白(图3)共有45个,通过MALDITOF-MS质谱鉴定出27个(表1)。与原始菌株CF4相比,通过质谱鉴定出的蛋白中诱变菌株ARTP5表达上调的有20个,主要是碳源和能量代谢、胁迫反应过程、蛋白翻译和折叠过程、氨基酸代谢等途径的蛋白,而表达下调的蛋白有7个,主要是碳源和能量代谢和高级醇代谢等途径的蛋白。
| 编号 Spot number | 蛋白名称 Protein name | 简介 Description | 比值 Ratio (ARTP5/CF4) | 等电点 pI | 分子量 Mr |
| Carbohydrate and energy metabolism | |||||
| Glycolysis/Gluconeogenesis | |||||
| 8 | ENO1 | Enolase | 3.15±0.048a | 6.16 | 46 802.11 |
| 23 | ENO1 | Enolase | − a | 6.16 | 46 802.11 |
| 39 | ENO1 | Enolase | 0b | 6.16 | 46 802.11 |
| 40 | ENO1 | Enolase | 0b | 6.16 | 46 802.11 |
| 10 | TDH1 | Glyceraldehyde-3-phosphate dehydrogenase | 2.58±0.024 a | 8.59 | 35 691.90 |
| 14 | TDH1 | Glyceraldehyde-3-phosphate dehydrogenase1 | 2.89±0.032 a | 8.29 | 35 749.94 |
| 27 | TDH1 | Glyceraldehyde-3-phosphate dehydrogenase | − a | 8.59 | 35 691.90 |
| 44 | TDH3 | Glyceraldehyde-3-phosphate dehydrogenase | 0b | 6.25 | 35 733.63 |
| TCA cycle | |||||
| 31 | PdhB | Pyruvate dehydrogenase E1-beta subunit | − a | 5.21 | 40 067.67 |
| Other | |||||
| 21 | Exg1p | Glucan 1,3-beta-glucosidase I/II | − a | 4.57 | 51 310.97 |
| Stress response | |||||
| 29 | Ahp1p | Peroxiredoxin type-2 | − a | 5.01 | 19 114.67 |
| 22 | HSP26 | Heat shock protein 26 | − a | 5.31 | 23 909.71 |
| 25 | HSP26 | Heat shock protein 26 | − a | 5.31 | 23 909.71 |
| 26 | HSP26 | Heat shock protein 26 | − a | 5.31 | 23 909.71 |
| 28 | Hsp26p | Heat shock protein 26 | − a | 5.31 | 23 909.71 |
| Protein translation and folding | |||||
| 17 | FPR1 | FK506-binding protein 1 | 3.9±0.075 a | 5.72 | 12 157.87 |
| 35 | AaceriAFL200Wp | Sequence-specific DNA binding RNA polymerase II transcription factor activity | − a | 5.82 | 69 068.56 |
| 24 | Prefoldin dubunit 5, putative | Protein folding | − a | 8.84 | 17 691.33 |
| Amino acids metabolism | |||||
| 5 | GDH1 | NADP-specific glutamate dehydrogenase 1 | 3.52±0.053 a | 5.68 | 49 552.02 |
| 7 | ILV5 | Ketol-acid reductoisomerase | 2.06±0.018 a | 9.10 | 44 368.46 |
| Higher alcohol metabolism | |||||
| 38 | ADH1 | Alcohol dehydrogenase 1 | 0b | 6.21 | 36 849.17 |
| 41 | ADH1 | Alcohol dehydrogenase 1 | 0b | 6.21 | 36 849.17 |
| 37 | ADH1 | Alcohol dehydrogenase 1 | 0b | 6.21 | 36 849.17 |
| Other | |||||
| 19 | PHO3 | Constitutive acid phosphatase | 2.9±0.073 a | 4.52 | 52 777.77 |
| 20 | CLC1 | Clathrin light chain | − a | 4.31 | 25 472.30 |
| 33 | BMH2 | − a | 4.82 | 31 167.51 | |
| 42 | Hypothetical protein, conserved | 0b | 8.42 | 90 786.70 | |
Note: a: Up-regulatedproteins; b: Down-regulated proteins. 0: There wasexpression of the protein in the strain CF4, with no expression in the strainARTP5; −: There was expression of the protein in the strain ARTP5,with no expression in the strain CF4. P-value of every protein in thetable is not higher than 0.05, it was considered to guarantee high statistical confidenceof differential expression.
与原始菌株CF4相比,诱变菌株ARTP5碳源和能量代谢途径的蛋白表达发生了很大的变化,有7个胞内蛋白(2个ENO1异构体、3个TDH1异构体、PdhB、Exg1p)表达被上调。有研究表明烯醇酶(Enolase)对糖酵解和糖异生途径的代谢流有促进作用,并且不同的enolase异构体具有不同的动力学特性[17]。TDH1蛋白是糖酵解途径的甘油醛-3-磷酸脱氢酶,是糖酵解途径的一个关键酶,3个TDH1异构体的表达上调促进了糖酵解代谢,为细胞应对诱变提供充足能量和合成相关代谢物提供前体。PdhB蛋白是TCA循环中的丙酮酸脱氢酶的亚基,而丙酮酸脱氢酶是TCA循环的限速酶,它的表达上调有助于为ARTP5菌株合成应对诱变相关蛋白提供能量。Exg1p蛋白是葡聚糖酶,与细胞壁水解有关。诱变菌株ARTP5胁迫途径有5个蛋白(Ahp1p、3个HSP26异构体、Hsp26p)表达上调,与抗氧化相关的Ahp1p蛋白与热激蛋白的表达上调有助于ARTP5菌株细胞修复诱变造成的损伤。诱变菌株ARTP5与原始菌株CF4翻译和折叠途径的差异胞内蛋白(FPR1、AaceriAFL200Wp、Prefoldindubunit 5,putative)均被上调,其中FPR1蛋白参与蛋白折叠过程的顺反异构化,AaceriAFL200Wp蛋白参与转录过程,还有一个蛋白(Prefoldindubunit 5,putative)与蛋白折叠有关,这些蛋白表达的上调可能与合成应对诱变相关蛋白有关。氨基酸代谢与高级醇代谢息息相关,与原始菌株CF4相比,诱变菌株ARTP5氨基酸代谢途径中有2个蛋白(GDH、ILV5)表达上调,GDH1蛋白催化谷氨酸发生转氨反应,它的表达上调促进了氨基酸的代谢,而ILV5蛋白作为支链氨基酸合成途径中的酶,对高级醇的合成可能有重要影响。诱变菌株ARTP5还有3个胞内蛋白(PHO3、CLC1、BMH2)表达被上调,PHO3蛋白参与含磷化合物的代谢过程,CLC1蛋白是细胞内膜的重要组分,BMH2蛋白在酵母芽孢形成过程发挥重要作用。
与原始菌株CF4相比,诱变菌株ARTP5碳源和能量代谢中有3个胞内蛋白(2个ENO1异构体、TDH3)表达被下调。奇怪的是enolase的不同异构体2个被上调,2个被下调,有研究发现enolase不同异构体表达上的调控可以调节糖酵解的代谢流[17],而ARTP5菌株enolase的不同异构体也有可能是调节糖酵解的代谢流的缘故,从而为应对诱变提高能量和代谢中间体。文献[18]报道TDH1蛋白只有在稳定期和热激的情况下才表达,而TDH2蛋白在热激情况下表达被抑制,这说明蛋白TDH1和TDH3在ARTP5菌株表达分别上调和下调很可能是因为诱变胁迫所导致的。高级醇代谢途径中的ADH1蛋白在诱变菌株ARTP5中表达被下调,而ADH1蛋白是催化醛合成对应醇的醇脱氢酶,它的表达下调与诱变菌株ARTP5高级醇产量的降低可能有很大的关联。诱变菌株ARTP5还有1个功能未知的胞内蛋白(Hypotheticalprotein,conserved)表达被下调。
2.4 基于诱变菌株ARTP5与原始菌株CF4胞内蛋白组差异的高级醇合成相关蛋白分析高级醇的合成途径主要为氨基酸分解代谢途径(Ehrlich途径)[3,4]和糖代谢合成途径[5,6],氨基酸分解代谢途径是指支链氨基酸通过转氨作用合成α-酮酸,然后再合成相应高级醇,而糖代谢合成途径是指通过葡萄糖经糖酵解分解合成丙酮酸后合成α-酮酸,或通过中间产物合成α-酮酸,然后再合成相应的高级醇。
支链氨基酸代谢与高级醇代谢紧密相关,在Ehrlich途径中支链氨基酸与高级醇可以相互转化,而ILV5蛋白是丙酮酸合成α-酮酸途径中的酮酸还原异构酶(Keto-acidreductoisomerase,图4),因此ILV5蛋白很可能对氨基酸合成和高级醇合成具有重要影响。ILV5蛋白对高级醇合成的作用还未明确,有研究发现啤酒酵母ILV5基因的过表达会提高正丙醇、异丁醇和异戊醇3种高级醇的产量[19],但有研究表明巴斯德酵母ILV5基因过表达并未对正丙醇、异丁醇、异戊醇、活性戊醇产量造成明显影响[20],还有学者进行了酿酒酵母ILV5与ILV2、ILV3等基因同时过表达对高级醇合成影响的研究[21],结果发现这些基因共同过表达提高了异丁醇的含量,因此ILV5蛋白的表达有可能对高级醇的合成有促进作用。ILV5蛋白在诱变菌株ARTP5中表达量是原始菌株CF4的2.06倍,ARTP5菌株ILV5蛋白表达上调有可能对其高级醇的合成有促进作用,进一步关于ILV5蛋白的研究有助于对ARTP菌株高级醇的控制以及揭示其ILV5蛋白对高级醇合成影响以及高级醇的调控。

|
| 图 4 酿酒酵母高级醇和支链氨基酸合成途径[20, 23] Figure 4 The biosynthetic pathway of higher alcoholsand branched chain amino acid in S. cerevisiae[20, 23] Note: Dashed arrowsare used when one or more intermediates or reactions are omitted. Dash-dotarrows are used to indicate the proteins catalyze corresponding reactions. KB:α-Ketobutyrate; AHB: α-Aceto-α-hydroxybutyrate; DHMV: α,β-Dihydroxy-β-methylvalerate;KMV: α-Keto-β-methylvalerate; AL: α-Acetolactate; DHIV: α,β-Dihydroxy-isovalerate;KIV: α-Keto-isovalerate; RI: α-Acetohydroxyacid reductoisomerase. |
高级醇代谢途径中的ADH1蛋白是催化醛合成对应醇的醇脱氢酶(图4),醇脱氢酶在醇的合成中扮演重要的角色,ADH1蛋白不仅是催化乙醛合成乙醇反应的主要酶,并且在高级醇合成途径中同样发挥重要作用,有研究表明蛋白ADH1、ADH2、ADH3、ADH4、ADH5和SFA1都可以完成高级醇合成途径中醛向醇的转化[22],并且通过敲除发现ADH3基因对高级醇合成的贡献要比ADH1基因大[11]。与原始菌株CF4相比,诱变菌株ARTP5的ADH1蛋白表达被下调,这很可能是ARTP5菌株高级醇产量降低的主要原因之一,ADH1蛋白对高级醇合成的影响有待进一步研究。
3 结论高级醇作为白酒微量香气成分的重要组成部分对白酒品质具有重要贡献,但是高级醇含量过高会严重影响白酒口感,并且高级醇含量过高对人体有一定毒害作用[1]。然而白酒中的高级醇主要是在酒精发酵过程由酵母产生的[2],酿酒酵母高级醇合成相关蛋白的研究对于酿酒酵母高级醇合成机制的认识以及白酒生产过程高级醇产量的控制具有重要意义。本文通过从蛋白组学水平比较诱变得到的低产高级醇酵母ARTP5与原始菌株CF4的胞内蛋白组差异,通过分析差异表达的胞内蛋白与高级醇合成的相关性寻找高级醇合成相关蛋白。研究发现,由于ARTP5菌株是由原始菌株CF4诱变得到的,ARTP5菌株糖酵解、TCA循环、胁迫反应、蛋白折叠和翻译、氨基酸代谢途径的部分蛋白的表达上调,这可能与细胞应对诱变所造成的过氧化胁迫等损伤进行的代谢调控有关。此外,诱变菌株ARTP5支链氨基酸代谢合成途径的ILV5蛋白表达上调,高级醇合成途径中的ADH1蛋白表达下调。ADH1蛋白参与催化醛合成对应高级醇的反应,有研究表明ADH1基因的敲除会降低高级醇的产量[11],因此ADH1蛋白表达下调很可能是诱变菌株ARTP5高级醇产量降低的主要原因。支链氨基酸代谢与高级醇代谢紧密相关,在Ehrlich途径中支链氨基酸可以通过转氨作用合成高级醇,蛋白ILV5催化的反应是丙酮酸合成支链氨基酸途径和丙酮酸合成高级醇途径所共有的,因此ILV5蛋白很可能对高级醇合成有重要作用,研究发现ILV5蛋白对高级醇合成可能有促进作用[19,21],ARTP5菌株ILV5蛋白表达上调与其高级醇降低是否有关有待进一步研究,进一步关于ILV5基因的研究有助于揭示其对高级醇合成影响以及高级醇的调控。这种通过蛋白组学方法分析高级醇合成相关蛋白对于代谢物合成机制的研究有重要的指导意义,进一步关于ILV5蛋白和ADH1蛋白对高级醇合成的影响的研究有助于推进酿酒酵母高级醇合成相关蛋白的研究、酿酒酵母高级醇合成代谢调控机制的认识以及白酒酿造过程对高级醇的控制。
| [1] | Zhang YT, Liu Q, Wang ZM. Simple discussion of fusel oil[J]. Liquor Making, 2002, 29(5): 18-20 (in Chinese)张跃廷, 刘琼, 王佐民. 浅淡杂醇油[J]. 酿酒, 2002, 29(5): 18-20 |
| [2] | Ding XQ. Views on the content of fusel oil in liquor[J]. Liquor-Making Science & Technology, 1983(1): 9-14 (in Chinese)丁祥庆. 对白酒中杂醇油含量的看法[J]. 酿酒科技, 1983(1): 9-14 |
| [3] | Sentheshanmuganathan S. The formation of tyrosol (2-p-hydroxyethanol) from tyrosine by Saccharomyces cerevisiae[J]. Biochemical Journal, 1956, 64: 37-38 |
| [4] | Sentheshanmuganathan S. The mechanism of formation of higher alcohols from amino acids by Saccharomyces cerevisiae[J]. Biochemical Journal, 1960, 74(3): 568-576 |
| [5] | Ough CS, Guymon JF, Crowell EA. Formation of higher alcohols during grape juice fermentations at various temperatures[J]. Journal of Food Science, 1966, 31(4): 620-625 |
| [6] | Giudici P, Romano P, Zambonelli C. A biometric study of higher alcohol production in Saccharomyces cerevisiae[J]. Canadian Journal of Microbiology, 1990, 36(1): 61-64 |
| [7] | Yoshimoto H, Fukushige T, Yonezawa T, et al. Genetic and physiological analysis of branched-chain alcohols and isoamyl acetate production in Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2002, 59(4/5): 501-508 |
| [8] | Verstrepen KJ, Moonjai N, Derdelinckx G, et al. Genetic regulation of ester synthesis in yeast: new Facts, insights and implications for the brewer[A]//Smart K. Brewing Yeast Fermentation Performance[M]. 2nd Editon. Oxford: Blackwell Science, 2003: 234-248 |
| [9] | Lilly M, Bauer FF, Lambrechts MG, et al. The effect of increased yeast alcohol acetyltransferase and esterase activity on the flavour profiles of wine and distillates[J]. Yeast, 2006, 23(9): 641-659 |
| [10] | Lilly M, Bauer FF, Styger G, et al. The effect of increased branched-chain amino acid transaminase activity in yeast on the production of higher alcohols and on the flavour profiles of wine and distillates[J]. FEMS Yeast Research, 2006, 6(5): 726-743 |
| [11] | Styger G, Jacobson D, Bauer FF, et al. Identifying genes that impact on aroma profiles produced by Saccharomyces cerevisiae and the production of higher alcohols[J]. Applied Microbiology and Biotechnology, 2011, 91(3): 713-730 |
| [12] | Styger G, Jacobson D, Prior BA, et al. Genetic analysis of the metabolic pathways responsible for aroma metabolite production by Saccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 2012, 97(10): 4429-4442 |
| [13] | Zhang JW, Zhang CY, Dai LH, et al. Effects of overexpression of the alcohol acetyltransferase-encoding gene ATF1 and disruption of the esterase-encoding gene IAH1 on the flavour profiles of Chinese yellow rice wine[J]. International Journal of Food Science & Technology, 2012, 47(12): 2590-2596 |
| [14] | Zhang CY, Liu YL, Qi YN, et al. Increased esters and decreased higher alcohols production by engineered brewer’s yeast strains[J]. European Food Research and Technology, 2013, 236(6): 1009-1014 |
| [15] | Chen LQ, Wu Q, Xu Y. Characteristics of low fusel alcohol yielded by Schizosaccharomyces pombe in Maotai-flavor liquor-making[J]. Industrial Microbiology, 2013, 43(3): 1-6 (in Chinese)陈良强, 吴群, 徐岩. 酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J]. 工业微生物, 2013, 43(3): 1-6 |
| [16] | Yao JB, Zu GR, Piao YZ, et al. Proteomic analysis of cell wall proteins from Saccharomyces cerevisiae with different generation numbers[J]. Microbiology China, 2013, 40(11): 1962-1969 (in Chinese)姚继兵, 祖国仁, 朴永哲, 等. 不同传代次数的酿酒酵母细胞壁蛋白组学分析[J]. 微生物学通报, 2013, 40(11): 1962-1969 |
| [17] | Avilán L, Gualdrón-López M, Qui?ones W, et al. Enolase: a key player in the metabolism and a probable virulence factor of trypanosomatid parasites-perspectives for its use as a therapeutic target[J]. Enzyme Research, 2011, 2011: Article ID 932549 |
| [18] | Boucherie H, Bataille N, Fitch IT, et al. Differential synthesis of glyceraldehyde-3-phosphate dehydrogenase polypeptides in stressed yeast cells[J]. FEMS Microbiology Letters, 1995, 125(2/3): 127-133 |
| [19] | Lu J, Dong J, Wu DG, et al. Construction of recombinant industrial brewer’s yeast with lower diacetyl production and proteinase A activity[J]. European Food Research and Technology, 2012, 235(5): 951-961 |
| [20] | Kusunoki K, Ogata T. Construction of self-cloning bottom-fermenting yeast with low vicinal diketone production by the homo-integration of ILV5[J]. Yeast, 2012, 29(10): 435-442 |
| [21] | Park SH, Kim S, Hahn JS. Metabolic engineering of Saccharomyces cerevisiae for the production of isobutanol and 3-methyl-1-butanol[J]. Applied Microbiology and Biotechnology, 2014, 98(21): 9139-9147 |
| [22] | Dickinson JR, Salgado LEJ, Hewlins MJE. The catabolism of amino acids to long chain and complex alcohols in Saccharomyces cerevisiae[J]. Journal of Biological Chemistry, 2003, 278(10): 8028-8034 |
| [23] | Rossouw D, Naes T, Bauer FF. Linking gene regulation and the exo-metabolome: a comparative transcriptomics approach to identify genes that impact on the production of volatile aroma compounds in yeast[J]. BMC Genomics, 2008, 9: 530 |
 2015, Vol. 42
2015, Vol. 42