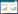扩展功能
文章信息
- 曾大兴, 张晓阳, 贾书娟, 喇文军, 涂国全
- ZENG Da-Xing, ZHANG Xiao-Yang, JIA Shu-Juan, LA Wen-Jun, TU Guo-Quan
- 枯草芽孢杆菌 C-D6 对辣椒炭疽菌附着胞形成的抑制作用研究
- Bacillus subtilis C-D6 as a potential biocontrol agent against appressorium formation of Colletotrichum capsici
- 微生物学通报, 2015, 42(12): 2377-2385
- Microbiology China, 2015, 42(12): 2377-2385
- 10.13344/j.microbiol.china.150203
-
文章历史
- 收稿日期: 2015-03-12
- 接受日期: 2015-06-10
- 优先数字出版日期(www.cnki.net): 2015-06-24
2. 江西农业大学 生物科学与工程学院 江西 南昌 330045
2. College of Bioscience and Bioengineering, Jiangxi Agricultural University, Nanchang, Jiangxi 330045, China
炭疽菌属(Colletotrichum Corda)真菌引起的植物炭疽病,分布广泛、危害严重[1]。辣椒炭疽菌(Colletotrichum capsici)是该属的重要种之一,其寄主范围广,在华南地区可危害多种蔬菜、花卉、药用植物和大田作物的果实、茎和叶,引起烂果、枯枝和叶斑等症状,对农林生产造成严重危害[1, 2]。炭疽病的防治以化学防治和选用抗病品种为主。近年来,由于规模化栽培、抗病品种退化、化学防治易产生抗药性和造成产品污染等原因,使该类病害处于较难防治的困境。因此,探索新的有效防治途径具有重要意义。
生物防治现已成为植物病害综合治理的重要内容。应用细菌、放线菌、酵母菌及其产生的抗菌物质开展炭疽病的生物防治研究取得了一些明显的进展[3, 4, 5]。枯草芽孢杆菌(Bacillus subtilis)因产生多种多样的抗菌物质,且具有易培养、所制备的菌剂抗逆性强,易保存等特点,已在病害生防上得到广泛应用[6, 7]。芽孢杆菌应用于炭疽病的生物防治也有少量报道[8, 9, 10, 11]。然而,Yakoby等认为搜寻应用于潜伏侵染病原的生防因子存在很大困难,因为穿透植物角质层的侵染菌丝会受到保护而避免生防因子发挥作用[12]。因此,潜伏侵染的炭疽病的生防研究报道较少,其传统的生物防治策略存在明显局限。
随着生物防治研究的深入发展,寻找新的病害防治靶标成为创新病害防治策略和方法的重要途径。病原菌与寄主植物需经历复杂的相互作用过程才能侵入寄主,炭疽菌的侵入过程中存在复杂的信号传导关系,其侵入结构——附着胞的形成由来自植物表面的物理和(或)化学信号的识别而触发[13]。如能阻断信号识别和传导过程,将可阻止附着胞的形成和病害的发展。Kim等的研究证实在大肠杆菌内表达的辣椒酯酶能抑制胶孢炭疽菌(C. gloeosporioides)和稻瘟病菌(Magnaporthe grisea)附着胞的形成,从而控制病害的发生[14]。从真菌中也发现了多种抑制炭疽菌附着胞形成的次生代谢产物,这些活性物质可有效地阻断病害的侵入过程,对发展新型杀菌剂具有重要意义[15]。然而,这一重要研究领域的文献报道较少。
从枯草芽孢杆菌分离抑制辣椒炭疽菌附着胞形成的抗菌肽或次生代谢物用于该菌引起的炭疽病的生物防治研究未见报道。我们发现枯草芽孢杆菌C-D6产生的蛋白类物质对抑制辣椒炭疽菌的附着胞形成具有明显的效果,该类蛋白对潜伏侵染的炭疽病防治具有重要意义。本文报道菌株C-D6对辣椒炭疽菌的抗菌活性、C-D6产生活性物质的培养基筛选以及活性蛋白的分离纯化及活性鉴定。
1 材料与方法 1.1 菌株枯草芽孢杆菌C-D6菌株由深圳职业技术学院应用化学与生物技术学院微生物室分离、筛选、鉴定和保存;供试病原菌:辣椒炭疽菌501由华南农业大学资源环境学院真菌室惠赠。
1.2 培养基PDA培养基(g/L):马铃薯200,葡萄糖20,琼脂20。YPD培养基(g/L):酵母膏10,蛋白胨10,葡萄糖10。LB培养基(g/L):蛋白胨10,酵母膏5,NaCl 5。LBP培养基(g/L):蛋白胨10,酵母膏5,NaCl 5,K2HPO4 1。LBG培养基(g/L):蛋白胨10,酵母膏5,葡萄糖5,NaCl 5。LBY培养基(g/L):蛋白胨10,酵母膏10,NaCl 5。LBYP培养基(g/L):蛋白胨10,酵母膏10,NaCl 5,K2HPO4 1。NA培养基(g/L):牛肉膏3,蛋白胨10,NaCl 5。NBP培养基(g/L):牛肉膏5,蛋白胨10,NaCl 5,K2HPO4 1。PDA培养基pH天然,其余培养基pH为7.0−7.2。
1.3 C-D6对辣椒炭疽菌的拮抗作用测定采用平板对峙培养法进行测定:辣椒炭疽菌在PDA平板上25 °C培养7 d,从菌落边缘取直径为6.5 mm的圆形小菌块接到PDA平板中央,在其对称三边等距(2.5 cm)对称接入活化培养的拮抗细菌C-D6,25 °C恒温培养7 d,测定其抑菌率。抑菌率=(对照菌落半径−处理菌落半径)/对照菌落半径×100%。每种处理3次重复。
1.4 C-D6培养及培养液的抑菌活性测定菌株C-D6的培养及培养液的抑菌活性测定参照文献[16]的方法进行,并稍加修改。将已斜面活化的C-D6菌株接种到YPD或NA、NBP等液体培养基中(50 mL/250 mL),37 °C、180 r/min振荡培养过夜,按1%的接种量接种到相同培养瓶中,相同条件下振荡培养48 h。培养液在低温(4 °C)下,9 000 r/min离心20 min去除菌体,上清液经过滤除菌获得无菌培养液。
菌株C-D6培养液对辣椒炭疽菌生长的影响用牛津杯法测定。方法同1.3的抗菌作用测定,仅在接种细菌处放置牛津杯,每个牛津杯中加入200 μL无菌培养液。
采用载片培养法测定细菌培养液对辣椒炭疽菌孢子萌发和附着胞形成的影响。将20 μL病原菌孢子悬液(1×105孢子/mL)与等量的细菌培养液混合滴加在无菌载玻片上,25 °C保湿培养12 h后,显微观察培养液对孢子萌发、附着胞形成和菌丝生长的影响。以对应培养基为对照。
1.5 抑制附着胞形成的活性蛋白分离纯化C-D6蛋白粗提液的(NH4)2SO4分级盐析制备及20%沉淀蛋白的Sephadex G-75凝胶柱层析粗分离参照文献[16]的方法进行。
通过阴离子交换层析Q-Sepharose Fast Flow对粗分离获得的活性组分进行进一步纯化。采用 AKTA蛋白纯化系统,以Q-Sepharose Fast Flow阴离子交换树脂柱为分离柱,柱长20 cm,柱高与直径之比为20:1,上样量为2 mL,流动相A为10 mmol/L pH 7.4的磷酸缓冲溶液,流动相B为1 mol/L NaCl洗脱液(含流动相A);采用线性梯度洗脱,洗脱速度为1 mL/min,先用A液洗脱30 min,待柱平衡后改用B液洗脱,并将梯度调整为100%,一直洗脱至基线平衡。280 nm紫外吸收检测,手动按峰收集纯化产物。
纯化蛋白经抗菌活性检测后,采用聚丙烯酰胺凝胶电泳(SDS-PAGE)进行纯度检测和分子量测定。SDS-PAGE分离胶浓度为12%。
采用高效液相色谱(HPLC)检测各级分离的活性蛋白纯度。色谱仪为Agilent 1200 HPLC,色谱柱为Agilent C3柱(4.6 mm×180 mm),流动相为含0.09% TFA的70%乙腈,流速1 mL/min,进样量20 μl,柱温4 °C,280 nm波长检测。
抑制附着胞形成活性蛋白的生物测定参见1.4的载片培养法,蛋白溶液用量为每处理20 μl。
1.6 数据处理用SPSS 11.0软件进行数据处理;用该软件的One-Way ANOVA进行方差分析,LSD法检验数据的差异显著性。
2 结果与分析 2.1 菌株C-D6对辣椒炭疽菌的拮抗作用用平板对峙培养法测定了菌株C-D6对辣椒炭疽菌501的拮抗效果。结果表明:菌株C-D6对辣椒炭疽菌有明显的拮抗作用,能显著抑制辣椒炭疽菌的生长,其抑菌率高达61.54% (图 1)。载片培养的结果显示:菌株C-D6培养48 h的YPD培养液能完全抑制辣椒炭疽菌的附着胞形成。

|
|
图 1
枯草芽孢杆菌C-D6对辣椒炭疽菌生长的抑制作用
Fig.1
Antifungal activity of antagonist C-D6 against C. capsici on PDA plates
注:A:C-D6对辣椒炭疽菌生长的抑制;B:对照菌落.
Note: A: Colony of C.capsici treated with the strain C-D6; B: Colony of C. capsici (CK). |
选用LB培养基、牛肉膏蛋白胨培养基和YPD培养基等8种培养基,进行C-D6产生抑菌活性物质的培养基筛选,平板对峙培养的测定结果见表 1。结果表明:C-D6菌株48 h摇瓶培养的YPD培养液的抑菌率最高,达到58.14%,LB培养液和NA培养液的抑菌率分别为33.19%和23.63%,其抑菌效果明显不如YPD培养液,LBP培养液和NBP培养液的抑菌率分别为49.62%和33.47%,其抑菌效果明显高于LB培养液和NA培养液,这一结果说明在LB培养基和牛肉膏蛋白胨培养基中添加1 g/L K2HPO4可明显促进C-D6菌株产生抗菌物质。
| (平均值±标准误) | |
| ( x±s) | |
| 培养基 Medium | 抑菌率 Inhibitory rate (%) |
| YPD | 58.14±0.28 a |
| LB | 33.19±0.54 d |
| LBP | 49.62±1.69 b |
| LBPY | 34.87±0.31 c |
| LBG | 15.83±0.96 f |
| LBY | 24.59±0.80 e |
| NA | 23.63±0.61 e |
| NBP | 33.47±1.38 cd |
Note: Values of each column followed by different letters are significantly different (p<0.05).
采用载片培养法测定了8种培养基及其细菌培养液对辣椒炭疽菌孢子萌发和附着胞形成的影响。结果表明:YPD培养基不影响辣椒炭疽菌的孢子萌发,在该培养基中25 °C培养12 h后,孢子萌发率高达96%−100%,而其余7种培养基对辣椒炭疽菌的孢子萌发都有显著的抑制作用,在这些培养基中孢子不萌发或萌发率很低(低于30%)。菌株C-D6的YPD培养液能完全抑制辣椒炭疽菌的附着胞形成。由于孢子在其余7种培养基中不萌发或萌发率很低,未测定这些培养基的细菌培养液对附着胞形成的影响。
YPD培养基不仅最适于抗菌活性物质的产生,而且对炭疽菌的孢子萌发没有影响,有利于通过载片培养直接测定培养液中抑制附着胞形成的活性物质的产生情况。这些结果说明:YPD培养基为培养C-D6提取活性抗菌物质的最适培养基。
2.3 培养时间对C-D6产生抗菌活性物质的影响用载片培养法测定了不同培养时间的YPD培养液对辣椒炭疽菌孢子萌发和附着胞形成的影响,结果见图 2。结果显示:25 °C、180 r/min摇瓶培养8 h后,菌株C-D6开始产生抗菌活性物质,所产生的抗性活性物质不抑制附着胞的形成,但能使部分附着胞膨大,形成膨大、色浅的无效附着胞,培养至14 h,所产生的活性物质能完全抑制附着胞形成,并在菌丝前端形成膨大的球形结构,培养24 h后,培养液使部分菌丝形成厚壁的串珠状膨大,此后至48 h的培养液对菌丝形态没有明显影响,但随着培养时间的延长,抑制菌丝生长的作用明显加强,培养60 h后,培养液开始明显抑制孢子萌发,并进一步抑制菌丝生长。
|
| 图 2 不同时间的YPD培养液对辣椒炭疽菌孢子萌发和附着胞形成的影响 Fig.2 Effect of C-D6 culture filtrates of YPD media from different culture time on spore germination and appressorium formation of C. capsici |
采用(NH4)2SO4分级盐析法,制备0−20%、20%−30%、30%−40%和40%−70%饱和度的盐析蛋白组分。载片培养的结果显示:0−20%饱和度的盐析蛋白粗提液能够强烈抑制辣椒炭疽菌的附着胞形成和芽管生长(图 3)。30%−40%和40%−70%饱和度的盐析蛋白粗提液对辣椒炭疽菌附着胞形成和芽管生长也有部分抑制活性,而20%−30%饱和度的盐析蛋白粗提液未检测到活性存在。所以可以确定分离抑制辣椒炭疽病附着胞形成的活性蛋白组分的硫酸铵盐析最适饱和度为20%。

|
|
图 3
20%饱和度硫酸铵盐析粗蛋白对辣椒炭疽菌附着胞形成的抑制作用
Fig.3
Effect of crude protein obtained from 20% ammonium sulfate precipitation on appressorium formation of C. capsici
注:A:在YPD培养基中形成附着胞(对照);B:在盐析粗蛋白中附着胞形成被抑制.
Note: A: Appressorium formation in YPD medium (CK); B: Appressorium formation was inhibited in crude protein extract. |
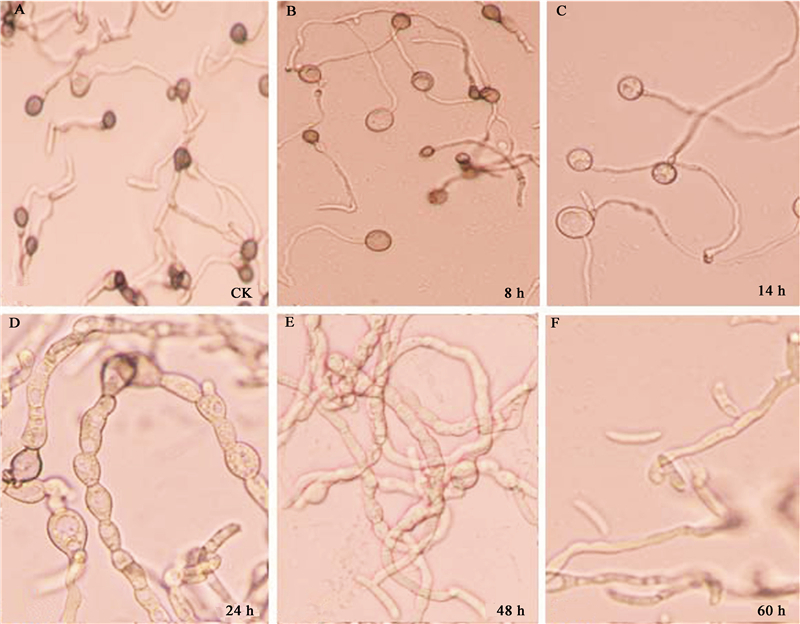
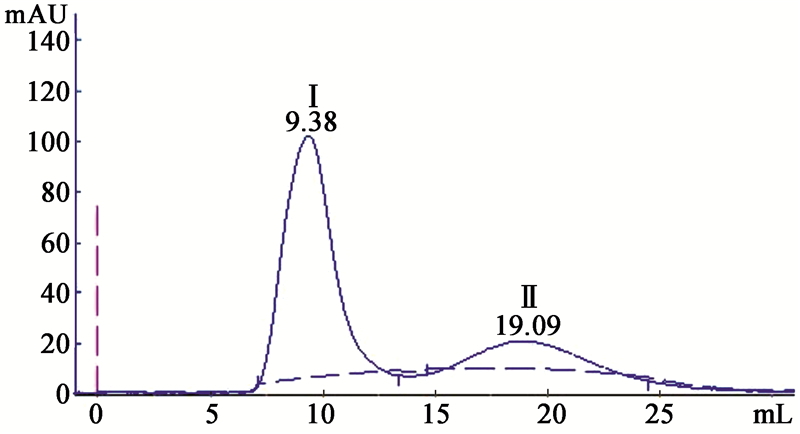
采用Sephadex G-75层析,将盐析后、透析除盐得到的20%饱和度盐析蛋白粗提液,用AKTA蛋白分离纯化系统进行分离纯化,洗脱结果如图 4所示。结果显示:20%饱和度盐析蛋白粗提液经Sephadex G-75柱层析分离,共出现2个峰,收集后标记为组分Ⅰ和组分Ⅱ。载片培养检测收集液的生物活性:组分Ⅰ对辣椒炭疽菌的附着胞形成的抑制作用与过柱前的效果一致,组分Ⅱ无效果。 采用Q-Sepharose Fast Flow阴离子交换层析对活性组分Ⅰ进行进一步纯化。结果见图 5。结果显示:从上样至洗脱完成共出现3个峰,其中峰Ⅰ为死体积峰,即鬼峰,峰Ⅱ和峰Ⅲ为1 mol/L NaCl洗脱峰。收集后分别标记为组分ⅰ、组分ⅱ和组分ⅲ。生物活性检测显示:组分ⅰ和组分ⅲ无活性,组分ⅱ能抑制附着胞形成,但抑制活性有所改变,表现为在芽管前端形成比正常附着胞大很多倍的球形结构,类似于C-D6 14 h培养液对附着胞形成的影响(图 2)。结果表明组分ⅱ是纯化的目的峰。分离过程所引起的抑制活性改变有待进一步研究。
|
| 图 4 20%饱和度硫酸铵盐析蛋白粗提液的Sephadex G-75柱层析分离图谱 Fig.4 Elution profile of crude protein obtained from 20% ammonium sulfate precipitation by Sephadex G-75 chromatography |
|
| 图 5 Sephadex G-75层析分离的活性蛋白的阴离子交换层析图谱 Fig.5 Elution profile of activated protein obtained from Sephadex G-75 chromatography by Q-Sepharose Fast Flow chromatography |
采用SDS-PAGE凝胶电泳检测20%饱和度盐析蛋白组分和经Sephadex G-75层析分离的活性组分I的纯度和分子量大小。结果如图 6所示。由图 6可知,20%饱和度盐析蛋白初提液的成分复杂,在40、32和31 kD附近均出现明显的蛋白条带,该蛋白粗提液经Sephadex G-75柱分离后,其活性组分I仅显示一条明显的蛋白带,分子量约为32 kD。这一结果表明:此分离过程去除了大部分杂蛋白,活性成分得到有效纯化。

|
|
图 6
不同纯化方法获得的活性蛋白的SDS-PAGE电泳图谱
Fig.6
SDS-PAGE electrophoretogram of activated protein obtained from different purification methods
注:M:标准蛋白分子量标记;1:20%饱和度硫酸铵盐析粗蛋白;2:Sephadex G-75层析分离的活性蛋白.
Note: M: Standard protein marker; 1: Crude protein by 20% ammonium sulfate precipitation;2: Activated protein by Sephadex G-75 chromatography. |
采用高效液相色谱(HPLC)检测20%饱和度硫酸铵盐析粗蛋白、Sephadex G-75层析分离的活性组分Ⅰ和Q-Sepharose Fast Flow阴离子交换层析分离的活性组分ⅱ,结果见图 7。结果表明:20%饱和度硫酸铵盐析蛋白成分复杂,在HPLC图谱上共显示14个分离峰,有待进一步纯化。活性粗蛋白经Sephadex G-75层析分离获得活性组分Ⅰ,在SDS-PAGE凝胶电泳图谱上仅有一条带,电泳检测结果显示成分较为单一,但经HPLC检测发现:该组分至少包含两种以上蛋白组分,仍需进一步纯化。活性蛋白经过Q-Sepharose Fast Flow阴离子交换柱层析纯化后获得的活性组分ⅱ,在HPLC图谱上显示单一峰,表明其组分单一。
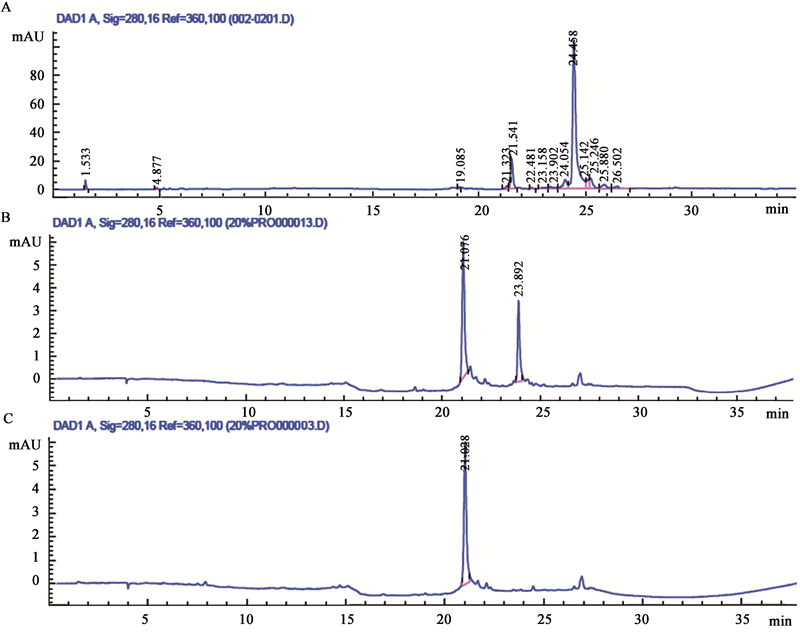
|
|
图 7
不同纯化方法获得的活性蛋白的HPLC图谱
Fig.7
HPLC chromatogram of activated protein obtained from different purification methods
注:A:20%饱和度硫酸铵盐析粗蛋白;B:Sephadex G-75层析分离的活性蛋白;C:阴离子交换层析分离的活性蛋白.
Note: A: Crude protein by 20% ammonium sulfate precipitation; B: Activated protein by Sephadex G-75 chromatography; C: Activated protein by Q-Sepharose Fast Flow chromatography. |
通过上述工作,建立了从C-D6菌株分离抑制辣椒炭疽菌附着胞形成的活性蛋白的实验方法。
3 结论在过去几十年,芽孢杆菌,尤其是枯草芽孢杆菌和解淀粉芽孢杆菌,因可产生多种脂肽类抗生素、细胞壁裂解酶和多种抗菌蛋白[7, 17, 18, 19],已广泛应用于多种重要真菌病害的生物防治。芽孢杆菌应用于炭疽病的生物防治也有少量报道[8, 9, 10, 11]。这些研究的防病机理主要集中在利用芽孢杆菌产生的各种抗生素和抗菌蛋白抑制孢子萌发、菌丝生长或直接杀死菌丝。然而,上述传统的生防途径对多种炭疽病的防治存在明显的局限,原因是炭疽病为潜伏侵染病害,其病原侵入植物后,潜伏侵染的菌丝会受到植物的保护而使生防因子不能发挥作用[12]。因此,以病菌侵入循环中的附着胞形成为靶点,筛选、分离抑制附着胞形成的细菌菌株或抗菌蛋白阻断侵入循环,从而预防病害发生的创新生防策略研究,对探索炭疽病生物防治的新途径具有重要的理论和现实意义。枯草芽孢杆菌C-D6是我们从植物根际土壤分离获得的一株抑制病原真菌附着胞形成的细菌菌株。在本研究中,C-D6菌株在PDA平板上对辣椒炭疽菌具有明显的抑制作用,其YPD培养液能完全抑制辣椒炭疽菌的附着胞形成,且抑制附着胞形成的活性物质产生时间早,作用效果稳定。这些结果表明菌株C-D6对多种炭疽病的生物防治具有潜在的应用价值。
从生防菌株分离抗菌活性物质是生防机理及应用研究的重要环节,我们曾应用硫酸铵分级沉淀和Sephadex G-75凝胶柱层析分离,从C-D6菌株的培养液中分离获得一个能抑制稻瘟病菌正常附着胞形成的抗菌蛋白[16]。本研究采用同样方法制备的抗菌蛋白对抑制辣椒炭疽菌的附着胞形成具有显著的效果。实验结果说明影响两种病原真菌附着胞形成的活性蛋白是一致的。但该活性蛋白对两种病原真菌附着胞形成的影响存在明显的差别,该蛋白不抑制稻瘟病菌附着胞的形成,仅使其形成色浅、膨大的异常附着胞[16];对于辣椒炭疽菌,该蛋白可完全抑制其附着胞的形成。这些结果表明C-D6菌株产生的活性蛋白对抑制辣椒炭疽菌附着胞形成的作用更好。
采用Sephadex G-75凝胶柱层析分离获得的抑制附着胞形成的活性蛋白,经SDS-PAGE检测,在凝胶图谱上只有一条大小为32 kD的蛋白条带。进一步用高效液相色谱(HPLC)检测,发现该蛋白存在两种以上的蛋白成分。为此,我们在优化前期分离过程的基础上,应用阴离子交换层析对该蛋白组分进行进一步纯化,获得的活性蛋白经高效液相色谱检测,在HPLC图谱上仅有一个峰,表明成分单一。这些研究为活性蛋白鉴定及该蛋白抑制附着胞形成的作用机理研究奠定了较好的基础。近年来,从芽孢杆菌分离抗菌蛋白应用于真菌病害生防研究的报道也不少[7, 17, 18, 19, 20, 21]。但从芽孢杆菌分离抑制炭疽菌附着胞形成的抗菌蛋白的研究未见报道,进一步对该蛋白进行鉴定和作用机理研究,将可能为植物炭疽病的防治提供新的途径。
| [1] | Sutton BC. The genus Glomerella and its anamorph Colletotrichum[A]//Bailey JA, Jeger MJ. Colletotrichum: Biology, Pathology and Control[M]. Wallingford: CAB International, 1992: 1-26 |
| [2] | Zeng DX, Qi PK, Jiang ZD. Identification of the falcate Colletotrichum on vegetable using RAPD analysis[J]. Acta Phytopathologica Sinica, 2002, 32(2): 170-174 (in Chinese) 曾大兴, 戚佩坤, 姜子德. 应用 RAPD 技术快速鉴定蔬菜上的弯孢类炭疽菌[J]. 植物病理学报, 2002, 32(2): 170-174 |
| [3] | Chanchaichaovivat A, Ruenwongsa P, Panijpan B. Screening and identification of yeast strains from fruits and vegetables: potential for biological control of postharvest chilli anthracnose (Colletotrichum capsici)[J]. Biological Control, 2007, 42(3): 326-335 |
| [4] | Silimela M, Korsten L. Evaluation of pre-harvest Bacillus licheniformis sprays to control mango fruit diseases[J]. Crop Protection, 2007, 26(10): 1474-1481 |
| [5] | Tripathi M, Johri BN, Sharma A. Plant growth-promoting Pseudomonas sp. strains reduce natural occurrence of anthracnose in soybean (Glycine max L.) in central Himalayan region[J]. Current Microbiology, 2006, 52(5): 390-394 |
| [6] | Elliott ML, Des Jardin EA, Batson WE Jr, et al. Viability and stability of biological control agents on cotton and snap bean seeds[J]. Pest Management Science, 2001, 57(8): 695-706 |
| [7] | Stein T. Bacillus subtilis antibiotics: structures, syntheses and specific functions[J]. Molecular Microbiology, 2005, 56(4): 845-857 |
| [8] | He H, Cai XQ, Guan X, et al. Biological control of capsicum anthracnose by endophytic Bacillus subtilis BS-2 and BS-1[J]. Acta Phytopathologica Sinica, 2003, 33(2): 170-173 (in Chinese) 何红, 蔡学清, 关雄, 等. 辣椒内生枯草芽孢杆菌(Bacillus subtilis) BS-2和 BS-1防治辣椒炭疽病研究[J]. 植物病理学报, 2003, 33(2): 170-173 |
| [9] | Kim PI, Chung KC. Production of an antifungal protein for control of Colletotrichum lagenarium by Bacillus amyloliquefaciens MET0908[J]. FEMS Microbiology Letters, 2004, 234: 177-183 |
| [10] | Kim PI, Ryu J, Kim YH, et al. Production of biosurfactant lipopeptides iturin A, fengycin, and surfactin A from Bacillus subtilis CMB32 for control of Colletotrichum gloeosporioides[J]. Journal of Microbiology and Biotechnology, 2010, 20(1): 138-145 |
| [11] | Ryu H, Park H, Suh DS, et al. Biological control of Colletotrichum panacicola on Panax ginseng by Bacillus subtilis HK-CSM-1[J]. Journal of Ginseng Research, 2014, 38(3): 215-219 |
| [12] | Yakoby N, Zhou R, Kobiler I, et al. Development of Colletotrichum gloeosporioides restriction enzyme-mediated integration mutants as biocontrol agents against anthracnose disease in Avocado fruits[J]. Phytopathology, 2001, 91(2): 143-148 |
| [13] | Kojima K, Kikuchi T, Takano Y, et al. The mitogen-activated protein kinase gene MAF1 is essential for the early differentiation phase of appressorium formation in Colletotrichum lagenarium[J]. Molecular Plant-Microbe Interactions, 2002, 15(12): 1268-1276 |
| [14] | Kim YS, Lee HH, Ko MK, et al. Inhibition of fungal appressorium formation by pepper (Capsicum annuum) esterase[J]. Molecular Plant-Microbe Interactions, 2001, 14(1): 80-85 |
| [15] | Thines E, Anke H, Weber RWS. Fungal secondary metabolites as inhibitors of infection-related morphogenesis in phytopathogenic fungi[J]. Mycological Research, 2004, 108(1): 14-25 |
| [16] | Jia SJ, Zeng DX, Wu XL, et al. Inhibitory of an antifungal protein produced by Bacillus subtilis C-D6 against Magnaporthe oryzae[J]. Chinese Journal of Biological Control, 2011, 27(3): 362-367 (in Chinese) 贾书娟, 曾大兴, 吴小丽, 等. 枯草芽孢杆菌 C-D6抗菌蛋白 对稻瘟病菌的抑菌作用[J]. 中国生物防治学报, 2011, 27(3): 362-367 |
| [17] | Leelasuphakul W, Sivanunsakul P, Phongpaichit S. Purification, characterization and synergistic activity of β-1, 3-glucanase and antibiotic extract from an antagonistic Bacillus subtilis NSRS 89-24 against rice blast and sheath blight[J]. Enzyme and Microbial Technology, 2006, 38(7): 990-997 |
| [18] | Liu D, Cai J, Xie CC, et al. Purification and partial characterization of a 36-kDa chitinase from Bacillus thuringiensis subsp. colmeri, and its biocontrol potential[J]. Enzyme and Microbial Technology, 2010, 46(3/4): 252-256 |
| [19] | Li J, Yang Q, Zhao LH, et al. Purification and characterization of a novel antifungal protein from Bacillus subtilis strain B29[J]. Journal of Zhejiang University Science B, 2009, 10(4): 264-272 |
| [20] | Theis T, Stahl U. Antifungal proteins: targets, mechanisms and prospective applications[J]. Cellular and Molecular Life Sciences, 2004, 61(4): 437-455 |
| [21] | Liu YF, Chen ZY, Ng TB, et al. Bacisubin, an antifungal protein with ribonuclease and hemagglutinating activities from Bacillus subtilis strain B-916[J]. Peptides, 2007, 28(3): 553-559 |
 2015, Vol. 42
2015, Vol. 42