扩展功能
文章信息
- 王洪秀, 靳亮, 陈庆隆, 魏云辉, 马吉平, 姚健, 陈柳萌, 钟国祥
- WANG Hong-Xiu, JIN Liang, CHEN Qing-Long, WEI Yun-Hui, MA Ji-Ping, YAO Jian, CHEN Liu-Meng, ZHONG Guo-Xiang
- 橘小实蝇成虫肠道可培养细菌群落结构分析
- The community structure of the intestine cultivable bacteria of Bactrocera dorsalis adults
- 微生物学通报, 2015, 42(12): 2351-2365
- Microbiology China, 2015, 42(12): 2351-2365
- 10.13344/j.microbiol.china.150403
-
文章历史
- 收稿日期: 2015-05-21
- 接受日期: 2015-07-08
- 优先数字出版日期(www.cnki.net): 20150716
2. 江西省科学院微生物研究所 江西 南昌 330096
2. Institute of Microbiology, Jiangxi Academy of Sciences, Nanchang, Jiangxi 330096, China
橘小实蝇[Bactrocera dorsalis (Hendel)],又名东方果实蝇,隶属双翅目(Diptera)实蝇科(Tephritidae)果实蝇属(Bactrocera),该虫现广泛分布于亚洲及环太平洋的许多国家和地区[1]。随着全球气候变化和国际贸易往来的日益频繁,现已成为我国华南、西南一带的危险性果蔬害虫[2]。因其繁殖能力强,寄主范围广,可为害柑橘、桃、芒果、香蕉、茄子、辣椒、瓜类等40多科250余种水果和蔬菜,素有果蔬“头号杀手”之称,是国际上重要的检疫性害虫,我国也曾在1995年将其列为二类检疫性害虫[3, 4]。
目前对橘小实蝇的防治措施包括植物检疫、农业防治、化学防治和生物防治等。化学药剂防治主要是有机磷类和拟除虫菊酯类,也有使用氨基甲酸酯和特异性杀虫剂[5]。化学防治的效果虽优势明显,但农药残留及对环境不友好的问题使得诱杀技术的应用越来越受到重视。性引诱灭雄技术和毒饵诱杀可作为早期的防治、监测措施。其中性诱剂最常用的是甲基丁香酚(Methyl eugenol)即诱虫醚,对性成熟的雄虫具有强烈的引诱作用,但对性未成熟的雄虫则无引诱作用,因而被广泛用来诱杀橘小实蝇雄虫以期降低田间雄成虫密度减少交配几率从而逐步控制橘小实蝇种群的扩增速度[6]。毒饵一般为食物诱饵,其引诱对象雌雄兼有。目前国内外采用的毒饵诱杀剂包括蛋白饵剂、糖醋类、酵母类及寄主挥发物类[7]。蛋白饵剂是近年来国内外防控实蝇类害虫的主要方式,其主要作用原理在于利用实蝇性成熟和产卵必须取食蛋白的生理特点,采用喷施水解蛋白来诱杀实蝇。目前国外应用较多的是美国陶氏公司的GF-120 (猎蝇)和马来西亚的Prina。
昆虫肠道中存在着大量的正常微生物,一般认为这些微生物是寄主昆虫正常生长发育所不可缺少的。它们不仅在维生素的合成、脂肪和碳水化合物的吸收与利用中起着重要作用,而且在抵御外来菌的侵入与定殖,以及在昆虫免疫系统的功能中也起着重要作用[8, 9]。有研究表明实蝇肠道细菌对其宿主具有引诱作用。Drew等[10]研究发现,某种来源于果实蝇属昆虫的细菌对橘小实蝇成虫有很好的引诱作用,并从这些昆虫体内分离得到了一种细菌,他们认为该细菌是引诱橘小实蝇的原因。后来,Drew和Lloyd[11]研究了该细菌所散发出来的气味对芒果大实蝇的引诱作用,发现在引诱到的芒果大实蝇群体中已经完全发育成熟的雌虫占15%,而未成熟的却占85%。据此,他们认为这可能是因为细菌在对成虫引诱过程中可以产生两种不同的作用:对未发育完全的雌虫提供食物和对发育完全的雌虫发挥类似性激素的作用。因此认为,细菌类物质是可以引诱到包括橘小实蝇在内的所有实蝇类害虫。
本研究利用16S rRNA基因序列分析技术,对橘小实蝇3个种群(实验室种群,标记为LRC;实验室无菌糖水喂养种群,标记为LSRC;野生种群,标记为FCC)成虫肠道可培养的细菌进行了分类鉴定,并结合细菌的菌落形态观察,以及生理生化反应特征,将橘小实蝇3个种群肠道可培养共有菌种的实验室种群部分鉴定到种。采用分子和常规技术相结合的方法客观、准确、全面地分析了橘小实蝇成虫肠道可培养细菌的群落结构。通过研究橘小实蝇成虫肠道可培养细菌群落结构组成,可为探讨肠道菌群对寄主的生理功能和生态学意义奠定基础,最终为利用微生物防治此类害虫提供新思路。
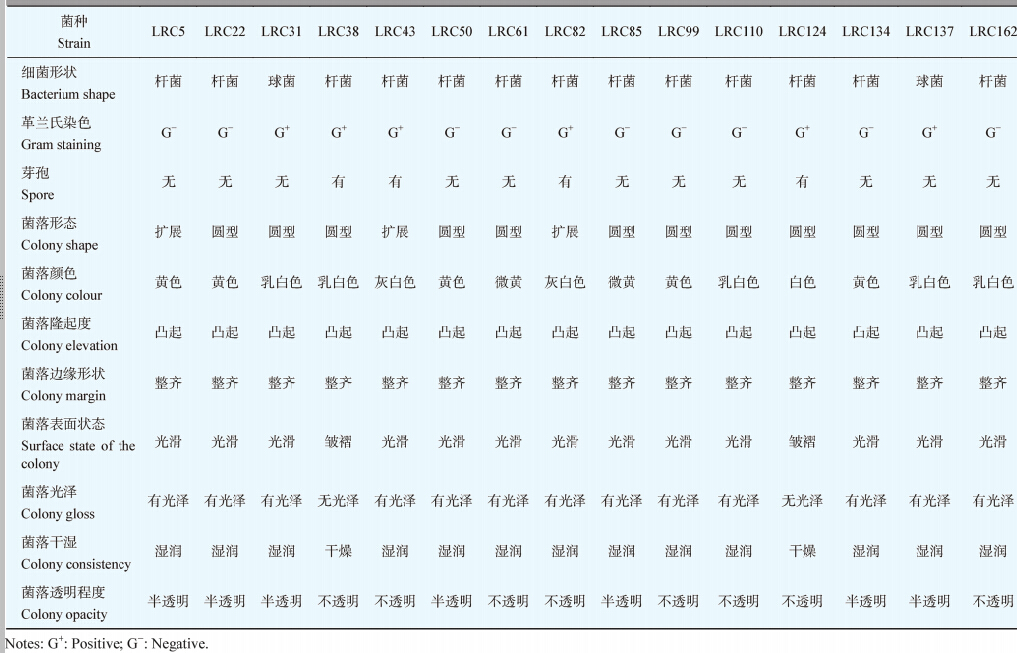
1 材料与方法 1.1 实验材料 1.1.1 橘小实蝇成虫:实验用成虫来自橘小实蝇3个种群,分别是实验室种群(laboratory-reared cultivable,LRC)、实验室无菌糖水喂养种群(laboratory sterile sugar-reared cultivable,LSRC)及野生种群(field-collected cultivable,FCC)。实验室种群及实验室无菌糖水喂养种群来自本实验室,养虫室饲养条件:温度27±1 °C,相对湿度70%−80%,光照周期为自然光源。实验室种群用蔗糖:酵母粉=1:3喂养,无菌糖水喂养种群用20%的蔗糖溶液(过滤除菌)喂养。野生种群采自武汉武昌区八一路军区干休所橘园,采虫后2 h内带回实验室进行肠道解剖。 1.1.2 培养基配制:NA培养基、KB培养基、NB培养基制作方法参考文献[12]。 1.1.3 引物序列:使用的上、下游引物为细菌通用引物[13],由上海捷瑞生物工程有限公司合成。968GC:5′-CGCCCGCCGCGCGCGGCGGGCGGG GCGGGGGCACGGGGGGAACGCGAAGAACCTTAC-3′;L1401:5′-CGGTGTGTACAAGACCC -3′。27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-AAGTCGTAACAAGGTARCCGTA-3′。 1.2 研究方法 1.2.1 肠道细菌的分离:在无菌操作下,分别选取橘小实蝇3个种群的成虫30只,放入70%的酒精中进行虫体表面消毒2−5 min,取出虫体并用无菌水漂洗3次。在加有1 mL水的培养皿中将其解剖,取出肠道在1.5 mL EP管中加入1 mL PBS缓冲液研磨,研磨液用无菌水稀释成10−1−10−6,各稀释度取0.5 mL于NA培养基、KB培养基、NB培养基平板上涂布分离,各稀释度重复3次,在30 °C的恒温培养箱中培养72 h后,选择不同生长性状的菌落进行纯化培养。每个橘小实蝇种群各挑取200个单菌落。 1.2.2 细菌DNA抽提及16S rRNA基因片段的扩增: 采用DNA抽提试剂盒提取各细菌基因组DNA (操作步骤按说明书进行)。以各细菌抽提的DNA为模板,利用细菌通用引物968GC-L1401进行PCR扩增。30 μL PCR反应体系为:10mmol/L dNTPs 0.5 μL、5 U/μL Taq酶0.5 μL、10×PCR buffer 3.0 μL、10 μmol/L引物968GC 0.5 μL、10 μmol/L引物L1401 0.5 μL、基因组DNA 1.0 μL,加ddH2O至30 μL。反应条件为:94 °C 5 min;94 °C 30 s,56 °C 30 s,72 °C 1 min,30个循环;72 °C 10 min;12 °C保温。 1.2.3 PCR产物的DGGE电泳分析:PCR产物采用Bio-Rad公司DcodeTM;突变检测系统进行分析。使用8%浓度的聚丙烯酸胺凝胶,电泳缓冲液为0.5×TAE,变性剂浓度梯度30%−70% (7 mol/L尿素和40%去离子甲酰胺为100%变性),PCR产物上样量为30 μL,其中加5 μL 10×Loading buffer。在60 °C恒温下,200 V预电泳10 min,然后85 V电泳16 h。待电泳完毕后,取下凝胶,用AgNO3溶液染色10 min,NaOH溶液显色,待条带清晰后拿出凝胶放在白光透射仪上,数码相机拍照。 1.2.4 DGGE分离后的PCR产物的电泳条带分析及测序:将DGGE分离到的不同条带对应的各菌株DNA,使用27F-1492R分别扩增其16S rRNA基因片段全长(1.5 kb左右)。PCR反应体积为30 μL,反应体系同1.2.2。反应条件为:94 °C 5 min;94 °C 40 s,55 °C 40 s,72 °C 110 s,30个循环;72 °C 10 min;12 °C保存。采用Axygen公司生产的DNA凝胶回收试剂盒,对相应菌株PCR产物进行纯化,而后分别连接到pMD18-T载体上,再转化到大肠杆菌DH5α感受态细胞中,在加有氨苄青霉素的LB液体培养基中,220 r/min下进行摇菌过夜。采用菌液直接PCR的方法对转化后的各菌株的克隆菌液进行鉴定和测序。 1.2.5 序列统计分析与系统发育树构建:将得到的序列提交到Ribosomal Datebase Projeet II (RDP)数据库,利用在线检测工具CHECK-CHIMERA检测嵌合体,去除嵌合体后的有效序列通过GenBank的BLASTn程序搜索高同源序列,采用ClustalX程序进行多序列匹配排列,然后通过MEGA 4.0程序中的Neighbor-Joining (NJ)方法、采用Jukes-Cantor计算模型构建系统发育树,bootstrap值设定为1 000。 1.2.6 序列登录号:将所得到的橘小实蝇3个种群可培养细菌的16S rRNA基因序列提交GenBank登记,序列号如下:JF772054−JF772106。 1.2.7 肠道可培养细菌的菌落形态观察:肠道可培养细菌在固体培养基上进行纯培养,然后对其菌落特征进行观察,分别从细菌形状、革兰氏染色、芽孢有无、菌落形态、颜色、隆起度、边缘形状、表面状态、光泽、干湿情况、透明度等方面进行。 1.2.8 肠道可培养细菌的生理生化实验:采用由法国梅里埃公司生产的ID 32E肠杆菌科和其它革兰氏阴性杆菌鉴定系统及API 50CHB芽孢杆菌属鉴定系统进行鉴定,具体操作参照使用说明书。 2 结果与分析 2.1 肠道可培养细菌16S rRNA基因片段的PCR扩增采用968GC-L1401通用引物扩增后通过1.2%的琼脂糖凝胶电泳检测发现,获得的细菌16S rRNA基因片段大小约在400−450 bp左右,是实验所需目的片段(图 1)。
|
| 图 1 细菌16S rRNA基因的PCR扩增 Fig.1 PCR amplification of bacterial16SrRNA gene with primer 968GC and L1401 Note: M: Marker DL2000; 1−6: PCR product ; CK: Control. |
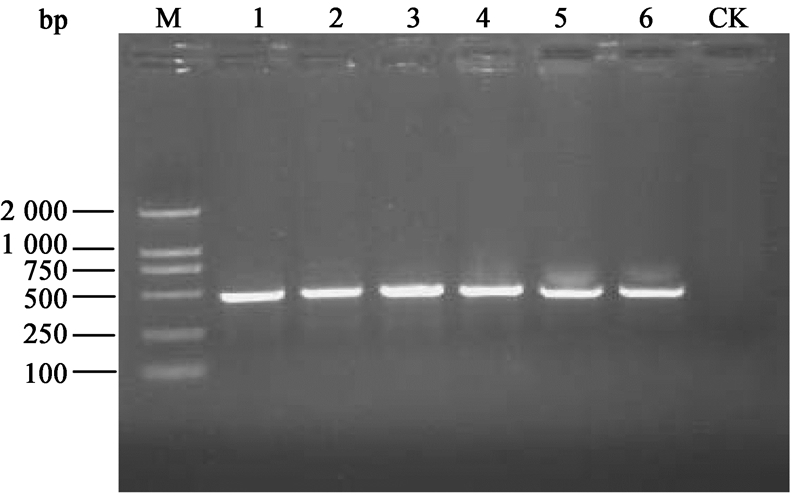
对橘小实蝇3个种群的600株可培养细菌的16S rRNA基因片段进行DGGE电泳分析,部分细菌电泳结果如图 2所示。
|
| 图 2 部分可培养细菌DGGE图谱 Fig.2 DGGE profiles of partial culturable bacterial 16S rRNA gene Note: 1−19: PCR product of different clones. |
橘小实蝇3个种群的600株可培养细菌(其中LRC、LSRC和FCC均为200株),经DGGE分析后共得到53株不同的细菌(其中LRC、LSRC和FCC 中分别是17、14和22株)。对53株不同的细菌使用引物27F-1492R扩增其16S rRNA基因片段全长后的部分结果如图 3所示。
|
| 图 3 细菌16S rRNA基因全长PCR扩增 Fig.3 PCR amplification of bacterial full-length 16S rRNA gene with primer 27F and 1492R Note: M: Marker DL2000; 1−16: PCR product; CK: Control. |
系统发育分析表明,53株不同细菌分别属于肠杆菌科(Enterobacteriaceae)、肠球菌科(Enterococcaceae)和芽孢杆菌科(Bacillaceae)等3个科。橘小实蝇3个种群可培养细菌分属各科所占比例如图 4所示,其中Enterobacteriaceae所占比例分别为LRC中72.0%、LSRC中82.5%和FCC中72.5%,为橘小实蝇3个种群可培养细菌的最优势细菌类群。Enterococcaceae也是橘小实蝇3个种群 可培养细菌群落中的优势细菌类群,在LRC、LSRC和FCC 3个种群所占的比例依次为15.5%、11%和10%。Bacillaceae在橘小实蝇各种群中只占据了很少的菌株数(每个橘小实蝇种群都少于15株)。另外,还有1个分类组(标记为Unclassified)无法归属于目前已知的细菌类群中,这是一类目前认识不足的微 生物类群,可能与橘小实蝇肠道特殊的微环境有关。

|
| 图 4 橘小实蝇3个种群不同细菌发育类群的相对比例 Fig.4 Ralative propotion in the different bacterial phylogenetic groups prepared from the three populations of B. dorsalis |
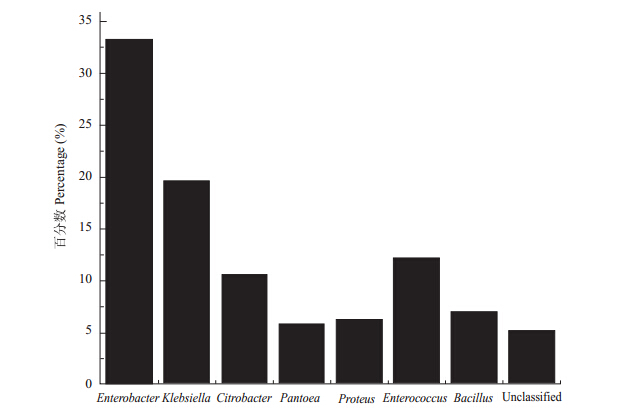
橘小实蝇3个种群肠道可培养细菌各个属所占比例如图 5所示。从图 5可以看出,肠杆菌属(Enterobacter)的细菌种类所占比例最大,分别占据橘小实蝇3个种群的35.0%、35.0%和29.5%,其次为克雷伯氏菌属(Klebsiella)、柠檬酸杆菌属(Citrobacter)和肠球菌属(Enterococcus)的细菌种类,分别占据橘小实蝇3个种群的19.7%、10.7%和12.2%。说明这4个属的细菌是肠道可培养细菌的优势属种类。而泛菌属(Pantoea)、变形杆菌属(Proteus)、芽孢杆菌属(Bacillus)及Unclassified在橘小实蝇3个种群中所占的比例都很小。
|
| 图 5 橘小实蝇3个种群不同细菌属的比例 Fig.5 Propotion of the different genera identified from the three populations of B. dorsalis |
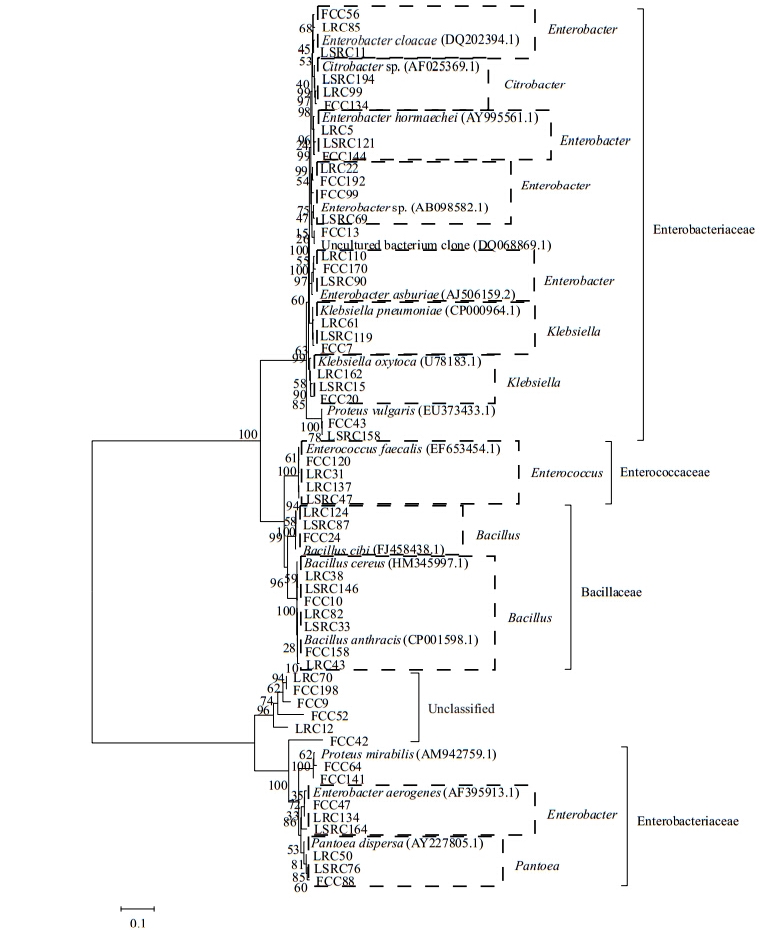
把橘小实蝇3个种群中序列相似性大于97%的菌株归为相同的细菌种类[14]。共有12组这样的细菌种类,在所归类的3个纲中都有存在(已用虚线框标出,图 6)。其中的2组(在600株可培养细菌中占据118株,所占比例为19.7%)隶属于Klebsiella pneumoniae (CP000964.1)和Klebsiella oxytoca (U78183.1);有1组(在600株可培养细菌中占据64株,所占比例为10.7%)隶属于Citrobacter sp. (AF025369.1);有1组(在600株可培养细菌中占据35株,所占比例为5.8%)隶属于Pantoea dispersa (AY227805.1);有5组(在600株可培养细菌中占据199株,所占比例为33.2%)隶属于Enterobacter cloacae (DQ202394.1)、Enterobacter hormaechei (AY995561.1)、Enterobacter sp. (AB098582.1)、Enterobacter asburiae (AJ506159.2)和Enterobacter aerogenes (AF395913.1);最后的2组(在600株可培养细菌中分别占据42株和73株,所占比例分别为7.0%和12.2%)分别隶属于Bacillus cibi (FJ458438.1)、Bacillus cereus (HM345997.1)、Bacillus anthracis (CP001598.1)和Enterococcus faecalis (EF653454.1)。在上述12组共有细菌中,Enterobacter spp.所占比例最大,其次为Klebsiella spp.和Citrobacter spp.,Enterococcus spp.,也说明这4个属的细菌是橘小实蝇3个种群肠道可培养细菌共有菌种的优势种类。
|
|
图 6
橘小实蝇3个种群可培养细菌系统发育树
Fig.6
Phylogenetic tree showing the relationship among individual bacterial 16S rRNA gene from the three populations (LRC, LSRC and FCC) of B. dorsalis
注:括号内的数字为GenBank序列号;结点处数字为Bootstrap值;标尺代表 10%的序列分歧. Notes: Numbers in parenthesis represented GenBank accession number. Numbers at the branch points indicated the bootstrap values. The scale bar represents a 10% sequence divergence. |
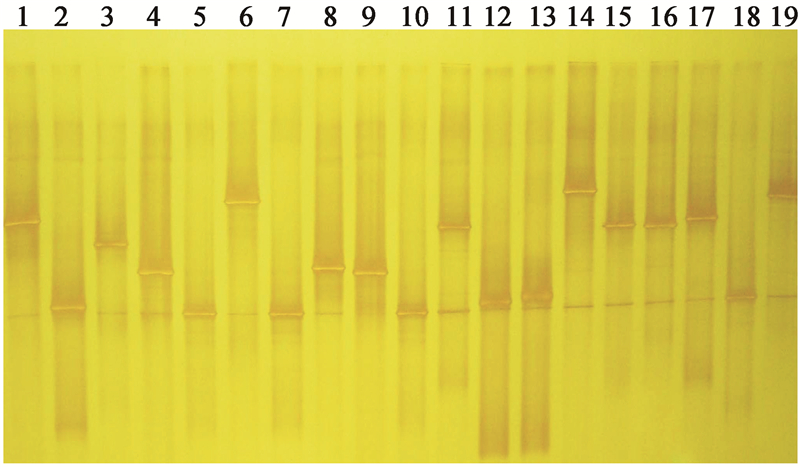
橘小实蝇3个种群可培养细菌的共有菌种,经纯培养后对其菌落特征进行了观察。结果如表 1所示。供试菌株在LB固体培养基上培养24 h后按照革兰氏染色法区别所有菌株。分析发现,15个细菌菌株中9个菌株呈革兰氏阴性反应,其余6个菌株呈革兰氏阳性反应。经显微镜观察,其中13个菌体均为杆状,2个为球状。几乎全部分离的细菌都可以在37 °C生长,培养24−48 h后菌落形态明显,但少数菌落需要72 h以后才显示出颜色特征。
表 2说明,9个试验菌株在糖分解、利用试验中多呈阳性反应,可见对碳素化合物均有较好的分解利用能力。在对醇、氮素化合物的分解利用及大分子化合物的分解试验中,不同菌株表现出了明显的差异性。经API 50CHB鉴定系统,得到如表 3所示的归属为芽孢杆菌科的各细菌生理生化特征的判读结果。从表 3中可以看出,4个试验菌株在对不同底物的分解利用中也表现出了差异性。
 |
| 特性 Characteristics | LRC124 | LRC38 | LRC82 | LRC43 | ||||
| 24 h | 48 h | 24 h | 48 h | 24 h | 48 h | 24 h | 48 h | |
| 对照 Control | - | - | - | - | - | - | - | - |
| 甘油 Glycerol | + | + | + | + | + | + | + | + |
| 赤癣醇 Erythritol | - | - | - | - | - | - | - | - |
| D-阿拉伯糖 D-arabinose | - | - | + | + | - | - | - | - |
| L-阿拉伯糖 L-arabinose | + | + | - | - | + | - | - | + |
| 核糖 Ribose | + | + | + | + | + | - | - | + |
| D-木糖 D-xylose | + | + | + | + | + | + | + | + |
| L-木糖 L-xylose | - | - | - | - | - | - | - | - |
| 阿东醇 Adonitol | - | - | - | - | - | - | - | - |
| β-甲基-D-木糖甙 β-Methyl-D-xyloside | - | - | - | - | - | - | - | - |
| 半乳糖 Galactose | + | + | + | + | + | + | + | + |
| 葡萄糖 Glucose | + | + | + | + | + | - | - | + |
| 果糖 Fructose | + | + | + | + | + | - | - | + |
| 甘露糖 Mannose | + | + | + | + | + | - | - | + |
| 山梨糖 Sorbose | - | - | - | - | - | - | - | - |
| 鼠李糖 Rhamnose | + | + | + | + | + | + | + | + |
| 卫茅醇 Dulcitol | + | + | - | - | - | - | - | - |
| 肌醇 Inositol | + | + | - | - | + | + | + | + |
| 甘露醇 Mannitol | + | + | - | - | + | - | - | + |
| 山梨醇 Sorbitol | + | + | + | + | + | + | + | + |
| α-甲基-D-甘露糖甙 α-Methyl-D-mannoside | - | - | - | - | - | - | - | - |
| α-甲基-D-葡萄糖甙 α-Methyl-D-glucoside | + | + | + | + | + | + | + | + |
| N-乙酰-葡糖胺 N-acetyl glucosamine | + | + | + | + | + | - | - | + |
| 苦杏仁甙 Amygdalin | - | + | + | + | + | + | - | + |
| 熊果甙 Arbutin | - | + | + | + | + | + | + | + |
| 七叶灵 Esculin | + | + | + | + | + | + | + | + |
| 柳醇 Salicin | + | + | + | + | + | + | + | + |
| 纤维二糖 Cellobiose | + | + | + | + | + | + | + | + |
| 麦芽糖 Maltose | + | + | + | + | + | + | + | + |
| 乳糖 Lactose | + | + | + | + | + | + | + | + |
| 蜜二糖 Melibiose | + | + | + | + | + | - | - | + |
| 蔗糖 Sucrose | + | + | + | - | + | - | - | + |
| 海藻糖 Trehalose | + | + | + | + | + | - | - | + |
| 菊糖 Inulin | - | - | - | - | - | - | - | - |
| 松叁糖 Melezitose | - | - | + | + | - | - | - | - |
| 棉子糖 Raffinose | + | + | + | + | + | - | - | + |
| 淀粉 Starch | - | - | + | + | - | - | - | - |
| 肝糖 Glycogen | - | - | - | - | - | - | - | - |
| 木糖醇 Xylitol | - | - | - | - | - | - | - | - |
| 龙胆二糖 Gentiobiose | + | - | - | - | + | - | - | - |
| D-松二糖 D-turanose | - | + | - | - | - | + | + | + |
| D-来苏糖 D-lyxose | - | - | + | + | - | + | + | - |
| D-塔格糖 D-tagatose | - | - | + | + | - | - | - | - |
| D-岩糖 D-fucose | - | - | + | + | - | - | - | - |
| L-岩糖 L-fucose | - | - | + | + | - | - | - | - |
| D-阿拉伯糖醇 D-arabitol | - | - | - | - | - | - | - | - |
| L-阿拉伯糖醇 L-arabitol | - | - | - | - | - | - | - | - |
| 葡萄糖酸盐 Gluconate | + | + | - | - | + | - | - | + |
| 2-酮基-葡萄糖酸盐 2-Keto-gluconate | - | - | - | - | - | - | - | - |
| 5-酮基-葡萄糖酸盐 5-Keto-gluconate | + | + | - | - | + | - | - | + |
根据供试菌株的16S rRNA基因片段全长测序、菌落形态观察和生理生化特征试验,确定了15株可培养细菌的菌种名称(表 4)。15株可培养细菌分别是:霍氏肠杆菌Enterobacter hormaechei、阪岐肠杆菌Enterobacter sakazakii、粪肠球菌Enterococcus faecalis、蜡样芽孢杆菌Bacillus cereus、炭疽芽孢杆菌Bacillus anthracis、分散泛菌Pantoea dispersa、肺炎克雷伯菌Klebsiella pneumoniae、炭疽芽孢杆菌Bacillus anthracis、阴沟肠杆菌Enterobacter cloacae、弗氏柠檬酸杆菌Citrobacter freundii、阿氏肠杆菌Enterobacter asburiae、食物芽孢杆菌Bacillus cibi、产气肠杆菌Enterobacter aerogenes、粪肠球菌Enterococcus faecalis和产酸克雷伯菌Klebsiella oxytoca。其中肠杆菌属5株,克雷伯氏菌属2株,柠檬酸杆菌属1株,泛菌属1株,肠球菌属2株,芽孢杆菌属4株。
| 菌株 Strains |
菌种名称 Strain name |
| LRC5 | Enterobacter hormaechei |
| LRC22 | Enterobacter sakazakii |
| LRC31 | Enterococcus faecalis |
| LRC38 | Bacillus cereus |
| LRC43 | Bacillus anthracis |
| LRC50 | Pantoea dispersa |
| LRC61 | Klebsiella pneumoniae |
| LRC82 | Bacillus anthracis |
| LRC85 | Enterobacter cloacae |
| LRC99 | Citrobacter freundii |
| LRC110 | Enterobacter asburiae |
| LRC124 | Bacillus cibi |
| LRC134 | Enterobacter aerogenes |
| LRC137 | Enterococcus faecalis |
| LRC162 | Klebsiella oxytoca |
通过变性梯度凝胶电泳技术对橘小实蝇3个种群成虫肠道可培养的细菌进行了分类鉴定,共得到53种不同的细菌遗传型,其中LRC为17种,LSRC为14种,FCC为22种。对不同遗传型的菌株再扩增其16S rRNA基因片段全长、测序及系统发育分析后,主要归为3个科,分别为肠杆菌科(Enterobacteriaceae)、肠球菌科(Enterococcaceae)和芽孢杆菌科(Bacillaceae)。另外,还有1个分类组(标记为Unclassified)无法归属于目前已知的细菌类群中,可能与橘小实蝇肠道特殊的微环境有关。其中肠杆菌科是肠道可培养细菌中最优势的细菌种类。Wang等[15]曾对橘小实蝇3个种群肠道细菌的分子多态性分析得出肠杆菌目(Enterobacteriales)是γ-变形菌纲(Gammaproteobacteria)中最大的1个目,通过研究肠道可培养细菌的群落结构再次证明了肠 杆菌目是橘小实蝇肠道的优势细菌种类。研究选用变性梯度凝胶电泳对橘小实蝇3个种群的600株可培养细菌进行了初筛,将处于同一迁移位置的条带归为相同的系统发育类型(phylotypes)或操作分类单元(OTUs)[16]。每种系统发育类型里选取1个代表菌株进行测序,由于处于相同位置的条带仅代表相同菌种,但有可能是不同类型的菌株,后续研究侧重不同菌种对橘小实蝇的引诱作用,但相同菌种不同菌株之间对橘小实蝇的引诱作用是否有差别也需要进一步考虑。
研究肠杆菌科的优势细菌为Enterobacter spp.、Klebsiella spp.和Citrobacter spp.。这些细菌同时也是几种其它实蝇科昆虫肠道可培养细菌的优势种类,如寡鬃实蝇属Dacus[17]、果实蝇属Bactrocera[18]、按实蝇属Anastrepha[19]、小条实蝇属Ceratitis[20]、Tephritis和Urophora[21]等。根据序列相似性大于97%的菌株归为相同的细菌种类,找到了橘小实蝇3个种群可培养细菌的共有菌种,通过菌落形态特征观察和生理生化试验,确定了这些共有菌种的名称。利用传统的细菌鉴定方法——形态学观察和生理生化特性分析和现代分子生物学方法——16S rRNA基因的PCR-DGGE技术相结合的手段鉴定细菌种类,可以使鉴定准确度提高,结果更可信。此种方法已广泛应用于多领域[19, 22, 23],尤其对具有重要利用价值菌株的鉴定[24, 25, 26]。
通过对橘小实蝇肠道可培养细菌的鉴定,得出野生种群细菌的遗传型最多,其次是实验室种群,最少的是实验室无菌糖水喂养种群,证明了实蝇不同的生活环境及饲养条件可影响到肠道可培养细菌的种类。在其他昆虫对其肠道可培养细菌研究中也发现类似的情况,如比较直接从野生环境采集的贡嘎蝠蛾幼虫和经人工模拟野生环境饲养的幼虫两种处理分离的可培养的细菌发现,两种环境下幼虫肠道细菌的数量和种类都有差异[27]。Dillon和Chamley[28]研究蝗虫(Schistocerca gregaria)肠道微生物数量和种类时发现,肠道微生物的数量和种类会因食物的不同发生很大的变化,这可能是因为肠道微生物的数量和种类与昆虫的营养密切相关。Hayashi等[29]在以家白蚁(Coptotermes formosanus)为模式生物的研究中发现,随着食物结构发生改变,宿主肠道中的细菌种类也随之发生改变。
Robacker等[30]证明由肺炎克雷伯菌(Klebsiella pneumoniae)和弗氏柠檬酸杆菌(Citrobacter freundii) 两种细菌产生的胺等化学成分对墨西哥实蝇Anastrepha ludens的引诱作用。Robacker等[31]报道从墨西哥实蝇Anastrepha ludens分离的团肠杆菌(Enterobacter agglomeras)的挥发物羟基丁酮(3-hydroxybutanone)对墨西哥实蝇具有显著的引诱活性。Martinez等[32]报道苏云金芽孢杆菌(Bacillus thuringiensis)对墨西哥实蝇具有引诱作用。早在2007年,Sacchetti等[33]证实橄榄实蝇olive fly (Bactrocera oleae)被分离自前肠的恶臭假单胞菌(Pseudomonas putida)滤液的挥发物所吸引。2013年,Liscia等[34]报道橄榄实蝇对该菌滤液的挥发物或其某一组分如乙酸甲硫酯(Methyl thiolacetate)会产生触角电位响应,可能是橄榄实蝇寻找寄主植物产卵或取食的原因。下一步,将重点研究橘小实蝇3个种群的共有菌种对橘小实蝇的引诱性能和引诱成分鉴定。综上所述,通过研究橘小实蝇成虫肠道可培养细菌群落结构组成,可为探讨肠道菌群对寄主的生理功能和生态学意义奠定基础,最终为利用微生物防治此类害虫提供新思路。
| [1] | Hsu JC, Feng HT, Wu WJ. Resistance and synergistic effects of insecticides in Bactrocera dorsalis (Diptera: Tephritidae) in Taiwan[J]. Journal of Economic Entomology, 2004, 97(5): 1682-1688 |
| [2] | Zhang B, Liu YH, Wan XW, et al. Research progress in phylogeny of Bactrocera dorsalis[J]. Plant Protection, 2010, 36(5): 6-10 (in Chinese) 张彬, 刘映红, 万宣武, 等. 橘小实蝇分子系统发育研究进 展[J]. 植物保护, 2010, 36(5): 6-10 |
| [3] | Li YM, Gu YQ, Xiang SY. Prevention and control technology of Oriental fruit fly (Bactrocera dorsalis Hendel)[J]. Rural Practical Technology, 2011(3): 42-43 (in Chinese) 李云明, 顾云琴, 项顺尧. 柑橘小实蝇防控技术[J]. 农村实 用技术, 2011(3): 42-43 |
| [4] | Li DL, Wang EG. Model study of Oriental fruit fly (Bactrocera dorsalis Hendel) occurrence and dynamic in citrus orchard[J]. Journal of Agriculture, 2011, 1(6): 23-28 (in Chinese) 李达林, 汪恩国. 柑橘园柑橘小实蝇入侵扩散规律与危害动 态模型研究[J]. 农学学报, 2011, 1(6): 23-28 |
| [5] | Lu XL, Bao YH, Yan CM. Occurrence and management of Oriental fruit fly (Bactrocera dorsalis Hendel)[J]. Shanghai Agricultural Science and Technology, 2009(1): 117 (in Chinese) 陆晓莉, 包月华, 颜春妹. 桔小实蝇发生与防控技术初探[J]. 上海农业科技, 2009(1): 117 |
| [6] | Lu YY, Zeng L, Liang GW, et al. Improvement of the monitoring technigue of Oriental fruit fly, Bactrocera dorsalis, males by sex attractant[J]. Chinese Bulletin of Entomology, 2006, 43(1): 123-126 (in Chinese) 陆永跃, 曾玲, 梁广文, 等. 对性引诱剂监测桔小实蝇雄成 虫技术的改进[J]. 昆虫知识, 2006, 43(1): 123-126 |
| [7] | Wang MQ. Occurrence and prevention of Oriental fruit fly, Bactrocera dorsalis[J]. Hubei Plant Protection, 2006(4): 40 (in Chinese) 王明清. 柑桔桔小实蝇的发生与防治[J]. 湖北植保, 2006(4): 40 |
| [8] | Hongoh Y, Ohkuma M, Kudo T. Molecular analysis of bacterial microbiota in the gut of the termite Reticulitermes speratus (Isoptera: Rhinotermitidae)[J]. FEMS Microbiology Ecology, 2003, 44(2): 231-242 |
| [9] | Eutick ML, O’Brien RW, Slaytor M. Bacteria from the gut of Australian termites[J]. Applied and Environmental Microbiology, 1978, 35(5): 823-828 |
| [10] | Drew RAI, Courtice AC, Teakle DS. Bacterial as a natural source of food for adult fruit flies (Dipetera: Tephritidae)[J]. Oecologia, 1983, 60(3): 279-284 |
| [11] | Drew RAI, Lloyd AC. Relationship of fruit flies (Diptera: Tephritidae) and their bacteria to host plants[J]. Annals of the Entomological Society of America, 1987, 80(5): 629-636 |
| [12] | Chen TS. Manufacture and Application of Microbial Culture Medium[M]. Beijing: China Agriculture Press, 1995: 179-184 (in Chinese) 陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出 版社, 1995: 179-184 |
| [13] | Zhang HY, Jackson TA. Autochthonous bacterial flora indicated by PCR-DGGE of 16S rRNA gene fragments from the alimentary tract of Costelytra zealandica (Coleoptera: Scarabaeidae)[J]. Journal of Applied Microbiology, 2008, 105(5): 1277-1285 |
| [14] | Mohr KI, Tebbe CC. Diversity and phylotype consistency of bacteria in the guts of three bee species (Apoidea) at an oilseed rape field[J]. Environmental Microbiology, 2006, 8(2): 258-272 |
| [15] | Wang HX, Jin L, Zhang HY. Comparison of the diversity of the bacterial communities in the intestinal tract of adult Bactrocera dorsalis from three different populations[J]. Journal of Applied Microbiology, 2011, 110(6): 1390-1401 |
| [16] | Simpson JM, Kocherginskaya SA, Aminov RI, et al. Comparative microbial diversity in the gastrointestinal tracts of food animal species[J]. Integrative and Comparative Biology, 2002, 42(2): 327-331 |
| [17] | Drew RAI, Lloyd AC. Bacteria in the life cycle of tephritid fruit flies[A]//Barbarosa P, Krischik VA, Jones CG. Microbial Mediation of Plant-Herbivore Interactions[M]. New York: John Wiley & Sons, 1991: 441-465 |
| [18] | Capuzzo C, Firrao G, Mazzon L, et al. ‘Candidatus Erwinia dacicola’, a coevolved symbiotic bacterium of the olive fly Bactrocera oleae (Gmelin)[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(4): 1641-1647 |
| [19] | Kuzina LV, Peloquin JJ, Vacek DC, et al. Isolation and identification of bacteria associated with adult laboratory Mexican fruit flies, Anastrepha ludens (Diptera: Tephritidae)[J]. Current Microbiology, 2001, 42(4): 290-294 |
| [20] | Behar A, Jurkevitch E, Yuval B. Bringing back the fruit into fruit fly-bacteria interactions[J]. Molecular Ecology, 2008, 17(5): 1375-1386 |
| [21] | Daser U, Brandl R. Microbial gut floras of eight species of tephritids[J]. Botanical Journal of the Linnean Society, 1992, 45(2): 155-165 |
| [22] | He F, Kang YJ, Shan J, et al. An oxygen-tolerant denitrifying strain and its denitrifying processes[J]. Microbiology China, 2008, 35(1): 35-39 (in Chinese) 何芳, 康贻军, 单君, 等. 一株高耐氧反硝化细菌的筛选及 其反硝化产物确定[J]. 微生物学通报, 2008, 35(1): 35-39 |
| [23] | Du CM, Guo YC, Liu XM. Evaluation of API 20E system and PCR methods for identification of salmonella[J]. Practical Preventive Medicine, 2005, 12(5): 1006-1007 (in Chinese) 杜春明, 郭云昌, 刘秀梅. API 20E、 PCR 方法在沙门菌鉴定中的应用[J]. 实用预防医学, 2005, 12(5): 1006-1007 |
| [24] | Wu XZ, Gao YX, Ou HL, et al. Isolation and characterization of Selenomonas ruminantium from the rumen of dairy cows[J]. Progress in Veterinary Medicine, 2008, 29(10): 25-28 (in Chinese) 武心镇, 高玉霞, 欧海龙, 等. 奶牛瘤胃中反刍兽月形单胞菌的分离鉴定[J]. 动物医学进展, 2008, 29(10): 25-28 |
| [25] | Yang Y, Wan MX, Peng H, et al. Isolation and characterization of bacterium for chalcopyrite bioleaching[J]. Journal of Central South University (Science and Technology Edition), 2007, 38(4): 639-644 (in Chinese) 杨宇, 万民熙, 彭宏, 等. 一株黄铜矿专属浸出细菌的分离与鉴定[J]. 中南大学学报: 自然科学版, 2007, 38(4): 639-644 |
| [26] | Feng YY, Chen J, Liu B, et al. Identification and characterization of a PTA-degrading bacterial strain[J]. Journal of Chemical Industry and Engineering (China), 2006, 57(8): 1968-1973 (in Chinese) 冯杨阳, 陈俊, 刘波, 等. 一株对苯二甲酸降解菌的鉴定及其降解特性[J]. 化工学报, 2006, 57(8): 1968-1973 |
| [27] | Zhuo FP, Chen SJ, Yin YP, et al. Analysis on the ‘Hepialus gonggaensis’ intestinal bacterial flora[J]. Journal of Chongqing University (Natural Science Edition), 2004, 27(11): 26-29 (in Chinese) 卓凤萍, 陈仕江, 殷幼平, 等. 贡嘎蝠蛾幼虫肠道菌群的分析[J]. 重庆大学学报: 自然科学版, 2004, 27(11): 26-29 |
| [28] | Dillon R, Chamley K. Mutualism between the desert locust Schistocerca gregaria and its gut microbiota[J]. Research in Microbiology, 2002, 153(8): 503-509 |
| [29] | Hayashi A, Aoyagi H, Yoshimura T, et al. Development of novel method for screening microorganisms using symbiotic association between insect (Coptotermes formosanus Shiraki) and intestinal microorganisms[J]. Journal of Bioscience and Bioengineering, 2007, 103(4): 358-367 |
| [30] | Robacker DC, Bartelt RJ. Chemicals attractive to Mexican fruit fly from Klebsiella pneumoniae and Citrobacter freundii. cultures sampled by solid-phase microextraction[J]. Journal of Chemical Ecology, 1997, 23(12): 2897-2915 |
| [31] | Robacker DC, Lauzon CR, He XD. Volatiles production and attractiveness to the Mexican fruit fly of Enterobacter agglomerans isolated from Apple maggot and Mexican fruit flies[J]. Journal of Chemical Ecology, 2004, 30(7): 1329-1347 |
| [32] | Martinez AJ, Robacker DC, Garcia JA, et al. Laboratory and field olfactory attraction of the Mexican fruit fly (Diptera: Tephritidae) to metabolites of bacterial species[J]. The Florida Entomologist, 1994, 77(1): 117-126 |
| [33] | Sacchetti P, Landini S, Granchietti A, et al. Attractiveness to the olive fly of Pseudomonas putida isolated from the foregut of Bactrocera oleae[J]. IOBC/WPRS Bulletin, 2007, 30: 37-42 |
| [34] | Liscia A, Angioni P, Sacchetti P, et al. Characterization of olfactory sensilla of the olive fly: Behavioral and electrophysiological responses to volatile organic compounds from the host plant and bacterial filtrate[J]. Journal of Insect Physiology, 2013, 59(7): 705-716 |
 2015, Vol. 42
2015, Vol. 42