扩展功能
文章信息
- 刘丽菲, 陈正军, 孙筱君, 梁运祥
- LIU Li-Fei, CHEN Zheng-Jun, SUN Xiao-Jun, LIANG Yun-Xiang
- 冷风干燥制备高活菌的恶臭假单胞菌菌粉
- Preparation of high viable count Pseudomonas putida bacteria powder by cold blast drying
- 微生物学通报, 2015, 42(12): 2330-2336
- Microbiology China, 2015, 42(12): 2330-2336
- 10.13344/j.microbiol.china.150185
-
文章历史
- 收稿日期: 2015-03-09
- 接受日期: 2015-04-28
- 优先数字出版日期(www.cnki.net): 2015-05-14
假单胞菌属是自然界分布最广的微生物之一[1],多定殖于土壤、水和植物根系中,其生物降解与生物转化能力强[2],因此在环境修复[3]、生物防治[4]、生物转化等方面有广阔的应用前景。然而,假单胞菌属于革兰氏阴性菌,无芽孢休眠体,对极端环境(缺水、饥饿、高温、低温)的抵抗能力较差,干燥及保藏存活率低。因此,如何解决假单胞菌菌剂制备以及长期保藏成为该类菌株工程应用的最大障碍。
近年来,国内外关于假单胞菌菌粉制备的研究较少,已报道的菌粉制备研究多采用吸附法和冷冻干燥法。吸附法操作简便,Kloepper等[5]利用黄原胶与树胶制备假单胞菌菌粉,4 °C保藏3个月,存活率为52%,活菌数为107 CFU/g。冷冻干燥法成本较高,低温对菌体损伤较大[6, 7],Palmfeldt等[7]冷冻干燥绿针假单胞菌存活率为32%,8 °C保藏50 d存活率降低至6%。目前,冷风干燥技术主要应用于食品干燥[8],是一种较新型的干燥方法,利用物料在低温、低湿及高风速的环境下,快速脱除水分,从而减少蛋白质热变性[9]。因此,针对假单胞菌菌剂制备的瓶颈,冷风干燥法是一次很好的尝试。
本文选取一株能降解石油、具备良好应用潜力的恶臭假单胞菌[10]作为研究对象。采用冷风干燥法与载体吸附法相结合,期望制备出一种低成本、高活菌、耐保藏的恶臭假单胞菌菌粉,为该菌剂在石油污染修复中应用奠定良好的基础,同时,也为假单胞菌属菌粉的制备提供借鉴。
1 材料与方法 1.1 供试菌株恶臭假单胞菌J7 (Pseudomonas putida J7),由实验室从华中农业大学橘园食堂排污口水样分离得到的一株石油烃降解菌[10]。
1.2 主要试剂与仪器胰蛋白胨、酵母粉购自OXOID LTD公司,其他试剂均购自国药集团化学试剂有限公司;稻草粉、玉米芯粉均为80目;SD-1500实验室喷雾干燥机,购自上海沃迪科技有限公司;YCFZD-2A热泵冷风干燥一体机,购自杭州欧易电器有限公司。
1.3 培养基LB固体培养基[10];KB培养基[11];发酵培养基(g/L):葡萄糖8,酵母粉28,KH2PO4 1.5,MgSO4×7H2O 1.3,pH 7.2,0.75×105 Pa灭菌20 min。
1.4 发酵菌液的制备取−20 °C保藏的恶臭假单胞菌J7在LB固体培养基上划线,28 °C倒置培养18 h,活化两代,将活化后的单菌落接种到KB培养基中(50 mL/250 mL),28 °C、220 r/min培养9 h。将种子液按2%接种于发酵培养基中(100 mL/500 mL),发酵48 h后,4 000 r/min离心40 min,发酵液浓缩将近5倍备用,测定浓缩液活菌数。
1.5 菌粉干燥方法 1.5.1 喷雾干燥法[12]:采用喷雾干燥法制备活菌粉,以浓缩菌液为芯材,阿拉伯胶、麦芽糊精、β-环糊精为壁材,壁材溶液按添加量为10% (质量比),阿拉伯胶:麦芽糊精为1:9,β-环糊精为10 g/L,制成胶体溶液,高温灭菌备用,芯材与壁材按体积比1:4混合均匀,用于喷雾干燥。制备得到的菌粉分装于7 mL离心管,封口胶密封,于4 °C及室温避光保藏。喷雾干燥条件为进风温度140 °C,出风温度55 °C,流量750 mL/h。测定喷雾干燥前、后菌粉活菌数,成品菌粉含水率,并定期检测保藏菌粉活菌数。 1.5.2 冷风干燥法:采用冷风干燥法制备活菌粉,以玉米芯粉为载体,高温灭菌2次,载体与浓缩菌液混合比例为1:2,玻璃棒搅拌均匀,平铺于不锈钢盘,置于冷风干燥机,设置干燥温度为28 °C,湿度为10%,盘管温差为2 °C,8−10挡风力干燥,每3 h翻动一次,干燥至恒重,制备得到的固体菌剂分装于7 mL离心管,封口胶密封,于4 °C及室温避光保藏。测定冷风干燥前、后菌粉活菌数,成品菌粉含水率,并定期检测保藏菌粉活菌数。 1.6 冷风干燥菌粉制备的研究 1.6.1 成品含水率的选择:以玉米芯粉为载体,选择冷风干燥结束时间为2、4、6、8 h,获得不同含水率的菌粉成品,制备方法见1.5.2。 1.6.2 载体的选择:测定玉米芯粉、稻草粉、硅藻土3种载体自然含水率及吸水能力,并用于冷风干燥法制备菌粉,干燥不同的时长,控制成品菌粉含水率相近,制备方法见1.5.2。 1.6.3 载体预处理方式的选择:以玉米芯粉为载体,分别采用酸处理及碱处理两种预处理方式改变载体pH,测定预处理后载体pH。玉米芯粉酸处理:添加载体量5% (质量比)的冰醋酸,30% (质量比)的蒸馏水,混匀密封60 °C处理2 d;玉米芯粉碱处理:添加载体量3% (质量比)的氨水,30% (质量比)的水,混匀密封60 °C处理2 d;分别以酸处理、碱处理、不处理玉米芯粉为吸附载体,冷风干燥法制备菌粉,制备方法见1.5.2。 1.6.4 载体与保护剂配方优化:选择混合载体配比、甘露醇、谷氨酸钠、甘油4个因素按L9(34)正交表设计实验(表 1),采用冷风干燥法制备菌粉,分别以室温保藏30 d及4 °C保藏60 d为响应值,获得最适菌粉制备配方。每组配制的保护剂溶液调至pH 8.0,高温灭菌备用。保护剂与浓缩菌液混合均匀后再与载体混匀。对照组(CK)载体为玉米芯粉,不添加保护剂;制备方法见1.5.2。| 水平 Level | 载体配比 a Mixed ratio of carries a | 甘露醇 Mannitol ( W/ W, %) | 谷氨酸钠 Sodium glutamate ( W/ W, %) | 甘油 Glycerol ( W/ W, %) |
| 1 | 0 | 1 | 1 | 1 |
| 2 | 1:2 | 4 | 5 | 5 |
| 3 | 1:1 | 7 | 10 | 10 |
Note: a: The mix ratio of diatomite to corncob powder pretreated by ammonia ( W/ W).
活菌数:测定采用稀释平板计数法;菌粉活菌数:称取一定量的菌粉,溶于30 mL 0.85%的生理盐水中,28 °C、220 r/min振荡30 min,取菌悬液稀释涂平板计数。

液体pH:室温条件下用pH计测定;固体pH:称取1 g固体,溶解于100 mL pH为7.0的水中测定pH,根据氢离子浓度换算出固体物质pH。
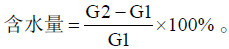
载体吸水能力:称取10 g载体,将蒸馏水和载体充分混匀,每次使用移液器加入1 mL,使载体湿润、疏松不结块,以每克载体吸水饱和的添加量来反应载体吸水能力,单位为mL/g。
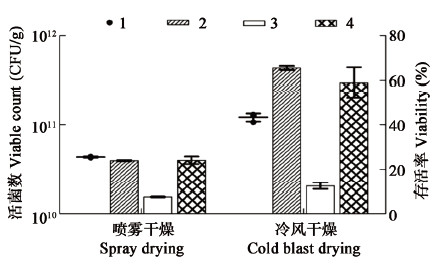
2 结果与分析 2.1 干燥方法的比较冷风干燥法与喷雾干燥法制成恶臭假单胞菌菌粉含水率分别为6.0%和6.9%。二者对菌粉制备的影响如图 1所示,冷风干燥制备菌粉在干燥和4 °C保藏存活率上明显优于喷雾干燥,室温保藏二者无显著差异。其中冷风干燥存活率达65%以上,4 °C保藏30 d存活率60%,室温保藏30 d存活率只有14%。冷风干燥法是一种较佳的菌粉制备方法,对菌体干燥损伤小,进一步提高菌粉保藏存活率是后续研究的重点。
|
|
图 1
不同干燥方法的效果
Figure 1
Effects of different drying methods
注:1:起始菌粉活菌数;2:干燥存活率;3:室温保藏30 d存活率;4:4 °C保藏30 d存活率. Note: 1: Instant viable cell count of J7 bacteria powder; 2: Viability of drying; 3: Viability after 30 d storage at RT; 4: Viability after 30 d storage at 4 °C. |
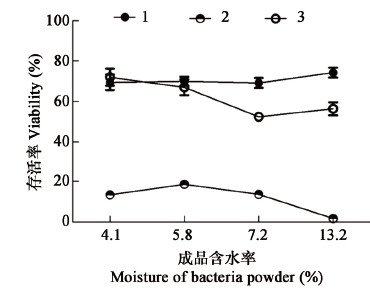
成品含水率对菌粉制备的影响如图 2所示,在一定范围内,随着成品含水率的升高,冷风干燥制备菌粉的干燥存活率有小幅的提升,说明干燥时间越短,干燥对菌体损伤越小。当成品含水率为13.2%,菌粉室温及4 °C保藏的存活率明显下降。分析原因是在较低含水率下,菌体更容易进入休眠状态。因此在制备冷风干燥菌粉时,必须控制成品含水率低于7%,避免保藏过程中回潮。
|
|
图 2
不同成品含水率对菌粉制备的影响
Figure 2
Effects of different moisture of bacteria powder
注:1:干燥存活率,2:室温保藏30 d存活率,3:4 °C保藏30 d存活率. Note: 1: Viability of drying; 2: Viability after 30 d storage at RT; 3: Viability after 30 d storage at 4 °C. |
3种载体对菌粉制备的影响如图 3所示,3种载体对菌体干燥存活率影响差异不显著,均能达到65%以上。菌粉室温和4 °C保藏结果表明,玉米芯粉为载体更利于菌粉的保藏,稻草粉次之,硅藻土最差。其中以玉米芯粉为载体,菌粉4 °C保藏180 d,存活率达36% (活菌数>3×1010 CFU/g)。
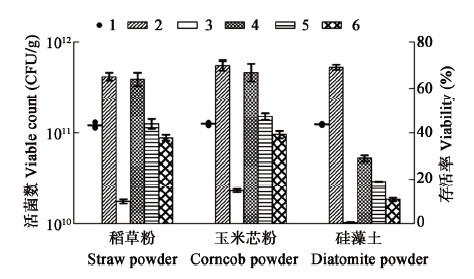
|
|
图 3
3种载体对菌粉制备的影响
Figure 3
Effects of different carriers
注:1:起始菌粉活菌数,2:干燥存活率,3:室温保藏30 d存活率,4:4 °C保藏30 d存活率,5:4 °C保藏60 d存活率,6:4 °C保藏180 d存活率. |
比较载体的物理特性(表 2)发现,玉米芯粉与稻草粉的吸水能力强于硅藻土,文献也有报道,玉米芯粉表面疏松,内部孔径较大[13],利于微生物的固定。此外,作者研究发现从自然含水率干燥到低于自然含水率这个干燥时间段,耗时相对较长,因此,考虑利用低自然含水率的硅藻土与玉米芯粉以一定配比混合,缩短干燥时长,同时增加菌剂的疏松性和均匀分散性。
| 载体 Carries | 自然含水率 Natural moisture (%) | 吸水能力 Absorbent ability (mL/g) |
| 稻草粉 Straw powder | 10.40 | 5.9 |
| 玉米芯粉 Corncob powder | 7.14 | 5.1 |
| 硅藻土 Diatomite powder | 0.03 | 2.3 |
酸处理、未处理、碱处理玉米芯粉的pH分别为5.93、7.12、8.02。玉米芯粉预处理对菌粉制备影响如图 4所示,碱处理后的玉米芯粉能提高菌粉保藏存活率,对干燥存活率没有影响;酸处理的玉米芯粉对菌粉的干燥及保藏均不利,说明碱性的环境更利于恶臭假单胞菌菌粉的保藏。
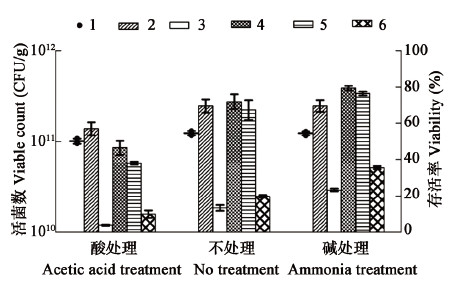
|
|
图 4
玉米芯粉预处理的效果
Figure 4
Effects of different pretreatment for corncob powder
注:1:起始菌粉活菌数,2:干燥存活率,3:室温保藏30 d存活率,4:4 °C保藏30 d存活率,5:4 °C保藏60 d存活率,6:4 °C保藏180 d存活率. Note: 1: Instant viable cell count of J7 bacteria powder; 2: Viability of drying; 3: Viability after 30 d storage at RT; 4: Viability after 30 d storage at 4 °C; 5: Viability after 60 d storage at 4 °C; 6: Viability after 180 d storage at 4 °C. |
菌粉制备正交试验 L9(34)及极差分析如表 3所示,冷风干燥菌粉制备最佳配方为:A2B3C2D1,菌剂活菌数为1.03×1011 CFU/g,室温保藏30 d菌剂的存活率提高到40.54%,4 °C保藏60 d存活率71.67%。对比CK组,室温存活率显著提高。
| 试验号 Medium No. | 因素 Factors | 响应值 Response value | ||||
| A 载体配比 * Mixed ratio of carries | B 甘露醇 Mannitol ( W/ W, %) | C 谷氨酸钠 Sodium glutamate ( W/ W, %) | D 甘油 Glycerol ( W/ W, %) | 室温30 d 存活率 Viability after 30 d storage at RT (%) | 4 °C 60 d存活率 Viability after 60 d storage at 4 °C (%) | |
| 1 | 0 | 1 | 1 | 1 | 20.43 | 65.12 |
| 2 | 0 | 4 | 5 | 5 | 19.73 | 59.53 |
| 3 | 0 | 7 | 10 | 10 | 8.60 | 50.30 |
| 4 | 1:2 | 1 | 10 | 5 | 5.92 | 60.33 |
| 5 | 1:2 | 4 | 1 | 10 | 5.17 | 48.77 |
| 6 | 1:2 | 7 | 5 | 1 | 40.54 | 71.67 |
| 7 | 1:1 | 1 | 5 | 10 | 1.99 | 47.36 |
| 8 | 1:1 | 4 | 10 | 1 | 22.00 | 58.37 |
| 9 | 1:1 | 7 | 1 | 5 | 0.75 | 51.83 |
| CK | 0 | 0 | 0 | 0 | 14.56 | 47.04 |
| K1 | 16.25 (58.31)# | 9.45 (57.60) | 8.78 (55.24) | 27.66 (65.06) | ||
| K2 | 17.21 (60.26) | 15.63 (55.56) | 20.75 (59.52) | 8.80 (57.23) | ||
| K3 | 8.25 (52.52) | 16.63 (57.93) | 12.17 (56.33) | 5.25 (48.81) | ||
| 极差 R | 8.96 (5.79) | 7.19 (2.38) | 11.97 (4.28) | 22.41 (16.25) | ||
Note: *: The mix of carries means the ratio of diatomite to corncob powder pretreated by ammonia ( W/ W); #: The outside of bracket shows viability after 30 d storage at RT and the inside shows viability after 60 d storage at 4 °C; CK: Control.
硅藻土与碱处理玉米芯粉配比为1:2时,保藏存活率最高,随着硅藻土比例增加,保藏存活率下降,说明添加一定比例的硅藻土并不会影响菌粉的保藏,但可以缩短干燥时长。
3种保护剂中,甘露醇浓度在1%−7%范围内,随着浓度增加,菌粉保藏存活率有所提高。说明甘露醇利于恶臭假单胞菌菌粉的保藏。谷氨酸钠浓度在1%−10%的范围内,随着浓度增加,保藏存活率先增加后减小。其中浓度为5%时,存活率最高,说明一定量的谷氨酸钠也能对菌体起到保护作用。甘油浓度在1%−10%范围内,随着浓度增加,菌粉保藏存活率呈下降趋势,1%的效果最好。
3 结论本研究采用冷风干燥法与载体吸附法相结合成功制备恶臭假单胞菌活菌粉,干燥存活率普遍达到65%以上,活菌数大于1011 CFU/g,优于Aoki等[6]和Palmfeldt等[7]的研究结果。原因是由于采用的冷风干燥温度为28 °C,不会对菌体造成损伤,并且利用的生物有机载体将菌体固定于微孔内,提供保护屏障。但是干燥过程中仍有大约35%的菌体死亡,可能是由于细胞脱水造成。
本研究对冷风干燥载体与保护剂深入优化,其中以玉米芯粉及稻草粉为载体制备的菌粉耐保藏性较高,原因可能是二者均属于生物有机载体,含有少量糖类、粗蛋白、氨基酸及微量元素[14, 15],生物兼容性好,吸附能力强。本研究发现,碱处理的玉米芯粉能增加菌粉的耐保藏性,原因可能是细胞代谢是一个产酸的过程,弱碱性的载体能削弱保藏过程中酸积累;另一方面,碱处理使玉米芯粉孔径增大,吸附性能增强[16]。本研究选用的保护剂中,甘露醇的保护作用可能由于其抗氧化性,Shen等发现植物叶绿体中的甘露醇能保护磷酸核酮糖激酶,从而防止氧自由基对植物的损害[17]。谷氨酸钠的保护作用可能是替代菌体蛋白受损[18, 19]。甘油为多羟基渗透型保护剂,然而研究发现,随着甘油浓度的提高,对恶臭假单胞菌菌粉的保护作用并没有增强,原因可能是菌粉含水率低,1%已是相对较高的浓度,浓度继续提升反而会造成细胞渗透压失衡。本研究制备的菌粉在室温条件下保藏存活率并不理想,但是4 °C保藏180 d存活率达到36%,活菌数可以达到3×1010 CFU/g,满足货架期的需求,依然具备应用价值。此外,研究可深入到载体的饱和吸附量及微观结构上,有望进一步提高制备菌粉活菌数。
冷风干燥制备恶臭假单胞菌菌粉,克服了目前革兰氏阴性菌难制备、难保藏的瓶颈。冷风干燥技术目前仍处于发展阶段,菌粉制备的大规模生产设备有待完善。作者认为,需增设一体化的物料水分监控装置,以准确控制成品含水率;为保证物料干燥的均匀性,辅助的搅拌装置或者干燥气流的分布器都有待改进。
| [1] | Yang GF, Wei YL. The research status and application prospect of Pseudomonas[J]. Biotechnology Bulletin, 2011(1): 37-39, 49 (in Chinese) 杨光富, 魏云林. 假单胞菌研究现状及应用前景[J]. 生物技 术通报, 2011(1): 37-39, 49 |
| [2] | Loh KC, Cao B. Paradigm in biodegradation using Pseudomonas putida—a review of proteomics studies[J]. Enzyme and Microbial Technology, 2008, 43(1): 1-12 |
| [3] | Sharma S, Pathak H. Pseudomonas in biodegradation[J]. International Journal of Pure & Applied Bioscience, 2014, 2(1): 213-222 |
| [4] | Weller DM. Pseudomonas biocontrol agents of soilborne pathogens: looking back over 30 years[J]. Phytopathology, 2007, 97(2): 250-256 |
| [5] | Kloepper JW, Schroth MN. Development of a powder formulation of rhizobacteria for inoculation of potato seed pieces[J]. Phytopathology, 1981, 71(6): 590-592 |
| [6] | Aoki M, Uehara K, Tsuji K, et al. Large-scale culture and preservation methods of Pseudomonas cepacia B5 for biological control against bacterial wilt disease[J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(4): 668-669 |
| [7] | Palmfeldt J, Rådström P, Hahn-Hägerdal B. Optimisation of initial cell concentration enhances freeze-drying tolerance of Pseudomonas chlororaphis[J]. Cryobiology, 2003, 47(1): 21-29 |
| [8] | Wang L. The technology and application of cooling air blast drying for animal food[J]. Refrigeration Technology, 2003(4): 28-30 (in Chinese) 王雷. 动物类食品冷风干燥技术及应用[J]. 制冷技术, 2003(4): 28-30 |
| [9] | Sun LW, Liu Q, Hou LL, et al. Effects of cold-blast air drying on quality and structure of scallop[J]. Academic Periodical of Farm Products Processing, 2013(12): 1-4, 7 (in Chinese) 孙丽雯, 刘倩, 侯丽丽, 等. 冷风干燥对扇贝柱品质及结构 的影响[J]. 农产品加工(学刊), 2013(12): 1-4, 7 |
| [10] | Yu W. Isolation of petroleum-degrading strains and study of their degrading characteristics[D]. Wuhan: Master’s Thesis of Huazhong Agricultural University, 2013 (in Chinese) 余薇. 石油降解微生物的筛选及其降解特性的研究[D]. 武汉: 华中农业大学硕士学位论文, 2013 |
| [11] | King EO, Ward MK, Raney DE. Two simple media for the demonstration of pyocyanin and fluorescin[J]. Journal of Laboratory and Clinical Medicine, 1954, 44(2): 301-307 |
| [12] | Han DD. Study of the microencapsulaton technology of gram-negative bacteria[D]. Dalian: Master’s Thesis of Dalian University of Technology, 2007 (in Chinese) 韩冬冬. 革兰氏阴性菌微胶囊制备技术的研究[D]. 大连: 大 连理工大学硕士学位论文, 2007 |
| [13] | Zhao L, Jiang XW, Bian JW, et al. Process conditions for L-lactic acid production by corncob-immobilized Rhizopus oryzae[J]. Food Science, 2013, 34(7): 201-205 (in Chinese) 赵龙, 蒋雪薇, 边佳为, 等. 玉米芯载体吸附法固定化米根 霉发酵L-乳酸的工艺条件[J]. 食品科学, 2013, 34(7): 201-205 |
| [14] | Chen JM, Yu WW, Wu H, et al. Analysis of the nutritional components of corn cobs[J]. Modern Food Science and Technology, 2012, 28(9): 1073-1075 (in Chinese) 陈家明, 余稳稳, 吴晖, 等. 玉米芯的营养成分分析[J]. 现代 食品科技, 2012, 28(9): 1073-1075 |
| [15] | Chen JC, Shen HS, Chen EL, et al. Effect of nutrients in rice straw on mycelium growth of Lentinula edodes[J]. Fujian Journal of Agricultural Sciences, 2001, 16(3): 35-38 (in Chinese) 陈君琛, 沈恒胜, 陈恩玲, 等. 稻草营养成分对香菇菌丝生 长的影响[J]. 福建农业学报, 2001, 16(3): 35-38 |
| [16] | Huang RL, Liu R, Su RX, et al. Aqueous ammonia pretreatment and enzymatic hydrolysis of corn cobs[J]. Chemical Engineering, 2009, 37(9): 40-43, 66 (in Chinese) 黄仁亮, 刘锐, 苏荣欣, 等. 玉米芯氨水预处理及酶解工艺 研究[J]. 化学工程, 2009, 37(9): 40-43, 66 |
| [17] | Shen B, Jensen RG, Bohnert HJ. Mannitol protects against oxidation by hydroxyl radicals[J]. Plant Physiology, 1997, 115(2): 527-532 |
| [18] | Tian SE, Cai JP. Effects of six kinds of protectants on shelf-life of Bdellovrio sp. BDS01[J]. Guangdong Agricultural Sciences, 2014, 41(16): 129-133 (in Chinese) 田双娥, 蔡俊鹏. 6种保护剂对蛭弧菌BDS01的保质作用研究 [J]. 广东农业科学, 2014, 41(16): 129-133 |
| [19] | Zhu AL, Yang J. The development of cryoprotector of biologic products and its protective mechanism[J]. Journal of Kashgar Teachers College, 2007, 28(6): 46-50 (in Chinese) 朱敖兰, 杨洁. 生物制品冻干保护剂及其保护机理的研究进 展[J]. 喀什师范学院学报, 2007, 28(6): 46-50 |
 2015, Vol. 42
2015, Vol. 42