扩展功能
文章信息
- 张俊玲, 章炉军, 刘建辉, 李亮, 尚晓冬, 谭琦
- ZHANG Jun-Ling, ZHANG Lu-Jun, LIU Jian-Hui, LI Liang, SHANG Xiao-Dong, TAN Qi
- 金针菇褐化病毒(FvBV)脱毒方法
- Elimination of Flammulina velutipes browning virus
- 微生物学通报, 2015, 42(10): 1952-1961
- Microbiology China, 2015, 42(10): 1952-1961
- 10.13344/j.microbiol.china.141014
-
文章历史
- 收稿日期: 2014-12-16
- 接受日期: 2015-01-27
- 优先数字出版日期(www.cnki.net): 2015-03-11
2. 上海市农业科学院食用菌研究所国家食用菌工程技术研究中心 上海 201403
2. Institute of Edible Fungi, Shanghai Academy of Agricultural Sciences, National Engineering Research Center of Edible Fungi, Shanghai 201403, China
金针菇(Flammulina velutipes)是我国工厂化发展最快、栽培范围最广、栽培量最大的食用菌。在金针菇栽培生产过程中病害防控是重要的技术难点,病毒病是众多病害的一种,具有潜伏期长、病症不稳定、不明显等特点,一旦发生将造成巨大的经济损失[1]。目前已报道金针菇菌株感染病毒后表现出菌丝生长变慢,子实体颜色异常、褐化,容易腐烂等一系列不正常现象[2, 3],降低了金针菇的品质和产量,对金针菇工厂化生产和设施化栽培已构成一种危害。因此,对金针菇进行快速检测病毒,并对带病毒菌株进行脱毒处理,为研究和生产提供无病毒优质菌种,对优化市场种质资源、育种选材、栽培生产等具有重要意义。
目前已报道的真菌和食用菌病毒绝大多数是双链RNA (Double-stranded RNA,dsRNA),而正常的生物组织内不存在dsRNA,dsRNA是绝大多数RNA病毒的表现形式或本身基因组的存在形式[4],故可通过检测食用菌中dsRNA的有无和大小进行病毒的初步检测,RT-PCR可进一步鉴定病毒种类[5]。目前dsRNA技术已广泛应用于果树[6]、葡萄[7]、稻瘟病菌(Pyricularia grisea)[8, 9]等病毒dsRNA检测,且在平菇[10]、香菇[11]、双胞蘑菇、金针菇[2, 3, 12]等食用菌的病毒检测中也得到了应用。
已报道制备脱毒菌种方法有菌丝尖端分离[13]、原基组织分离[14]和原生质体再生脱毒法[15]。菌丝尖端分离脱毒与植物茎尖分生组织脱毒原理和方法相似,通过切取单根菌丝尖端进行继代培养,连续继代若干次,电镜观察菌丝没有发现病毒粒子[13];原基组织分离脱毒是通过切取刚形成原基的组织分离培养得到脱毒菌种,在糙皮侧耳(Pleurotus ostreatus)中脱毒效果不佳[15];原生质体单核化脱毒法是将双核菌丝体酶解成原生质体,原生质体发生单核化再生后得到无病毒单核菌株,在糙皮侧耳原生质体再生脱毒中得到少数不含dsRNA的再生菌株,但对原生质体单核菌株脱毒效果没有检测[15, 16];有性生殖脱毒法是通过菌株在有性生殖过程中产生担孢子而得到脱毒孢子单核菌株,在糙皮侧耳(Pleurotus ostreatus) TD300中得到无病毒孢子单核菌株[17],但检测菌株数目较少;核迁移脱毒法是利用不同核型在交配过程中的核迁移现象[18],将带毒菌株的细胞核迁移至无毒菌株中,从而获得核迁移无毒双核菌株的方法。
本研究采用菌丝尖端分离、原基组织分离、原生质体单核化、有性生殖和核迁移共5种脱毒方法,对带金针菇褐化病毒(FvBV)菌株F-4889进行脱毒处理,利用dsRNA技术和RT-PCR对脱毒效果进行检测和鉴定,并结合脱毒菌株菌丝生长速度、生物量、漆酶活力等,比较这5种方法的脱毒效果,以期筛选出脱毒率高、脱毒后菌株的农艺性状等改善明显的脱毒方法,为栽培生产、育种选材、市场种质资源等提供无病毒优质菌种,促进我国金针菇产业健康稳定发展。
1 材料与方法 1.1 供试菌株“F-4889”菌株是昆山青禾食用菌科技有限公司工厂化栽培生产用种,由上海市农业科学院食用菌研究所菌种保藏中心保存。
1.2 培养基与栽培料PDMS再生培养基(g/L):土豆200,葡萄糖20,蔗糖200,琼脂粉20,蒸馏水定容至1 L,1×105 Pa灭菌30 min;GYM培养基(g/L):葡萄糖100,酵母提取物4,麦芽提取物10,蒸馏水定容至1 L,1×105 Pa灭菌30 min;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)和马铃薯葡萄糖肉汤(Potato dextrose broth,PDB)培养基(BD公司,美国)按说明书配制后,1×105 Pa灭菌30 min。
栽培料配方(干重比):30%木屑,40%玉米芯,26%麸皮,3%玉米粉,1%石膏,混合后加水至含水量65%,1×105 Pa灭菌150 min。
1.3 金针菇褐化病毒(FvBV)的检测和鉴定参照Magae [12]的方法处理F-4889菌株的菌丝体,Redzol法从处理后菌丝中提取双链RNA (dsRNA),根据已知的FvBV两个组分(dsRNA1:1.915 kb,NCBI登录号:AB465308;dsRNA2:1.730 kb,NCBI登录号:AB465309)的基因序列设计引物进行RT-PCR,扩增结果经电泳和测序证实F-4889菌株中带有FvBV [19]。本文采用dsRNA技术和RT-PCR法(引物FvBV-C2-S)对不同脱毒方法的脱毒效果进行检测。
1.4 不同脱毒方法脱毒效果的比较 1.4.1 菌丝尖端和原基组织分离脱毒:F-4889菌株采用菌丝尖端分离方法[13],连续7代分离培养,每代60个重复,对第5、6和7代存活的菌株进行脱毒效果检测;对F-4889菌株进行工厂化出菇试验[20],待原基形成后分离原基组织[14],获得原基组织分离菌株,随机抽取30个分离存活菌株进行脱毒效果检测。 1.4.2 原生质体单核化脱毒:制备F-4889菌株的原生质体,在含有PDMS再生培养基的平板上再生恢复,经纯化、显微镜鉴定后,建立原生质体单核体群体[21],随机抽取40株进行脱毒效果检测和交配型鉴定(将F-4889菌株中两个核的交配型定为A1B1和A2B2)[22]。将交配型亲和的脱毒单核菌株进行配对杂交获得原单杂交脱毒菌株并进行病毒dsRNA检测。 1.4.3 有性生殖脱毒:以步骤1.4.1出菇试验中F-4889菌株的子实体为研究材料,取将要开伞的金针菇鲜子实体,收集孢子印[22],涂平板,挑取单菌落,经纯化、显微镜鉴定等步骤,建立孢子单核体群体[23],随机抽取40株进行脱毒效果检测。将交配型亲和的脱毒单核菌株进行配对杂交获得单孢杂交脱毒菌株并进行病毒dsRNA检测。 1.4.4 核迁移脱毒:将步骤1.4.2中获得的原生质体单核菌株,选择经检测有dsRNA和无dsRNA交配型亲和的菌株进行单单杂交[18],探索利用不同核型在交配过程中的核迁移现象[24],将带毒菌株的细胞核迁移至脱毒菌株中,从而获得核迁移脱毒双核菌株。具体步骤如下:首先将脱毒的原生质体单核菌株接种于PDA培养皿(90 mm)离中心约10 mm处,19℃黑暗培养5 d,再将未脱毒单核菌株接种于上述培养皿,两菌块之间距离约20 mm,19℃继续黑暗培养7−10 d后,挑取先接种的脱毒菌株远离杂交线一端的菌丝,显微镜观察是否有锁状联合,将有锁状联合的菌株经纯化、显微镜鉴定等步骤获得核迁移双核菌株[18]。 1.5 脱毒效果电镜检测将待检测菌株接于含有GYM培养基的三角瓶中,19℃、120 r/min振荡培养10 d后收集菌丝体,参照Magae [12]的方法处理待检测菌株的菌丝体得到沉淀悬浮液,该悬浮液采用超速离心机(OPTIMAL-80XP) 150 000×g离心2 h,用PBS (0.1 mol/L,pH 7.0)悬浮沉淀,经2%磷钨酸负染色90 s,透射电镜(日立H-7650)观察病毒粒子的存在情况和形态特征。
1.6 不同脱毒方法处理菌株生长速度、生物量和漆酶活力比较 1.6.1 菌丝生长速度的测定:将不同脱毒方法处理菌株和出发菌株用打孔器(直径5 mm)制备成接种菌块,分别接入PDA培养皿中,19℃避光培养,每隔3 d划圈一次,共划2次,计算菌丝在PDA中的日平均生长速度,3个重复[25]。将不同脱毒处理菌株和出发菌株接种于含有栽培料的玻璃大试管(3 cm×20 cm×0.15 cm)中,当菌丝发满试管口料面时开始测量每隔7 d的菌丝生长距离,计算菌丝在培养料中的日平均生长速度,3个重复[23]。
1.6.2 生物量的测定:取10个1.6.1中用打孔器制备的菌块接种于含有120 mL PDB培养基的三角瓶中,19℃黑暗条件下,120 r/min振荡培养10 d,过滤、收集菌丝体,50℃烘箱烘至重量不再发生变化[26],称重,记录。 1.6.3 漆酶活力的测定:方法按照步骤1.6.2培养菌丝,14 d时取培养液1−2 mL[27],用ABTS法测定漆酶活力[28]。 2 结果与分析 2.1 dsRNA的提取、酶切验证和病毒种类鉴定从金针菇F-4889菌株的菌丝体中成功提取了病毒的dsRNA,分子量大小约2 kb (图 1A),与FvBV的病毒组分大小相似。将提取的dsRNA分别经DNase I和S1 Nuclease酶处理,排除DNA和mRNA干扰(图 1B)。利用RT-PCR鉴定 F-4889菌株中提取的dsRNA,扩增产物电泳检测结果:FvBV特异引物扩增出产物条带大小约1.8、0.6、1.7和0.5 kb,4个片段均符合预期大小(图 1C),表明菌株中所提取病毒为FvBV的病毒组分[19],RT-PCR中以FvBV-C2-S为引物鉴定各脱毒方法处理后菌株的脱毒效果。

|
|
图1
F-4889菌株的dsRNA、酶处理和RT-PCR鉴定结果
Figure 1
dsRNA extracted from F-4889 strain, dsRNA treated with endonuclease and identification results of RT-PCR
注:M1、M2:Marker. A:F-4889菌株提取的dsRNA. B:dsRNA经DNase I和S1 Nuclease酶处理,1和3:F-4889菌株;2:F-4889菌株经DNase I酶处理;4:F-4889菌株经S1 Nuclease酶处理. C:RT-PCR鉴定结果,1−4:分别为引物FvBV-C1-L、FvBV-C1-S、FvBV-C2-L和FvBV-C2-S扩增结果. Note: M1, M2: Marker. A: dsRNA extracted from the mycelium of F-4889 strain. B: Endonuclease result of dsRNA treated with DNase I and S1 Nuclease, 1 and 3: F-4889 strain, 2: F-4889 strain treated with DNase I, 4: F-4889 strain treated with S1 Nuclease. C: Identification results of RT-PCR, 1−4: Amplification results of the primers FvBV-C1-L, FvBV-C1-S, FvBV-C2-L and FvBV-C2-S, respectively. |

|
|
图2
菌丝尖端分离菌株和原基组织分离菌株dsRNA检测和RT-PCR鉴定
Figure 2
dsRNA detection and RT-PCR identification of hyphal tips isolation strains and primordium tissue isolation strains
注:A:菌丝尖端分离菌株和原基组织分离菌株的dsRNA;B:RT-PCR鉴定结果. M2:Marker;1:F-4889菌株;2−5:菌丝尖端分离5、6、7、7代菌株;6−18:原基组织分离菌株. Note: A: dsRNA extracted from strains of hyphal tips isolation and primordium tissue isolation; B: RT-PCR identification results. M2: Marker; 1: F-4889 strain; 2−5: 5, 6, 7 and 7 generation strains of hyphal tips isolation; 6−18: Primordium tissue isolation strains. |
增出大小为0.5 kb目的片段(图 2B),证明该dsRNA为FvBV的病毒组分,不存在dsRNA带型的菌株没有扩增出目的产物。以上结果表明:菌丝尖端分离法可以得到脱毒菌株;原生组织分离法未能获得脱毒菌株,该方法脱毒效果不佳。
2.2.2 原生质体单核化脱毒:将F-4889菌株原生质体单核化,获得292株原生质体单核菌株(存活率94.0%),随机抽取40株进行脱毒效果的检测,dsRNA检测结果表明,绝大多数的原生质体单核菌株有dsRNA带型,只有3株无dsRNA带型(交配型分别为A1B1、A1B1、A2B2),泳道1−3 (图 3A),脱毒率达7.5%,脱毒单核菌株配对杂交获得的2株原单杂交菌株中也无dsRNA带型,泳道7、8 (图 3A),说明该方法可以得到脱毒原菌株,同时脱毒单核菌株的获得也表明FvBV不存在菌丝体的细胞核中。 2.2.3 有性生殖脱毒:F-4889菌株经过有性生殖获得孢子单核菌株225株(存活率91.4%),随机抽取40株,dsRNA检测结果表明,在孢子单核菌株中,4株dsRNA带型很亮(10.0%),13株dsRNA带型亮度弱(32.5%),23株dsRNA带型完全消失(57.5%),泳道9−19 (图 3A);脱毒孢子单核菌株配对杂交获得的8株单孢杂交脱毒菌株经检测也不存在dsRNA带型,泳道20−23 (图 3A)。RT-PCR鉴定结果表明:步骤2.2.2和2.2.3中存在dsRNA带型的菌株均扩增出目的条带证明dsRNA为FvBV的病毒组分,无dsRNA带型的菌株均未扩增出条带(图 3B),表明该菌株中不存在FvBV,脱毒较彻底。

|
|
图3
原生质体单核菌株和孢子单核菌株dsRNA检测和RT-PCR鉴定
Figure 3
dsRNA technique and RT-PCR detected and identified strains of protoplast monokaryon (PM) and sporulated monocaryon (SM)
注:M2:Marker;A:原生质体单核菌株和孢子单核菌株dsRNA检测,1−6:原生质体单核菌株;7−8:原单杂交脱毒菌株;9−19:孢子单核菌株;20−23:单孢杂交脱毒菌株. B:RT-PCR鉴定结果,1−3:原生质体单核菌株(带毒);4−7:孢子单核菌株(带毒);8:原生质体单核菌株(脱毒);9−10:原单杂交脱毒菌株;11:孢子单核菌株(脱毒);12−13:单孢杂交脱毒菌株. Note: M2: Marker; A: Strains of PM and SM were detected by dsRNA technique, 1−6: PM strains; 7−8: Protoplast monokaryon hybridization virus elimination (PMHVE) strains; 9−19: SM strains; 20−23: single spore hybridization virus elimination (SSHVE) strains. B: RT-PCR identification results, 1−3: PM strains (virus-containing); 4−7: SM strains (virus-containing); 8: PM strains (virus-free); 9−10: PMHVE strains; 11: SM strains (virus-free); 12−13: SSHVE strains. |
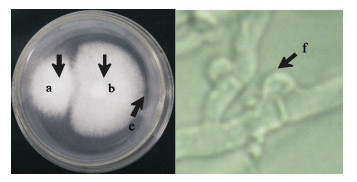
|
|
图4
单单杂交及核迁移双核菌株显微镜鉴定(400×)
Figure 4
Mono-mono mating and microscopic identification of nuclei migration’ dikaryotic strains (400×)
注:A:单单杂交,B:显微镜镜检. a和b:单核菌株,a:交配型为A1B1;b:交配型为A2B2;e:指通过核迁移获取的双核菌株位点;f:箭头所指为锁状联合. Note: A: Mono-mono mating; B: microscopic identification. a and b: Monokaryon strain, a: Mating type A1B1; b: Mating type A2B2; e: Indicate site of dikaryon strains obtained from using nuclei migration; f: The arrow indicate clamp connection. |
所有操作、菌丝量、点样量等均一致的情况下,F-4889出发菌株、菌丝尖端分离部分脱毒的菌株和核迁移脱毒菌株所提取的dsRNA电泳检测结果显示出很亮(图 2A,泳道1)、弱(图 2A,泳道2)、无(图 5,泳道9),将这3个菌株经步骤1.5处理,透射电镜检测脱毒效果结果如图 6所示:F-4889菌株中病毒粒子直径大小约25.0 nm,且数量较多(图 6A),

|
|
图5
核迁移双核菌株dsRNA检测
Figure 5
dsRNA detection of nuclei migration’ dikaryotic strains
注:M2:Marker;1−5:带毒原生质体单核菌株,交配型为A1B1;6:脱毒原生质体单核菌株,交配型为A2B2;7−11:核迁移双核菌株. Note: M2: Marker; 1−5: Protoplast monokaryon strains (virus-containing), mating type A1B1; 6: Protoplast monokaryon strains (virus-free), mating type A2B2; 7−11: Nuclei migration’ dikaryotic strains. |
菌丝尖端分离部分脱毒菌株中病毒数量较F-4889菌株降低(图 6B),而核迁移脱毒菌株则完全不存在病毒粒子(图 6C),这与dsRNA电泳检测结果一致,表明所有操作、处理等均一致的情况下,dsRNA电泳带型的有无和亮度在一定程度上可反映病毒粒子的有无和数量。

|
|
图6
F-4889出发菌株、菌丝尖端部分脱毒菌株和核迁移脱毒菌株的透射电镜观察结果
Figure 6
Electron micrograph of F-4889 original strain, hyphal tips isolation partial virus elimination strain and nuclei migration virus elimination strain
注:A:F-4889出发菌株;B:菌丝尖端部分脱毒菌株;C:核迁移脱毒菌株. 白色的线代表 200 nm. Note: A: F-4889 original strain;B: Hyphal tips isolation partial virus elimination strain;C: Nuclei migration virus elimination strain. The bar represents 200 nm. |
对5种脱毒方法的脱毒效果进行比较,结果表明:原基组织分离法未能得到脱毒菌株,这种脱毒方法效果不佳,而菌丝尖端分离、原生质体单核化和核迁移脱毒法均可得到脱毒的原菌株,脱毒率分别为25.0%、7.5%、100%,但菌丝尖端分离脱毒法分离成活率较低;而有性生殖脱毒法能得到脱毒菌株,且脱毒率高达57.5%,但不能得到脱毒的原菌株(表 1),因此可根据不同的脱毒目的、用途选择不同的脱毒方法。
| 脱毒方法 Methods | 存活率 surviving rate (%) | 存活菌株数(株) Number of surviving strains | dsRNA检测 dsRNA detection | 脱毒菌株数(株) Number of virus elimination strains | 脱毒率 Virus elimination rate (%) | 脱毒的原菌株数(株) Number of virus-eliminated original strain |
| 1 | 5.0 | 每代3−5 | 5,6,7代菌株 | 1 | 25.0 | 1 |
| 2 | 80.0 | 80 | 随机抽取30株 | 0 | 0 | 0 |
| 3 | 94.0 | 292 | 随机抽取40株 | 3 | 7.5 | 2 |
| 4 | 91.4 | 225 | 随机抽取40株 | 23 | 57.5 | 0 |
| 5 | 100 | 5 | 5株 | 5 | 100 | 5 |
Note: 1−5: Followed by virus elimination methods of hyphal tips isolation, primordium tissue isolation, protoplast monokaryonization, sexual reproduction and nuclei migration.
| 菌株 Strains | 菌丝生长速度(PDA) Mycelia growth rate (PDA) (mm/d) | 菌丝生长速度(栽培料) Mycelia growth rate (cultivation materials) (mm/d) | 生物量 Biomass (g) | 漆酶活性 Laccase activity (U) |
| 1 | 5.45±0.12 | 2.45±0.04 | 0.90±0.05 | 0.92±0.12 |
| 2 | 5.50±0.17 | 2.60±0.34 | 0.98±0.08 | 0.99±0.14 |
| 3 | 5.64±0.10* | 2.54±0.03 | 1.01±0.32 | 1.01±0.11 |
| 4 | 5.39±0.59 | 2.35±0.16 | 1.05±0.01 | 0.93±0.02 |
| 5 | 5.49±0.14 | 2.47±0.13 | 0.96±0.11 | 0.94±0.08 |
| 6 | 5.67±0.12* | 2.64±0.19* | 1.12±0.16* | 1.06±0.05* |
| 7 | 5.69±0.11* | 2.62±0.06* | 0.97±0.14 | 1.13±0.16* |
| 8 | 5.64±0.10* | 2.54±0.07 | 1.08±0.32* | 1.10±0.02* |
| 9 | 5.61±0.12* | 2.62±0.03* | 1.13±0.16* | 1.05±0.20* |
| 10 | 6.06±0.10** | 2.85±0.09** | 1.04±1.08* | 1.04±0.01* |
| 11 | 5.72±0.10* | 2.83±0.12** | 1.05±0.06* | 1.14±0.08** |
| 12 | 5.89±0.19** | 2.88±0.17** | 1.05±0.07* | 1.08±0.05* |
| 13 | 5.89±0.17** | 2.70±0.14* | 1.04±0.09* | 1.12±0.05** |
Note: Statistical data calculated from 3 replicates. *: significant difference at 0.05 level; **: extremely significant difference at 0.01 level. 1: F-4889 original strain; 2: hyphal tips isolation partial virus-eliminated strain; 3: hyphal tips isolation virus-eliminated strain; 4: Primordium tissue isolation strain; 5: Protoplast monokaryon hybridization virus-containing strain; 6 and 7: Protoplast monokaryon hybridization virus-free strains; 8 and 9: Nuclei migration virus elimination strains; 10−13: Single spore hybridization virus elimination strains.
生长速度差异显著,而带毒与脱毒的孢子单核菌株菌丝生长速度(PDA)之间进行t检验,P=0.841>0.05,表明带毒孢子单核菌株与脱毒孢子单核菌株之间菌丝生长速度无显著性差异。
2.5.2 生物量的测定:从不同脱毒方法处理菌株菌丝生物量的测定结果可以看出,脱毒菌株生物量均有所提高,方差分析表明,与原菌株相比,菌丝尖端和原基组织分离菌株生物量均未达到显著水平;原单核杂交脱毒菌株、核迁移脱毒菌株及4株单孢杂交脱毒菌株生物量均达到显著水平(表 2)。 2.5.3 漆酶活力的测定:测定不同脱毒方法处理菌株的漆酶活力,与原代菌株相比,这5种脱毒方法处理的菌株漆酶活力均有所增加。菌丝尖端和原基组织分离菌株漆酶活力无显著性差异,原单杂交脱毒菌株、核迁移脱毒菌株及4株单孢杂交脱毒菌株漆酶活力达到差异显著水平(表 2)。综合比较分析这5种脱毒方法的脱毒效果和脱毒后菌株的菌丝生长速度、生物量、漆酶活力等性状。菌丝尖端分离、原生质体单核化、核迁移脱毒法均可获得脱毒的原菌株,有性生殖脱毒法能获得脱毒菌株,但未能得到脱毒的原菌株,原基组织分离法未能获得脱毒菌株(表 1);菌丝尖端脱毒菌株的菌丝生长速度、生物量和漆酶活力等与出发菌株相比均有所增加,但没有达到显著差异水平,而原单杂交脱毒菌株、核迁移脱毒菌株、单孢杂交脱毒菌株达到显著水平(表 2)。因此,原生质体单核化、有性生殖和核迁移这3种脱毒方法脱毒效果较好,均能有效地脱除FvBV,脱毒率高,分别为7.5%、57.5%、100%,且脱毒后菌株的农艺性状等明显改善。
3 结论dsRNA技术是现阶段最普遍用于检测真菌病毒的方法,已广泛应用于真菌和植物病毒或类病毒的检测、病毒的分类和比较等方面的研究。dsRNA技术在食用菌如糙皮侧耳[15]、香菇[11]、金针菇[12]等的病毒检测也得到了广泛应用。国内金针菇工厂化生产菌种普遍遗传相似性高,亲缘关系近,可能有着相同的来源或相似的亲本[29],主栽金针菇品种F-4889中检测到FvBV病毒,表明国内所用金针菇菌种携带相同病毒的可能性也较高,对国内金针菇栽培生产构成潜在的威胁,及时对带病毒菌株进行脱毒处理,已成为金针菇栽培生产中必需要解决的问题。
本研究采用菌丝尖端分离、原基组织分离、原生质体单核化、有性生殖以及核迁移共5种方法对F-4889菌株进行脱毒处理,结果表明:菌丝尖端分离连续继代7次后得到一株脱毒菌株,说明菌丝尖端分离法能够获得脱毒菌株,这与张朝辉等[17]在粗皮侧耳研究中的结果一致,可能与菌丝结构有关[30];原基组织分离脱毒后所有菌株仍存在dsRNA带型,脱毒效果不明显,这与张朝辉等[17]、关园园等[15]在粗皮侧耳研究中的结果相一致。以上结果表明植物茎尖分生组织脱毒的原理和方法不太适于食用菌脱毒研究;有性生殖脱毒法脱毒率高达57.5%,带毒孢子单核菌株的获得说明FvBV可以通过担孢子进行垂直传播,该方法脱毒率高的原因可能在于子实体阶段病毒繁殖被抑制或者子实体生长发育速度远远大于病毒的繁殖速度,导致子实体阶段病毒浓度降低,有性生殖形成担孢子过程中可能得到较多的无病毒担孢子。
核迁移脱毒研究中,FvBV不能通过细胞核的迁移进行水平传播,这与郭杰等[31]在香菇中真菌病毒LeV能通过核迁移进行水平传播的结果不同,可能与病毒、寄主菌株种类有关,病毒侵染和传播力因病毒、寄主菌株种类不同而不同;也可能与核迁移有关,脱毒原生质体单核菌株的获得证明FvBV不在菌丝体的细胞核内,而是在细胞质中,单单杂交时可能细胞核的迁移速度较快,细胞质没有随着核的迁移而迁移[32],或者随细胞核迁移的细胞质很少,挑取菌丝时没有取到带毒菌株的细胞质或者量很少,无法检测到病毒的dsRNA。该方法的不足之处在于必需借助原生质体单核化脱毒法才能获得脱毒原菌株。针对核迁移脱毒法能否用于其它食用菌脱毒和双单或单单杂交育种工作中还有待于进一步研究。
不同脱毒方法处理后菌株的菌丝生长速度、生物量、漆酶活力等测定结果表明,菌丝尖端分离脱毒菌株未到达显著水平,可能在营养匮乏的琼脂上连续继代7次之后,影响了菌株的活力和代谢功能;其它方法所获得的脱毒菌株均达到显著差异水平,说明FvBV对菌丝的生长、漆酶活力等生理生化过程均有明显的抑制作用,这都充分表明5种脱毒方法中:原生质体单核化、有性生殖和核迁移脱毒法脱毒效果较佳,这3种方法均能有效脱除FvBV,可根据脱毒后菌株的目的、用途合理选择其中任何一种脱毒方法。
| [1] | Li YP, Liang ZP, Zhang XX, et al. Research progress in mushroom virus[J]. Chinese Agricultural Science Bulletin, 2006, 22(8): 408-413 (in Chinese)李彦鹏, 梁振普, 张小霞, 等. 食用菌病毒研究进展[J]. 中国农学通报, 2006, 22(8): 408-413 |
| [2] | Magae Y, Sunagawa M. Characterization of a mycovirus associated with the brown discoloration of edible mushroom, Flammulina velutipes[J]. Virology Journal, 2010, 7: 342 |
| [3] | Magae Y, Hayashi N. Double-stranded RNA and virus-like particles in the edible basidiomycete Flammulina velutipes (Enokitake)[J]. FEMS Microbiology Letters, 1999, 180(2): 331-335 |
| [4] | Ghabrial SA. New developments in fungal virology[J]. Advances in Virus Research, 1994, 43(1): 303-388 |
| [5] | Chen CL, Zhang ZX, Ying GH, et al. Detection of a rod-shaped virus in Lentinula edodes mycelium using RT-PCR[J]. Acta Edulis Fungi, 2011, 18(3): 79-82 (in Chinese)陈春乐, 张忠信, 应国华, 等. 香菇菌丝体杆形病毒的RT-PCR检测及鉴定[J]. 食用菌学报, 2011, 18(3): 79-82 |
| [6] | Jelkmann W. Cherry virus A: cDNA cloning of dsRNA, nucleotide sequence analysis and serology reveal a new plant capillovirus in sweet cherry[J]. Journal of General Virology, 1995, 76(8): 2015-2024 |
| [7] | Niu JX, Li DD. Virus detection by double-stranded RNA (dsRNA) analysis in grape[J]. Journal of Fruit Science, 2002, 19(3): 149-152 (in Chinese)牛建新, 李东栋. 葡萄病毒病的双链RNA(dsRNA)检测技术研究[J]. 果树学报, 2002, 19(3): 149-152 |
| [8] | Hunst PL, Latterell FM, Rossi AE. Variation in double-stranded RNA from isolates of Pyricularia oryzae[J]. Phytopathology, 1986, 76(7): 674-678 |
| [9] | Fang X, Ye HZ, Cao Y. Studies on double-strand RNA elements in Pyricularia grisea from sichuan province[J]. Journal of Sichuan Agricultural University, 2000, 18(4): 315-318 (in Chinese)方祥, 叶华智, 曹燕. 四川省稻瘟病菌中dsRNA因子的检测[J]. 四川农业大学学报, 2000, 18(4): 315-318 |
| [10] | Fu YY, Yang HY. Extraction and elimination of virus of dsRNA from Pleurotus ostreatus[J]. Northern Horticulture, 2013(12): 111-113 (in Chinese)付月月, 杨洪一. 平菇病毒dsRNA的提取及脱除[J]. 北方园艺, 2013(12): 111-113 |
| [11] | Wang L. Studies on the detection dsRNA virus of Lentinula edodes and virus-free strain[D]. Fuzhou: Master’s Thesis of Fujian Agriculture and Forestry University, 2009 (in Chinese)王丽. 香菇病毒的检测与脱毒研究[D]. 福州: 福建农林大学硕士学位论文, 2009 |
| [12] | Magae Y. Double stranded RNA elements in the cultivated Flammulina velutipes, shinano No.6[J]. Japanese Society of Mushroom Science and Biotechnology, 2003, 11(2): 93-96 |
| [13] | Last FT, Hollings M, Stone OM. Effects of cultural conditions on the mycelial growth of healthy and virus-infected cultivated mushrooms, Agaricus bisporus[J]. Annals of Applied Biology, 1974, 76(1): 99-111 |
| [14] | Cao DB. Virus-eliminated technology of edible fungi[J]. Beijing Agriculture, 2001(5): 21 (in Chinese)曹德宾. 食用菌种脱毒技术[J]. 北京农业, 2001(5): 21 |
| [15] | Guan YY, Zhou SJ, Wang Z, et al. Effect of protoplast regeneration technology on the virus elimination of Pleurotus ostreatus[J]. Mycosystema, 2011, 30(1): 108-115 (in Chinese)关园园, 周素静, 王震, 等. 原生质体再生对糙皮侧耳Pleurotus ostreatus 病毒脱除的效果[J]. 菌物学报, 2011, 30(1): 108-115 |
| [16] | van der Lende TR, Harmsen MC, Go SJ, et al. Double-stranded RNA mycoviruses in mycelium of Pleurotus ostreatus[J]. FEMS Microbiology Letters, 1995, 125(1): 51-56 |
| [17] | Zhang CH, Liu YM, Qi YC, et al. Comparisons of different methods for virus-elimination of edible fungi[J]. Chinese Journal of Virology, 2010, 26(3): 249-254 (in Chinese)张朝辉, 刘映淼, 戚元成, 等. 食用菌病毒脱毒方法的比较[J]. 病毒学报, 2010, 26(3): 249-254 |
| [18] | Liu JY, Liu XR, Deng YJ, et al. The application of the ‘bidirectional haploid nuclei migration’ in breeding and genetics of Lentinula edodes[J]. Mycosystema, 2011, 30(5): 774-781 (in Chinese)刘靖宇, 刘新锐, 邓优锦, 等. 双向核迁移在香菇遗传和育种中的应用研究[J]. 菌物学报, 2011, 30(5): 774-781 |
| [19] | Zhang JL, Zhang LJ, Tan Q, et al. Rapid detection and identijication of mycoving inthe main chltivated strains of Flammulina velutipes[J]. Chinese Agriculture Science Bulletin, 2015, 31(6): 234-240 (in Chinese)张俊玲, 章炉军, 谭琦, 等. 主栽金针菇品种中病毒的快速检测和鉴定[J]. 中国农学通报, 2015, 31(6): 234-240 |
| [20] | Xu Z, Shang XD, Tan Q. Multispore inbreeding and selection of Flammulina velutipes strains for industrial cultivation[J]. Acta Edulis Fungi, 2012, 19(4): 11-13 (in Chinese)徐珍, 尚晓冬, 谭琦. 多孢自交选育工厂化栽培的金针菇菌种[J]. 食用菌学报, 2012, 19(4): 11-13 |
| [21] | Zhang MY, Tan Q, Chen MJ, et al. Distribution of a specific SCAR marker among Lentinula edodes protoplast monokaryons for strain 135[J]. Mycosystema, 2008, 27(2): 252-257 (in Chinese)张美彦, 谭琦, 陈明杰, 等. 香菇135菌株特异 SCAR 标记在其原生质体单核中的分布[J]. 菌物学报, 2008, 27(2): 252-257 |
| [22] | Fu JS, Cai YS, Ke LN, et al. Mating system of Tricholoma giganteum[J]. Acta Edulis Fungi, 2007, 14(3): 10-12 (in Chinese)傅俊生, 蔡衍山, 柯丽娜, 等. 金福菇的交配型研究[J]. 食用菌学报, 2007, 14(3): 10-12 |
| [23] | Xu Z, Shang XD, Su R, et al. Cross breeding and selection of Flammulina velutipes hybrid strains for industrial cultivation[J]. Acta Edulis Fungi, 2008, 15(4): 26-30 (in Chinese)徐珍, 尚晓冬, 苏蓉, 等. 杂交选育工厂化生产的金针菇菌株[J]. 食用菌学报, 2008, 15(4): 26-30 |
| [24] | Fukuda M, Harada Y, Imahori S, et al. Inheritance of mitochondrial DNA in sexual crosses and protoplast cell fusions in Lentinula edodes[J]. Current Genetics, 1995, 27(6): 550-554 |
| [25] | Yang XM. Research Methods of the Edible Mushroom[M]. Beijing: China Agriculture Press, 1998 (in Chinese)杨新美. 食用菌研究法[M]. 北京: 中国农业出版社, 1998 |
| [26] | Xu K. Based on molecular markers assisted breeding for Ganoderma lucidum[D]. Nanjing: Master’s Thesis of Nanjing Agricultural University, 2014 (in Chinese)徐凯. 基于分子标记手段辅助灵芝育种的研究[D]. 南京: 南京农业大学硕士学位论文, 2014 |
| [27] | Zhang JJ. The development of agrobacterium tumefaciens-medidted transformation and ITS application in studying fruiting body development of basidiomycete Hypsizigus marmoreus[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2014 (in Chinese)张津京. 农杆菌介导的斑玉蕈遗传转化体系的建立及其在斑玉蕈子实体发育研究中的应用[D]. 南京: 南京农业大学博士学位论文, 2014 |
| [28] | Bourbonnais R, Paice MG. Veratryl alcohol oxidase from the lignin-degrading basidiomycete Pleurotus sajor-caju[J]. Biochemical Journal, 1988, 255, 445-450 |
| [29] | Lu H, Zhang LJ, Zhang D, et al. Genetic diversity analysis industry-cultivated Flammulina velutipes in china using SSR and AFLP markers[J]. Chinese Agricultural Science Bulletin, 2014, 30(19): 92-97 (in Chinese)陆欢, 章炉军, 张丹, 等. 中国金针菇工厂化生产用种SSR和AFLP遗传多样性分析[J]. 中国农学通报, 2014, 30(19): 92-97 |
| [30] | Zhang JX. China’s Edible Fungus Strains[M]. Beijing: China Agriculture Press, 2011 (in Chinese)张金霞. 中国食用菌菌种学[M]. 北京: 中国农业出版社, 2011 |
| [31] | Guo J, Wu XP. Transmission of mycovirus LeV in Lentinula edodes[J]. Acta Edulis Fungi, 2013, 20(3): 38-42 (in Chinese)郭杰, 吴小平. 香菇真菌病毒LeV的传播途径[J]. 食用菌学报, 2013, 20(3): 38-42 |
| [32] | Kües U. Life history and developmental processes in the basidiomycete Coprinus cinereus[J]. Microbiol and Molecular Biology Reviews, 2000, 64(2): 316-353 |
 2015, Vol. 42
2015, Vol. 42




