扩展功能
文章信息
- 史延华, 任磊, 贾阳, 赵百锁, 闫艳春
- SHI Yan-Hua, REN Lei, JIA Yang, ZHAO Bai-Suo, YAN Yan-Chun
- 施氏假单胞菌YC-YH1 的萘降解特性及产物分析
- Characteristics and product analysis of naphthalene degradation by Pseudomonas stutzeri YC-YH1
- 微生物学通报, 2015, 42(10): 1866-1876
- Microbiology China, 2015, 42(10): 1866-1876
- 10.13344/j.microbiol.china.140952
-
文章历史
- 收稿日期: 2014-11-27
- 接受日期: 2015-05-18
- 优先数字出版日期(www.cnki.net): 2015-05-21
在当代,随着石油消耗的增加,环境中多环芳烃(PAHs)的浓度也逐渐增大,广泛分布在空气、土壤、海水及沉淀物中[1, 2, 3, 4]。PAHs具有毒性、致突变性、潜在致癌性等特点,且不能够被自然环境条件轻易降解[1]。它们可对动植物种群产生毒害作用,经食物链的积累,从而对人类的健康造成严重损害[5, 6, 7]。萘是一种结构最简单的、具有两个苯环的PAHs,是美国环保署鉴定的优先控制的16种PAHs污染物之一,在环境中普遍存在,常用作研究PAHs环境降解的模式化合物[8, 9]。萘具有较低的水溶性和较高的固液分配系数,这使得它能够抵抗微生物的利用且促进其在土壤中浓度的增加[10]。
释放到环境中的萘能够通过一些途径移除,包括蒸发、光氧化、化学氧化、生物富集、生物降解和吸附。生物降解被认为是有效、经济且无二次污染的技术,如细菌和真菌等微生物可将萘转化为低毒或无毒化合物[11]。近几十年来,人们已经发现了多种能够降解萘的菌种,包括微球菌(Micrococcus sp.)[12]、假单胞菌(Pseudomonas sp.)[13]、产碱菌(Alcaligenes sp.)[14]、红球菌(Rhodococcus sp.)[15]和棒状杆菌(Corynebacteria sp.)[16]等,并阐明了萘在需氧和厌氧条件下的降解途径[17, 18, 19]。生物降解速率及程度受到多种因素的影响,包括pH、温度、氧气、生物接种量、营养物质等[20, 21, 22],为了更好地去除污染物,降解微生物应得到最优的培养条件而得到最快的生长和降解速率。本文研究了各个因素对菌株YC-YH1降解萘的影响,并运用响应面法优化萘的降解条件并检测其在最优条件下对萘的降解能力。同时利用LC-MS鉴定施式假单胞菌降解萘的代谢产物,推测其降解途径,为水体环境中萘污染的生物修复提供了理论和实验基础。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株:所用菌株为本实验室分离的可同时降解毒死蜱和萘的降解菌施氏假单胞菌(Pseudomonas stutzeri) YC-YH1,在中国普通微生物菌种保藏管理中心的保藏号为CGMCC 9624。 1.1.2 试剂:萘(浓度>99.5%)购自国药集团化学试剂有限公司,硝酸铵、氯化钠、硫酸铵、磷酸盐等均为国产分析纯,蛋白胨、酵母粉购自OXID公司,色谱纯甲醇购自Fisher公司。 1.1.3 仪器:Aglient 1200高效液相色谱仪,Zorbax Eclipse Plus C18色谱柱(4.6 mm×150 mm×5 μm),二极管阵列(DAD)检测器,LC-MS仪器为一台二元泵液相色谱Agilent 1260连接一台三重四级杆质谱仪Agilent QQQ 6420,HDL HZQ-F160型振荡培养箱,JSP超声波清洗器,Thermo Scientific BioMate 3S紫外可见光分光光度计,哈希(HACH) COD测定仪的配置为一台DRB200消解器和一台DR2800分光光度计以及配套的COD预制试管。 1.1.4 培养基:LB培养基和IM无机盐培养基参照文献[21]配制。 1.1.5 磷酸盐(PBS)缓冲液(g/L):NaCl 8.00,KCl 0.20,Na2HPO4 1.42,KH2PO4 0.27,pH 7.4。 1.1.6 碳源萘的添加[13, 23]:准确称量2.0 g固体萘溶于20 ml丙酮中,制成浓度为1×105 mg/L的萘储备液。在研究的前期实验中已证明菌株YC-YH1不能够利用丙酮作为碳源进行生长,所以选择丙酮作为溶剂。实验时将所需体积的萘储备液滴加至灭菌后的无机盐液体培养基IM中,加盖密封。 1.2 实验方法 1.2.1 降解菌的接种:将施氏假单胞菌YC-YH1接种到LB液体培养基中,30 °C、180 r/min振荡培养至OD600为0.6,取10 mL菌液,5 000 r/min离心收集沉淀,用PBS缓冲液洗涤沉淀2次,用IM培养基悬浮后接种到含100 mL IM培养基和萘的250 ml螺口锥形瓶中,盖紧瓶盖,暗处振荡培养。 1.2.2 环境单因素对萘降解的影响:研究检测多种单因素包括初始pH值、培养温度和初始接种量对萘降解的影响。以10%接种量、30 °C、pH 7.0、180 r/min、100 mg/L萘浓度为基本条件,通过改变条件中的接种量(1%,5%,10%,15%,20%)、温度(10,20,30,40,50 °C)、pH (5.0,6.0,7.0,8.0,9.0),在其他条件不变的情况下进行单因素试验,培养4 d后测定菌株对萘的降解率。各单因素设计以不接种为对照,每个处理分别进行3次重复。 1.2.3 响应面优化菌株YC-YH1对萘的降解条件:选择能够显著影响萘降解速率的因素进行条件优化:培养温度范围为20−40 °C,pH为5.0−9.0,接种量为1%−20%。利用Box-Behnken设计进行响应面分析以优化培养条件。菌株YC-YH1接种到萘浓度为100 mg/L的IM培养基中,以萘为唯一碳源培养4 d。实验设计如表 1所示。| 变量 Variance | 编码 Code | 编码水平 Code level | ||
| −1 | 0 | 1 | ||
| 温度 Temperature (°C) | X1 | 20 | 30 | 40 |
| pH值 pH value | X2 | 6 | 7 | 8 |
| 接种量 Inoculums amount (%) | X3 | 5 | 10 | 15 |
COD的测定按照哈希COD检测说明手册进行。取2 ml样品加入到哈希COD预制试管中,轻轻颠倒混匀,然后放入到DRB200消解器中,在150 °C下加热2 h,冷却至室温,用DR2800分光光度计在620 nm波长下测定样品中COD的含量。
1.2.6 菌株YC-YH1降解萘代谢产物的检测:将菌株YC-YH1接种到含萘浓度为100 mg/L的100 mL IM培养基中,在优化条件下培养24 h。取10 mL培养物在5 000 r/min离心10 min,去除菌体,在上清液中加入浓度为2 mol/L的盐酸,将pH调整为2.0,然后加入等体积的乙酸乙酯,超声波振荡萃取10 min,用分液漏斗将有机相和水相分离,再重复萃取一次,将两次的乙酸乙酯合并用无水Na2SO4除去水分后,用旋转蒸发仪在30 °C水浴中蒸发近干,然后用20 mL色谱纯甲醇重溶。取100 μL重溶样品用甲醇进行稀释,使其含有的萘的浓度低于1 mg/L,0.22 μm滤膜过滤后上机检测。将过滤后的样品用LC-MS质谱进行检测,流动相为100%甲醇,流速0.2 mL/min,直接进样,进样量1 μL,使用ESI源,在负离子模式下进行母离子扫描检测。质谱仪的毛细管电压和碎裂电压分别设置为3 500 V和150 V,源温度和去溶剂化温度分别设为150 °C和350 °C,离子扫描范围设为100−200 Da。使用软件Agilent MassHunter收集和分析数据。
1.2.7 菌株YC-YH1降解萘的质量平衡分析:将菌株YC-YH1接种到含萘100 mg/L的100 mL IM培养基中,在优化条件下培养,每隔2 h取样,并按1.2.6所述方法萃取培养物中的代谢产物,将过滤后的样品用高效液相色谱检测。 2 结果与分析 2.1 温度对YC-YH1降解萘的影响温度是影响微生物体内物质代谢过程的一个重要环境因素,它能够通过影响降解酶的活性来调节微生物对外源物质的降解速度。在适宜的温度范围内,细菌的代谢能达到较高的速率,从而能较快的降解外源物质。温度单因素对YC-YH1降解萘的影响如图 1所示,30 °C时菌株YC-YH1对萘的降解效率最高,达到100%;40 °C时的降解效率也较高,为96.4%;20 °C下的降解率较低,为76.7%;最低温10 °C和最高温50 °C时明显抑制菌株YC-YH1对萘的降解,降解率分别为33.8%和39.6%。该结果表明温度对YC-YH1降解萘具有较大影响。

|
| 图 1 温度对YC-YH1降解萘的影响 Figure 1 The effect of temperature for the naphthalene degradation of YC-YH1 |
pH值能够对蛋白质的空间构象产生显著影响,过低或过高的pH值均能够降低酶的活性,不利于降解酶活性的发挥。同时,不适宜的pH值会使得细胞膜上的电荷产生变化,从而影响菌株对营养物质的吸收,改变微生物的生长速度并影响其代谢途径[24]。因此,微生物菌体及其产生的降解酶通常只能在特定的pH值范围内具有活性。图 2所示为pH对YC-YH1降解萘的影响,pH为7.0和8.0时,具有最高的降解效率,分别为100%和94.3%,pH为6.0时菌株YC-YH1对萘的降解率较低,达到84.2%;当pH为5.0和9.0时的降解效率分别为19.3%和25.4%。从结果可以看出,碱性和酸性条件下,菌株YC-YH1对萘的降解效率都很低。

|
| 图 2 pH对YC-YH1降解萘的影响 Figure 2 The effect of pH for the naphthalene degradation of YC-YH1 |
细菌在培养物中的生长可以分为:迟缓期、对数期、稳定期和衰亡期4个阶段。当菌体的初始接种量较少时,生长的迟缓期较长,从而导致菌株对底物的降解时间也变长,适当扩大接种量,可以缩短迟缓期,从而缩短底物的降解时间。但当初始接种量太高时,会导致单个菌体吸收不到充足的碳源和能源用于生长,从而导致反应速率降低,因此初始接种量也是影响菌株对底物降解的较为关键的因素[24]。
接种量对YC-YH1降解萘的影响如图 3所示,接种量为1%时,菌株对萘的降解效率较低,仅为52.7%,当接种量小于5%时,YC-YH1对萘的降解效率随着初始接种量的增加而增高。但当接种量超过5%后,接种量的继续增加对降解率的提高作用十分有限,初始降解率有所上升但后期的降解率有所降低,这是因为初始接种量过大会使培养物中的菌体浓度过大,而生长所需的营养物质相对不足,产生种内竞争从而降低降解效率。因此,从降解效果以及经济角度考虑,接种量不宜过高,以5%左右为宜,且还需进一步优化。
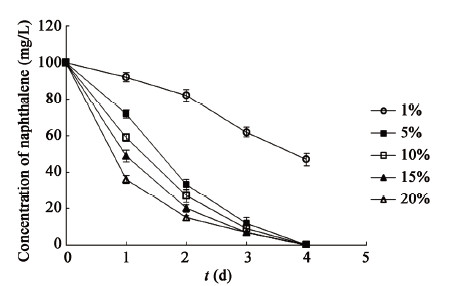
|
| 图 3 接种量对YC-YH1降解萘的影响 Figure 3 The effect of inoculums amount for the naphthalene degradation of YC-YH1 |
基于单因素实验结果,在萘浓度为100 mg/L条件下,选取培养温度、接种量和pH值3个因素,利用Design-Expert软件(版本V.8.0.5)对菌株YC-YH1降解萘的条件进行Box-Behnken设计,萘降解率为响应值,每个因素取3个水平。实验设计及结果如表 2所示。
| 实验序号 Experimental No. | 编码 Code | 萘降解率 Degradation of naphthalene (%) | ||
| X1 | X2 | X3 | ||
| 1 | −1 | 0 | −1 | 88.3 |
| 2 | 1 | 0 | −1 | 94.6 |
| 3 | 0 | 1 | −1 | 93.1 |
| 4 | 0 | −1 | 1 | 84.5 |
| 5 | 0 | −1 | −1 | 89.2 |
| 6 | 0 | 0 | 0 | 98.7 |
| 7 | −1 | −1 | 0 | 76.4 |
| 8 | −1 | 0 | 1 | 83.1 |
| 9 | −1 | 1 | 0 | 78.2 |
| 10 | 0 | 0 | 0 | 99.3 |
| 11 | 0 | 1 | 1 | 93.5 |
| 12 | 0 | 0 | 0 | 99.4 |
| 13 | 1 | 1 | 0 | 89.3 |
| 14 | 1 | 0 | 1 | 96.7 |
| 15 | 1 | −1 | 0 | 84.5 |
| 16 | 0 | 0 | 0 | 97.2 |
| 17 | 0 | 0 | 0 | 98.4 |
对实验结果进行方差分析,由表 3可知,X1、X2、X12、X22、对萘降解率的影响极显著(P<0.001),
| 来源 Source | 离差平方和 Sum of squares | 自由度 df | 均方 Mean square | F value | P-value Prob>F |
| Model | 876.64 | 9 | 97.40 | 81.73 | <0.000 1 |
| X1 | 191.10 | 1 | 191.10 | 160.35 | <0.000 1 |
| X2 | 47.53 | 1 | 47.53 | 39.88 | 0.000 4 |
| X3 | 6.84 | 1 | 6.84 | 5.74 | 0.047 7 |
| X1X2 | 2.25 | 1 | 2.25 | 1.89 | 0.211 8 |
| X1X3 | 13.32 | 1 | 13.32 | 11.18 | 0.012 4 |
| X2X3 | 6.50 | 1 | 6.50 | 5.46 | 0.052 2 |
| X12 | 266.12 | 1 | 266.12 | 223.29 | <0.000 1 |
| X22 | 307.80 | 1 | 307.80 | 258.27 | <0.000 1 |
| X32 | 2.632E-003 | 1 | 2.632E-003 | 2.208E-003 | 0.963 8 |
| 残差Residual | 8.34 | 7 | 1.19 | ||
| 失拟Lack of fit | 5.20 | 3 | 1.73 | 2.21 | 0.229 5 |
| 纯误差Pure error | 3.14 | 4 | 0.78 | ||
| 总和 Cor total | 884.98 | 16 |
说明温度、pH和接种量是降解过程中的重要因素,其中温度和pH的影响最大。失拟项不显著(P>0.05),说明数据中没有异常点,模型适当[22]。对模型的可信度进行方差分析,结果见表 4。
| 项目 Item | 数据 Data | 项目Item | 数据 Data |
| 标准差 Std. Dev. | 1.09 | 复相关系数 R-Squared | 0.990 6 |
| 均值 Mean | 90.85 | 校正相关系数 Adj R-Squared | 0.978 5 |
| 变异系数 C.V.% | 1.20 | 预测相关系数 Pred R-Squared | 0.900 4 |
| 预测残差平方 PRESS | 88.15 | 信噪比 Adeq Precisior | 27.559 |
根据响应面系数的回归分析,得到该次模型的拟合方程为:Y=98.60+4.89X1+2.44X2−0.92X3+0.75X1X2+1.83X1X3+1.28X2X3−7.95X12−8.55X22+0.025X32。
根据分析结果得出,回归模型极显著(P<0.001),失拟不显著(P=0.229 5>0.05),表明回归方程拟合度良好,可信度高;回归方程的复相关系数为0.990 6,表明此模型可以解释99.06%的萘降解率的变化[22]。该方程为菌株YC-YH1降解萘提供了一个合适的模型。两个最显著因素培养温度和pH值交互影响菌株YC-YH1降解萘的响应面图和等高线图如图 4所示。利用软件对回归模型进行规范分析,得到萘最大降解率所对应的因素水平为:温度32.42 °C,pH为7.08,接种量为5.74%,预测的最大降解率为99.82%。
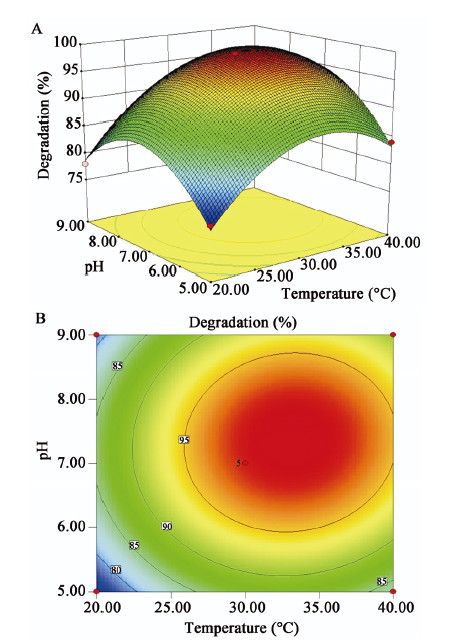
|
| 图 4 温度和pH值对萘降解率影响的响应面图(A)和等高线(B) Figure 4 Response surface (A) and contour graphs (B) of the effect of temperature and pH for degradation rate of naphthalene |
根据响应面优化得到的条件,以5.74%接种量将YC-YH1菌株接种到含有萘浓度为100 mg/L的pH 7.10的无机盐培养基中,32.4 °C、80 r/min振荡培养。得到的结果如图 5A所示。在第3天YC-YH1即可将萘完全降解,降解率为100%,与回归方程的理论预测值相近,误差为0.18%。可见该模型较好的预测了菌株YC-YH1对萘的降解情况。
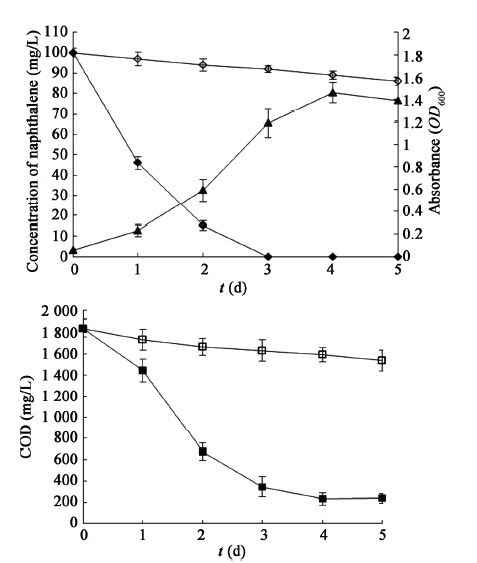
|
|
图 5
最优条件下菌株YC-YH1的生长曲线和萘降解曲线(A)和COD变化曲线(B)
Figure 5
Bacterial growth curve of strain YC-YH1 during degrading naphthalene under optimum conditions (A) and COD curve (B)
注:◇:100 mg/L萘对照;◆:YC-YH1对萘的降解曲线;▲:菌株的生长曲线;¢:接种YC-YH1的培养基中COD变化曲线;£:对照组的COD变化曲线. Note: ◇: 100 mg/L naphthalene control; ◆: Naphthalene degrading curve inoculated YC-YH1; ▲: Microbial growth curve; ¢: COD curve inoculated YC-YH1; £: COD curve uninoculated YC-YH1. |
从图 5B可以看出,在接种菌株YC-YH1的培养物中,COD的去除率与萘的降解趋势稍有差异,而与菌株生长曲线的变化趋势基本吻合。这些菌株在接种后的第0−1天处于延滞期,细菌生长量少,这是因为当菌株从营养丰富的LB培养基中转移到条件较为苛刻的无机盐培养环境中时,会出现延滞期。此时,细胞首先要将萘代谢成为中间代谢产物,萘的残留量会有较大程度的降低,但培养基中总的化学物质的量仍较高,所以COD的去除率不高。第1−3天,菌株处于对数生长期,生长较快,此时COD的去除率不断提高,表明此阶段菌株能够充分利用萘为碳源,大量繁殖。第3−4天,此时培养基中的萘已降解完全,但仍含有部分中间代谢产物,所以菌株仍能生长,且COD进一步降低。第4−5天,培养基中的碳源已经消耗完毕,菌株停止生长,且有部分细胞死亡,释放出一些化合物,导致COD有些许增加。
2.6 菌株YC-YH1降解萘代谢产物的检测据报道,假单胞菌对萘的降解分为两条途径:一条为水杨酸途径,萘首先被双加氧酶和脱氢酶催化生成1,2-二羟基萘,随后生成水杨酸,然后被水杨酸羟化酶转化为邻苯二酚,最终进入三羧酸循环被彻底降解;另一条途径为龙胆酸途径,萘被转化为水杨酸,随后被单加氧酶催化生成龙胆酸,然后通过龙胆酸途径被彻底降解[25, 26]。
液体培养基中萘的代谢产物的LC-MS检测结果表明,在负离子模式下有4种萘代谢相关产物的母离子被检测到。其中质荷比m/z=127.00 [M-H]¯的峰鉴定为萘,质荷比m/z=159.00 [M-H]¯的峰鉴定为1,2-二羟基萘,质荷比m/z=137.00 [M-H]¯的峰鉴定为水杨酸,质荷比m/z=109.00 [M-H]¯的峰鉴定为邻苯二酚,见图 6。这表明施氏假单胞菌YC-YH1可以将萘通过水杨酸途径进行降解,代谢产物最终通过三羧酸循环(TCA)生成水和二氧化碳,如图 7所示。

|
| 图 6 菌株YC-YH1对萘代谢产物的LC-MS图 Figure 6 LC-MS scanning profile of the metabolite of naphthalene during the degradation by strain YC-YH1 |
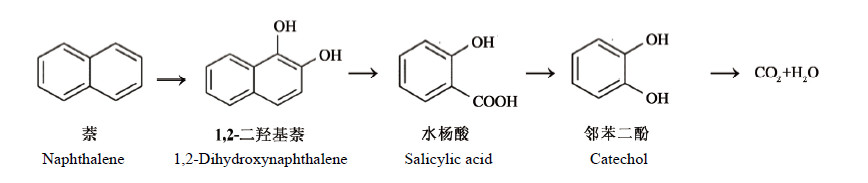
|
| 图 7 菌株YC-YH1对萘的降解途径 Figure 7 Degradation pathway of naphthalene by strain YC-YH1 |
为检验在IM无机盐培养基中菌株YC-YH1对萘降解途径及代谢产物的唯一性,对萘降解实验进行了进一步的质量平衡分析,结果如表 5所示。在接种菌株YC-YH1后,对萘及其代谢产物进行检测,培养2 h后,萘和1,2-二羟基萘的浓度分别为98.4 mg/L和2.2 mg/L,其浓度之和(100.6 mg/L)等于萘在培养前的初始浓度(100 mg/L)的100.6%。在培养4 h后,所检测到的萘、1,2-二羟基萘和水杨酸的浓度分别为94.3、5.1和1.4 mg/L,其浓度之和(100.8 mg/L)等于萘初始浓度的100.8%。同样地,培养6 h和8 h时溶液中的萘与其产物之间仍存在良好的质量平衡关系,误差均在2%范围内。然而,光照10 h和12 h时,溶液中所检测到的萘及代谢产物的总量分别为初始值的97.5%和96.4%,表明萘与其产物之间的质量平衡关系变差,这是因为在降解过程中生成了新的物质如CO2和H2O,这些产物无法被正己烷萃取,从而未检测到。
| 时间 Time (h) | 萘 Naphthalene (mg/L) | 1,2-二羟基萘 1,2-Dihydroxynaphthalene (mg/L) | 水杨酸 Salicylic acid (mg/L) | 邻苯二酚 Catechol (mg/L) | 总浓度 Total concentration (mg/L) |
| 0 | 100.0 | 0 | 0 | 0 | 100.0 |
| 2 | 98.4 | 2.2 | 0 | 0 | 100.6 |
| 4 | 94.3 | 5.1 | 1.4 | 0 | 100.8 |
| 6 | 89.2 | 8.6 | 2.1 | 0 | 99.9 |
| 8 | 85.9 | 12.4 | 5.2 | 1.7 | 101.2 |
| 10 | 73.4 | 15.1 | 6.8 | 2.2 | 97.5 |
| 12 | 68.7 | 16.2 | 8.1 | 3.4 | 96.4 |
研究表明,环境因素能够影响微生物对外源物质的生物降解,对这些影响因素进行优化能够提高降解菌的生物降解速率。本研究通过单因素实验方法对影响菌体降解速率的各个因素进行了评价,得到了影响最显著的3个因素,pH、温度、接种量及其适应范围。但单因素实验没有充分考虑到环境因素之间相互作用对菌株降解效率的影响,因此还需要其他的实验设计对影响因素进行进一步优化。
响应面法(Response surface method,RSM)是一种对试验条件中各个因素进行综合优化的方法,适宜处理环境因素影响实验中所产生的大量非线性数据。通过对所产生的数据进行回归拟合并绘制相应的响应曲面和等高线,可以快速得出对应于各个影响因素不同水平的响应值。在此基础上,可以得出响应面优化模型所预测的响应最优值及其相应的各个影响因素的水平。本研究在单因素实验结果的基础上,利用Design-Expert 8.0.5软件中含有的Box-Behnken实验设计对pH、温度、接种量3个因素进行响应面优化分析,建立了对萘降解率影响的优化模型,优化了菌株YC-YH1对萘的降解条件。经实验证实,在培养温度为32.4 °C、pH 7.10、接种量5.74%(体积比)的条件下培养3 d即可将浓度为100 mg/L的萘100%降解。结果表明,降解条件的优化能够促进YC-YH1菌株对萘的生物降解,可提高萘的降解效率。
Tattersfield于1928年首次发现土壤中的细菌能够降解萘[27]。随后,许多研究者陆续分离到多种能够利用萘作为碳源进行降解的细菌和真菌。本研究中的施氏假单胞菌YC-YH1能够在3 d内将浓度为100 mg/L的萘100%降解,其降解效率高于大部分已分离到的萘降解菌,如余兵等分离到一株纺锤芽孢杆菌(Bacillus fusiformis)可以利用萘作为碳源进行生长,需要96 h才能完全降解无机盐培养基中浓度为100 mg/L的萘[28],假单胞菌N7在萘浓度为100 mg/L的无机盐培养基中经72 h对萘的降解率为95.66%[13]。然而,YC-YH1对高浓度萘的耐受性和降解效率低于部分降解菌,例如微球菌N-1在最适条件下培养72 h后,对浓度小于500 mg/L的萘的降解率可达94.7%以上[29],宋昊等分离到的帕氏氢噬胞菌(Hydrogenophaga palleronii) LHJ38在最适条件下培养96 h后对浓度为2 000 mg/L的萘的降解率大于98%[23]。
Davies和Evans于1964年首次报道了萘生物降解的可能途径[30]。随着研究的进展,研究人员对萘代谢途径的了解已比较深入[26, 31]。萘的微生物降解主要有好氧和厌氧两种降解模式。萘的好氧生物降解途径主要有两种,一种为邻苯二酚途径[32],萘首先在加氧酶的作用下生成1,2-二羟基萘,然后经加氧酶和脱氢酶作用生成水杨酸,而后被羟化酶转化为邻苯二酚,最后在邻位裂解酶和双加氧酶的催化下进行间位或者邻位裂解开环,降解为小分子物质,进入三羧酸循环生成CO2和H2O。另一条途径为龙胆酸途径[33, 34],萘在加氧酶和脱氢酶的作用下生成水杨酸后,在水杨酸羟化酶的作用下,生成龙胆酸,而后经过一系列的氧化作用被降解成为小分子物质。在好氧降解途径中的关键酶和限速酶是萘双加氧酶(其编码基因为nahAC)[35, 36]、水杨醛脱氢酶(其编码基因为nahF)[37]、水杨酸羟化酶(其编码基因为nahG)[38]和儿茶酚2,3-双加氧酶(其编码基因为nahH)[38],同时也发现了一些萘降解基因簇萘,如nah-like基因簇、phn基因簇、phd基因簇和nid基因簇等[39, 40]。厌氧生物降解途径也分为两种,一种是萘的双苯环结构中2号位碳原子的羧基化[41, 42],然后由加氢辅酶对苯环进行二次加氢和羧基化,使苯环开环,形成较易被厌氧微生物利用的结构;另一种途径是将富马酸引入到萘结构中[43],进行甲基化,然后经脱氢辅酶的多次作用,对苯环进行羧基化开环,从而被进一步降解。
本研究对萘代谢产物的分析表明,菌株YC-YH1能够利用萘作为唯一的碳源和能源生长,同时能将萘按照萘→1,2-二羟基萘→水杨酸→邻苯二酚→三羧酸循环的途径降解萘,最终生成二氧化碳和水。该降解途径为好氧的邻苯二酚代谢途径,虽与大部分已报道的假单胞菌中萘的降解途径相似,但是首次以LC-MS和COD检测的方法明确了施氏假单胞菌中萘的代谢产物,并检测了培养过程中的质量平衡关系,为进一步探究菌株YC-YH1中萘降解的编码基因和遗传机制奠定了基础。
| [1] | Patel V, Jain S, Madamwar D. Naphthalene degradation by bacterial consortium (DV-AL) developed from Alang- Sosiya ship breaking yard, Gujarat, India[J]. Bioresource Technology, 2012, 107: 122-130 |
| [2] | Jeon CO, Park M, Ro HS, et al. The naphthalene catabolic (nag) genes of Polaromonas naphthalenivorans CJ2: evolutionary implications for two gene clusters and novel regulatory control[J]. Applied and Environmental Microbiology, 2006, 72(2): 1086-1095 |
| [3] | Sukor MZ, Yin C, Savory RM, et al. Biodegradation kinetics of naphthalene in soil medium using Pleurotus ostreatus in batch mode with addition of fibrous biomass as a nutrient[J]. Bioremediation Journal, 2012, 16(3): 177-184 |
| [4] | Batterman S, Chin JY, Jia C, et al. Sources, concentrations, and risks of naphthalene in indoor and outdoor air[J]. Indoor Air, 2012, 22(4): 266-278 |
| [5] | Dong Y, Han TT, Shen X, et al. The current situation of study on agriculture soil[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2013, 44(1): 155-159 (in Chinese) 董彦, 韩甜甜, 沈向, 等. 我国农业土壤中PAHs研究现状[J]. 山东农业大学学报: 自然科学版, 2013, 44(1): 155-159 |
| [6] | Chang Y, Cheng H, Lai S, et al. Biodegradation of naphthalene in the oil refinery wastewater by enriched activated sludge[J]. International Biodeterioration & Biodegradation, 2014, 86(Part C): 272-277 |
| [7] | Kleemann R, Meckenstock RU. Anaerobic naphthalene degradation by Gram-positive, iron-reducing bacteria[J]. FEMS Microbiology Ecology, 2011, 78(3): 488-496 |
| [8] | Xu JH, Li RQ, Li HJ, et al. Isolation and identification of naphthalene-degrading strains and determination of dehydrogenase activity[J]. Journal of Shanxi University (Natural Science Edition), 2013, 36(3): 471-474 (in Chinese) 徐建红, 李日强, 李红娇, 等. 萘降解菌的分离鉴定以及脱 氢酶活性的测定[J]. 山西大学学报: 自然科学版, 2013, 36(3): 471-474 |
| [9] | Wang B, Liu ZP, Long XH, et al. Isolation and degradation pathway of a naphthalene- degrading strain[J]. Natural Product Research and Development, 2012, 24(12): 1697-1702 (in Chinese) 王博, 刘兆普, 隆小华, 等. 一株萘降解菌的筛选及其降解 途径[J]. 天然产物研究与开发, 2012, 24(12): 1697- 1702 |
| [10] | Lin C, Shen F, Tan C, et al. Characterization of Gordonia sp. strain CC-NAPH129-6 capable of naphthalene degradation[J]. Microbiological Research, 2012, 167(7): 395-404 |
| [11] | Rockne KJ, Strand SE. Anaerobic biodegradation of naphthalene, phenanthrene, and biphenyl by a denitrifying enrichment culture[J]. Water Research, 2001, 35(1): 291-299 |
| [12] | Jegan J, Vijayaraghavan K, Senthilkumar R, et al. Naphthalene degradation kinetics of Micrococcus sp., isolated from activated sludge[J]. CLEAN-Soil, Air, Water, 2010, 38(9): 837-842 |
| [13] | Jia Y, Yin H, Ye JS, et al. Characteristics and pathway of naphthalene degradation by Pseudomonas sp. N7[J]. Environmental Science, 2008, 29(3): 756-762 (in Chinese) 贾燕, 尹华, 叶锦韶, 等. 假单胞菌N7的萘降解特性及其降解 途径研究[J]. 环境科学, 2008, 29(3): 756-762 |
| [14] | Guerin WF, Boyd SA. Maintenance and induction of naphthalene degradation activity in Pseudomonas putida and an Alcaligenes sp. under different culture conditions[J]. Applied and Environmental Microbiology, 1995, 61(11): 4061-4068 |
| [15] | Grund E, Denecke B, Eichenlaub R. Naphthalene degradation via salicylate and gentisate by Rhodococcus sp. strain B4[J]. Applied and Environmental Microbiology, 1992, 58(6): 1874-1877 |
| [16] | Nath N, Deb JK. Partial characterization of small plasmids from Corynebacterium renale[J]. Plasmid, 1995, 34(3): 229-233 |
| [17] | Galushko A, Minz D, Schink B, et al. Anaerobic degradation of naphthalene by a pure culture of a novel type of marine sulphate-reducing bacterium[J]. Environmental Microbiology, 1999, 1(5): 415-420 |
| [18] | Langenhoff AA, Zehnder AJ, Schraa G. Behaviour of toluene, benzene and naphthalene under anaerobic conditions in sediment columns[J]. Biodegradation, 1996, 7(3): 267-274 |
| [19] | Lin C, Gan L, Chen Z. Biodegradation of naphthalene by strain Bacillus fusiformis(BFN)[J]. Journal of Hazardous Materials, 2010, 182(1): 771-777 |
| [20] | Song J, Gu J, Zhai Y, et al. Biodegradation of nicosulfuron by a Talaromyces flavus LZM1[J]. Bioresource Technology, 2013, 140: 243-248 |
| [21] | Shi YH, Qu J, Li K, et al. Isolation, identification and degradative properties of CP1 for chlorpyrifos[J]. Microbiology China, 2011, 38(9): 1311-1338 (in Chinese) 史延华, 曲杰, 李康, 等. CP1菌株的分离, 筛选及其对毒死 蜱的降解[J]. 微生物学通报, 2011, 38(9): 1311-1338 |
| [22] | Liu Y, Zhang XY, Bai YL, et al. Optimization of response surface for degrading phorbol esters in Jatropha curcas seed cake through Klebsiella variicola solid-state fermentation[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(3): 431-438 (in Chinese) 刘莹, 张晓喻, 白艳林, 等. 利用响应面优化Klebsiella variicola 对麻疯树籽饼粕佛波酯的固态发酵降解[J]. 应用与 环境生物学报, 2014, 20(3): 431-438 |
| [23] | Song H, Qiu S, Zhang J, et al. Study on Hydrogenophaga Palleronii LHJ38-a naphthalene- degrading strain with high activity[J]. Environmental Protection of Chemical Industry, 2006, 26(2): 87-90(in Chinese) 宋昊, 邱森, 章俭, 等. 高活性萘降解细菌Hydrogenophaga Palleronii LHJ38的研究[J]. 化工环保, 2006, 26(2): 87-90 |
| [24] | Yang X, Tang YB, Chen FY, et al. Isolation and identification of naphthalene- degrading strain and its degradation characteristics[J]. Environmental Science &Technology, 2011, 34(10): 43-47 (in Chinese) 杨旭, 唐玉斌, 陈芳艳, 等. 一株萘降解菌的分离鉴定及其 降解特性研究[J]. 环境科学与技术, 2011, 34(10): 43-47 |
| [25] | Li SS. Biological function and transcriptional regulatory model of salicylaldehyde dehydrogenase NahV in naphthalenedegrading Pseudomonas putida ND6[D]. Tianjin: Doctoral Dissertation of Nankai University, 2011 (in Chinese) 李珊珊. 萘降解菌株Pseudomonas putida ND6中水杨醛脱氢 酶NahV 的生物学功能和转录调控[D]. 天津: 南开大学博士 学位论文, 2011 |
| [26] | Zhao BS, Wang H, Li RR, et al. Recent advances in biodegradative mechanism of polycyclic aromatic hydrocarbons by aerobic bacteria[J]. Microbiology China, 2008, 35(3): 414-420 (in Chinese) 赵百锁,王慧,李瑞瑞,等. 好氧细菌对多环芳烃降解机制 的研究进展[J]. 微生物学通报, 2008, 35(3): 414-420 |
| [27] | Tattersfield F. The decomposition of naphthalene in the soil and the effect upon its insecticidal action[J]. Annals of Applied Biology, 1928, 15(1): 57-80 |
| [28] | Yu B, Jin XY, Kuang Y, et al. Characteristics and kinetics of naphthalene biodegradation by Bacillus fusiformis (BFN)[J]. Chinese Journal of Environmental Engineering, 2014, 8(6): 2611-2616 (in Chinese) 余兵,金晓英,况烨,等. 纺锤芽孢杆菌(Bacillus fusiformis) 降解萘的特性及动力学[J]. 环境工程学报, 2014, 8(6): 2611-2616 |
| [29] | Wen HY, Liao YZ, Li XD. Degradation characteristics of naphthalene by strain N-1[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(1): 96-98 (in Chinese) 温洪宇, 廖银章, 李旭东. 菌株N-1对萘的降解特性研究[J]. 应用与环境生物学报, 2006, 12(1): 96-98 |
| [30] | Davies JI, Evans WC. Oxidative metabolism of naphthalene by soil pseudomonads. The ring-fission mechanism[J]. Biochemical Journal, 1964, 91(2): 251-261 |
| [31] | Harayama S. Polycyclic aromatic hydrocarbon bioremediation design[J]. Current Opinion in Biotechnology, 1997, 8(3): 268-273 |
| [32] | Seo J, Keum Y, Li QX. Bacterial degradation of aromatic compounds[J]. International Journal of Environmental Research and Public Health, 2009, 6(1): 278-309 |
| [33] | Wang Y, Xin JY, Song H, et al. Advances in biodegradation of naphthalene[J]. China Biotechnology, 2009, 29(9): 119-124 (in Chinese) 王艳, 辛嘉英, 宋昊, 等. 生物降解萘的研究进展[J]. 中国生 物工程杂志, 2009, 29(9): 119-124 |
| [34] | Tomás Gallardo L, Gómez álvarez H, Santero E, et al. Combination of degradation pathways for naphthalene utilization in Rhodococcus sp. strain TFB[J]. Microbial Biotechnology, 2014, 7(2): 100-113 |
| [35] | Lloyd-Jones G, Laurie AD, Hunter DW, et al. Analysis of catabolic genes for naphthalene and phenanthrene degradation in contaminated New Zealand soils[J]. FEMS Microbiology Ecology, 1999, 29(1): 69-79 |
| [36] | Bosch R, Garcı?a-Valdés E, Moore ER. Genetic characterization and evolutionary implications of a chromosomally encoded naphthalene-degradation upper pathway from Pseudomonas stutzeri AN10[J]. Gene, 1999, 236(1): 149-157 |
| [37] | Li W, Shi J, Wang X, et al. Complete nucleotide sequence and organization of the naphthalene catabolic plasmid pND6-1 from Pseudomonas sp. strain ND6[J]. Gene, 2004, 336(2): 231-240 |
| [38] | Xu ZY, Chen WL. Isolation and identification of naphthalene degrading bacteria and characterization of its degradation pathways[J]. Journal of Huazhong Agricultural University, 2015, 34(1): 59-65 (in Chinese) 徐中阳, 陈雯莉. 萘降解菌的分离、鉴定及降解途径[J]. 华中 农业大学学报, 2015, 34(1): 59-65 |
| [39] | Li CX. Isolation, identification and application on naphthalene-degrading Bacteria[D]. Changchun: Master’s Thesis of Changchun University of Science and Technology, 2014 (in Chinese) 李春霞. 环境污染物—萘降解菌的筛选、鉴定及应用[D]. 长 春:长春理工大学硕士学位论文, 2014 |
| [40] | Ma J. Isolation of PAHs-degrading bacteria and characterization of the degradation metabolism[D]. Dalian: Doctoral Dissertation of Dalian University of Technolgy, 2013 (in Chinese) 马静. 多环芳烃降解菌的筛选、降解机理及降解性能研究[D]. 大连:大连理工大学博士学位论文, 2013 |
| [41] | Sun MM, Teng Y, Luo YM. Progresses in anaerobic biodegradation of polycyclic aromatic hydrocarbons—A review[J]. Acta Microbiologica Sinica, 2012, 52(8): 931-939 (in Chinese) 孙明明,滕应,骆永明. 厌氧微生物降解多环芳烃研究进展 [J]. 微生物学报, 2012, 52(8): 931-939 |
| [42] | Meckenstock RU, Mouttaki H. Anaerobic degradation of non-substituted aromatic hydrocarbons[J]. Current Opinion in Biotechnology, 2011, 22(3): 406-414 |
| [43] | Musat F, Galushko A, Jacob J, et al. Anaerobic degradation of naphthalene and 2-methylnaphthalene by strains of marine sulfate-reducing bacteria[J]. Environmental Microbiology, 2009, 11(1): 209-219 |
 2015, Vol. 42
2015, Vol. 42




