扩展功能
文章信息
- 赵晶, 张福蓉, 崔一, 许永斌, 陈明, 权春善, 范圣第
- ZHAO Jing, ZHANG Fu-Rong, CUI Yi, XU Yong-Bin, CHEN Ming, QUAN Chun-Shan, FAN Sheng-Di
- 嗜水气单胞菌群体感应信号分子AI-2 的细胞外生物合成及活性检测
- In vitro biosynthesis and activity detection of quorum sensing signal molecule AI-2 of Aeromonas hydrophila
- 微生物学通报, 2015, 42(10): 1858-1865
- Microbiology China, 2015, 42(10): 1858-1865
- 10.13344/j.microbiol.china.141010
-
文章历史
- 收稿日期: 2014-12-16
- 接受日期: 2015-02-05
- 优先数字出版日期(www.cnki.net): 2015-03-11
2.大连工业大学生物工程学院 辽宁大连 116034
2.School of Biological Engineering,Dalian Polytechnic University,Dalian,Liaoning 116034,China
嗜水气单胞菌(Aeromonas hydrophila)是一种广泛存在于水体环境中的革兰氏阴性菌,能够导致鱼类的出血性败血症,是水产养殖中最常见的致病菌之一[1]。嗜水气单胞菌的致病性与其产生的毒力因子及生物膜的形成密切相关[2]。其病害的有效防治是水产养殖业面临的重要问题。
研究发现,细菌中存在群体感应(quorum sensing,QS)现象,细胞密度达到一定阈值后,细菌能够感知自体诱导的信号分子(autoinducers,AIs)浓度,进而调控毒力相关基因的表达,表现出致病性[3]。因此,对QS系统的研究有助于深入了解细菌的致病机理。目前发现多种水生病原菌中均存在LuxS/AI-2 QS系统,LuxS参与催化AI-2信号分子的合成。该QS系统能够调控多种毒力基因的表达[4, 5, 6, 7, 8, 9]。嗜水气单胞菌菌株ATCC7966基因组信息表明,其存在着LuxS同源蛋白的基因,预测嗜水气单胞菌中可能存在LuxS/AI-2 QS系统。
细菌体内AI-2的生物合成途径如下:以S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)作为甲基供体,在甲基转移酶的作用下,产生中间产物S-腺苷高半胱氨酸(S-adenosylhomocysteine,SAH),SAH在甲硫腺苷(methylthioadenosine,MTA)/S-腺苷高半胱氨酸核苷酶(Pfs/MTAN)和LuxS蛋白的催化作用下,生成等摩尔的4,5-羟基-2,3戊二酮(4,5-dihydroxy-2,3-pentanedione,DPD)和高半胱氨酸,DPD通过化学重排生成AI-2[10]。
本研究拟对嗜水气单胞菌AI-2进行检测,并对嗜水气单胞菌中LuxS和Pfs同源蛋白进行表达和纯化,实现AI-2的细胞外生物合成及活性检测。该研究有利于嗜水气单胞菌群体感应信号分子AI-2纯品的制备,将为其结构的解析和QS系统对致病性调控作用的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株及其培养条件:嗜水气单胞菌ATCC7966,购自中国普通微生物菌种保藏管理中心(CGMCC)。哈维氏弧菌BB152 (野生型哈维氏弧菌BB120 luxLM::Tn5)和哈维氏弧菌BB170 (野生型哈维氏弧菌BB120 luxN::Tn5),由中国农业科学院上海兽医研究所韩先干研究员馈赠。哈维氏弧菌MM77 (野生型哈维氏弧菌BB120 luxLM::Tn5,luxS::Tn5)由普林斯顿大学Bassler B. L.教授馈赠。嗜水气单胞菌于Luria-Bertani (LB)培养基[11]中培养。哈维氏弧菌于AB培养基[12]中培养,培养温度均为28 °C。 1.1.2 主要试剂及仪器:pET-28a(KmR)和pPROEX- HTa(ApR)载体由本实验室保存;限制性内切酶EcoR I和Hind III、T4 DNA连接酶、ExTaq DNA聚合酶、DNA胶回收试剂盒、DNA纯化试剂盒、质粒提取试剂盒等,均购自宝生物工程(大连)有限公司;Flx800荧光发光微孔检测仪,购自美国伯腾(BioTek)仪器有限公司;BioDrop μLite超微量分光光度计,购自英国柏楉(Biochrom)有限公司。 1.2 方法 1.2.1 嗜水气单胞菌AI-2的活性检测:利用哈维氏弧菌报告菌株BB170检测AI-2的活性,哈维氏弧菌BB152和MM77培养至OD600为1.0−1.1的无菌上清液分别作为阳性对照和阴性对照。哈维氏弧菌BB170于AB培养基中培养至OD600为1.0−1.1,用AB培养基按照1:5 000的比例稀释BB170培养液,分别加入10%的嗜水气单胞菌无菌上清液、哈维氏弧菌BB152、MM77的无菌上清液和AB培养基。28 °C培养4 h,培养液加入96孔板中,用荧光发光微孔检测仪上预存的检测程序读取发光读数,检测其发光强度。以报告菌株培养液稀释后仅加入AB培养基作为空白对照,AI-2的活性用相对发光强度表示,即上清液中AI-2诱导发光强度相对于空白对照诱导发光强度的倍数。 1.2.2 嗜水气单胞菌LuxS、MtnN-1、MtnN-2氨基酸序列分析:利用美国国家生物技术信息中心(The National Center for Biotechnology Information,NCBI)网站信息,选取具有代表性的LuxS和Pfs氨基酸序列,提供序列在Genbank中登录号。用软件ClustalX 1.81将嗜水气单胞菌LuxS、MtnN-1、MtnN-2氨基酸序列与代表性序列进行多重序列比对,用软件DNAman 6.0进行序列比对分析及着色处理。 1.2.3 嗜水气单胞菌| 引物 Primer | 序列 Sequence (5′→3′) | 酶切位点 Restriction site |
| luxS-F luxS-R | ccggaattcatgccgttattggac cccaagctttcagaggcttttcag | EcoR I Hind III |
| mtnN-1-F mtnN-1-R | ccggaattcatggcggccaagccg cccaagctttcaggctttgttgaagccgt | EcoR I Hind III |
| mtnN-2-F | ccggaattcatgaaagtaggtattatcggcgc | EcoR I |
| mtnN-2-R | cccaagctttcacagcttgccgagcat | Hind III |
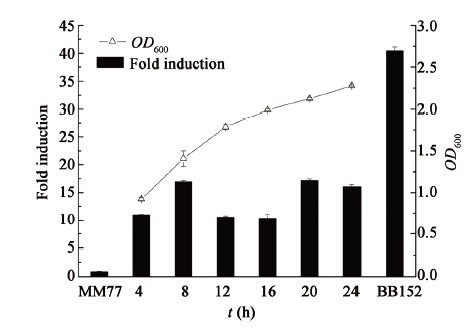
利用哈维氏弧菌报告菌株BB170检测AI-2的活性,结果表明,嗜水气单胞菌菌株ATCC7966培养不同时间后制备的无菌上清液均能诱导BB170发光(图 1),证明嗜水气单胞菌能够合成信号分子AI-2。发光强度表明,AI-2在嗜水气单胞菌培养前12 h呈先增加后降低的趋势,其活性在8 h达到空白对照的16.96倍(OD600为1.4)。在12−24 h内,AI-2的活性先降低后增加,24 h略有下降。其活性在20 h达到空白对照的17.2倍。
|
|
图 1
嗜水气单胞菌生长过程中AI-2活性检测
Figure 1
Detection of AI-2 activity in Aeromonas hydrophila culture
注:OD600为嗜水气单胞菌培养液吸光值. Note: OD600 corresponding to absorbance of Aeromonas hydrophila culture. |
NCBI中提供的嗜水气单胞菌ATCC7966基因组信息显示,嗜水气单胞菌中含有LuxS和Pfs蛋白编码基因。与其他微生物不同的是,嗜水气单胞菌中含有两种Pfs蛋白编码基因mtnN-1和mtnN-2。在AI-2生物合成中,MtnN-1与MtnN-2是否均具有催化活性仍有待研究。
选取几种具有代表性的LuxS氨基酸序列与嗜水气单胞菌菌株ATCC7966 LuxS氨基酸序列进行比对(图 2),结果表明,嗜水气单胞菌LuxS与革兰氏阴性菌LuxS有较高同源性,如大肠埃希氏菌(一致性79.29%),以及水生病原菌哈维氏弧菌(一致性76.33%)和迟钝爱德华氏菌(一致性78.70%);与革兰氏阳性菌LuxS同源性较低,如肺炎链球菌(一致性33.12%)和解淀粉芽孢杆菌(一致性35.90%)。据报道,几个高度保守的氨基酸(H54−H58−C128)是金属离子结合位点,组成LuxS蛋白的催化中心[13],保守的C83/E57氨基酸位点也在LuxS催化活性中起重要作用[14];此外,保守的G93也被证实为产生AI-2所必需的氨基酸[15]。在嗜水气单胞菌LuxS氨基酸序列中可见以上保守氨基酸位点,表明其很可能具有LuxS家族成员蛋白的功能。

|
|
图 2
LuxS氨基酸序列比对
Figure 2
LuxS amino acid sequence alignment
注:1:哈维氏弧菌BB120 (登录号AAD17292);2:嗜水气单胞菌ATCC7966 (登录号ABK38869);3:迟钝爱德华氏菌ATCC 23685 (登录号EFE24408);4:大肠埃希氏菌O104:H4 C227-11 (登录号EGT69648);5:肺炎链球菌Kor74 (登录号AFC91868); 6:解淀粉芽孢杆菌FZB42 (登录号ABS75126). Note: 1: Vibrio harveyi BB120 (accession no. AAD17292); 2: Aeromonas hydrophila ATCC7966 (accession no. ABK38869); 3: Edwardsiella tarda ATCC 23685 (accession no. EFE24408); 4: Escherichia coli O104:H4 C227-11 (accession no. EGT69648); 5: Streptococcus pneumoniae Kor74 (accession no. AFC91868); 6: Bacillus amyloliquefaciens FZB42 (accession no. ABS75126). |
选取几种具有代表性的Pfs氨基酸序列与嗜水气单胞菌ATCC7966 Pfs氨基酸序列进行比对(图 3),结果表明,嗜水气单胞菌Pfs与革兰氏阳性菌及阴性菌Pfs同源性差别不大。与MtnN-1相比,MtnN-2与代表性蛋白同源性较高,如大肠埃希氏菌(一致性53.71%),以及水生病原菌哈维氏弧菌(一致性53.48%)和迟钝爱德华氏菌(一致性55.46%);如肺炎链球菌(一致性46.72%)和解淀粉芽孢杆菌(一致性50.87%)。MtnN-1与代表性蛋白同源性较低,如大肠埃希氏菌(一致性22.33%)、哈维氏弧菌(一致性20.35%)和迟钝爱德华氏菌(一致性21.65%);如肺炎链球菌(一致性23.37%),解淀粉芽孢杆菌(一致性23.38%)。

|
|
图 3
Pfs氨基酸序列比对
Figure 3
Pfs amino acid sequence alignment
注:1:哈维氏弧菌CAIM 1792 (登录号EMR37082);2:嗜水气单胞菌ATCC7966 MtnN-1 (登录号ABK36761);3:嗜水气单胞菌MtnN-2 (登录号ABK39195);4:迟钝爱德华氏菌ATCC 15947 (登录号GAC64529);5:大肠埃希氏菌O104:H4 C227-11 (登录号EHF20296);6:肺炎链球菌R6 (登录号AAK99698);7:解淀粉芽孢杆菌UASWS BA1 (登录号ERK82321). Note: 1: Vibrio harveyi CAIM 1792 (accession no. EMR37082); 2: Aeromonas hydrophila ATCC7966 MtnN-1 (accession no. ABK36761); 3: Aeromonas hydrophila ATCC7966 MtnN-2 (accession no. ABK39195); 4: Edwardsiella tarda ATCC 15947 (accession no. GAC64529); 5: Escherichia coli O104:H4 C227-11 (accession no. EHF20296); 6: Streptococcus pneumoniae R6 (accession no. AAK99698); 7: Bacillus amyloliquefaciens UASWS BA1 (accession no. ERK82321). |
MtnN-1与MtnN-2氨基酸序列一致性为26.37%,虽然同为MTA/SAH核苷酶,两者序列仍存在较大差异。据报道,E175和R194是Pfs蛋白中的保守氨基酸[16],D198、D209氨基酸位点在Pfs蛋白催化活性中起重要作用[17]。在嗜水气单胞菌MtnN-2氨基酸序列中可见以上氨基酸位点,MtnN-1氨基酸序列中同样含有上述保守氨基酸位点,但对应位置发生变化(E200/R219)。表明MtnN-1与MtnN-2可能均具有Pfs/MTAN家族成员蛋白的功能。
2.3 嗜水气单胞菌luxS、mtnN-1、mtnN-2克隆及表达载体的构建与其他微生物不同的是,嗜水气单胞菌ATCC7966基因组信息显示含有两种Pfs蛋白编码基因mtnN-1和mtnN-2。以嗜水气单胞菌ATCC7966基因组为模板PCR分别扩增luxS、mtnN-1、mtnN-2,电泳结果表明成功扩增出3条大小与预期相符的条带(图 4)。重组质粒双酶切后电泳检测均发现与预期相符的条带,测序结果表明重组质粒pPROEX-HTa-luxS、pPROEX-HTa-mtnN-1和pET-28a-mtnN-2构建成功。

|
| 图 4 luxS、mtnN-1和mtnN-2基因扩增 Figure 4 Gene amplification of luxS, mtnN-1 and mtnN-2 |
SDS-PAGE电泳结果(图 5)表明,重组蛋白LuxS、MtnN-1、MtnN-2均得以表达,三者均为细胞内可溶性蛋白。对细胞破碎并离心后的上清液进行亲和层析纯化、组氨酸标签切除及凝胶过滤层析纯化得到单一条带的目的蛋白,蛋白大小符合预期。

|
|
图 5
LuxS、MtnN-1、MtnN-2蛋白表达及纯化
Figure 5
Expression and purification of LuxS, MtnN-1 and MtnN-2 proteins
注:A:LuxS蛋白表达及纯化;B:MtnN-1蛋白表达及纯化;C:MtnN-2蛋白表达及纯化. 1:蛋白分子量标准,ProteinRulerII;2:未诱导的全蛋白;3:诱导后全蛋白;4:诱导后离心上清液;5:诱导破碎离心后沉淀;6:诱导破碎离心后上清;7:纯化后蛋白. Note: A: Expression and purification of LuxS; B: Expression and purification of MtnN-1; C: Expression and purification of MtnN-2. 1: Marker, ProteinRuler II; 2: Negative control; 3: Total cellular proteins of E. coli BL21(DE3) harboring constructed plasmid with IPTG induction; 4: Supernatant of E.coli BL21(DE3) harboring constructed plasmid with IPTG induction; 5: Precipitation of E. coli BL21(DE3) harboring constructed plasmid with IPTG induction and cell disruption; 6: Supernatant of E. coli BL21(DE3) harboring constructed plasmid with IPTG induction and cell disruption; 7: Purified protein. |
细胞外合成AI-2的体系中,SAH终浓度为1 mmol/L,每种酶终浓度均为1 g/L。AI-2的活性检测结果(表 2)表明,LuxS能够分别与MtnN-1、MtnN-2催化合成具有活性的AI-2。证明MtnN-1、MtnN-2虽然氨基酸序列具有较大差异,但均能够发挥Pfs/MTAN家族蛋白的功能。反应体系1和2中,AI-2对报告菌株哈维氏弧菌BB170的诱导发光分别为空白对照诱导发光的45.04倍和63.62倍。
| 反应体系 reaction system | 底物 substrate | 酶 enzyme | AI-2活性 AI-2 activity (fold induction) |
| 1 | SAH | LuxS+MtnN-1 | 45.04±0.47 |
| 2 | SAH | LuxS+MtnN-2 | 63.62±0.57 |
目前已发现LuxS/AI-2群体感应系统参与调控多种病原菌的毒力基因表达。在大肠埃希氏菌(Escherichia coli O156:H7)中鉴定出5个致病相关蛋
白表达受到AI-2的浓度调节[18]。除此之外,在多种水产养殖的常见病原菌中也发现了相似现象。Kozlova等[19]研究表明,嗜水气单胞菌luxS基因突变能够影响其生物被膜形态、运动性和毒力。哈维氏弧菌中AI-2能够调节细胞外毒素、III-型分泌系统相关蛋白、溶血素等合成。创伤弧菌中LuxS/AI-2群体感应系统能够调节蛋白酶(VvpE)和溶血素(VvhA)等毒力蛋白的表达。溶藻弧菌luxS基因突变能够影响其生物被膜形态及运动性。迟钝爱德华氏菌luxS基因突变能够影响其III-型分泌系统、生物被膜及丝氨酸蛋白酶的表达[20]。然而,除哈维氏弧菌外,其他水生病原菌中的AI-2信号分子的结构尚未揭晓,AI-2的生理学功能有待进一步研究。因此,体外合成嗜水气单胞菌AI-2有助于揭示其结构信息及研究其对毒力相关基因的调控机制。
本研究表明,嗜水气单胞菌能够产生信号分子AI-2,AI-2活性在对数生长期早期就接近最高值,意味着AI-2信号分子可能较早地发挥其生理学功能,调控相关毒力因子的表达,该结论与Han等[9]的研究相符。然而,在菌株培养后期仍检测到较高活性的AI-2信号分子,其合成机制仍有待研究。
嗜水气单胞菌基因组中存在着编码LuxS酶的基因luxS和编码MTA/SAH核苷酶的基因mtnN-1和mtnN-2。氨基酸序列比对分析表明,嗜水气单胞菌与革兰氏阴性菌LuxS有较高同源性,与水生病原菌哈维氏弧菌和迟钝爱德华氏菌一致性达到76%以上。值得注意的是,与其他微生物不同,嗜水气单胞菌能够合成Pfs/MTAN家族蛋白中的两种蛋白MtnN-1和MtnN-2。MtnN-1与MtnN-2氨基酸序列一致性为26.37%,两者存在较大差异,其中MtnN-2与几种代表性Pfs氨基酸序列同源性较高,与水生病原菌哈维氏弧菌、迟钝爱德华氏菌Pfs一致性达到53%以上。本研究通过细胞外生物合成,证明嗜水气单胞菌的LuxS可以分别与MtnN-1、MtnN-2共同催化合成具有活性的AI-2。合成的AI-2对报告菌株哈维氏弧菌BB170的诱导发光强度分别为空白对照诱导发光的45.04倍和63.62倍。推测MtnN-2可能比MtnN-1蛋白具有更强的催化活性。
本研究对嗜水气单胞菌AI-2信号分子进行了细胞外生物合成及活性检测,为嗜水气单胞菌AI-2的结构解析以及AI-2对嗜水气单胞菌致病性的调控作用研究奠定了基础。同时,为进一步开发针对嗜水气单胞菌的群体感应抑制剂明确了目标。
| [1] | Austin B, Adams C. Fish pathogens[A]//Altwegg M, Gosling PJ, Joseph S. The Genus Aeromonas[M]. Chichester: John Wiley & Sons, 1996: 197-243 |
| [2] | Zhu DL, Li AH, Qian D, et al. Advances in studies on virulence genes of Aeromonas hydrophila[J]. Acta Hydrobiologica Sinica, 2004, 28(1): 80-84 (in Chinese) 朱大玲, 李爱华, 钱冬, 等. 嗜水气单胞菌毒力基因的研究 进展[J]. 水生生物学报, 2004, 28(1): 80-84 |
| [3] | Jayaraman A, Wood TK. Bacterial quorum sensing: signals, circuits, and implications for biofilms and disease[J]. Annual Review of Biomedical Engineering, 2008, 10: 145-167 |
| [4] | Croxatto A, Pride J, Hardman A, et al. A distinctive dual-channel quorum-sensing system operates in Vibrio anguillarum[J]. Molecular Microbiology, 2004, 52(6): 1677-1689 |
| [5] | Henke JM, Bassler BL. Three parallel quorum-sensing systems regulate gene expression in Vibrio harveyi[J]. Journal of Bacteriology, 2004, 186(20): 6902-6914 |
| [6] | Kim SY, Lee SE, Kim YR, et al. Regulation of Vibrio vulnificus virulence by the LuxS quorum-sensing system[J]. Molecular Microbiology, 2003, 48(6): 1647-1664 |
| [7] | Zhang M, Sun K, Sun L. Regulation of autoinducer 2 production and luxS expression in a pathogenic Edwardsiella tarda strain[J]. Microbiology, 2008, 154(7): 2060-2069 |
| [8] | Li X, Han Y, Yang Q, et al. Detection of quorum sensing signal molecules and mutation of luxS gene in Vibrio ichthyoenteri[J]. Research in Microbiology, 2010, 161(1): 51-57 |
| [9] | Han Y, Li X, Qi Z, et al. Detection of different quorum-sensing signal molecules in a virulent Edwardsiella tarda strain LTB-4[J]. Journal of Applied Microbiology, 2010, 108(1): 139-147 |
| [10] | Schauder S, Shokat K, Surette MG, et al. The LuxS family of bacterial autoinducers: biosynthesis of a novel quorum-sensing signal molecule[J]. Molecular Microbiology, 2001, 41(2): 463-476 |
| [11] | Miller JH. Experiments in Molecular Genetics[M]. New York: Cold Spring Harbor Laboratory Press, 1972 |
| [12] | Greenberg EP, Hastings JW, Ulitzur S. Induction of luciferase synthesis in Beneckea harveyi by other marine bacteria[J]. Archives of Microbiology, 1979, 120(2): 87-91 |
| [13] | Hilgers MT, Ludwig ML. Crystal structure of the quorum sensing protein LuxS reveals a catalytic metal site[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(20): 11169-11174 |
| [14] | Pei D, Zhu J. Mechanism of action of S-ribosylhomocysteinase (LuxS)[J]. Current Opinion in Chemical Biology, 2004, 8(5): 492-497 |
| [15] | Plummer P, Zhu J, Akiba M, et al. Identification of a key amino acid of LuxS involved in AI-2 production in Campylobacter jejuni[J]. PLoS One, 2011, 6(1): e15876 |
| [16] | Ronning DR, Iacopelli NM, Mishra V. Enzyme-ligand interactions that drive active site rearrangements in the Helicobacter pylori 5'-methylthioadenosine/ S-adenosylhomocysteine nucleosidase[J]. Protein Science, 2010, 19(12): 2498-2510 |
| [17] | Mishra V, Ronning DR. Crystal structures of the Helicobacter pylori MTAN enzyme reveal specific interactions between S-adenosylhomocysteine and the 5'-alkylthio binding subsite[J]. Biochemistry, 2012, 51(48): 9763-9772 |
| [18] | Cagno RD, de Angelis M, Calasso M, et al. Proteomics of the bacterial cross-talk by quorum sensing[J]. Journal of Proteomics, 2011, 74(1): 19-34 |
| [19] | Kozlova EV, Popov VL, Sha J, et al. Mutation in the S-ribosylhomocysteinase (luxS) gene involved in quorum sensing affects biofilm formation and virulence in a clinical isolate of Aeromonas hydrophila[J]. Microbial pathogenesis, 2008, 45(5/6): 343-354 |
| [20] | Zhao J, Chen M, Quan CS, et al. Mechanisms of quorum sensing and strategies for quorum sensing disruption in aquaculture pathogens[J]. Journal of Fish Diseases, 2015, 38(9): 771-786 |
 2015, Vol. 42
2015, Vol. 42




