扩展功能
文章信息
- 魏小文, 马翠, 熊亮, 张明明, 赵心清, 白凤武
- WEI Xiao-Wen, MA Cui, XIONG Liang, ZHANG Ming-Ming, ZHAO Xin-Qing, BAI Feng-Wu
- 液泡蛋白酶B对酿酒酵母高温乙醇发酵效率的影响
- Effect of vacuolar proteinase B on high temperature ethanol fermentation of Saccharomyces cerevisiae
- 微生物学通报, 2015, 42(10): 1841-1846
- Microbiology China, 2015, 42(10): 1841-1846
- 10.13344/j.microbiol.china.140978
-
文章历史
- 收稿日期: 2014-12-03
- 接受日期: 2015-02-11
- 优先数字出版日期(www.cnki.net): 2015-03-11
近年来,燃料乙醇已经作为大规模生产和应用的可再生清洁能源在国内外被普遍使用,但生产成本高的问题是燃料乙醇工业化生产的瓶颈。因此,提高燃料乙醇生产的经济性,一直是国内外学者研究的重点。酿酒酵母是常用的乙醇发酵生产菌株,经过遗传改造的酿酒酵母菌株,可有效发酵纤维素水解液中的多种可发酵糖[1]。因此,利用来源丰富、廉价、可再生的纤维素原料进行纤维素乙醇的生产,也普遍使用酿酒酵母。但是,酿酒酵母在发酵过程中会受到多种胁迫条件的影响,包括高温、高浓度乙醇以及纤维素原料水解产生的毒性抑制物等[2, 3, 4]。此外,在利用纤维素原料进行同步糖化发酵过程中,纤维素酶的最适温度一般在50 °C左右,而酵母菌的最适生长温度和发酵温度通常在30−37 °C,这种最适温度的显著差异阻碍了同步糖化发酵的有效进行[5, 6]。因此,提高酵母菌的耐热性以及高温胁迫条件下的发酵性能,不仅可以减少发酵过程中冷却水的使用量,节省工业生产成本,还可以大大提高同步糖化发酵效率及纤维素乙醇生产的经济性。
酵母细胞中的液泡在pH的调节以及代谢调控等方面发挥重要的生理作用,而液泡中的蛋白酶对液泡的生理功能至关重要,其中研究较多的有蛋白酶A和蛋白酶B等[7]。本文中研究的液泡蛋白酶B (Prb1p)是类似于枯草杆菌蛋白酶家族的一种丝氨酸蛋白酶,由PRB1基因编码[8, 9]。国内学者曾报道,酿酒酵母液泡蛋白酶A的缺陷可导致细胞的抗氧化胁迫能力下降[10],但对于Prb1p与胁迫反应的关系研究较少,该酶蛋白与高温胁迫的关系还未见报道。研究发现,PRB1基因受到转录因子Yap1p和Zap1p的调节,在其启动子区域也找到了这两个转录因子的保守结合基序[11, 12]。Zap1p及Yap1p均是胁迫条件响应的转录因子,分别与锌浓度缺乏条件下基因的转录及氧化胁迫条件下基因的转录有关[11, 12]。由于PRB1基因受这两个转录调节因子的调控,推测PRB1基因所编码的蛋白可能与细胞的胁迫耐受性有关。此外,最新研究发现,Prb1p具有组蛋白H3链N末端的内切酶的活性[13],可能参与广泛的基因表达调控过程。但是,PRB1基因的过表达对酿酒酵母发酵性能的影响还没有相关报道。因此,本文通过将PRB1基因进行过表达,研究该基因对酵母细胞胁迫耐受性的影响。
1 材料与方法 1.1 微生物菌种及培养基大肠杆菌DH5α、酿酒酵母模式菌株S288c及乙醇发酵工业酵母菌株Sc4126,由本实验室保存。
YPD液体培养基(g/L):蛋白胨20,葡萄糖20,酵母浸粉10。YPD固体培养基(g/L):YPD液体培养基中添加终浓度为20 g/L的琼脂粉。酵母菌种子培养基(g/L):葡萄糖30,酵母浸粉4,蛋白胨3。乙醇发酵培养基(g/L):葡萄糖85,酵母浸粉4,蛋白胨3;添加乙酸发酵时,使用前加入乙酸至终浓度为5 g/L。LB培养基(g/L):蛋白胨10,酵母浸粉5,氯化钠10。固体培养基为LB液体培养基中,加入终浓度为20 g/L的琼脂粉。
1.2 过表达蛋白酶B基因PRB1的重组酿酒酵母的构建和转化以酿酒酵母S288c基因组为模板,利用引物PRB1-F (5′-CCCCCCGGGATGAAGTTAGAAAATA CTC-3′)和PRB1-R (5′-CCCTTAATTAATTAAATAA TATTCAATT-3′)扩增得到PRB1基因,然后将PRB1基因与pHO整合表达载体[14]连接后转化到大肠杆菌DH5α中,通过含100 mg/L氨苄青霉素的平板筛选得到转化子。随后将确定含有目的基因的质粒用Not I酶切线性化后转化到工业酿酒酵母Sc4126中,转化子的筛选利用真菌抗生素G418,终浓度为300 mg/l (固体)或100 mg/l (液体)。提取转化子的基因组,利用引物PRB1-F (5′-CCCCCCGGGATG AAGTTAGAAAATACTC-3′)和G418-R (5′-AGCCG TTTCTGTAATGAAGGAG- 3′)进行PCR验证。
1.3 重组菌的遗传稳定性分析将重组菌株在YPD斜面上活化后,按文献[15]方法进行遗传稳定性分析。
1.4 重组菌株在高温条件下的生长和发酵评价 1.4.1 重组菌株与对照菌株的耐受性比较:本文使用的载体为整合表达载体,整合在酿酒酵母的HO位点,该位点整合不影响菌株在30 °C条件下的生长和发酵[16, 17]。在前期实验过程中未发现出发菌株和含有pHO空载体的菌株在生长和发酵上存在差异。将对照菌株Sc4126-HO和重组酿酒酵母Sc4126-PRB1菌株接种到含有50 mL种子培养基的250 mL摇瓶中,30 °C、150 r/min培养过夜。分别取菌液,测其在620 nm处吸光值OD,用灭菌后的蒸馏水调节OD值至相同;对调节后的菌液按10倍梯度稀释,取2 µl点样于对照YPD平板,于30 °C静置培养;此外,为了测菌株的高温耐受能力,将未添加胁迫因素的YPD平板置于43 °C培养,待菌落长出后观察对比并拍照。实验至少重复3次,得到一致的结果。 1.4.2 在41 °C条件下的高温摇瓶发酵实验:把对照酵母菌株Sc4126-HO和重组酿酒酵母Sc4126-PRB1接种到含有50 ml种子培养基的250 mL三角瓶中,培养16−20 h至OD620值达到相同水平。然后从种子培养基中取5%样品分别接种到装有100 mL发酵培养基的250 mL三角瓶中,置于41 °C、150 r/min条件下发酵。在相同的时间点取样,取菌液适当稀释后用酶标仪测定菌液在620 nm下的吸光值来确定菌体含量,离心后取上清检测剩余葡萄糖、乙醇及甘油含量。摇瓶发酵实验重复2次,得到一致的结果。 1.5 葡萄糖浓度、乙醇浓度、生物量及代谢物的测定乙醇得率、生物量得率和乙醇产率的计算参考文献[18]进行。
发酵液中葡萄糖、乙醇和甘油用高效液相色谱进行分析,分离条件为:Aminex HP-87H 有机酸分析柱(300 mm×7.8 mm;Bio-Rad,Hercules),0.005 mol/L H2SO4为流动相,流速0.5 mL/min,进样量20 μL,柱温50 ºС,示差折光检测器温度50 ºС。
1.6 RNA提取及实时定量分析PRB1过表达菌株和对照菌株对数生长期的总RNA采用TransGen Biotech试剂盒提取,经TaKaRa PrimeScriptTM RT reagent Kit试剂盒反转录为cDNA后,采用SYBR® Premix ExTaqTM II (Tli RNaseH Plus)试剂盒进行了实时定量分析。PRB1的RT-PCR引物为rtPRB1-F (5′-GCGGTGTCACGTC CTATGTT-3′)和rtPRB1-R (5′-TCGTCGTTAAGTGG GATGGTT-3′),并以管家基因ACT1作为内参,其引物为ACT1-F (5′-GCCGAAAGAATGCAAAAGG A-3′)和ACT1-R (5′-GGAAGGTAGTCAAAGAAGC CAAGA-3′)。实时定量PCR在Rotor-Gene RG-3000 (Corbett Research,Australia)荧光定量PCR系统中进行,反应条件为:95 °C 2 min;95 °C 10 s,56 °C 20 s,72 °C 20 s,40个循环。定量结果分析采用2-ΔΔCT法。
2 结果与讨论 2.1 重组菌株验证及传代稳定性实验验证提取重组菌株及对照菌株的基因组,以PRB1-R引物和G418-F引物进行PCR验证,过表达菌株中得到目的片段,而对照菌株中没有目的片段,证明含有PRB1的重组菌株已成功构建(结果未显示)。同时,将得到的重组菌株进行传代稳定性实验,在无抗性平板上传代5次后,随机挑取的100个单菌落均在抗性平板上正常生长,证明重组菌株具有良好的稳定性。
2.2 重组酿酒酵母Sc4126-PRB1在高温胁迫条件下的平板生长比较将重组菌株Sc4126-PRB1与对照菌株在高温胁迫条件下进行点板实验比较,结果见图 1。可以得出Sc4126-PRB1的菌株与空载对照菌株在30 °C条件下的YPD平板上没有生长差异,说明PRB1基因过表达不会影响菌株的正常生长。由高温条件培养的平板可以看出,过表达PRB1基因可以提高酵母菌株的高温耐受性,这对于提高菌株在高温条

|
| 图 1 温胁迫条件下的重组菌株与对照菌株的耐受性对比 Figure 1 Effect of over-expression of PRB1 on cell growth of S. cerevisiae Sc4126 under high temperature |
件下的乙醇发酵具有重要的意义,因此后续进一步研究了高温条件下重组酿酒酵母乙醇发酵性能。
2.3 重组菌株在41 °C高温条件下的乙醇发酵在39、40、41、42及43 °C条件下比较对照菌株和PRB1过表达菌株的生长,结果表明,在39 °C条件下,重组菌株与对照菌株的生长没有差别;40−42 °C时,PRB1过表达重组菌株的生长明显好于对照菌株;在43 °C条件下的发酵结果表明,两株菌的生长情况相似,均受到明显抑制(结果未显示)。由于41 °C条件下的发酵结果能显著的表明PRB1基因过表达对于菌株高温耐受性的提高,因此选择41 °C作为发酵温度比较两株菌的高温耐性,结果见图 2。图 2A为细胞生长的比较,可以看出,Sc4126-PRB1菌株在高温条件下,菌体生长远好于对照菌株,在23 h时OD620值达到对照菌株的近1.5倍。图 2B及图 2C为菌株发酵过程中测得的残糖量及乙醇产量的变化,可以看出Sc4126-PRB1重组菌的葡萄糖的消耗速度及乙醇终产量均高于空载菌株。重组菌株在发酵27 h时已经将葡萄糖完全消耗,而对照菌株在发酵31 h时还剩35 g/L葡萄糖,即使延长发酵时间也无法将糖完全消耗。甘油是酿酒酵母胁迫条件下细胞合成的保护性物质之一[19],虽然高温条件胁迫下,过表达PRB1的重组菌株甘油产量高于对照菌株(图 2D),但由于过表达PRB1的菌株生物量较高,按照平均每OD620生物量来计算,未发现过表达PRB1菌株与对照的差别,因此,推断过表达PRB1菌株高温耐性提高与甘油的合成无关。由于高温可引起细胞内蛋白的变性[20],而Prb1p可以通过降解蛋白而帮助细胞清除变性的蛋白,因此推测PRB1过表达提高高温耐性的原因与突变体内有害变性蛋白可及时清除有关。本文结果说明PRB1基因过表达会提高发酵过程中菌体高温的耐受性,提高菌株的生长及发酵性能。
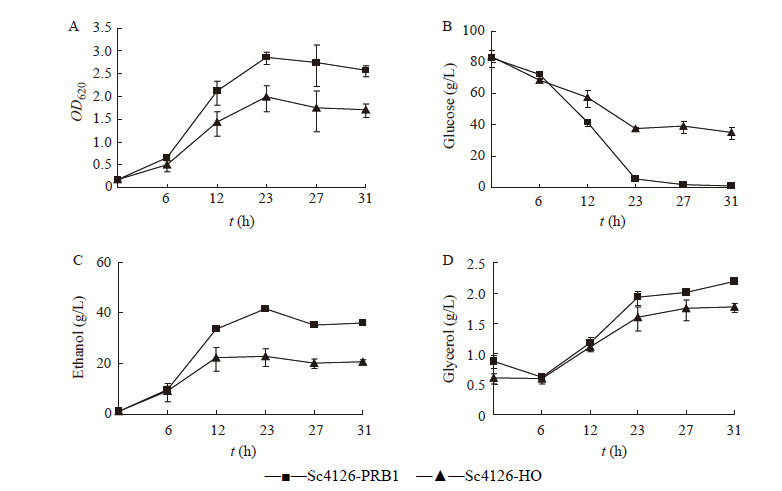
|
|
图 2
PRB1过表达菌株Sc4126-PRB1菌株与对照菌株Sc4126-HO在41 °C高温条件下乙醇发酵性能比较
Figure 2
Ethanol fermentation of the PRB1 over-expressing strain Sc4126-PRB1 at 41 °C in comparison with that of the control strain Sc4126-HO
注:A:过表达PRB1基因对酵母菌株在41 °C条件下生长的影响;B:过表达PRB1基因对菌株在41 °C条件下消耗葡萄糖的影响;C:过表达PRB1基因对菌株在41 °C条件子下乙醇产量的影响;D:过表达PRB1 基因对菌株在41 °C条件下甘油积累的影响.
Note: A: Effect of over-expression of PRB1 on cell growth of S. cerevisiae at 41 °C; B: Effect of over-expression of PRB1 on sugar consumption of S. cerevisiae at 41 °C; C: Effect of over-expression of PRB1 on ethanol production of S. cerevisiae at 41 °C; D: Effect of over-expression of PRB1 on glycerol accumulation of S. cerevisiae at 41 °C. |
为了证明在重组菌株中PRB1的表达水平的确提高,利用高温发酵实验(41 °C)及正常温度(30 °C)发酵实验中两株菌的对数生长期细胞进行了实时定量PCR分析。图 3A为高温条件下对数期样品的实时定量分析结果,重组菌株中PRB1基因的相对表达量是对照菌株的1.47倍。图 3B为正常温度条件下对数期样品的实时定量分析结果,重组菌株中PRB1基因的相对表达量是对照菌株的1.57倍。结果表明PRB1基因的确在重组菌细胞中过量表达,推测该基因的过表达很有可能是重组菌高温发酵效率提高的原因。

|
|
图 3
不同温度条件下PRB1基因的相对表达量的比较
Figure 3
The relatively expression of PRB1 under different conditions of the PRB1 over-expressing strain Sc4126-PRB1 in comparison with the control strain Sc4126-HO
注:A:在41 °C发酵时PRB1基因的相对表达量;B:在30 °C发酵时PRB1基因的相对表达量. Note: A: Relatively expression of PRB1 at 41 °C; B: Relatively expression of PRB1 at 30 °C. |
Prb1p参与多种细胞内关键代谢酶的降解[21];此外,Prb1p也参与其自身及其他蛋白水解酶如PrA和CpY的成熟过程[22]。作为液泡(溶酶体)蛋白酶的一种,Prb1p可能对其他错误折叠或失去功能的酶进行降解[23, 24],保证细胞的活性和正常功能的行使,并进一步促进氨基酸的循环。因此PRB1基因所编码的蛋白可能参与细胞的胁迫耐受性应激反应。本文结果也显示,过表达PRB1基因可以提高酿酒酵母的高温耐性,使菌株在高温条件下的获得良好的乙醇发酵性能。
3 结论(1) 液泡蛋白酶B基因PRB1过表达可以提高酿酒酵母的高温耐性。
(2) 过表达PRB1基因的重组菌株在41 °C表现出良好的乙醇发酵性能,可完全消耗培养基中的葡萄糖,而对照菌株只能消耗部分葡萄糖。
本研究为首次报道过表达液泡蛋白酶B基因可提高酿酒酵母的高温耐性。本文的研究结果为进一步提高酿酒酵母在高温下的乙醇发酵效率,节约工业生产中冷却水的使用,降低生产成本,提高燃料乙醇工业生产的经济效益提供了参考。
| [1] | Madhavan A, Srivastava A, Kondo A, et al. Bioconversion of lignocellulose-derived sugars to ethanol by engineered Saccharomyces cerevisiae[J]. Critical Review in Biotechnology, 2012, 32(1): 22-48 |
| [2] | Li HX, Zhang XR, Shen Y, et al. Inhibitors and their effects on Saccharomyces cerevisiae and relevant countermeasures in bioprocess of ethanol production from lignocellulose-a review[J]. Chinese Journal of Biotechnology, 2009, 25(9): 1321-1328 (in Chinese) 李洪兴, 张笑然, 沈煜, 等. 纤维素乙醇生物加工过程中的 抑制物对酿酒酵母的影响及应对措施[J]. 生物工程学报, 2009, 25(9): 1321-1328 |
| [3] | Zhao XQ, Bai FW. Mechanism of yeast ethanol tolerance and its manipulation for efficient fuel ethanol production[J]. Journal of Biotechnology, 2009, 144(1): 23-30 |
| [4] | Wallace-Salinas V, Gorwa-Grauslund MF. Adaptive evolution of an industrial strain of Saccharomyces cerevisiae for combined tolerance to inhibitors and temperature[J]. Biotechnology for Biofuels, 2013, 6(1): 151 |
| [5] | Costa DA, de Souza CJ, Costa PS, et al. Physiological characterization of thermotolerant yeast for cellulosic ethanol production[J]. Applied Microbiology and Biotechnology, 2014, 98(8): 3829-3840 |
| [6] | Abdel-Banat BM, Hoshida H, Ano A, et al. High-temperature fermentation: how can processes for ethanol production at high temperatures become superior to the traditional process using mesophilic yeast?[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 861-867 |
| [7] | Liu XJ, Zhang HF, Fu ML, et al. Research progress in Saccharomyces cerevisiae vacuolar proteinase[J]. Science and Technology of Food Industry, 2010, 31(12) : 377-379 (in Chinese) 刘晓杰, 章海锋, 傅明亮, 等. 酵母液泡蛋白酶的研究进展 [J]. 食品工业科技, 2010, 31(12): 377-379 |
| [8] | Moehle CM, Tizard R, Lemmon SK, et al. Protease B of the lysosomelike vacuole of the yeast Saccharomyces cerevisiae is homologous to the subtilisin family of serine proteases[J]. Molecular and Cellular Biology, 1987, 7(12): 4390-4399 |
| [9] | Naik RR, Nebes V, Jones EW. Regulation of the proteinase B structural gene PRB1 in Saccharomyces cerevisiae[J]. Journal of Bacteriology, 1997, 179(5): 1469-1474 |
| [10] | Feng Y, Xu TY, Cai J, et al. Effect of deficiency of vacuolar proteinase-A in Saccharomyces cerevisiae on its oxidative stress[J]. Journal of Chinese Institute of Food Science and Technology, 2013(2): 13-18 (in Chinese) 冯宇, 徐滕洋, 蔡瑾, 等. 蛋白酶 A 敲除对酿酒酵母抗氧化 性的影响[J]. 中国食品学报, 2013(2): 13-18. |
| [11] | Dumond H, Danielou N, Pinto M, et al. A large-scale study of Yap1p-dependent genes in normal aerobic and H2O2- stress conditions: the role of Yap1p in cell proliferation control in yeast[J]. Molecular Microbiology, 2000, 36(4): 830-845 |
| [12] | Wu CY, Bird AJ, Chung LM, et al. Differential control of Zap1-regulated genes in response to zinc deficiency in Saccharomyces cerevisiae[J]. BMC Genomics, 2008, 9(1): 370 |
| [13] | Xue Y, Vashisht AA, Tan Y, et al. PRB1 is required for clipping of the histone H3 N terminal tail in Saccharomyces cerevisiae[J]. PLoS One, 2014, 9(2): e90496 |
| [14] | He LY, Zhao XQ, Bai FW. Engineering industrial Saccharomyces cerevisiae strain with the FLO1-derivative gene isolated from the flocculating yeast SPSC01 for constitutive flocculation and fuel ethanol production[J]. Applied Energy, 2012, 100: 33-40 |
| [15] | Zhang JN, He XP, Guo XN, et al. Genetically modified industrial breing yeast with high-glutathione and low-diacetyl production[J]. Chinese Journal of Biotechnology, 2006, 21(6): 942-946 (in Chinese) 张吉娜, 何秀萍, 郭雪娜, 等. 低双乙酰抗老化啤酒酵母工 程菌的构建[J]. 生物工程学报, 2006, 21(6): 942-946 |
| [16] | He LY, Zhao XQ, Ge XM, et al. Identification and functional study of a new FLO10-derivative gene from the industrial flocculating yeast SPSC01[J]. Journal of Industrial Microbiology and Biotechnology, 2012, 39(8): 1135-1140 |
| [17] | Voth WP, Richards JD, Shaw JM, et al. Yeast vectors for integration at the HO locus Yeast vectors for integration at the HO locus[J]. Nucleic Acids Research, 2001, 29(12): e59 |
| [18] | Xu GH, Zhao XQ, Li N, et al. Improvent of acetic acid tolerance of self-flocculating yeast by zinc supplementation[J]. Journal of Chemical Industry and Engineering, 2012, 63(6): 1823-1829 (in Chinese) 徐桂红, 赵心清, 李宁, 等. 锌离子提高絮凝酵母乙酸胁迫 耐受性[J]. 化工学报, 2012, 63(6): 1823-1829 |
| [19] | Aldiguier AS, Alfenore S, Cameleyre X, et al. Synergistic temperature and ethanol effect on Saccharomyces cerevisiae dynamic behaviour in ethanol bio-fuel production[J]. Bioprocess and Biosystems Engineering, 2004, 26(4): 217-222 |
| [20] | Friant S, Meier KD, Riezman H. Increased ubiquitin-dependent degradation can replace the essential requirement for heat shock protein induction[J]. EMBO Journal, 2003, 22(15): 3783-3791 |
| [21] | Wolf DH, Ehmann C. Studies on a proteinase B mutant of yeast[J]. European Journal of Biochemistry, 1979, 98(2): 375-384 |
| [22] | Hirsch HH, Schiffer HH, Wolf DH. Biogenesis of the yeast vacuole (lysosome) Proteinase yscB contributes molecularly and kinetically to vacuolar hydrolase-precursor maturation[J]. European Journal of Biochemistry, 1992, 207(3): 867-876 |
| [23] | Chiang HL, Schekman R, Hamamoto S. Selective uptake of cytosolic, peroxisomal, and plasma membrane proteins into the yeast lysosome for degradation[J]. Journal of Biological Chemistry, 1996, 271(17): 9934-9941 |
| [24] | van Den Hazel HB, Kielland-Brandt MC, Winther JR. Review: biosynthesis and function of yeast vacuolar proteases[J]. Yeast, 1996, 12(1): 1-16 |
 2015, Vol. 42
2015, Vol. 42




