扩展功能
文章信息
- 杨宇, 黄露, 杨罗, 谢丹, 王涛
- YANG Yu, HUANG Lu, YANG Luo, XIE Dan, WANG Tao
- 隐藏嗜酸菌Acidiphilium cryptum XTS的Cr(VI)还原特性及相关基因的差异表达
- Reduction characteristics and differential expression of Acidiphilium cryptum XTS Cr(VI)-reduced related gene
- 微生物学通报, 2015, 42(1): 64-73
- Microbiology China, 2015, 42(1): 64-73
- 10.13344/j.microbiol.china.140051
-
文章历史
- 收稿日期: 2014-01-14
- 接受日期: 2014-03-19
- 优先数字出版日期(www.cnki.net): 2014-09-15
2. 中南大学 生物冶金教育部重点实验室 湖南 长沙 410083
2. Key Laboratory of Biometallurgy, Ministry of Education, Central South University, Changsha, Hunan 410083, China
工业的迅猛发展,尤其是制革、印染、电镀等行业的发展,导致了大量含Cr(VI)工业废水的产生。近年来发现Cr(VI)具有潜在的致癌性和基因诱变性,使得环境Cr(VI)污染问题变得倍受关注。Cr(VI)污染的处理方式是通过物理化学方法或生物方法将水体中高毒游离的Cr(VI)还原为低毒稳定的Cr(III)[1, 2]。物理化学治理方法价格较贵,且容易因反应不完全而造成二次污染。因此,Cr(VI)污染的生物治理方法由于环保高效、成本低廉等特点而备受关注[3]。目前国内外在含Cr(VI)废水微生物处理方面的研究主要利用的都是在碱性环境生长良好的菌株,而在酸性环境下微生物直接还原Cr(VI)的研究鲜见报道。电镀厂废水、矿区废水等Cr(VI)污染多为酸性环境,若用碱性菌株进行处理,则需将pH值调成碱性,提高了处理成本。因此,开发酸性条件下新型Cr(VI)还原菌种资源迫在眉睫。隐藏嗜酸菌A.cryptum是一种革兰氏阴性、兼性异养的嗜酸异化铁还原菌,属于α-变形菌纲嗜酸菌属。最适宜的生长温度为30-35 °C,耐受的pH值范围为1.9-5.9,因其在酸性环境下还原高价金属离子的能力,而成为酸性Cr(VI)还原菌株的最佳候选之一[4]。该菌对Cr(VI)的还原与一种I型细胞色素c (ApcA)的作用有关,其基因编号为Acry_2099[5]。本研究考察了该菌还原Cr(VI)的特性和最佳工艺,并通过RT-qPCR探究Acry_2099的差异表达与Cr(VI)还原速率的相关性,为Cr(VI)污染环境的修复提供参考。
1 材料与方法 1.1 材料 1.1.1 菌株:Acidiphilium cryptum XTS为本实验室从酸性矿坑水中分离得到,已由本实验室保存。 1.1.2 培养基:9K基础培养基(g/L)[6]:(NH4)2SO4 3.00,KCl 0.10,K2HPO4 0.50,MgSO4·7H2O 0.50,Ca(NO3)2 0.01。菌株的富集、活化及扩大培养时采用向上述9 K基础培养基中加入质量体积比为1%的葡萄糖作为外源能源物质,用硫酸调pH至3.5。各组分充分溶解后于1×105 Pa灭菌30 min。 1.2 Cr(VI)的测定:采用二苯碳酰二肼分光光度法(GB/T 15555.5-1995)测定Cr(VI)的浓度[7]。
1.3 A. cryptum XTS对Cr(VI)的还原将实验所需菌株A. cryptumXTS传代活化,培养至生长活性最高的对数期,再以5%接种量转接到新鲜的50 mL含有重铬酸钾的液体培养基,于最适生长温度30 °C恒温170 r/min振荡培养。取样时,吸取500 μL菌液,12 000 r/min离心取上清液,取200 μL上清液至50 mL容量瓶中,加水稀释至刻度线,混匀,加入3 mL含混合酸的DPCI溶液,摇匀,静置5 min,用30 mm比色皿,在540 nm的波长下用紫外可见分光光度仪测吸光度。
1.4 A. cryptum XTS对Cr(VI)的还原条件研究 1.4.1 A. cryptum XTS对Cr(VI)的还原能力:分别设置加菌组与不加菌组,每隔一定时间取样,测定Cr(VI)还原率情况。设立3组平行实验同时测定。 1.4.2 不同pH对A. cryptum XTS还原Cr(VI)的影响:分别设置pH 1.9、2.9、3.9、4.9、5.9的梯度,每隔一定时间取样,测定Cr(VI)还原率情况。设立3组平行实验同时测定。 1.4.3 不同初始Cr(VI)浓度对A. cryptum XTS还原Cr(VI)的影响:分别设置初始Cr(VI)浓度为20、40、60、80和100 mg/L 5个梯度,每隔一定时间取样,测定Cr(VI)还原率情况。设立3组平行实验同时测定。 1.4.4 Fe(III)的加入对A.cryptum XTS还原Cr(VI)的影响:在初始Cr(VI)浓度均为50 mg/L的前提下设置不含Fe(III)和Fe(III)浓度为50 mg/L两个梯度,每隔一定时间取样,测定Cr(VI)还原率情况。设立3组平行实验同时测定。 1.4.5 氧气含量对A.cryptum XTS还原Cr(VI)的影响:在初始Cr(VI)浓度均为50 mg/L的前提下设置好氧与厌氧两种培养条件,厌氧组平行处理12份,塞紧橡胶塞,充氮气5 min除氧后密封,分别于培养的4、18、23、27、41、48、65、75、89、113、137和151 h取出一瓶进行取样,测定Cr(VI)还原率情况。设立3组平行实验同时测定。 1.4.6 正交试验表的设计[8]:由上述实验结果可知,初始Cr(VI)浓度、pH值和Fe(III)加入浓度这3个因素对A.cryptum XTS还原Cr(VI)具有显著影响,而氧气的含量则对A. cryptum XTS还原相同起始浓度的Cr(VI)的影响不大,因此选取初始Cr(VI)浓度、pH值和Fe(III)加入浓度3个因素,每个因素3个水平,设立3组平行实验同时测定。选用L9(34)作为该考察试验指标的正交表,因素水平试验分配方案见表 1。| 编号 Number | 初始Cr(VI)浓度 Initial Cr(VI) concentration (mg/L) | pH | Fe(III)加入浓度 Fe(III) concentration (mg/L) |
| 1 | 40 | 1.9 | 0 |
| 2 | 60 | 2.9 | 50 |
| 3 | 80 | 3.9 | 100 |
| 基因 Gene | 引物名称 Primer name | 引物序列 Primer sequence (5′→3′) | 扩增长度 Amplicon length (bp) |
| 16S rRNA | 16S-F | CCTTACCAGGATTTGACA | 148 |
| 16S-R | CAACTAAAGGCGAGGG | ||
| Acry_2099 | 2099-F | AGCCTGCCATAGCGTGAGC | 105 |
| 2099-R | GCCGGGGAGAACTGGAATC |
Rratio=EtargetΔCttarget(control-sample)/ErefereΔCtreference(control-sample)
Etarget为目的基因的扩增效率,Erefere为内参基因16S rDNA的扩增效率,ΔCttarget为参照体系中目的基因的Ct减去待测样品中目的基因的Ct,ΔCtref为参照体系中内参基因的Ct减去待测样本中内参基因的ΔCt。计算结果表示,目的基因在实验组的表达量为对照组中表达量的倍数。
2 结果与分析 2.1 A.cryptum XTS对Cr(VI)的还原条件研究 2.1.1 A. cryptum XTS对Cr(VI)的还原能力:其他培养条件相同的情况下,加入细菌与不加细菌组对Cr(VI)的还原情况如图 1所示。可以看到,初始Cr(VI)浓度同样为50 mg/L的条件下,加菌组对Cr(VI)的还原速率很快,151 h内,98.60%的Cr(VI)被还原;而不加菌组对Cr(VI)浓度的影响则很小。可见Cr(VI)浓度降低的原因主要来自细菌对其的还原能力,与培养基中所含的其他物质无关。

|
| 图 1 A.cryptum XTS还原Cr(VI)的能力 Figure 1 Cr(VI) reducing capacity of A. cryptum XTS |
|
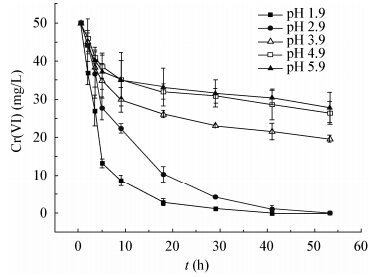
| 图 2 不同pH对A. cryptum XTS还原Cr(VI)的影响(初始Cr(VI)为50 mg/L) Figure 2 Effects of different pH on Cr(VI) reducing capacity of A. cryptum XTS |
|
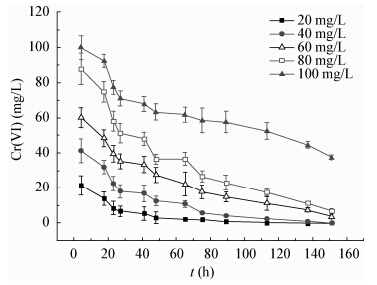
| 图 3 不同初始Cr(VI)浓度对A. cryptum XTS还原Cr(VI)的影响(初始pH为2) Figure 3 Effects of different initial Cr(VI) concentration on Cr(VI) reducing capacity of A. cryptum XTS |
Cr(VI)+3Fe(II)→Cr(III)+3Fe(III)
从图 4中可以看出,其他培养条件相同,初始pH为2.0的条件下,加Fe(III)组的Cr(VI)还原率与还原速率均高于不加Fe(III)组,还原率达到74.09%,比不加Fe(III)组高出30.68%。这证明,Fe(III)的存在确实能促进A. cryptum XTS对Cr(VI)的还原,而该过程究竟是采取电子穿梭机制还是Fe(III)的加入能影响Acry_2099基因表达水平,还有待后续实验进一步研究。

|
| 图 4 Fe(III)的加入对A. cryptum XTS还原Cr(VI)的影响 Fig. 4 Effects of the existence of Fe(III) on Cr(VI) reducing capacity of A.cryptum XTS |

|
| 图 5 不同氧气含量对A. cryptumXTS还原Cr(VI)的影响 Figure 5 Effects of different oxygen concentration on Cr(VI) reducing capacity of A.cryptum XTS |

|
| 图 6 A. cryptum JF-5六价铬还原电子传递假想模型 Figure 6 Hypothetical electron transport model for A.cryptum JF-5 chromate reduction |
rS=$\frac{{{k_{ + 2}}{c_{E0}}{c_S}}}{{{K_S} + {c_S}}}$=${\frac{{{r_{\max }}{c_S}}}{{{K_S} + {c_S}}}_{}}$
进行积分,得到:
rmaxt=(cS0-cS)+Kmln$\frac{{{c_{S0}}}}{{{c_S}}}$
对该式进行整理,分别得到下式:
$\frac{{\ln \frac{{{c_{S0}}}}{{{c_S}}}}}{{{c_{S0}} - {c_S}}} = \frac{{{r_{\max }}}}{{{K_m}}}\frac{t}{{{c_{S0}} - {c_S}}} - \frac{1}{{{K_m}}}$
$\frac{1}{t}\ln \frac{{{c_{S0}}}}{{{c_S}}} = \frac{{{r_{\max }}}}{{{K_m}}} - \frac{1}{{{K_m}}}\frac{{{c_{S0}} - {c_S}}}{t}$
由图 2-5实验,测出cS −t系列数据,并代入上述各式,分别以$\frac{{\ln ({c_{S0}}/{c_S})}}{{{c_{S0}} - {c_S}}}$与$\frac{t}{{{c_{S0}} - {c_S}}}$为纵、横坐标对应作图,结果使用Oringin 8.0可拟合为一直线,这表明该反应符合M-M方程,得到动力学回归方程及Km值如表 3所示。
| 条件 Conditions | 回归方程 Regression equation | Km (mol/L) |
| pH (30 °C, CCr(VI)=50 mg/L) | ||
| 1.9 | y=0.107x−0.765 | 1.307×10−3 |
| 2.9 | y=0.096x−0.165 | 6.061×10−3 |
| 3.9 | y=0.002x−1.158 | 8.636×10−4 |
| 4.9 | y=0.003x−1.099 | 9.099×10−4 |
| 5.9 | y=0.006x−1.122 | 8.913×10−4 |
| CCr(VI) (mg/L) (30 °C, pH 1.9) | ||
| 20 | y=0.032x−0.401 | 2.494×10−3 |
| 40 | y=0.033x−1.076 | 9.294×10−4 |
| 60 | y=0.017x−0.191 | 5.236×10−3 |
| 80 | y=0.014x−0.02 | 5.000×10−2 |
| 100 | y=0.002x−0.496 | 2.016×10−3 |
| CFe(III) (mg/L) (30 °C, pH 1.9, CCr(VI)=50 mg/L) | ||
| 0 | y=0.002x−1.071 | 9.337×10−4 |
| 50 | y=0.007x−1.014 | 9.862×10−4 |
| Coxygen (30 °C, pH 1.9, CCr(VI)=50 mg/L) | ||
| Aerobic | y=0.002x−1.071 | 9.337×10−4 |
| Anaerobic | y=0.002x−1.034 | 9.671×10−4 |
Km是酶的特征常数,反映了酶同底物亲和力的大小。当Km值较大时,酶与底物的结合力弱,易解离,表示酶对底物的亲和力小;当Km值较小时,酶与底物的结合力强,不易解离,表示酶对底物的亲和力大。由表 3可知,Fe(III)的加入和氧气的存在与否对ApcA酶动力学参数Km的影响不明显,而A. cryptum XTS在不同pH下还原Cr(VI)的Km值则有显著性差异。在pH为2.9时,有最大Km;pH为3.9时,Km最小,表明pH 3.9有明显激活ApcA活性的作用。对A. cryptum XTS在不同初始Cr(VI)浓度下还原Cr(VI)的Km值进行比较,也可以看到,Cr(VI)浓度为80 mg/L时有最大Km;当初始Cr(VI)浓度为40 mg/L时,Km最小,表明初始Cr(VI)浓度对ApcA的催化反应有显著影响,Cr(VI)浓度为 40 mg/L能明显激活ApcA活性。
2.2 正交试验结果 2.2.1 正交试验数据处理及结果:使用24 h内被还原的Cr(VI)浓度作为衡量指标,每组设置3次平行,按照表 4进行数据处理。| 编号 Number | 初始Cr(VI)浓度 Initial Cr(VI) concentration (mg/L) | pH | Fe(III)加入浓度 Fe(III) concentration (mg/L) | 被还原的Cr(VI) Reduced Cr(VI) (mg/L) |
| 1 | 40 | 1.9 | 0 | y1=19.78 |
| 2 | 40 | 2.9 | 50 | y2=28.75 |
| 3 | 40 | 3.9 | 100 | y3=34.54 |
| 4 | 60 | 1.9 | 50 | y4=33.98 |
| 5 | 60 | 2.9 | 100 | y5=51.74 |
| 6 | 60 | 3.9 | 0 | y6=33.33 |
| 7 | 80 | 1.9 | 100 | y7=41.74 |
| 8 | 80 | 2.9 | 0 | y8=53.98 |
| 9 | 80 | 3.9 | 50 | y9=44.54 |
| I1 | y1+y2+y3=83.07 | y1+y4+y7=95.50 | y1+y6+y8=107.09 | Y=1/9(Eyj)=38.04 其中,j=1,2,3…9 |
| I2 | y4+y5+y6=119.05 | y2+y5+y8=134.47 | y2+y4+y9=107.27 | |
| I3 | y7+y8+y9=140.26 | y3+y6+y9=112.41 | y3+y5+y7=128.02 | |
| I1 | I11=(y1+y2+y3)/3=27.69 | I12=(y1+y4+y7)/3=31.83 | I13=(y1+y6+y8)/3=35.70 | |
| I2 | I21=(y4+y5+y6)/3=39.68 | I22=(y2+y5+y8)/3=44.82 | I23=(y2+y4+y9)/3=35.76 | |
| I3 | I31=(y7+y8+y9)/3=46.75 | I32=(y3+y6+y9)/3=37.47 | I33=(y3+y5+y7)/3=42.67 |
| 编号 Number | D1 | D2 | D3 | R | T |
| 1 | D11=I11−Y=−10.35 | D21=I21−Y=1.64 | D31=I31−Y=8.71 | R01=max(D11,D21,D31)=8.71 | T1=R01−R11=19.06 |
| R11=min(D11,D21,D31)=−10.35 | |||||
| 2 | D12=I12−Y=−6.21 | D22=I22−Y=6.78 | D32=I32−Y=−0.57 | R02=max(D12,D22,D32)=6.78 | T2=R02−R12=12.99 |
| R12=min(D12,D22,D32)=−6.21 | |||||
| 3 | D13=I13−Y=−2.34 | D23=I23−Y=−2.28 | D33=I33−Y=4.63 | R03=max(D13,D23,D33)=4.63 | T3=R03−R13=6.97 |
| R13=min(D13,D23,D33)=−2.34 |
试验结果经过极差分析,得到的结果为T1>T2>T3。即:在变化的水平范围内,因素1 (即初始Cr(VI)浓度)对结果造成的影响最大,其次为因素2 (pH值),因素3 (Fe(III)浓度)对结果造成的影响最小。反之,T越小,与之对应的那一列的因素试验的结果影响越小。
试验结果为:D31>D21>D11,D22>D32>D12,D33>D23>D13,D值为Cr(VI)还原量,一般希望Cr(VI)还原量越大越好,因此根据D值的大小很快可以确定对应因素水平组合,即配合比为A3B2C3的试验结果是最优化配合比,即初始Cr(VI)浓度为80 mg/L,pH为2.9,Fe(III)浓度为100 mg/L是最优化配合比。在该条件下处理24 h,Cr(VI)的还原率达到67.48%。
2.3 RT-qPCR 2.3.1 目的基因的序列比对及相关引物质量评估:以XTS基因组DNA为模板PCR结果如图 7,内参基因引物对16S-F和16S-R的扩增产物片段在 150 bp左右,目的基因引物对2099-F和2099-R的扩增产物片段在100 bp左右,与预期引物扩增产物长度148 bp和105 bp相符。相关基因阳性质粒菌体PCR产物经由BLAST比对结果证实,其序列与模式菌A. cryptumJF-5的同源功能基因序列一致性达到了99.7%,可用于后续实验研究。

|
| 图 7 PCR产物电泳结果 Figure 7 Electrophoresis analysis of PCR products Note: 1: 16S rRNA; 2: Acry_2099; M: Marker. |

|
| 图 8 不同pH值下,Acry_2099基因的表达差异与A.cryptum XTS铬还原速率的相关性 Figure 8 Correlation of differential expression of Acry_2099 and rate of Cr(VI) reduction under different pH |

|
| 图 9 不同初始Cr(VI)浓度下,Acry_2099基因的表达差异与A.cryptum XTS铬还原速率的相关性 Figure 9 Correlation of differential expression of Acry_2099 and rate of Cr(VI) reduction under different initial Cr(VI) concentration |

|
| 图 10 Fe(III)的存在下,Acry_2099基因的表达差异与A.cryptum XTS铬还原速率的相关性 Figure 10 Correlation of differential expression of Acry_2099 and rate of Cr(VI) reduction under the existence of Fe(III) |

|
| 图 11 不同氧气含量下,Acry_2099基因的表达差异与A.cryptum XTS铬还原速率的相关性 Figure 11 Correlation of differential expression of Acry_2099 and rate of Cr(VI) reduction under different oxygen concentration |
(1) pH对A. cryptum XTS还原Cr(VI)具有重要影响作用,该菌还原Cr(VI)的最适pH与其最适生长pH并不相同,较低pH能够促进ApcA传递电子给Cr(VI),有助于细菌六价铬的还原;
(2) 随着初始Cr(VI)浓度的增高,A. cryptum XTS对Cr(VI)的还原能力呈现递减趋势;这可能是由于具有毒性的Cr(VI)部分抑制了微生物活性,阻碍了其生物代谢过程所致;
(3) Fe(III)的存在下,A. cryptum XTS能够通过“电子穿梭”机制加速细菌对六价铬的还原,但Fe(III)的加入对Acry_2099基因表达水平没有显著的影响;
(4) 好氧与微厌氧条件对细菌还原Cr(VI)的影响相差不大,这说明细菌还原Cr(VI),是ApcA充当中间电子运输体,通过其化学位移形成氧化和还原两种状态而还原Cr(VI),氧气并不是充当主要的最终电子受体,其存在与否并不是还原Cr(VI)的关键因素;
(5) 正交试验结果显示,初始Cr(VI)浓度为 80 mg/L,pH为2.9,Fe(III)浓度为100 mg/L是A.cryptum XTS还原Cr(VI)的最优化配合比。
| [1] | Zheng YJ, Zhang J, Yi BLY. The application of microorganism in the treatment for heavy metal waste water[J]. Foreign Medical Sciences (Section of Medgeography), 2006, 27(1): 39-42 (in Chinese) 郑玉健, 张杰, 依不拉音. 微生物在水体重金属污染治理中的应用[J]. 国外医学医学地理分册, 2006, 27(1): 39-42 |
| [2] | Kim DS. The removal by crab shell of mixed heavy metal ions in aqueous solution[J]. Bioresource Technology, 2003(87): 355-357 |
| [3] | Williams CJ, Aderhold D, Edyvean RGJ. Comparison between biosorbent for the removal of metal ions from aqueous solution[J]. Water Research, 1998, 32(1): 216-224 |
| [4] | Yang Y, Wang X, Huang L, et al. Progresses on Acidiphilium cryptum[J]. Life Science Research, 2013, 17 (2): 179-184 (in Chinese) 杨宇, 王项, 黄露, 等. 隐藏嗜酸菌Acidiphilium cryptum的研究进展[J]. 生命科学研究, 2013, 17(2): 179-184 |
| [5] | Timothy SM, Michael WS, Andrzej JP, et al. Proteogenomic and functional analysis of chromate reduction in Acidiphilium cryptum JF-5, an Fe(III)-respiring acidophile[J]. Biometals, 2010, 23(6): 1129-1138 |
| [6] | Purushothaman M, Anderson RKL, Narayana S. Industrial byproducts as cheaper medium components influencing the production of polyhydroxyalkanoates (PHA)-biodegradable plastics[J]. Bioprocess and Biosystems Engineering, 2001, 24(3): 131-136 |
| [7] | Chen YX. Chemical engineering & equipment diphenyl carbonyl 2 hydrazine spectrophotometric method of determination of hexavalent chromium in electroplating waste water improvement research[J]. 2008(6): 109-111 (in Chinese) 陈育翔. 二苯碳酰二肼分光光度法测定电镀废水中六价铬的改进研究[J]. 化学工程与设备, 2008(6): 109-111 |
| [8] | Dong RH, Xiao BF, Fang YS. Theoretical analysis of orthogonal test design method and application[J]. Journal of Anhui Institute of Architecture (Natural ScienceEdition), 2004, 12(6): 103-106 (in Chinese) 董如何, 肖必华, 方永水. 正交试验设计的理论分析方法及应用[J]. 安徽建筑工业学院学报: 自然科学版, 2004, 12(6): 103-106 |
| [9] | Xu AL, Xia JL, Liu KK, et al. Real-time PCR analysis of metabolic pathway of PHB in Acidiphilium cryptum DX1-1[J]. Journal of Microbiology and Biotechnology, 2010, 20(1): 71-77 |
| [10] | Liu KK, Nie ZY, Xu AL, et al. Cloning and differential expression of Acidiphilium cryptum DX1-1 CO fixed-related gene[J]. Progress in Modern Biomedicine, 2011, 18(5): 3408-3412 (in Chinese) 刘可可, 聂珍媛, 徐爱玲, 等. Acidiphilium cryptum DX1-1 CO2固定相关基因的克隆及在不同营养方式下的差异表达研究[J]. 现代生物医学进展, 2011, 18(5): 3408-3412 |
| [11] | Michael WP. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Reseach, 2001, 29(9): 2002-2007 |
| [12] | Zou LH ,Qian L, Zhang YF, et al. Isolation and identification of Acidiphilium strain DY from complex sulfide mines and its bioleaching characterization[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(2): 336-341 (in Chinese) 邹俐宏, 钱林, 张燕飞, 等. 源自硫化矿区Acidiphilium属菌的分离极其浸矿性能[J]. 中国有色金属学报, 2008, 18(2): 336-341 |
| [13] | David EC, Scott F, Nathan S, et al. Reduction of Cr(VI) under acidic conditions by the facultative Fe(III)-reducing bacterium Acidiphilium cryptum[J]. Environmental Science & Technology, 2007, 41(1): 146-152 |
| [14] | Li Y, Low GK, Scott JA, et al. The role of iron in hexavalent chromium reduction by municipal landfill leachate[J]. Journal of Hazardous Materials, 2009, 161: 657-662 |
| [15] | Cort JR, Swenson MW, Magnuson TS, et al. 1H, 13C, and 15N backbone, side-chain, and heme chemical shift assignments for oxidized and reduced forms of the monoheme c-type cytochrome ApcA isolated from the acidophilic metal-reducing bacterium Acidiphilium cryptum[J]. Biomolecular NMR Assignments, 2011, 5(1): 89-92 |
 2015, Vol. 42
2015, Vol. 42




