中国科学院微生物研究所、中国微生物学会主办
文章信息
- 刘康, 乔杨怡, 张尚杰, 郭峰, 马江锋, 信丰学, 章文明, 姜岷
- LIU Kang, QIAO Yangyi, ZHANG Shangjie, GUO Feng, MA Jiangfeng, XIN Fengxue, ZHANG Wenming, JIANG Min
- 甲醇生物转化合成化学品的研究进展
- Advances in biotransformation of methanol into chemicals
- 生物工程学报, 2023, 39(6): 2430-2448
- Chinese Journal of Biotechnology, 2023, 39(6): 2430-2448
- 10.13345/j.cjb.221010
-
文章历史
- Received: December 15, 2022
- Accepted: March 7, 2023
2. 南京工业大学 江苏先进生物与化学制造协同创新中心, 江苏 南京 210000
2. The Jiangsu National Synergetic Innovation Center for Advanced Materials, Nanjing Tech University, Nanjing 210000, Jiangsu, China
通过合成生物学技术构建微生物细胞工厂,利用可再生原料生产有价值的化学品是绿色生物制造的主要目标。目前,生物制造业高度依赖于糖类为主要原料,导致食品和饲料行业的恶性竞争。因此,开发非粮和低成本的替代原料来取代糖类对于生物制造的可持续发展至关重要。甲醇作为一种非食品原料,因其储量丰富、价格低廉而被认为是下一代碳源[1]。同时,通过二氧化碳加氢合成甲醇的进展也为可再生的甲醇生产开辟了一条途径[2]。与葡萄糖和甘油等传统碳源相比,甲醇的还原性更强,含有更高的能量,这将有利于细胞生长和生物合成[3]。
甲基营养菌是一种能够利用包括甲醇和甲烷在内的C1化合物作为唯一碳源进行生长的微生物。在所有的甲基营养菌中,甲醇在胞内首先会被氧化为有毒的甲醛,然后通过同化途径进入中心碳代谢途径进行甲基营养生长,与此同时部分甲醛会通过异化途径氧化成CO2进行脱毒反应[4]。由于生物多样性,不同的甲基营养菌具有不同的同化和异化途径。目前,天然甲基营养菌已被开发用于将甲醇转化为多种增值化学品,如萜类、有机酸及氨基酸等,但由于存在遗传背景不清晰及缺乏有效的基因编辑工具等局限,制约了天然甲基营养菌的广泛应用发展[3]。随着CRISPR-Cas9等高效基因编辑技术的出现,天然甲基营养菌的传统局限性也正被打破。与此同时,随着对甲醇代谢机制的深入了解,以模式菌株为底盘细胞通过遗传操作与工程化改造将其代谢网络重塑为能以甲醇作为碳源合成高附加值化学品的合成甲基营养细胞工厂也成为了另一重要发展方向[5-6]。而由于自身代谢网络与甲醇代谢模块适配性较差,合成甲基营养菌也面临着甲醇利用效率低下及需要辅助碳源的窘境。与传统碳源相比,甲醇的转化效率相对较低,尚不能实现工业化利用。因此本文对目前在甲基营养菌中已发现的甲醇代谢途径进行了综合讨论,为构建人工合成甲基营养菌提供了方案;此外还总结了目前天然和合成甲基营养菌将甲醇生物转化成各种增值化学品的重要进展,并探讨了甲基营养细胞工厂所面临的机遇与挑战。
1 甲醇氧化成甲醛在所有甲基营养细胞中,甲醇氧化成甲醛是甲醇代谢中的第一步,该步骤主要是由甲醇脱氢酶(Methanol dehydrogenase, MDH)与醇氧化酶(Alcohol oxidase, AOX)进行催化。基于它们的不同电子受体,MDH被分为3种:吡咯并喹啉醌(Pyrroloquinoline quinone, PQQ)依赖型甲醇脱氢酶、烟酰胺腺嘌呤二核苷酸(NAD+)依赖型甲醇脱氢酶和O2依赖型AOX (图 1)。
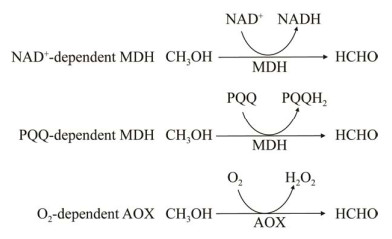
|
| 图 1 两种甲醇脱氢酶与醇氧化酶 Fig. 1 Two classes of methanol dehydrogenases and alcohol oxidase. |
| |
革兰氏阴性甲基营养菌中的MDH包含PQQ辅基,该辅基从甲醇氧化过程中捕获电子,并将它们传递给细胞色素c。PQQ辅基将氧化还原反应连接到呼吸链[7]。在扭脱甲基杆菌(M. extorquens) AM1中,15个基因参与甲醇氧化,其中14个基因被共转录,包括MDH的大小亚单位(mxaF和mxaI)、电子受体细胞色素c (mxaG)和参与运输和装配的辅助蛋白(mxaJR-SACKLD)等[8]。然而,PQQ的生物合成需要氧分子[9],这将限制PQQ依赖型MDH的应用,因为一些代谢物必须在厌氧条件下产生。
1.2 NAD+依赖型的MDH在嗜热性革兰氏阳性甲基营养细胞中,NAD+依赖型的MDH利用NAD+作为辅因子。目前,大多数研究集中在嗜热芽孢杆菌(Bacillus thermophilus)和甲醇芽孢杆菌(Bacillus methanolicus)中MDH的识别和表征上[10-11]。与PQQ依赖型MDH介导的甲醇氧化不同,NAD+依赖型MDH仅需要一个基因来实现其功能[12]。甲醇芽孢杆菌MGA3是一种众所周知的甲基营养菌,包含3个NAD+依赖型MDH基因(mdh、mdh2和mdh3),这3个MDH的活性受到MDH激活蛋白(ACT)的调控。体外研究表明,ACT可提高NAD+依赖型MDH的甲醇亲和力、氧化率和活性[11, 13],但在体内并无明显效果[14]。与依赖PQQ的MDH相比,依赖NAD+的MDH利用普遍存在的辅因子NAD+为代谢产物提供电子,并以NADH的形式产生还原力。此外,它可以在有氧和无氧条件下实现功能,而依赖PQQ的MDH仅限于有氧条件。鉴于此,依赖NAD+的MDHs可能是合成甲基营养菌更好的候选者。
1.3 O2依赖型的AOX真核甲基营养菌,如毕赤酵母(Pichia pastoris),主要利用依赖O2的AOX来氧化甲醇[15]。与PQQ依赖型MDH或NAD+依赖型MDH不同,依赖O2的AOX位于酵母的过氧化物酶体中。甲醇被AOX氧化,并转化为对细胞具有高毒性的甲醛和过氧化氢。然后,位于过氧化物酶体中的二羟基丙酮合酶(Dihydroxyacetone synthase, DAS)和过氧化氢酶(Catalase, CTA)会将其转化为无毒化合物,这是甲醇利用中最重要的步骤之一。类似于PQQ依赖的MDH,O2依赖的AOX仅在有氧条件下实现功能,然而,O2依赖型的AOX的电子守恒不如PQQ依赖的MDH。与依赖NAD+的MDH (ΔrG′=34.2 kJ/mol)和依赖PQQ的MDH (ΔrG′=–24.8 kJ/mol)相比,依赖O2的AOX (ΔrG′=–99.2 kJ/mol)具有更高的甲醇氧化效率。
2 甲醛同化为生物质甲醛是甲醇氧化中的第1个中间体,会被进一步同化为生物质。虽然甲醛是甲醇代谢的重要中间体,但是它有剧毒,毒性来源于甲醛与蛋白质和核酸的高水平非特异性反应[16]。因此,甲醛必须迅速被转化为生物质或者二氧化碳来进行脱毒作用。目前已经发现了3种不同的同化循环途径,分别是:核酮糖单磷酸途径(RuMP)、丝氨酸途径和木酮糖单磷酸途径(XuMP)。前两条通路主要存在于原核生物中,最后1条通路出现在酵母中。虽然3个通路的途径不同,但是3种途径的最终产物都是由3个C1化合物合成的三碳化合物。
2.1 通过RuMP途径吸收甲醛RuMP途径是由3个甲醛分子合成三碳化合物,可以分为3个部分:固定部分、裂解部分和重排部分(图 2A)。在固定部分中,甲醛与核酮糖-5-磷酸(Ru5P)反应,最终在3-己糖-6-磷酸合成酶(HPS)和6-磷酸-3己糖异构酶(PHI)两种关键酶的催化下形成果糖6-磷酸(F6P) [17];然后F6P通过主要的代谢细胞途径代谢:糖酵解途径、2-酮-3-脱氧-6-磷酸葡糖酸(KDPG)途径,或者磷酸戊糖途径。裂解部分主要含有由三碳化合物和3-磷酸甘油醛(G3P)转化而来的F6P。该部分发现了两个变体,其中1个是果糖-1, 6-二磷酸醛缩酶变体(FBPA),另外1个是KDPG醛缩酶变体(KDPGA)。在FBPA中,F6P被转化为FBP,随后被FBPA裂解为GAP和磷酸二羟基丙酮(DHAP),后者可以进一步转化为丙酮酸,生成1分子NAD(P)H和两个ATP。但是,在KDPGA中,F6P被几种酶转化为KDPG,然后被KDPGA裂解为GAP和丙酮酸。但是,在这个变体中只能生成1分子NAD(P)H。
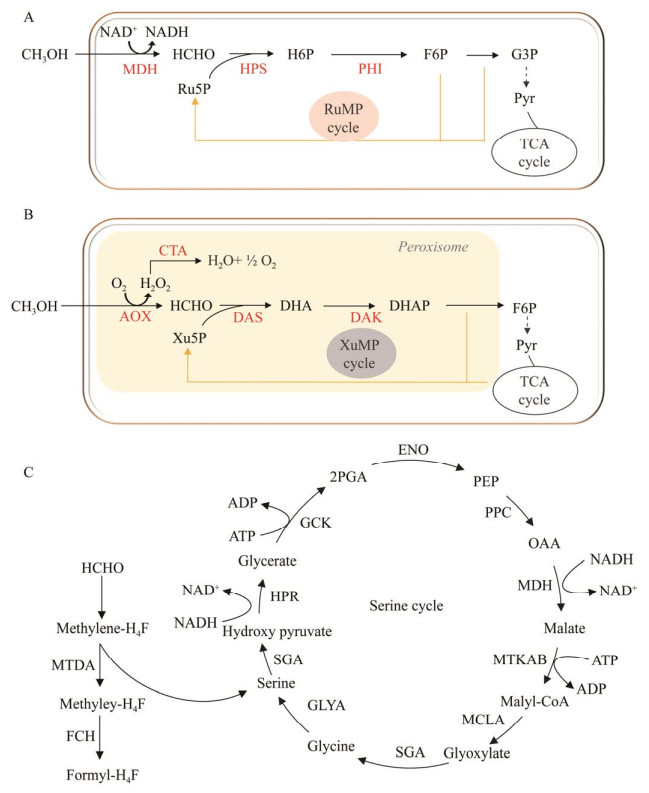
|
| 图 2 自然界中3种甲醇同化路径图 Fig. 2 Schematic representation of naturally occurring methanol-assimilation pathways. A:RuMP路径. B:XuMP路径. C:丝氨酸路径 A: RuMP. B: XuMP. C: Serine cycle. HCHO: Formaldehyde; Ru5P: Ribulose 5-phosphate; H6P: Hexulose 6-phosphate; F6P: Fructose 6-phosphate; DHAP: Dihydroxyacetone phosphate; GAP: Glyceraldehyde phosphate; HPS: 3-hexulose-6-phosphate synthase; PHI: 6-phospho-3-hexuloisomerase; Xu5P: Xylulose 5-phosphate; DHA: Dihydroxyacetone; DAS: Dihydroxyacetone synthase; DAK: Dihydroxyacetone kinase; H4F: Tetrahydrofolate; GLY: Glycine; SER: Serine; HPA: Hydroxypyruvate; 2PGA: Glycerate-2-phosphate; PEP: Phosphoenolpyruvate; OAA: Oxaloacetate; GlyA: Serine hydroxymethyl transferase; SGA: Serine-glyoxylate aminotransferase; HPR: Hydroxypyruvate reductase; GCk: Glycerate kinase; Eno: Enolase; PPC: Phosphoenolpyruvate carboxylase; MDH: Malate dehydrogenase; MtkAB: Malate-CoA ligase; MCLA: l-malyl-CoA lyase. |
| |
Ru5P的再生对于保持循环的运行至关重要,在重排部分存在两种变体:转醛醇酶(TA)和景天庚酮糖1, 7-二磷酸酶(SBPase)。但是,最后几个步骤在两种变体中是相同的,也就是GAP和景天庚酮糖1, 7-二磷酸(S7P)通过转酮醇酶(TK)重排为两个五碳糖磷酸:木酮糖5-磷酸(Xu5P)和核糖5-磷酸(Ri5P),后者进一步转化为Ru5P,完成再生途径。TA变体表现出更有效的化学计量:3HCHO+NAD++ADP=Pyruvate+NADH+ATP[18]。其中,温度的影响是非常重要的,因为NAD+依赖型MDH和FBA都在50 ℃时具有最佳活性,这也是甲醇芽孢杆菌的最佳生长的温度[19]。
2.2 通过丝氨酸途径吸收甲醛丝氨酸循环是甲基营养菌型细菌中另一种吸收甲醛的途径(图 2B)。在丝氨酸循环途径中,甲醛生成亚甲基四氢叶酸有两种途径,一种是甲醛和四氢叶酸自发转化为亚甲基四氢叶酸[20]。在另一种途径中,甲醛首先通过依赖四氢甲烷喋呤(H4MPT)的酶转化为甲酸,随后甲酸通过依赖四氢叶酸的酶进一步转化为亚甲基四氢叶酸。虽然在前一种途径中,涉及的酶较少,消耗的ATP也较少,但研究表明亚甲基四氢叶酸主要是通过第二条途径形成的[21]。
2.3 通过XuMP途径吸收甲醛所有甲基营养型酵母都具有相同的甲醛同化途径,也就是XuMP途径(图 2C)。在该途径中,甲醛首先与Xu5P结合,形成二羟基丙酮(DHA)和GAP。然后DHA和GAP在细胞质中进一步被吸收[22]。DHA被磷酸化形成磷酸二羟基丙酮,它可以与GAP缩合形成果糖-1, 6-二磷酸(FBP)。随后FBP将被去磷酸化形成F6P,其中一部分用于Xu5P的再生,而剩下的部分将用于细胞生物质的合成。甲醛同化途径中的两个关键酶AOX和DAS,在甲醇上生长时会在体内高度表达,但在其他碳源(如葡萄糖或甘油)上生长时,它们的酶活性几乎检测不到[23],表明它们是底物诱导性的。此时,该循环的总体碳平衡为:3HCHO+NAD++2ADP=Pyruvate+NADH+2ATP。
3 天然甲基营养菌用于化学品生产 3.1 萜类化合物的生产萜类化合物是自然界中结构最多样化的化学品之一,在香料及药品等领域有着广泛应用。以甲醇为底物来合成萜类化合物的策略主要是在天然甲基营养菌中引入外源性甲羟戊酸(MVA)途径[24]。虽然大肠杆菌是目前生产甲羟戊酸的主要工业微生物,但是一些天然甲基营养菌也具有一定的生产潜力,如扭脱甲基杆菌等[25] (表 1)。由于扭脱甲基杆菌AM1上游乙酰辅酶A的供给受到限制,因而导致下游MVA途径代谢通量不足,限制了MVA的高效生产。为了解决这一限速问题,Zhao等[24]采用了一种名为甲羟戊酸传感器辅助转录调控工程(SATRE)的策略,以控制代谢通量的重新分配,从而增加从甲醇到MVA生产过程中的乙酰辅酶A通量。通过在QscR转录调控文库中进行基于传感器的高通量筛选后,MVA的产量提高了60%。最后,在5 L生物反应器中进行补料分批发酵,MVA的终产量达到2.67 g/L。
| Product category | Product | Substrate | Fermentation method | Production | Strain | References |
| Terpenoids | α humulenee | Methanol | Flask | 58 mg/L | M. extorquens AM1 | [26] |
| α humulene | Methanol | Fed-batch culture | 1.65 g/L | M. extorquens AM1 | [31] | |
| Mevalonate | Methanol | Fed-batch culture | 2.67 g/L | M. extorquens AM1 | [32] | |
| Organic acid | Pyruvic acid | Methanol+Glucose | 0.26 g/L | Pichia pastoris | [33] | |
| Malic acid | Methanol+Glucose | Fed-batch culture | 2.79 g/L | Pichia pastoris | [34] | |
| Mesaconic acid | Methanol | 70 mg/L | M. extorquens AM1 | [35] | ||
| Methyl succinic acid | Methanol | 60 mg/L | M. extorquens AM1 | [35] | ||
| Fatty acids | Fatty acid | Methanol | Fed-batch culture | 15.9 g/L | Hansenula polymorpha | [36] |
| Fatty acid | Methanol | Fed-batch culture | 23.4 g/L | Pichia pastoris | [37] | |
| Polyhydroxy fatty acids | Poly β hydroxybutyric acid | Methanol | 149 g/L | M. extorquens AM1 | [29] | |
| Amino acids | Glutamic acid | Methanol+Yeast Extract | Fed-batch culture | 59 g/L | Methanol bacillus | [38] |
| Lysine | Methanol | Fed-batch culture | 0.4 g/L | Methanol bacillus | [39] | |
| Serine | Methanol | Fed-batch culture | 54.5 g/L | M. extorquens AM1 | [39] | |
| Glutamic acid | Methanol | Fed-batch culture | 38.8 g/L | Methanol bacillus | [40] | |
| Glutamic acid lysine | Methanol | Fed-batch culture | 37 g/L8 g/L | Bacillus methanol mutants DHL 122 | [40] | |
| Glutamic acid lysine | Methanol | Fed-batch culture | 28 g/L35 g/L | Bacillus methanol mutants 13A52-8A66 | [38] | |
| Other chemicals | Monacolin | Methanol+Yeast Extract+Glucose | Fermentation tank | 593.9 mg/L | Pichia pastoris | [41] |
| Lovastatin | Methanol+Yeast Extract+Glucose | Fermentation tank | 250.8 mg/L | Pichia pastoris | [41] | |
| Chondroitin sulfate | Methanol+Yeast Extract | Fermentation tank | 2.1 g/L | Pichia pastoris | [42] |
在另一项研究中,Sonntag等[26]在扭脱甲基杆菌AM1引入了来自黄色粘球菌(Myxococcus xanthus)的MVA途径,结合RBS优化α-蛇麻烯合成酶和法尼基焦磷酸合成酶,使得扭脱甲基杆菌中α-蛇麻烯的滴度从18 mg/L增加至54 mg/L。进一步在甲醇浓度限制下进行分批补料发酵,并添加十二烷进行原位萃取,将产量提高至1.65 g/L,与工业平台菌株相比,这些研究中描述的MVA和α-蛇麻烯的产品滴度已经处于具有竞争力的范围,表明通过天然甲基营养菌利用甲醇生产高价值萜类化合物是具有前景的。
3.2 聚羟基脂肪酸的生产聚羟基脂肪酸(PHAs)作为不可降解石油基塑料的潜在可持续替代品,因其具有良好的生物相容性和生物降解性而受到广泛关注[27-28]。PHAs可以由部分微生物利用多种碳源进行生物合成。基于甲醇作为底物的优点,甲基营养菌的应用被认为是甲醇生物合成PHAs的一种很有前途的途径[29]。近些年,人们专注于提高聚羟基脂肪酸的含量,控制聚羟基脂肪酸的结构,形成均聚物、随机共聚物和嵌段共聚物,来满足材料性能的多样性。扭脱甲基杆菌AM1菌株能以甲醇为唯一碳源生产聚-3-羟基丁酸酯(PHB),其最高生产滴度可达到149 g/L[30]。扭脱甲基杆菌ATCC 55366对PHB的积累可达46%,PHB的产率为0.09 g/g甲醇。由于PHB结构的刚性和脆性有限,因此以不饱和羧酸为辅助碳源生成含C‒C双键的功能化PHA的研究也被进一步开展。当以甲醇与戊酸为共底物时,甲基乳杆菌(Lactobacillus methyl) GW2可积累共聚酯聚-3-羟基丁酸酯-聚-3-羟基戊酸酯(PHB/HV)。此外,在甲醇限制条件下会产生较高分子量的PHB (900–1 800 kDa)。在缺氮和镁的条件下,扭脱甲基杆菌DSMZ 1340的PHB产量可达9.5 g/L,产率为0.16 g/g。扭脱甲基杆菌AM1菌株在钴限制条件下,能以甲醇为唯一碳源合成聚羟基脂肪酸。经过基因工程改造后,重组菌株可生产由3HB、3HV和c6单体(R)-3-羟基己酸酯组成的聚羟基烷酸三元共聚物,这表明甲基营养菌可以以甲醇为原料生产实用的聚羟基脂肪酸共聚物[29]。由于甲醇成本低,因此用甲基营养菌生产聚羟基脂肪酸可以降低成本。但值得注意的是,细胞利用甲醇生产的聚羟基脂肪酸含量(46%细胞干质量)低于糖(50%‒88%细胞干质量) [43]。由于发酵过程中甲醇的浓度在100 mol/L以下,因此需要提高菌株对甲醇的耐受性,才能更好地实现工业化的应用。此外,在工业化生产之前,还需要进一步研究如何提高PHA的含量和收率。
3.3 有机酸有机酸,特别是低分子量羧酸,在食品、制药、化妆品、洗涤剂、聚合物、纺织等行业中有着广泛的应用[44]。鉴于化石燃料的危机和对环境污染的担忧,人们越来越重视利用可再生原料生产有机酸。在过去的10年里,人们利用各种微生物通过生物精炼生产出了多种有机酸,比如大肠杆菌[45-46]或解脂耶氏酵母(Yarrowia lipolytica)[47-48]产生琥珀酸,米曲霉生产苹果酸[49-50],黑曲霉生产柠檬酸[51]和地曲霉生产衣康酸[34]。采用廉价的甲醇为原料生产有机酸是实现工业化生产和提高生物工艺经济性的一种很有前途的选择。
Guo等[52]通过在毕赤酵母中合理分配代谢通量,构建了以甲醇为原料生产苹果酸的重组菌株。首先在毕赤酵母中对不同的苹果酸积累模块进行系统优化使得重组PP-CM301能利用葡萄糖为碳源生产8.55 g/L苹果酸,比出发菌株提高3.45倍。然而,当以甲醇为碳源时,并未检测到苹果酸的产生。为了释放滞留在XuMP循环中的代谢流量,对甲醇同化途径中的一个关键节点-葡萄糖-6-磷酸异构酶进行了基因敲除,最终实现了从单一甲醇补料发酵中积累2.79 g/L的苹果酸。
一些不常见的二元羧酸,如乙基丙二酸、甲基琥珀酸、中康酸和甲基苹果酸,也可以用甲醇生产[35]。扭脱甲基杆菌AM1中的乙基丙二酰辅酶A通路(EMCP)被发现含有几个饱和或不饱和羧化C4和C5酰基辅酶A酯[53]。通过在扭脱甲基杆菌AM1中异源表达酰基辅酶A硫酯水解酶,可实现从甲醇中生产70 mg/L的介康酸和60 mg/L的甲基琥珀酸。这项工作为其他甲基营养菌生产EMCP衍生的二元羧酸提供了可能性。
3.4 醇类的生产由于正丁醇具有许多优点,已被认为是一种更好的乙醇替代品。如正丁醇在水中的溶解度低于乙醇,减少了地下水污染的可能性,这一特点也使得在工业发酵中采用液-液萃取回收正丁醇可行。此外,正丁醇与目前的石油基础设施兼容,可以与汽油以高比例混合。虽然梭状芽孢杆菌是发酵生产正丁醇的主要工业微生物,但梭状芽孢杆菌的工业发酵仍存在一些局限性,如伴随副产物形成、孢子形成和低细胞密度。Hu等[54]通过将齿密螺旋体(Treponema)的TER基因和丙酮丁醇梭菌(Clostridium acetobutylicum)的adhE2基因在扭脱甲基杆菌AM1进行外源表达,尽管在甲醇上生长的细胞并不能产生正丁醇,但工程菌在乙胺上生长时能够产生15.2 mg/L的正丁醇。进一步采用适应性进化(adaptive evolution,ALE)策略,在200代后分离到一株对正丁醇耐受性高达0.5%的突变株。突变菌株能够生产25.5 mg/L的正丁醇,比原始菌株增产87%[55]。全基因组测序显示,突变菌株中编码钾/质子逆向转运蛋白的基因kefB存在SNP突变。对该基因中的一个基因敲除突变的分析证实,该突变确实是导致正丁醇耐受性增加的原因。全局代谢组学分析进一步发现,适应菌株对正丁醇胁迫的反应中,包括脂肪酸、氨基酸、二糖和类胡萝卜素在内的多种关键代谢物受到影响。总体而言,这项研究揭示了扭脱甲基杆菌AM1对溶剂压力的一系列细胞反应,从而为进一步合理设计该菌株的衍生物以增加正丁醇产量提供了遗传蓝图。
3.5 脂肪酸的生产脂肪酸及其衍生物是制造先进生物燃料、洗涤剂、润滑剂和表面活性剂等的重要原料[56]。由于脂肪酸的生产需要还原力的参与,因此还原力更高的甲醇相比糖类是更具吸引力的底物。巴斯德毕赤酵母(Pichia pastoris)由于其优秀的甲醇利用能力,可利用甲醇进行高密度发酵,被认为是以甲醇为基础的生物制造的理想宿主。最近,Cai等[37]在毕赤酵母中通过重新连接中心代谢和代谢转化,以单一甲醇为碳源,在最低限度的培养基中高水平生产脂肪酸和脂肪醇。他们首先通过敲除脂肪酸下游代谢路径来增加脂肪酸的积累,并进一步增加前体物质乙酰辅酶A和辅因子NADPH的供应来增加脂肪酸的产量。最终,通过分批补料发酵,工程菌株能积累23.4 g/L脂肪酸和2.0 g/L脂肪醇,甲醇消耗率为1.2 g/(L·h),细胞密度(OD600)可达到163。这一产量与酿酒酵母利用葡萄糖的产量相当,并且远远高于其他几种由甲醇生物合成的化学品。Gao等[36]通过将适应性进化、合理的代谢工程和多组学分析(基因组学、转录组学和脂类组学)相结合,也成功在天然甲基营养酵母汉逊酵母(Hansenula)中实现从甲醇到脂肪酸的合成。他们首先发现,阻断脂肪酸的下游代谢途径会使得酵母失去在甲醇中生长的能力。通过在葡萄糖和甲醇的比例逐渐降低的最小培养基中进行菌株适应性进化使得菌株恢复了甲醇生长能力。进一步增加乙酰辅酶A和NADPH的供应,结合分批补料发酵策略,使得游离脂肪酸产量达到15.9 g/L。这些工作为开发高效定制的甲基营养型酵母细胞工厂,用于以甲醇为基础的生物制造脂肪酸衍生燃料和化学品提供了重要基础。
3.6 氨基酸的生产氨基酸被广泛用于食品和饲料添加剂、风味增强剂、药品和高分子材料[40]。目前,规模化生产氨基酸的主要途径还是微生物发酵,谷氨酸棒状菌(Corynebacterium glutamate)是其主要的生产菌株。为了降低生产成本,人们开发了许多廉价的底物,如糖蜜和淀粉来生产氨基酸。同时,一些微生物利用更便宜的非食品底物来降低生产成本。
许多天然甲基营养菌被用于从甲醇中生产不同的氨基酸,包括谷氨酸、赖氨酸、丝氨酸和苏氨酸[38-39, 57-62]等。例如,甲醇芽孢杆菌RV3可以生产38.8 g/L的L-谷氨酸。经过化学诱变后,突变体AL119可以分泌11 g/L的L-苏氨酸。突变体DHL 122可以产生3.1 g/L的L-赖氨酸和5.6 g/L的L-苏氨酸[57]。在突变体DHL 122中过量表达内源性羧酸合酶后,可以产生37 g/L的谷氨酸和8 g/L的赖氨酸[58]。甲醇芽孢杆菌同样是一种具有从甲醇中生产氨基酸潜力的菌种。因为在甲醇芽孢杆菌参与甲醇代谢的基因是由质粒编码的,在使用甲醇的细胞中可以被上调,因此甲醇芽孢杆菌MGA3有很高的甲醇消耗率。以甲醇为碳源时,在50 ℃条件下分批补料培养可生产59 g/L谷氨酸和0.4 g/L赖氨酸[38-39]。由于缺乏有效的遗传工具,随机化学诱变是菌株工程的主要方法。例如,高丝氨酸脱氢酶突变体13A52-8A66能分泌35 g/L的L-赖氨酸和28 g/L的L-谷氨酸[38]。
细胞中分泌转运系统对氨基酸的生产至关重要。当在嗜甲烷菌(Methanotroph)中过量表达来源于谷氨酸棒杆菌的L-赖氨酸/L-精氨酸输出蛋白(LysE)后,L-赖氨酸产量提高至11.3 g/L,表明氨基酸输出体系有利于氨基酸的生产[60]。由于丝氨酸循环的存在,扭脱甲基杆菌可以从甲醇和甘氨酸中生产丝氨酸。在扭脱甲基杆菌静息细胞中,适当条件下L-丝氨酸可达到54.5 g/L[61]。同样,在甲基杆菌(Methyloba cterium sp.) MN43静息细胞中,当丝氨酸降解被阻断时,从104 mg/mL甲醇和50 mg/mL甘氨酸中获得65 mg/mL L-丝氨酸[62]。
底物消耗率和产物收率是微生物生产过程的重要指标。据报道,甲醇芽孢杆菌MGA3的细胞生长速率和甲醇消耗速率可达0.4/h和7 g/(L·h),这接近谷氨酸棒杆菌的细胞生长速率(0.53/h)和葡萄糖消耗速率[6.6 g/(L·h)][63-64]。此外,甲醇芽孢杆菌从甲醇中生产L-赖氨酸的理论产率(0.71 g/g)与谷氨酸棒杆菌从葡萄糖中生产L-赖氨酸的理论产率(0.78 g/g)相当[40]。重要的是,甲基营养菌能够在35–60 ℃的温度下生长,最佳生长温度在50–55 ℃左右[65]。基于以上优点,利用甲醇酵母生物合成甲醇氨基酸是一种有前景和可持续发展的方法。
3.7 其他化学品的生产以甲醇来生产更高附加值的精细化学品也具有一定的前景。Liu等[41]通过在毕赤酵母中组装莫那可林J和洛伐他汀的生物合成模块,在pH控制下以甲醇为底物进行培养,莫那可林J的产量为60.0 mg/L,洛伐他汀的产量为14.4 mg/L。为了缓解细胞在单培养条件下的代谢失衡和代谢应激,对其进行了通路拆分并重新分配。结果表明,莫那可林J和洛伐他汀的产量分别提高了55%和71%。最终在生物反应器中发酵得到莫那可林J的浓度为593.9 mg/L,洛伐他汀的浓度为250.8 mg/L。Jin等[42]同样以毕赤酵母为底盘细胞实现从甲醇到硫酸软骨素的合成,硫酸软骨素被广泛应用于医疗、临床、保健等领域。首先,研究人员将来源于大肠杆菌和枯草芽孢杆菌中的软骨素合成途径关键基因在毕赤酵母进行外源表达,实现了5.5 mg/L软骨素的合成。通过密码子优化、启动子工程及整合磺化模块,在补料分批发酵中产生2.1 g/L硫酸软骨素。以上研究验证了甲基营养菌还可以用于药品的生产,为甲醇转化为化学品提供了新的思路方法。
4 合成甲基营养菌用于化学品生产的研究进展尽管天然的甲基营养菌能利用甲醇进行生长并产生多种化学品,但仍然存在一些问题,如缺乏有效的基因编辑工具用于菌株改造,不能产生高水平的代谢物。此外,大多数天然的甲基营养菌是强制好氧菌,更多的还原能量被电子传递链消耗而影响了所需代谢物的积累。
合成生物学为设计微生物细胞工厂以制造化学品和其他高附加值产品提供了巨大机会,不仅可用于组装复杂的合成途径以生产次级代谢物,而且还可用于扩展底物谱甚至改变菌株营养模式。因此,一些遗传背景清晰且基因编辑工具成熟的模式菌株,如大肠杆菌、谷氨酸棒杆菌和酿酒酵母,可以通过为它们配备上游甲醇代谢模块改造为人工合成甲基营养菌,实现从甲醇到高附加值产物的生物转化(表 2)。
| Product | Substrate | Fermentation method | Production | Strain | References |
| Propyl alcohol Butanol | Methanol+Glucose | Fed-batch culture | 2.6 g/L acetone1.8 g/L butanol | Escherichia coli | [66] |
| FlavanoneNaringenin | Methanol+Yeast powder | Escherichia coli | [67] | ||
| Acetic acid Ethanol | Methanol+Xylose | 2.2 g/L acetic acid 1.6 g/L Ethanol | Escherichia coli | [68] | |
| Succinic acid | Methanol+Glucose | Fed-batch culture | (0.9±0.1) g/g | Escherichia coli | [69] |
| Fructose 6 phosphate | Methanol+Mdh, Hps and Phi Supramolecular enzyme complexes | Escherichia coli | [70] | ||
| Propylene glycol | Methanol+Glucose | 32.7 mg/L | Escherichia coli | [71] | |
| Glutamic acid | Methanol+Xylose | 90 mg/L | Corynebacterium glutamicum | [72] | |
| Cadaveramines | Methanol+Glucose | 1.5 g/L | Corynebacterium glutamicum | [73] | |
| Pyruvic acid | Methanol+Yeast powder | 2.3 g/L | Saccharomyces cerevisiae | [33] | |
| Succinic acid | Methanol+Xylose | Two-stage fermentation | 0.9 g/L | Yarrowia lipolytica | [74] |
大肠杆菌(Escherichia coli)自2015年首次被Müller等[67]开发为合成甲基营养菌以来,已成为甲醇生物转化领域研究最为广泛的底盘细胞。在大肠杆菌中构建甲醇代谢途径通常选择RuMP途径,因为该途径大多数所需的酶在大肠杆菌中是天然存在的。只有3个关键酶Mdh、Hps、Phi是大肠杆菌完成功能性RuMP途径所需要进行外源表达的。此外,由于具备成熟的基因编辑工具,大肠杆菌中的基因敲除过程快速且简单。通过敲除甲醇异化途径中的S-(羟甲基)谷胱甘肽脱氢酶(Hydroxymethylglutathione dehydrogenase, FrmA),可以有效减少甲醇到CO2的流失,提高甲醇同化到中心碳代谢途径的代谢通量。
由于甲醇在大肠杆菌中通过RuMP代谢过程中需要核酮糖五磷酸(Ru5P)的参与,而Ru5P的再生由于涉及多个循环反应,难以通过代谢工程改造手段实现有效再生,因此,通常会添加葡萄糖或木糖等辅助碳源来促进甲醇的吸收利用。Bennett等[66]在敲除了FrmA的大肠杆菌中外源性表达RuMP途径中的关键酶,并进一步敲除磷酸葡萄糖异构酶为Ru5P提供更多代谢通量。当以葡萄糖与甲醇为共底物发酵时,产生了2.6 g/L的丙酮和1.8 g/L的丁醇。然而,当使用13C标记甲醇时,结果显示终产物的标记碳相当低,其丙酮和丁醇分别约为3.6%和0.7%。
决定甲基营养型大肠杆菌能否高效利用甲醇的一个关键因素是MDH是否具备优良的酶动力。Whitake等[67]利用来自嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)的NAD+依赖型MDH和来自甲醇芽孢杆菌的RuMP途径关键酶,改造大肠杆菌使其能利用甲醇。通过13C甲醇标记实验,证明构建的甲基营养型大肠杆菌能有效将甲醇转化为生物质。例如,关键的TCA循环中间产物琥珀酸和苹果酸的标记率高达39%,而较低的糖酵解中间产物3-磷酸甘油酸的标记率高达53%。每种化合物都标记了多个碳,证明了甲醇同化支持生长的循环途径。进一步通过整合黄烷酮柚皮素的合成途径,实现以甲醇为底物生产3.5 mg/L的柚皮苷元。
除了RuMP途径,丝氨酸循环也被证明能在大肠杆菌中实现甲醇的同化。Yu等[68]基于营养缺陷型选择平台和逐步优化开发了一种用于甲醇同化的修饰性丝氨酸循环。在这条修饰性丝氨酸循环中,甲醇首先氧化成甲酸,甲酸变成亚甲基四氢呋喃,与甘氨酸缩合产生丝氨酸,丝氨酸随后转化为草酰乙酸,然后还原为苹果酸,苹果酸随后分解成乙醛酸和乙酰辅酶A,乙醛酸作为这条途径的终产物。工程大肠杆菌利用该途径在含有木糖的培养基中,可利用甲醇生产2.2 g/L乙酸和1.6 g/L乙醇。13C甲醇标记结果表明,甲醇同化为乙酸的比例约为38%,乙醇的同化比例约为25%。Zhang等[69]利用来自甲醇芽孢杆菌的NAD+依赖型的MDH和来自不同供体来源的RuMP途径将甲醇同化模块引入产琥珀酸的大肠杆菌中。在厌氧发酵下,以甲醇和葡萄糖为共底物,琥珀酸收率从(0.91±0.08) g/g提高到(0.98±0.11) g/g。进一步的13C标记实验表明,重组菌株成功地将甲醇转化为琥珀酸。
虽然上述环状通路在功能上得到了证明,但环状通路在体内的功能性表达需要精细的调控。因此,线性路径具有易于实施的潜在优势。Siegel等[75]借助计算机模拟系统构建了一种名为甲醛酶(Formaldehydease, FLS)的途径,可直接将3个甲醛分子缩合成一分子的二羟基丙酮。这一途径已在体外进行了功能验证,并且能够在含有甲醇的复杂培养基中促进大肠杆菌的生长。另一种不同的线性途径被称为合成乙酰辅酶A途径(Synthesis of acetyl-CoA, SACA),它利用乙醛酸合酶将两个甲醛分子转化为一分子乙醛酸[76],随后乙醛酸通过磷酸酮醇酶的次要反应转化为乙酰磷酸,乙酰磷酸通过磷酸乙酰转移酶(PTA)可以被高效转化为乙酰辅酶A进入中心碳代谢途径。SACA途径首先是通过13C标记在体外被证明的,获得了大约50%的碳产率。重要的是,SACA途径也在体内得到了证实。在添加1 g/L酵母粉和2 g/L胰蛋白胨的最低限度的培养基中,添加甲醇对菌体生长具有促进作用,甲醇的生物产量为0.03 g CDW/g。然后用13C甲醇通过SACA途径验证甲醇的同化作用,在磷酸烯醇式丙酮酸中得到约17%的平均碳标记。尽管与其他研究相比,这些结果并不显著,但这一线性途径能在细胞内发挥作用,进一步的适应性进化可能导致改进的途径动力学、速率和产量,以实现自主的甲基化营养。
4.2 谷氨酸棒杆菌与大肠杆菌相比,谷氨酸棒杆菌被大众认为是安全的,所以其适合于生产与人类消费相关的生化制品。目前,微生物发酵仍然是大规模生产氨基酸的主要途径。例如,谷氨酸棒杆菌在工程化后,可以在甲醇和木糖作为底物条件下产生谷氨酸。由此产生的谷氨酸滴定度[72]达到90 mg/L。通过进一步的ALE提高工程菌株对于甲醇的耐受性,提高甲醇浓度至15 g/L进行发酵发现谷氨酸产量也随之提高至230 mg/L,表明ALE对于提高甲醇的生物转化效率有明显的促进作用[77]。
除了与食物相关的化合物之外,尸胺(一种赖氨酸脱羧产物)也实现了以甲醇为原料的生产。Lessmeier等[73]设计了一株工程化谷氨酸棒杆菌,它能代谢非天然碳底物甲醇,并将甲醇至少部分转化为非原生产物尸胺。工程菌株表达了来自大肠杆菌的赖氨酸脱羧酶、来自甲醇芽孢杆菌的MDH、来自枯草芽孢杆菌的Hps和Phi并敲除了内源性乙醛脱氢酶基因ald和fadH来阻断甲醇的异化途径。在这种情况下,当使用甲醇与葡萄糖为共底物时,工程谷氨酸棒杆菌产生1.5 g/L的尸胺,其中15%的碳被13C甲醇所标记。
4.3 合成甲基营养型酵母除了原核甲基养菌外,酿酒酵母也表现出了作为甲醇转化微生物底盘的巨大潜力,因为它对高浓度甲醇的耐受能力很强。Dai等[33]将源自甲基化酵母毕赤酵母的甲醇氧化途径[包括醇氧化酶(AOX)、过氧化氢酶(CAT)、二羟丙酮合酶(DAS1/2)和二羟丙酮激酶(Dihydroxyacetone Kinase, DAK)]整合到酿酒酵母的染色体中。这些来自毕赤酵母的具有靶向信号的甲基化酶被发现能够在重组的酿酒酵母的过氧化物酶中定位并功能性地表达。当使用甲醇作为唯一碳源时,经过富集培养后的工程酿酒酵母显示出1.04 g/L的甲醇消耗和3.13%的细胞生长增加,并成功生产260 mg/L的丙酮酸。最近,解脂耶氏酵母经过改造后,也可以在甲醇作为碳源的条件下实现琥珀酸的生产[78]。研究团队首先在解脂耶氏酵母的过氧化物酶体中构建了来自于毕赤酵母的甲醇利用模块,初步赋予其甲醇同化利用能力。随后为了提高甲醇代谢效率,作者采取了两种策略:(1) 构建前体供给模块,通过外源表达木糖利用途径并以木糖作为辅助碳源,来提供甲醇代谢过程中必不可少的前体物木酮糖五磷酸(Xu5P)。(2) 构建前体再生模块,在解脂耶氏酵母的过氧化物酶体内构建来源于毕赤酵母的Xu5P循环。这种区室化策略使得甲醇消耗从3.4 g/L提高至4.5 g/L。随后,13C甲醇同位素标记实验证明甲醇被成功同化进入中心碳代谢途径。此外,转录组学分析挖掘到了多个甲醇代谢相关元件,通过强化相关元件进一步提高甲醇消耗至5.2 g/L。为了验证甲醇到化学品的生物转化,作者通过敲除琥珀酸脱氢酶来实现琥珀酸的积累,最终通过富集发酵的方式,实现以甲醇为唯一碳源生产0.92 g/L丁二酸。利用甲醇作为唯一碳源、提高甲醇的利用率和增值化学品产量的研究仍然是一项巨大的挑战,但是这些研究初步显示了在工程化非甲基营养型真核微生物中甲醇的利用以及在未来将其应用扩大到大规模工业化工厂的潜力。
5 甲醇生物转化的潜在问题及解决策略 5.1 甲醇的氧化甲醇在甲基营养菌中的氧化主要依赖上述所提及的3种酶(PQQ依赖型MDH、NAD+依赖型MDH与O2依赖型AOX)。从能量消耗角度来看,NAD+依赖型MDH由于比其他两种类型更经济,形成的NADH可用于促进产物的合成,因而受到广泛研究。然而,其较差的热动力学是构建高效甲基营养细胞工厂的一个重大瓶颈,亟需开发更加高效的MDH。蛋白质设计和定向进化技术有助于这一过程的推进。例如,Chen等[70]利用定向分子进化技术,构建了来源于钩虫贪铜菌(Cupriavidus necator) N-1的MDH2变体,与原始MDH2相比,甲醇氧化的催化效率提高了6倍。此外,Roth等[79]用甲醛传感器开发噬菌体辅助非连续进化(phage-assisted non-continuous evolution, PANCE)方法,对来自甲醇芽孢杆菌的MDH2进行进化,使其最大反应速度提高了3.5倍,为MDH进一步改造提供了理论基础。
5.2 碳通量的合理分配甲基营养菌中的甲醇异化途径既是细胞免受甲醛毒害作用的自我保护机制,也是NADH和ATP的重要来源。然而,甲醇的过度异化会产生过量CO2造成碳原子流失,从而影响生物质和目标化学品的产量。例如,对巴斯德毕赤酵母的化学计量模型分析表明,在甲醇补料分批发酵过程中,会有70%‒80%的碳原子经异化途径流失[80]。对异化途径进行敲除虽然能够减少碳原子的流失,但也会使得甲醛积累,并且造成NADH与ATP的供给失衡,从而抑制细胞的生长[34]。由于只有不能被及时同化的甲醛才会进入异化途径进行脱毒作用,因此通过强化甲醛同化途径来合理分配碳通量以达到产品产量和生物量增长之间的平衡似乎是一种更优策略。由于RuMP和XuMP等天然甲醇同化途径是循环性的,因此前体物Ru5P或Xu5P的再生对于提高整个途径的效率非常重要,这意味着可能需要一个活跃的非氧化戊糖-磷酸途径来驱动碳重排过程,从而提高整体生产力。对天然甲基营养菌和合成甲基营养菌的研究证实了这种再生过程对有效同化甲醛的重要性。
最近,线性化甲醛同化途径的开发也受到广泛关注。基于FLS或乙醇醛合酶(glycolaldehyde synthase , GALS)等计算设计酶的甲醛缩合线性途径已被证实具备可行性,并应用于化学品的合成。例如,FLS被成功开发用于将甲醛转化为L-赤藓酮糖的高效全细胞生物催化工艺中,最终生产滴度为252 g/L,产率为126 g/(L·h)。然而,由于FLS和GALS的Km值较高,这些酶的催化效率仍需进一步提高,才能将这些人工线性途径用于构建更高效地合成甲基营养菌。
5.3 甲醇同化与产物合成模块的适配性无论是在天然甲基营养菌还是合成甲基营养菌中,如何提高甲醇同化与产物合成模块的适配性一直是构建高效甲醇细胞工厂亟需解决的瓶颈问题。单一地在天然甲基营养菌中引入产物合成模块或在模式菌株中引入甲醇同化模块通常难以实现甲醇的高效生物转化。这种模块间适配性差的问题可以通过以下两种策略来解决。首先,在深入了解甲醇代谢及其与中心代谢途径联系的基础上,实施合理的设计与代谢工程改造。例如,Guo等[34]在毕赤酵母在引入苹果酸合成模块,当以葡萄糖为底物进行发酵时,工程菌株能够生产8.55 g/L苹果酸。然而,当以甲醇为底物进行发酵时,却并未检测到苹果酸的产生,这表明大量进入同化途径的碳原子被限制在XuMP循环中,并未流入到产物合成模块中。随后,通过敲除葡萄糖-6-磷酸异构酶(GPI)来修饰甲醇同化模块使其与产物合成模块具有良好适配性,最终实现了甲醇到苹果酸的生物合成。其次,基于ALE和系统生物技术相结合的逆向工程策略也已被证明是改善甲醇同化模块与甲醇同化模块之间适配性的有效策略。ALE是构建工程菌株过程中经常使用的方法,在特定的生长条件下长期培养微生物,直到它们产生具有所需表型的突变株。Gao等[37]发现在天然甲基营养型酵母多形汉逊酵母中构建了产脂肪酸模块后,菌株失去了在甲醇中的生长能力,这可能归因于产物合成模块的引入干扰了甲醇同化模块。通过引入ALE策略,工程菌株恢复了以甲醇为唯一碳源生长和生产游离脂肪酸的能力。通过逆向工程发现lpl1 (编码假定的脂肪酶)和izh3 (编码与锌代谢相关的膜蛋白)的失活是恢复菌株生长的关键元件,为后续构建生物细胞工厂实现从甲醇到脂肪酸高效合成提供了重要指导。
6 展望与总结从经济、生态和工艺的角度来看,甲醇在生物技术过程中是一种具有吸引力的非食品替代原料。甲基营养菌被广泛用于生产各种产品,如PHB和一些氨基酸等。新一代生物技术的快速发展,特别是机器学习和代谢网络模型的发展,为基于甲醇的生物制造开辟了新的机遇。特别是随着高效基因编辑工具的开发,如CRISPR-Cas9系统,使得构建更高效的甲基营养菌成为可能。因此,利用这些天然甲基营养菌开发基于甲醇作为替代碳源的具有经济竞争力的生物工艺将更加现实。此外,随着合成生物学的发展,代谢工程变得更加高效且多样化,使得我们可以在非天然的甲基营养菌中创造新的甲醇代谢,以便它们可以利用甲醇作为碳水化合物的共底物来产生代谢物作为生物燃料和化学品。虽然目前在甲醇的生物转化领域取得了许多进展,但仍然存在一些局限性和挑战。首先是甲醇同化途径的关键酶催化效率低。例如,MDH的动力学是设计合成甲基营养菌时要考虑的一个关键限制因素,除了寻找替代酶和合理的代谢工程改造外,还需要借助计算机辅助蛋白质设计来提高酶的催化效率并克服这一限制。此外,利用甲醇的甲基营养菌,尤其是合成甲基营养菌在甲醇或有辅助碳源的甲醇培养基中的生长速度都低于在传统碳源培养基中的生长速度。主要原因是甲醇的代谢中间物甲醛对细胞具有毒性作用。通过蛋白组装策略构建的多酶复合物,可以快速固定甲醛,显著提高甲醛同化效率,从而缓解细胞毒性[70]。鉴于ALE可以选择有利于所需表型的突变,通过ALE提高细胞对甲醇的耐受性同样是解决上述问题的重要策略。总之,随着合成生物学的快速发展和对天然甲基营菌的深度学习认知,以天然/合成甲基营养菌进行的甲醇生物转化过程在不久的将来有着更有前景的应用。
| [1] |
OLAH GA. Beyond oil and gas: the methanol economy. Angewandte Chemie International Edition, 2005, 44(18): 2636-2639. DOI:10.1002/anie.200462121
|
| [2] |
COTTON CA, CLAASSENS NJ, BENITO-VAQUERIZO S, BAR-EVEN A. Renewable methanol and formate as microbial feedstocks. Current Opinion in Biotechnology, 2020, 62: 168-180. DOI:10.1016/j.copbio.2019.10.002
|
| [3] |
ZHANG WM, SONG M, YANG Q, DAI ZX, ZHANG SJ, XIN FX, DONG WL, MA JF, JIANG M. Current advance in bioconversion of methanol to chemicals. Biotechnology for Biofuels, 2018, 11(1): 1-11. DOI:10.1186/s13068-017-1003-x
|
| [4] |
张卉, 袁姚梦, 张翀, 杨松, 邢新会. 合成甲基营养细胞工厂同化甲醇的研究进展及未来展望. 合成生物学, 2021, 2(2): 222-233. ZHANG H, YUAN YM, ZHANG C, YANG S, XING XH. Research progresses and future prospects of synthetic methylotrophic cell factory for methanol assimilation. Synthetic Biology Journal, 2021, 2(2): 222-233 (in Chinese). |
| [5] |
陶雨萱, 张尚杰, 景艺文, 信丰学, 董维亮, 周杰, 蒋羽佳, 章文明, 姜岷. 甲基营养型大肠杆菌构建策略的研究进展. 化工进展, 2021, 40(7): 3932-3941. TAO YX, ZHANG SJ, JING YW, XIN FX, DONG WL, ZHOU J, JIANG YJ, ZHANG WM, JIANG M. Recent advances in the construction strategy of methylotrophic Escherichia coli. Chemical Industry and Engineering Progress, 2021, 40(7): 3932-3941 (in Chinese). DOI:10.16085/j.issn.1000-6613.2020-1607 |
| [6] |
高教琪, 周雍进. 甲醇生物转化的机遇与挑战. 合成生物学, 2020, 1(2): 158-173. GAO JQ, ZHOU YJ. Advances in methanol bio-transformation. Synthetic Biology Journal, 2020, 1(2): 158-173 (in Chinese). |
| [7] |
MATSUSHITA K, ARENTS JC, BADER R, YAMADA M, ADACHI O, POSTMA PW. Escherichia coli is unable to produce pyrroloquinoline quinone (PQQ). Microbiology, 1997, 143(10): 3149-3156. DOI:10.1099/00221287-143-10-3149
|
| [8] |
CHISTOSERDOVA L, CHEN SW, LAPIDUS A, LIDSTROM ME. Methylotrophy in Methylobacterium extorquens AM1 from a genomic point of view. Journal of Bacteriology, 2003, 185(10): 2980-2987. DOI:10.1128/JB.185.10.2980-2987.2003
|
| [9] |
VELTEROP JS, SELLINK E, MEULENBERG JJ, DAVID S, BULDER I, POSTMA PW. Synthesis of pyrroloquinoline quinone in vivo and in vitro and detection of an intermediate in the biosynthetic pathway. Journal of Bacteriology, 1995, 177(17): 5088-5098. DOI:10.1128/jb.177.17.5088-5098.1995
|
| [10] |
SHEEHAN MC, BAILEY CJ, DOWDS BA, McCONNELL DJ. A new alcohol dehydrogenase, reactive towards methanol, from Bacillus stearothermophilus. Biochemical Journal, 1988, 252(3): 661-666. DOI:10.1042/bj2520661
|
| [11] |
KROG A, HEGGESET TMB, MÜLLER JEN, KUPPER CE, SCHNEIDER O, VORHOLT JA, ELLINGSEN TE, BRAUTASET T. Methylotrophic Bacillus methanolicus encodes two chromosomal and one plasmid born NAD+ dependent methanol dehydrogenase paralogs with different catalytic and biochemical properties. PLoS One, 2013, 8(3): e59188. DOI:10.1371/journal.pone.0059188
|
| [12] |
OCHSNER AM, MÜLLER JEN, MORA CA, VORHOLT JA. In vitro activation of NAD-dependent alcohol dehydrogenases by Nudix hydrolases is more widespread than assumed. FEBS Letters, 2014, 588(17): 2993-2999. DOI:10.1016/j.febslet.2014.06.008
|
| [13] |
WITTHOFF S, SCHMITZ K, NIEDENFÜHR S, NÖH K, NOACK S, BOTT M, MARIENHAGEN J. Metabolic engineering of Corynebacterium glutamicum for methanol metabolism. Applied and Environmental Microbiology, 2015, 81(6): 2215-2225. DOI:10.1128/AEM.03110-14
|
| [14] |
MÜLLER JEN, MEYER F, LITSANOV B, KIEFER P, POTTHOFF E, HEUX S, QUAX WJ, WENDISCH VF, BRAUTASET T, PORTAIS JC, VORHOLT JA. Engineering Escherichia coli for methanol conversion. Metabolic Engineering, 2015, 28: 190-201. DOI:10.1016/j.ymben.2014.12.008
|
| [15] |
LIMTONG S, SRISUK N, YONGMANITCHAI W, YURIMOTO H, NAKASE T.. Ogataea chonburiensis sp. nov. and Ogataea nakhonphanomensis sp. nov., thermotolerant, methylotrophic yeast species isolated in Thailand, and transfer of Pichia siamensis and Pichia thermomethanolica to the genus Ogataea. International Journal of Systematic and Evolutionary Microbiology, 2008, 58(1): 302-307. DOI:10.1099/ijs.0.65380-0
|
| [16] |
YURIMOTO H, KATO N, SAKAI Y. Assimilation, dissimilation, and detoxification of formaldehyde, a central metabolic intermediate of methylotrophic metabolism. The Chemical Record, 2005, 5(6): 367-375. DOI:10.1002/tcr.20056
|
| [17] |
KATO N, YURIMOTO H, THAUER RK. The physiological role of the ribulose monophosphate pathway in bacteria and Archaea. Bioscience, Biotechnology, and Biochemistry, 2006, 70(1): 10-21. DOI:10.1271/bbb.70.10
|
| [18] |
DALTON H. The biochemistry of methylotrophs. Trends in Biochemical Sciences, 1983, 8(9): 342-343.
|
| [19] |
STOLZENBERGER J, LINDNER SN, WENDISCH VF. The methylotrophic Bacillus methanolicus MGA3 possesses two distinct fructose 1, 6-bisphosphate aldolases. Microbiology, 2013, 159(Pt_8): 1770-1781. DOI:10.1099/mic.0.067314-0
|
| [20] |
VUILLEUMIER S, CHISTOSERDOVA L, LEE MC, BRINGEL F, LAJUS A, ZHOU Y, GOURION B, BARBE V, CHANG J, CRUVEILLER S, DOSSAT C, GILLETT W, GRUFFAZ C, HAUGEN E, HOURCADE E, LEVY R, MANGENOT S, MULLER E, NADALIG T, PAGNI M, et al. Methylobacterium genome sequences: a reference blueprint to investigate microbial metabolism of C1 compounds from natural and industrial sources. PLoS One, 2009, 4(5): e5584. DOI:10.1371/journal.pone.0005584
|
| [21] |
CROWTHER GJ, KOSÁLY G, LIDSTROM ME. Formate as the main branch point for methylotrophic metabolism in Methylobacterium extorquens AM1. Journal of Bacteriology, 2008, 190(14): 5057-5062. DOI:10.1128/JB.00228-08
|
| [22] |
KAWAGUCHI K, YURIMOTO H, OKU M, SAKAI Y. Yeast methylotrophy and autophagy in a methanol-oscillating environment on growing Arabidopsis thaliana leaves. PLoS One, 2011, 6(9): e25257. DOI:10.1371/journal.pone.0025257
|
| [23] |
CEREGHINO JL, CREGG JM. Heterologous protein expression in the methylotrophic yeast Pichia pastoris. FEMS Microbiology Reviews, 2000, 24(1): 45-66. DOI:10.1111/j.1574-6976.2000.tb00532.x
|
| [24] |
ZHAO LS, CHANG WC, XIAO YL, LIU HW, LIU PH. Methylerythritol phosphate pathway of isoprenoid biosynthesis. Annual Review of Biochemistry, 2013, 82: 497-530. DOI:10.1146/annurev-biochem-052010-100934
|
| [25] |
NAGAI H, MASUDA A, TOYA Y, MATSUDA F. Shimizu H.. Metabolic engineering of mevalonate-producing Escherichia coli strains based on thermodynamic analysis. Metabolic Engineering, 2018, 47: 1-9. DOI:10.1016/j.ymben.2018.02.012
|
| [26] |
SONNTAG F, KRONER C, LUBUTA P, PEYRAUD R, HORST A, BUCHHAUPT M, SCHRADER J. Engineering Methylobacterium extorquens for de novo synthesis of the sesquiterpenoid α-humulene from methanol. Metabolic Engineering, 2015, 32: 82-94. DOI:10.1016/j.ymben.2015.09.004
|
| [27] |
ALI SHAH A, HASAN F, HAMEED A, AHMED S. Biological degradation of plastics: a comprehensive review. Biotechnology Advances, 2008, 26(3): 246-265. DOI:10.1016/j.biotechadv.2007.12.005
|
| [28] |
GAO X, CHEN JC, WU Q, CHEN GQ. Polyhydroxyalkanoates as a source of chemicals, polymers, and biofuels. Current Opinion in Biotechnology, 2011, 22(6): 768-774. DOI:10.1016/j.copbio.2011.06.005
|
| [29] |
ORITA I, NISHIKAWA K, NAKAMURA S, FUKUI T. Biosynthesis of polyhydroxyalkanoate copolymers from methanol by Methylobacterium extorquens AM1 and the engineered strains under cobalt-deficient conditions. Applied Microbiology and Biotechnology, 2014, 98(8): 3715-3725. DOI:10.1007/s00253-013-5490-9
|
| [30] |
SUZUKI T, YAMANE T, SHIMIZU S. Kinetics and effect of nitrogen source feeding on production of poly-β-hydroxybutyric acid by fed-batch culture. Applied Microbiology and Biotechnology, 1986, 24(5): 366-369. DOI:10.1007/BF00294591
|
| [31] |
van DIEN SJ, MARX CJ, O՚BRIEN BN, LIDSTROM ME. Genetic characterization of the carotenoid biosynthetic pathway in Methylobacterium extorquens AM1 andIsolation of a Colorless Mutant. Applied and Environmental Microbiology, 2003, 69(12): 7563-7566. DOI:10.1128/AEM.69.12.7563-7566.2003
|
| [32] |
LIANG WF. Biosensor-assisted transcriptional regulator engineering for Methylobacterium extorquens AM1 to improve mevalonate synthesis by increasing the acetyl-CoA supply. Metabolic Engineering, 2017, 39: 159-168. DOI:10.1016/j.ymben.2016.11.010
|
| [33] |
DAI ZX. Metabolic construction strategies for direct methanol utilization in Saccharomyces cerevisiae. Bioresource Technology, 2017, 245: 1407-1412. DOI:10.1016/j.biortech.2017.05.100
|
| [34] |
KUENZ A, GALLENMÜLLER Y, WILLKE T, VORLOP KD. Microbial production of itaconic acid: developing a stable platform for high product concentrations. Applied Microbiology and Biotechnology, 2012, 96(5): 1209-1216. DOI:10.1007/s00253-012-4221-y
|
| [35] |
SONNTAG F, BUCHHAUPT M, SCHRADER J. Thioesterases for ethylmalonyl-CoA pathway derived dicarboxylic acid production in Methylobacterium extorquens AM1. Applied Microbiology and Biotechnology, 2014, 98(10): 4533-4544. DOI:10.1007/s00253-013-5456-y
|
| [36] |
GAO JQ, LI YX, YU W, ZHOU YJ. Rescuing yeast from cell death enables overproduction of fatty acids from sole methanol. Nature Metabolism, 2022, 4(7): 932-943. DOI:10.1038/s42255-022-00601-0
|
| [37] |
CAI P, WU XY, DENG J, GAO LH, SHEN YW, YAO L, ZHOU YJ. Methanol biotransformation toward high-level production of fatty acid derivatives by engineering the industrial yeast Pichia pastoris. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(29): e2201711119. DOI:10.1073/pnas.2201711119
|
| [38] |
BRAUTASET T, WILLIAMS MD, DILLINGHAM RD, KAUFMANN C, BENNAARS A, CRABBE E, FLICKINGER MC. Role of the Bacillus methanolicus citrate synthase Ⅱ gene, citY, in regulating the secretion of glutamate in l-lysine-secreting mutants. Applied and Environmental Microbiology, 2003, 69(7): 3986-3995. DOI:10.1128/AEM.69.7.3986-3995.2003
|
| [39] |
BRAUTASET T, JAKOBSEN ØM, DEGNES KF, NETZER R, NÆRDAL I, KROG A, DILLINGHAM R, FLICKINGER MC, ELLINGSEN TE. Bacillus methanolicus pyruvate carboxylase and homoserine dehydrogenase Ⅰ and Ⅱ and their roles for l-lysine production from methanol at 50 ℃. Applied Microbiology and Biotechnology, 2010, 87(3): 951-964. DOI:10.1007/s00253-010-2559-6
|
| [40] |
BRAUTASET T, JAKOBSEN ØM, JOSEFSEN KD, FLICKINGER MC, ELLINGSEN TE. Bacillus methanolicus: a candidate for industrial production of amino acids from methanol at 50 ℃. Applied Microbiology and Biotechnology, 2007, 74(1): 22-34. DOI:10.1007/s00253-006-0757-z
|
| [41] |
LIU YQ. Engineered monoculture and co-culture of methylotrophic yeast for de novo production of monacolin J and lovastatin from methanol. Metabolic Engineering, 2018, 45: 189-199. DOI:10.1016/j.ymben.2017.12.009
|
| [42] |
JIN XR, ZHANG WJ, WANG Y, SHENG JY, XU RR, LI JH, DU GC, KANG Z. Biosynthesis of non-animal chondroitin sulfate from methanol using genetically engineered Pichia pastoris. Green Chemistry, 2021, 23(12): 4365-4374. DOI:10.1039/D1GC00260K
|
| [43] |
HÖFER P, CHOI YJ, OSBORNE MJ, MIGUEZ CB, VERMETTE P, GROLEAU D. Production of functionalized polyhydroxyalkanoates by genetically modified Methylobacterium extorquens strains. Microbial Cell Factories, 2010, 9(1): 1-13. DOI:10.1186/1475-2859-9-1
|
| [44] |
BECKER J, WITTMANN C. Advanced biotechnology: metabolically engineered cells for the bio-based production of chemicals and fuels, materials, and health-care products. Angewandte Chemie International Edition, 2015, 54(11): 3328-3350. DOI:10.1002/anie.201409033
|
| [45] |
WU MK, ZHANG WM, JI YL, YI XY, MA JF, WU H, JIANG M. Coupled CO2 fixation from ethylene oxide off-gas with bio-based succinic acid production by engineered recombinant Escherichia coli. Biochemical Engineering Journal, 2017, 117: 1-6.
|
| [46] |
ZHANG WM. Expression of global regulator IrrE for improved succinate production under high salt stress by Escherichia coli. Bioresource Technology, 2018, 254: 151-156. DOI:10.1016/j.biortech.2018.01.091
|
| [47] |
GAO CJ, YANG XF, WANG HM, RIVERO CP, LI C, CUI ZY, QI QS, LIN CSK. Robust succinic acid production from crude glycerol using engineered Yarrowia lipolytica. Biotechnology for Biofuels, 2016, 9(1): 1-11. DOI:10.1186/s13068-015-0423-8
|
| [48] |
CUI ZY. Engineering of unconventional yeast Yarrowia lipolytica for efficient succinic acid production from glycerol at low pH. Metabolic Engineering, 2017, 42: 126-133. DOI:10.1016/j.ymben.2017.06.007
|
| [49] |
KNUF C, NOOKAEW I, BROWN SH, McCULLOCH M, BERRY A, NIELSEN J. Investigation of malic acid production in Aspergillus oryzae under nitrogen starvation conditions. Applied and Environmental Microbiology, 2013, 79(19): 6050-6058. DOI:10.1128/AEM.01445-13
|
| [50] |
OCHSENREITHER K, FISCHER C, NEUMANN A, SYLDATK C. Process characterization and influence of alternative carbon sources and carbon-to-nitrogen ratio on organic acid production by Aspergillus oryzae DSM1863. Applied Microbiology and Biotechnology, 2014, 98(12): 5449-5460. DOI:10.1007/s00253-014-5614-x
|
| [51] |
HU W, LIU J, CHEN JH, WANG SY, LU D, WU QH, LI WJ. A mutation of Aspergillus niger for hyper-production of citric acid from corn meal hydrolysate in a bioreactor. Journal of Zhejiang University: Science B, 2014, 15(11): 1006-1010. DOI:10.1631/jzus.B1400132
|
| [52] |
GUO F, DAI ZX, PENG WF, ZHANG SJ, ZHOU J, MA JF, DONG WL, XIN FX, ZHANG WM, JIANG M. Metabolic engineering of Pichia pastoris for malic acid production from methanol. Biotechnology and Bioengineering, 2021, 118(1): 357-371. DOI:10.1002/bit.27575
|
| [53] |
ERB TJ, FUCHS G, ALBER BE. (2S)-Methylsuccinyl-CoA dehydrogenase closes the ethylmalonyl-CoA pathway for acetyl-CoA assimilation. Molecular Microbiology, 2009, 73(6): 992-1008. DOI:10.1111/j.1365-2958.2009.06837.x
|
| [54] |
HU B, LIDSTROM ME. Metabolic engineering of Methylobacterium extorquens AM1 for 1-butanol production. Biotechnology for Biofuels, 2014, 7(1): 1-10. DOI:10.1186/1754-6834-7-1
|
| [55] |
HU B, YANG YM, BECK DAC, WANG QW, CHEN WJ, YANG J, LIDSTROM ME, YANG S. Comprehensive molecular characterization of Methylobacterium extorquens AM1 adapted for 1-butanol tolerance. Biotechnology for Biofuels, 2016, 9(1): 1-14. DOI:10.1186/s13068-015-0423-8
|
| [56] |
FILLET S, ADRIO JL. Microbial production of fatty alcohols. World Journal of Microbiology and Biotechnology, 2016, 32(9): 1-10.
|
| [57] |
MOTOYAMA H, ANAZAWA H, KATSUMATA R, ARAKI K, TESHIBA S. Amino acid production from methanol byMethylobacillus glycogenes Mutants: isolation of l-glutamic acid hyper-producing mutants from M. glycogenes strains, and derivation of l-threonine and l-lysine-producing mutants from them. Bioscience, Biotechnology, and Biochemistry, 1993, 57(1): 82-87. DOI:10.1271/bbb.57.82
|
| [58] |
MOTOYAMA H, YANO H, TERASAKI Y, ANAZAWA H. Overproduction of l-lysine from methanol by Methylobacillus glycogenes derivatives carrying a plasmid with a mutated dapA gene. Applied and Environmental Microbiology, 2001, 67(7): 3064-3070. DOI:10.1128/AEM.67.7.3064-3070.2001
|
| [59] |
HANSON RS, DILLINGHAM R, OLSON P, LEE GH, CUE D, SCHENDEL FJ, BREMMON C, FLIEKINGER MC. Production of l-lysine and some other amino acids by mutants of B. methanolicus[M]// Microbial Growth on C1 Compounds. Dordrecht: Springer Netherlands, 1996: 227-236.
|
| [60] |
GUNJI Y, YASUEDA H. Enhancement of l-lysine production in methylotroph Methylophilus methylotrophus by introducing a mutant LysE exporter. Journal of Biotechnology, 2006, 127(1): 1-13. DOI:10.1016/j.jbiotec.2006.06.003
|
| [61] |
SIRIROTE P, YAMANE T, SHIMIZU S. Production of l-serine from methanol and glycine by resting cells of a methylotroph under automatically controlled conditions. Journal of Fermentation Technology, 1986, 64(5): 389-396. DOI:10.1016/0385-6380(86)90025-7
|
| [62] |
HAGISHITA T, YOSHIDA T, IZUMI Y, MITSUNAGA T. Efficient l-serine production from methanol and Glycine by resting cells of Methylobacterium sp. strain MN43. Bioscience, Biotechnology, and Biochemistry, 1996, 60(10): 1604-1607. DOI:10.1271/bbb.60.1604
|
| [63] |
SCHENDEL FJ, BREMMON CE, FLICKINGER MC, GUETTLER M, HANSON RS. l-lysine production at 50 degrees C by mutants of a newly isolated and characterized methylotrophic Bacillus sp.. Applied and Environmental Microbiology, 1990, 56(4): 963-970. DOI:10.1128/aem.56.4.963-970.1990
|
| [64] |
AOKI R, WADA M, TAKESUE N, TANAKA K, YOKOTA A. Enhanced glutamic acid production by a H+-ATPase-defective mutant of Corynebacterium glutamicum. Bioscience, Biotechnology, and Biochemistry, 2005, 69(8): 1466-1472. DOI:10.1271/bbb.69.1466
|
| [65] |
ARFMAN N, DIJKHUIZEN L, KIRCHHOF G, LUDWIG W, SCHLEIFER KH, BULYGINA ES, CHUMAKOV KM, GOVORUKHINA NI, TROTSENKO YA, WHITE D, SHARP RJ. Bacillus methanolicus sp. nov., a new species of thermotolerant, methanol-utilizing, endospore-forming bacteria. International Journal of Systematic Bacteriology, 1992, 42(3): 439-445. DOI:10.1099/00207713-42-3-439
|
| [66] |
BENNETT RK. Expression of heterologous non-oxidative pentose phosphate pathway from Bacillus methanolicus and phosphoglucose isomerase deletion improves methanol assimilation and metabolite production by a synthetic Escherichia coli methylotroph. Metabolic Engineering, 2018, 45: 75-85. DOI:10.1016/j.ymben.2017.11.016
|
| [67] |
WHITAKER WB. Engineering the biological conversion of methanol to specialty chemicals in Escherichia coli. Metabolic Engineering, 2017, 39: 49-59. DOI:10.1016/j.ymben.2016.10.015
|
| [68] |
YU H, LIAO JC. A modified serine cycle in Escherichia coli coverts methanol and CO2 to two-carbon compounds. Nature Communications, 2018, 165‒174: 3992.
|
| [69] |
ZHANG WM, ZHANG T, SONG M, DAI ZX, ZHANG SJ, XIN FX, DONG WL, MA JF, JIANG M. Metabolic engineering of Escherichia coli for high yield production of succinic acid driven by methanol. ACS Synthetic Biology, 2018, 7(12): 2803-2811. DOI:10.1021/acssynbio.8b00109
|
| [70] |
PRICE JV, CHEN L, WHITAKER WB, PAPOUTSAKIS E, CHEN W. Scaffoldless engineered enzyme assembly for enhanced methanol utilization. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(45): 12691-12696. DOI:10.1073/pnas.1601797113
|
| [71] |
WANG C, REN J, ZHOU LB, LI ZD, CHEN L, ZENG AP. An aldolase-catalyzed new metabolic pathway for the assimilation of formaldehyde and methanol to synthesize 2-keto-4-hydroxybutyrate and 1, 3-propanediol in Escherichia coli. ACS Synthetic Biology, 2019, 8(11): 2483-2493. DOI:10.1021/acssynbio.9b00102
|
| [72] |
TUYISHIME P. Engineering Corynebacterium glutamicum for methanol-dependent growth and glutamate production. Metabolic Engineering, 2018, 49: 220-231. DOI:10.1016/j.ymben.2018.07.011
|
| [73] |
LESSMEIER L, PFEIFENSCHNEIDER J, CARNICER M, HEUX S, PORTAIS JC, WENDISCH VF. Production of carbon-13-labeled cadaverine by engineered Corynebacterium glutamicum using carbon-13-labeled methanol as co-substrate. Applied Microbiology and Biotechnology, 2015, 99(23): 10163-10176. DOI:10.1007/s00253-015-6906-5
|
| [74] |
CUI LY, LIANG WF, ZHU WL, SUN MY, ZHANG C, XING XH. Medium redesign for stable cultivation and high production of mevalonate by recombinant Methtylobacterium extorquens AM1 with mevalonate synthetic pathway. Biochemical Engineering Journal, 2017, 119: 67-73. DOI:10.1016/j.bej.2016.12.001
|
| [75] |
SIEGEL JB, LEE SMITH A, POUST S, WARGACKI AJ, BAR-EVEN A, LOUW C, SHEN BW, EIBEN CB, TRAN HM, NOOR E, GALLAHER JL, BALE J, YOSHIKUNI Y, GELB MH, KEASLING JD, STODDARD BL, LIDSTROM ME, BAKER D. Computational protein design enables a novel one-carbon assimilation pathway. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(12): 3704-3709. DOI:10.1073/pnas.1500545112
|
| [76] |
LU XY, LIU YW, YANG YQ, WANG SS, WANG Q, WANG XY, YAN ZH, CHENG J, LIU C, YANG X, LUO H, YANG S, GOU JR, YE LZ, LU LN, ZHANG ZD, GUO Y, NIE Y, LIN JP, LI S, et al. Constructing a synthetic pathway for acetyl-coenzyme A from one-carbon through enzyme design. Nature Communications, 2019, 10: 1378. DOI:10.1038/s41467-019-09095-z
|
| [77] |
YANG JG, SUN SS, MEN Y, ZENG Y, ZHU YM, SUN YX, MA YH. Transformation of formaldehyde into functional sugars via multi-enzyme stepwise cascade catalysis. Catalysis Science & Technology, 2017, 7(16): 3459-3463.
|
| [78] |
ZHANG SJ, GUO F, YANG Q, JIANG YJ, YANG SH, MA JF, XIN FX, HASUNUMA T, KONDO A, ZHANG WM, JIANG M. Improving methanol assimilation in Yarrowia lipolytica via systematic metabolic engineering combined with compartmentalization. Green Chemistry, 2023, 25(1): 183-195. DOI:10.1039/D2GC02783F
|
| [79] |
ROTH TB, WOOLSTON BM, STEPHANOPOULOS G, LIU DR. Phage-assisted evolution of Bacillus methanolicus methanol dehydrogenase 2. ACS Synthetic Biology, 2019, 8(4): 796-806. DOI:10.1021/acssynbio.8b00481
|
| [80] |
CELIK E, CALIK P, OLIVER SG. Metabolic flux analysis for recombinant protein production by Pichia pastoris using dual carbon sources: effects of methanol feeding rate. Biotechnology and Bioengineering, 2010, 105(2): 317-329. DOI:10.1002/bit.22543
|
 2023, Vol. 39
2023, Vol. 39




