中国科学院微生物研究所、中国微生物学会主办
文章信息
- 黄雅文, 江小龙, 陈五九, 张桂敏, 王钦宏
- HUANG Yawen, JIANG Xiaolong, CHEN Wujiu, ZHANG Guimin, WANG Qinhong
- 高活性酪氨酸解氨酶的表征及其在对香豆酸生物合成中应用
- Characterization of highly active tyrosine ammonia lyase and its application in biosynthesis of p-coumaric acid
- 生物工程学报, 2022, 38(12): 4553-4566
- Chinese Journal of Biotechnology, 2022, 38(12): 4553-4566
- 10.13345/j.cjb.220182
-
文章历史
- Received: March 9, 2022
- Accepted: May 30, 2022
2. 中国科学院天津工业生物技术研究所, 天津 300308;
3. 国家合成生物技术创新中心, 天津 300308;
4. 北京化工大学 生命科学与技术学院, 北京 100029
2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Science, Tianjin 300308, China;
3. National Center of Technology Innovation for Synthetic Biology, Tianjin 300308, China;
4. College of life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China
对香豆酸(p-coumaric acid) 又称为羟基肉桂酸,具有抗氧化[1]、抗炎[2]和预防心血管疾病[3]的作用,是很多重要化合物的前体。对香豆酸的生产主要有植物提取、化学合成和微生物合成3种方法[4]。其中植物来源因其培养周期长,易受季节气候影响,不适宜工业大规模生产;化学合成存在反应条件苛刻、污染较大的缺点;而利用微生物生产对香豆酸成本低、可控性强、绿色环保,具有很高的开发潜力和应用价值[5]。如图 1所示,在生物体内,对香豆酸既可以在苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL) 和肉桂酸羟化酶(cinnamate 4-hydroxylase, C4H) 的催化下由苯丙氨酸生成,也可以在酪氨酸解氨酶(tyrosine ammonia-lyase, TAL) 的催化下直接由酪氨酸生成[6]。C4H是一种细胞色素P450酶,难以通过原核表达系统功能性表达,增加了催化的难度。相对而言,在TAL的催化作用下,酪氨酸发生脱氨反应生成对香豆酸更加简单。
TAL最早发现于高粱、水稻、小麦、欧芹等植物中,后来陆续在微生物中发现。2002年,Kyndt等[8]首次在荚膜红细菌(Rhodobacter capsulatus) 中分离到与光敏黄色蛋白(photoactive yellow protein, PYP) 生色团合成有关的Rc-tal基因,并于大肠杆菌中异源表达,纯化的Rc-TAL对酪氨酸的kcat/Km是苯丙氨酸的150倍。随后的几年里,来自球状红杆菌(Rhodobacters sphaeroides) 的Rs-TAL[9]、西班牙糖丝菌(Saccharothrix espanaensis) 的Se-sam8[10]、粘红酵母(Rhodotorula glutinis) 的Rg-TAL[6]陆续被鉴定为酪氨酸解氨酶。由于不同课题组实验条件不尽相同,为了统一比较,获得更高活性和特异性的酪氨酸解氨酶,2015年,Jendresen等[11]将先前鉴定过的tal基因和新挖掘的tal基因一同进行异源表达,发现约翰逊黄杆菌(Flavobacterium johnsoniae) 来源Fj-TAL具有较高活性的同时,对酪氨酸的kcat/Km是苯丙氨酸的2 400倍,是目前底物特异性最强的酪氨酸解氨酶。含有Fj-TAL的重组大肠杆菌作为全细胞催化剂,对香豆酸产量达到440 μmol/(L·OD600)。2016年,Zhou等[12]通过定向进化对Rg-TAL进行改造,获得的三突变体Rg-TALS9N/A11T/E518V较野生型对香豆酸产率提高65.9%。2020年,Cui等[13]表征了分别来源于放线菌Saccharothrix sp. NRRL B-16348和Streptomyces sp. NRRL F-4489的2个新型酪氨酸解氨酶——Sas-TAL和Sts-TAL。其中,含Sts-TAL的大肠杆菌作为全细胞催化剂时,对香豆酸的生产率达到(2.88±0.12) g/(L·h),这是目前微生物生产对香豆酸的最高效率。然而,大肠杆菌BL21(DE3)/Sts-TAL催化较高浓度酪氨酸(30 mmol/L) 的转化率仅为58.6%,依然限制了对香豆酸的大量生产。鉴于现有酶资源存在底物特异性、活性和耐受性较低的问题,无法满足工业生产的需要,筛选高活性和高底物耐受性的TAL备受大家关注。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒大肠杆菌DH5α和BL21(DE3) 分别用于基因克隆和蛋白质表达,两者均由本实验室保藏。北京擎科生物科技有限公司对本研究中的基因进行密码子优化并合成,选择NdeⅠ和BamHⅠ位点构建于pET28a载体上,具体见表 1。
| Plasmids | Descriptions | Sources |
| pET28a | Expression plasmid, KanR | Lab stock |
| pET28a-Fc-tal2 | Expression of Fc-TAL2 (WP_105195266.1), KanR | This work |
| pET28a-Fs-tal | Expression of Fs-TAL (WP_026980402.1), KanR | This work |
| pET28a-Sts-tal | Expression of Sts-TAL (WP_066973014.1), KanR | This work |
| pET28a-Fj-tal | Expression of Fj-TAL (WP_012023194.1), KanR | This work |
硫酸卡那霉素、咪唑、BCA试剂盒购自生工生物工程(上海) 股份有限公司;异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside, IPTG)、L-酪氨酸、对香豆酸、L-苯丙氨酸、肉桂酸、色谱级二甲基亚砜(dimethyl sulfoxide, DMSO)、色谱级乙腈均购自上海阿拉丁生化科技股份有限公司。酵母提取物、蛋白胨购自Oxford公司。磷酸、甘氨酸、氢氧化钠、氯化钠等常规试剂均购于国药集团化学试剂有限公司。LB培养基:10 g/L胰蛋白胨,5 g/L酵母提取物,10 g/L NaCl,固体培养基添加15 g/L琼脂粉。
1.2 方法 1.2.1 序列比对工具使用邻接法在MEGA 7中构建系统发育树,并用Clustal W进行多重序列比对,比对结果由Espript (http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi) 输出。使用ExPASy (https://web.expasy.org/protparam/) 预测目的蛋白分子质量、等电点(isoelectric point, pI)。
1.2.2 重组酪氨酸解氨酶的表达与纯化将表 1中含有酪氨酸解氨酶基因的质粒转化到大肠杆菌BL21(DE3) 中,用于候选基因Fc-tal2、Fs-tal、Sts-tal、Fj-tal的异源重组表达。将单菌落接种到2 mL含有50 μg/mL卡那霉素的LB培养基中,在37 ℃、250 r/min的摇床中培养过夜,次日按照1%的接种率转接到含100 mL LB (Kan) 培养基的250 mL锥形瓶中,于37 ℃摇床培养至OD600值为0.6左右进行诱导。将Sts-TAL以0.5 mmol/L IPTG、在18 ℃诱导18 h,其余蛋白均用0.1 mmol/L IPTG、在30 ℃诱导6 h,以获得较高表达量。诱导结束后以4 000×g离心收集菌体。
向离心管中加入10 mL 50 mmol/L Tris-HCl缓冲液(pH 8.5) 重悬,用超声破碎仪破菌15 min (功率为35%,开4 s,关2 s),然后将细胞破碎液以10 000×g离心15 min,取上清液过0.45 μm水系滤膜备用。使用Ni SepharoseTM 6 Fast Flow (GE healthcare) 作为填料进行蛋白纯化,具体方法参照说明书,其中结合缓冲液:pH 8.5、50 mmol/L Tris-HC1,20 mmol/L咪唑,500 mmol/L NaCl;洗涤缓冲液:pH 8.5、50 mmol/L Tris-HC1,50 mmol/L咪唑,500 mmol/L NaCl;洗脱缓冲液:pH 8.5、50 mmol/L Tris-HC1,500 mmol/L咪唑,500 mmol/L NaCl。最后用50 mmol/L Tris-HCl缓冲液(pH 8.5) 作为脱盐缓冲液,使用超滤杯进行脱盐。以上操作都在冰上或者4 ℃进行。
1.2.3 重组酪氨酸解氨酶酶学性质表征酶活的测定方法:500 μL反应体系中包含3 mmol/L酪氨酸、10 μL (0.5 mg/mL) 纯酶。将未加酶的反应液于水浴锅中放置5 min后,加入10 μL酶液反应15 min,然后在100 ℃金属浴中放置10 min使酶失活。将反应液以12 000×g离心5 min,取200 μL于96孔UV微孔板(Corning® 3679) 测量OD310。酪氨酸解氨酶活力单位(U):1 min生成1 nmol对香豆酸所需的酶量。
重组酪氨酸解氨酶的最适温度:在pH 8.5的条件下,测定30–70 ℃范围内酪氨酸解氨酶的酶活,将测得的最高酶活作为100%,比较其他温度下的相对酶活,确定最适反应温度。以上反应进行3组平行实验。
重组酪氨酸解氨酶的最适pH:在最适温度下,测定pH 6.5–10.5范围内酪氨酸解氨酶的酶活,将测得的最高酶活作为100%,比较其他pH值条件下的相对酶活,确定最适pH。以上反应进行3组平行实验。
重组酪氨酸解氨酶动力学参数测定:在酶反应体系中添加不同浓度的酪氨酸,使其终浓度为60–3 000 μmol/L,在45 ℃的Gly-NaOH缓冲液(50 mmol/L,pH 9.5) 中进行反应,测其初始反应速率。根据Michaelis-Menten方程进行非线性回归分析,获得Km和Vmax值,并计算出kcat值。
蛋白浓度测定:利用二辛可宁酸(bicinchonininc acid, BCA) 法测定。其原理是,在碱性环境下蛋白质与二价铜离子络合并将二价铜离子还原为一价铜离子。BCA与一价铜离子结合形成稳定的蓝紫色复合物,该复合物在562 nm处有较高的吸光值,并与蛋白质浓度成正比。
1.2.4 全细胞催化含有tal基因的重组大肠杆菌BL21(DE3) 被用作生产对香豆酸的全细胞催化剂。将诱导后收集的菌体用50 mmol/L Tris-HCl缓冲液(pH 8.5) 清洗2次,放–20 ℃冰箱冷冻24 h,从而提高细胞膜的通透性[14]。在10 mL Gly-NaOH (pH 9.5) 中进行全细胞生物催化,该体系中包含终浓度1 g/L (5.52 mmol/L) 酪氨酸和OD600值为1的重组大肠杆菌全细胞。将反应混合物置于37 ℃、250 r/min摇床中反应10 h,取样,测量对香豆酸产量。随后,在10 mL Gly-NaOH (pH 9.5) 中,将体系中酪氨酸的终浓度提高至10 g/L (55.19 mmol/L),对应重组大肠杆菌全细胞OD600值为10。将50 mL锥形瓶置于37 ℃、250 r/min摇床中反应36 h,取样,测量对香豆酸产量和酪氨酸剩余量。以上反应进行3组平行实验。
此外,利用全细胞催化对酶的底物特异性进行了比较。在10 mL Gly-NaOH (pH 9.5) 中进行全细胞生物催化,该体系中包含终浓度1 g/L (6.05 mmol/L) 苯丙氨酸和OD600为1的重组大肠杆菌全细胞。将反应混合物置于37 ℃、250 r/min摇床中反应10 h,取样,测量反式肉桂酸产量。
产率(yield) (%)=生成对香豆酸浓度×181.19/ (164.16×初始酪氨酸浓度)×100。
1.2.5 HPLC检测方法检测对香豆酸、肉桂酸时催化样品处理:取20 μL反应液,加入980 μL DMSO,充分混匀后过0.22 μm有机系滤膜。HPLC检测参数设置:用Agilent Technologies 1206系列检测对香豆酸、肉桂酸的含量,紫外检测器的检测波长是310 nm。所用的色谱柱为Agela Technologies公司的Innoval C18 (5 μm, 4.6 mm×250 mm)。柱温设置30 ℃,流速设置为0.8 mL/min,流动相为30%的纯乙腈溶液和70%的1‰ (V/V) 磷酸水溶液。
检测酪氨酸剩余量时样品处理:取20 μL反应液,加入980 μL水,充分混匀后过0.22 μm水系滤膜。HPLC检测参数设置:用Agilent Technologies 1206系列检测酪氨酸的含量,紫外检测器的检测波长是280 nm。所用的色谱柱为Agela Technologies公司的Innoval C18 (5 μm, 4.6 mm×250 mm)。柱温设置30 ℃,流速设置为0.8 mL/min,流动相为50%的纯甲醇溶液和50%的1‰ (V/V) 磷酸水溶液。
1.2.6 同源建模YASARA (yet another scientific artificial reality application) 软件可以实现自动的多模板搜索与比对,并根据每个模板建模结果进行杂合建模,进一步提高模型建立的准确性。本研究利用YASARA对同源性较高的Fc-TAL2、Fs-TAL和Fj-TAL进行同源建模,分析活性差异的原因。
2 结果与分析 2.1 酪氨酸解氨酶编码基因的挖掘目前发现的酪氨酸解氨酶(tyrosine ammonia-lyase, TAL) 存在活性不高、底物特异性不强的问题,限制了对香豆酸及其衍生物的大规模生产。来源于约翰逊黄杆菌(Flavobacterium johnsoniae) 的Fj-TAL是目前报道底物专一性最高的酪氨酸解氨酶,为了进一步丰富酶资源,实现对香豆酸的绿色高效生物合成,以Fj-TAL (GenBank登录号: WP_012023194) 为模板,根据其氨基酸序列,在NCBI蛋白数据库中进行序列比对,满足与模板序列同源性大于60%且氨基酸数在500–600的非重复序列为假定酪氨酸解氨酶的序列。随后通过系统发育树和多序列比对分析,最终选择了2个未见报道的序列,分别为WP_105195266.1和WP_026980402.1,二者均具有酪氨酸解氨酶的保守位点。为了统一比较所选基因的性质,同时合成了已报道底物特异性最高的Fj-TAL和全细胞生产对香豆酸生成效率最高的Sts-TAL,详细信息见表 2。
| Name | Source | Accession number | Length | Molecular weight (kDa) | pI |
| Fc-TAL2 | Flavobacterium columnare | WP_105195266.1 | 505 | 58 | 5.41 |
| Fs-TAL | Flavobacterium suncheonense | WP_026980402.1 | 505 | 59 | 5.26 |
| Sts-TAL | Streptomyces sp. NRRL F-4489[13] | WP_066973014.1 | 492 | 54 | 5.55 |
| Fj-TAL | Flavobacterium johnsoniae[11] | WP_012023194.1 | 506 | 59 | 5.47 |
将已经表征的8个酪氨酸解氨酶(Fj-TAL[11]、Se-Sam8[9]、Sts-TAL[13]、Sas-TAL[13]、Rc-TAL[7]、Rs-TAL[8]、Ha-TAL[11]和Rg-TALS9N/A11Y[15]) 和新发掘的2个蛋白进行多序列比对(图 2),所有蛋白序列均具有保守的Y-ASG-Y活性位点。Ala-Ser-Gly能自发环化脱水形成辅因子3, 5-二氢-5-次甲基-4H-咪唑-4-酮(3, 5-dihydro-5-methylidene-4H-imidazol-4-one, MIO),MIO的亚甲基碳与酪氨酸的α-氨基发生亲核加成,使酪氨酸脱去氨基生成对香豆酸[16]。2个保守Tyr作为路易斯碱,参与底物的去质子化,并维持反应中间体的稳定性[17]。

|
| 图 2 TALs多序列比对 Fig. 2 Multiple sequence alignment of TALs. The catalytically active sites are marked with triangles. Fc-TAL2: WP_105195266.1; Fs-TAL: WP_026980402.1; Fj-TAL: WP_012023194.1; Ha-TAL1: AKE50829.1; Rc-TAL: AKE50816.1; Rs-TAL: ABA81174.1; Sas-TAL: KOX24380.1; Sts-TAL: WP_066973014.1; SeSam8: WP_015103237.1; Rt-TALS9N/A11Y: AGZ04575.1. |
| |
构建系统发育树(图 3) 可知,Fc-TAL2、Fs-TAL和Fj-TAL的亲缘关系较近,Fs-TAL与Fc-TAL的同源性是85%,二者与Fj-TAL的同源性也达到80%,而与Sts-TAL的同源性仅为28%。

|
| 图 3 不同物种来源TAL的系统发育树分析 Fig. 3 Phylogenetic analysis of TAL homologs from different organisms. |
| |
将诱导后的重组大肠杆菌收集并重悬至OD600值为10,破菌后离心,取上清液通过SDS-PAGE分析蛋白表达情况。为了获得尽可能多的重组蛋白质,对诱导条件进行优化,发现Sts-TAL以0.5 mmol/L IPTG于18 ℃诱导18 h,其余蛋白均用0.1 mmol/L IPTG于30 ℃诱导6 h时表达情况较好,如图 4A所示,重组蛋白均可较好地在大肠杆菌中可溶性表达,且与理论分子量接近。由图 4A可以看出重组Sts-TAL占了细胞总蛋白的60%以上,这暗示着报道的Sts-TAL全细胞转化率最高很可能是因为该蛋白在大肠杆菌中表达较高。将重组TALs通过镍柱进行亲和纯化,纯化脱盐后的蛋白见图 4B。

|
| 图 4 重组TALs的SDS-PAGE分析 Fig. 4 SDS-PAGE analysis of the recombinant TALs. (A) The lysis supernatant of the recombinant TALs. Lane 1: Fc-TAL2; lane 2: Fs-TAL; lane 3: Fj-TAL; lane 4: Sts-TAL. (B) The purified protein of the recombinant TALs. Lane 1: Fc-TAL2; lane 2: Fs-TAL; lane 3: Fj-TAL; lane 4: Sts-TAL. |
| |
对新挖掘的重组Fc-TAL2和Fs-TAL进行酶学性质分析,结果显示,Fs-TAL和Fc-TAL2在pH 7.0时,相对活性仅有20%,随着pH升高,活性迅速增加,并在pH 9.5时达到最高,从pH 8.0−10.0都有60%以上活性;它们的最适温度都是55 ℃,在45–65 ℃之间均有60%以上的活性(图 5)。
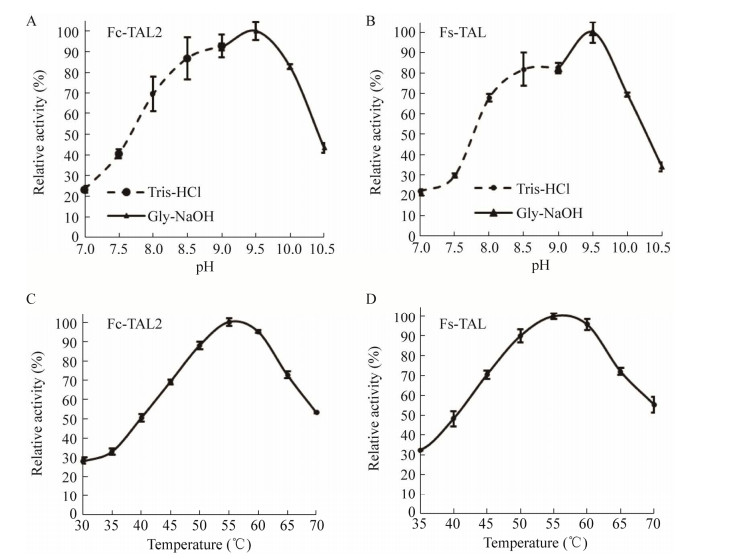
|
| 图 5 pH和温度对重组TALs的影响 Fig. 5 Effects of pH and temperature on recombinant TALs. Effects of pH on Fc-TAL2 (A) and Fs-TAL (B). Effects of temperature on Fc-TAL2 (C) and Fs-TAL (D). |
| |
测定重组TALs的比酶活和动力学参数(表 3),结果显示在37 ℃、pH 9.5的条件下,Fs-TAL的活性最高。Fs-TAL的比酶活为82.47 U/mg,Fc-TAL2的比酶活为13.27 U/mg,相差6倍。Fs-TAL的Km为209.1 μmol/L,小于Fc-TAL2 (314.5 μmol/L),说明Fs-TAL对酪氨酸的亲和力更强。Fs-TAL的kcat/Km比Fc-TAL2高10倍,这和比酶活相差6倍的结果相吻合。
| Name | Optimal pH | Optimal temperature (℃) | Km (μmol/L) | kcat (1/s) | kcat/Km (L/(μmol·s)) | Specific activity (U/mg) | References |
| Fc-TAL2 | 9.5 | 55 | 314.5 | 0.014 0 | 4.46×10‒5 | 13.27 | This work |
| Fs-TAL | 9.5 | 55 | 209.1 | 0.084 5 | 4.04×10‒4 | 82.47 | This work |
| Fj-TAL | / | / | 76.6 | 0.067 8 | 8.85×10‒4 | 70.33 | This work |
| 10.5 | / | 6.7 | 0.023 0 | 2.99×10‒3 | / | [11] | |
| Sts-TAL | / | / | 248.1 | 0.026 1 | 1.05×10‒4 | 21.11 | This work |
| 11.0 | 50 | 336.5 | 439.100 0 | 1.30 | / | [13] | |
| The specific activity was carried out at 37 ℃, pH 9.5. / meant no characterization. | |||||||
Fs-TAL、Fj-TAL和Fc-TAL2的氨基酸序列一致性在80%以上,但是Fs-TAL和Fj-TAL的活性明显高于Fc-TAL2,为了解释活性差异的原因,我们利用YASARA对这3个蛋白进行了同源建模,并对所建模型进行评价,Fc-TAL2、Fj-TAL和Fs-TAL模型的Z-scores分别为–0.488、–0.767和–0.539,表明模型具有可信度。与报道的Rs-TAL结构类似,3个蛋白都是同源四聚体,每3个单体参与形成一个活性空腔,每个同源四聚体会形成4个活性空腔,即有4个活性口袋(图 6)。以Fs-TAL为例,每个单体的核心部分是5个α-螺旋束,这些螺旋束的侧翼区域,以及第4和第5个螺旋束的延伸发夹环,与单体-单体界面的形成有关。每个单体的N端形成了包含MIO辅因子和内盖环(inner-lid loop) 的结构域,C末端形成α-螺旋层。C末端结构域参与协助同源四聚体的稳定,C末端还有一个突出的外盖环(outer-lid loop)[18] (图 7)。这3个蛋白最明显的差别在于内盖环上保守的Y50残基朝向底物的方向和距离不同(图 8),Y50残基能够作为路易斯碱夺取底物的β-H,从而加速脱氨反应的进行[17]。Fs-TAL和Fj-TAL的Y50酚羟基朝向底物,并且相较于Fj-TAL,Fs-TAL的Y50酚羟基距离酪氨酸的β-H更近,这一现象也与酶活差异相符合。而Fc-TAL2的Y50酚羟基朝向活性口袋外侧,远离底物的β-H,不利于对质子的夺取,这可能是Fs-TAL和Fj-TAL活性高于Fc-TAL2的主因。

|
| 图 6 重组酪氨酸解氨酶的模拟结构 Fig. 6 Structure of recombinant tyrosine ammonia lyase. Fj-TAL: green; Fc-TAL2: cyan; Fs-TAL: yellow. Four active sites are boxed. |
| |

|
| 图 7 Fs-TAL的单体结构 Fig. 7 Ribbon representation of the Fs-TAL monomer. |
| |

|
| 图 8 Y50残基构象的比较 Fig. 8 Comparision of the Y50 residue conformations. (A) Fj-TAL (green). (B) Fc-TAL (cyan). (C) Fs-TAL (yellow). |
| |
鉴于Fs-TAL的活性更高,我们下一步将这个酶和已经报道底物特异性最高的Fj-TAL和全细胞催化效率最高的Sts-TAL的全细胞催化效果进行比较。首先比较在酸性(50 mmol/L NaAc-HAc, pH 5.0)、中性(50 mmol/L PBS, pH 7.5) 和碱性(50 mmol/L Gly-NaOH, pH 9.5) 条件下,不同重组大肠杆菌催化生成对香豆酸的能力,结果发现总体趋势相同,但是pH 9.5条件下,催化效果更好,对香豆酸产率更高,符合酶的最适pH。因此全细胞催化反应在50 mmol/L Gly-NaOH (pH 9.5) 中进行。在37 ℃、250 r/min的摇床中反应10 h,含有Fs-TAL和Sts-TAL的重组大肠杆菌均能完全转化1 g/L酪氨酸,而含有Fj-TAL的重组大肠杆菌体系中对香豆酸产率仅为50%。由SDS-PAGE中破菌上清的重组蛋白表达量(图 4B) 和比酶活(表 3) 推测Fj-TAL体系中较低的对香豆酸产率与其低可溶性蛋白表达量和较低酶活有关。由于现有酪氨酸解氨酶底物特异性不高,往往伴有苯丙氨酸解氨酶的活性,所以测试了这3个TALs对苯丙氨酸的转化效率。将含有TALs的重组大肠杆菌与1 g/L苯丙氨酸在50 mmol/L Gly-NaOH (pH 9.5)、37 ℃、250 r/min的条件下反应10 h,其中Sts-TAL的体系中有微量肉桂酸产生,而Fj-TAL和Fs-TAL对苯丙氨酸没有活性(图 9A),说明Fs-TAL同Fj-TAL都是高特异性的酪氨酸解氨酶,这对于获得高纯度对香豆酸具有重要价值。

|
| 图 9 重组TAL大肠杆菌全细胞催化 Fig. 9 Whole cell catalysis of recombinant Escherichia coli with different TAL. (A) The biocatalysis of 1 g/L L-tyrosine and 1 g/L L-phenylalanine. (B) The biocatalysis of 10 g/L L-tyrosine with different reaction time. |
| |
随后利用重组大肠杆菌BL21(DE3)/pET28a-Fs-tal、BL21(DE3)/pET28a-Sts-tal催化高浓度(10 g/L) 酪氨酸。在12 h时,含有Fs-TAL和Sts-TAL的体系中对香豆酸产率相近,说明在全细胞催化中,酶的表达量和活性对催化效率都至关重要。随着时间增加,BL21(DE3)/pET28a-Fs-tal体系中对香豆酸产率增长较快,36 h达到67.9%,生成6.2 g/L对香豆酸,体现Fs-TAL较强的底物耐受性和pH稳定性。而在BL21(DE3)/ pET28a-Sts-tal的体系中,12 h以后对香豆酸生成缓慢,同时该体系中酪氨酸的剩余量变化不大(图 9B),这说明Sts-TAL在12 h以后催化能力下降,推测其在高浓度底物和碱性条件下稳定性不佳。
3 讨论对香豆酸因其强大的自由基清除活性,具有抗氧化、抗炎、抗癌、抗糖尿病和抗黑色素形成的特性,被广泛应用于医药、化妆品和食品行业[19]。另外,作为苯丙氨酸途径的中间物质,对香豆酸也是很多次级代谢产物的前体,能够通过简单的反应进一步合成其他高价值的保健品和药物[20]。目前对香豆酸的生产主要通过化学合成法、植物提取法和生物合成法。化学合成转化率低,污染大;植物提取受到季节和地域限制,得率低;而生物合成法具有环境友好、可大规模发酵生产等优点,一般来说,生物合成法主要包括从头合成和全细胞催化2种。2015年,Rodriguez等[21]构建了高产对香豆酸的酿酒酵母平台菌株。该菌株敲除了苯基丙酮酸脱羧酶(phenylpyruvate decarboxylase) 基因(ARO10) 和丙酮酸脱羧酶(pyruvate decarboxylase) 基因(PDC5),减少副产物苯乙醛和对羟基乙醛的生成量,同时,引入Flavobacterium johnsoniaeu来源的酪氨酸氨解酶TAL,并分别过表达解除L-酪氨酸反馈抑制的DAHP合成酶ARO4K229L、解除L-苯丙氨酸反馈抑制的分支酸变位酶ARO7G141S和对芳香族氨基酸途径的通量有重要控制作用的莽草酸激酶Ⅱ,最终对香豆酸的产量达到(1.937±0.260) g/L,较野生型提高7.9倍。2019年,该研究团队又引入磷酸酮醇酶途径增加前体赤藓糖-4-磷酸的供给,并结合启动子置换策略进一步优化了糖酵解途径和芳香族氨基酸合成途径之间的碳通量分配,使工程酵母中对香豆酸产量提高到12.5 g/L,这是目前从头合成的最高产量[22]。全细胞催化则是一种直接通过全细胞体进行生物催化的反应方法,反应的实质还是细胞内的酶分子参与反应。相较于从头合成,全细胞催化既保留了细胞内复杂催化反应所需要的多酶体系和辅因子,也无需冗长的发酵周期,能够更加快速地获得目的产物,是一种非常有工业应用前景的生物转化方式。无论是从头合成还是全细胞催化生产对香豆酸,都需要优良特性的酪氨酸解氨酶,然而,目前已知的酪氨酸解氨酶活性较低,底物特异性不强,无法实现对香豆酸的高效转化,因此,挖掘新型酪氨酸解氨酶对实现高效对香豆酸生物合成意义重大。
本研究通过多序列比对和同源分析,挖掘了2个黄杆菌来源的酪氨酸解氨酶,异源表达表征后发现Fs-TAL比酶活是Fc-TAL2活性的6倍。Fs-TAL和Fc-TAL2的同源性高达80%,但是活性差异大,为了分析活性差异的原因,利用YASARA软件模拟了二者的结构。通过比较分析发现,位于内盖环上的Y50残基的酚羟基方向明显不同。Fs-TAL中,Y50侧链的酚羟基朝向底物,而Fc-TAL2酚羟基则朝向口袋外侧。在脱氨反应时,MIO的亚甲基对底物的α-氨基进行亲核攻击,Y50作为碱夺取底物酪氨酸的β-H,从而发生氨基的离去和双键的生成。Fs-TAL的Y50酚羟基的氧距离β-H更近,更有利于底物去质子化使脱氨顺利进行,这可能是Fs-TAL活性高于Fc-TAL2的原因。
通过全细胞催化的方法对底物特异性和耐受性进行比较。Fs-TAL和Fj-TAL对苯丙氨酸没有催化能力,而Sts-TAL显示出苯丙氨酸解氨酶活性,这表明Fs-TAL对L-酪氨酸具有严格的底物特异性,有助于生产高纯度的对香豆酸。Fs-TAL和Sts-TAL的重组大肠杆菌体系中,对香豆酸产率接近100%,而含有Fj-TAL的重组大肠杆菌体系中产率仅为50%,这可能与Fj-TAL相对较低的表达量和活性有关。在工业应用中,高浓度底物有利于降低成本,然而酪氨酸微溶于水,常温下溶解度小于0.5 g/L,高浓度下,固体酪氨酸晶体无疑增加了酪氨酸解氨酶催化底物生成对香豆酸的难度。为了进一步探究Fs-TAL和Sts-TAL的底物耐受性和催化效率,将酪氨酸浓度提高至10 g/L,发现含有Fs-TAL的重组大肠杆菌催化能力更强,36 h产生6.2 g/L对香豆酸,产率为67.9%。在36 h的催化过程中,Sts-TAL体系中对香豆酸生成速率越来越慢,说明体系中Sts-TAL不再稳定催化酪氨酸转化。而在Fs-TAL的体系中,对香豆酸含量不断增加,说明在此时间段,Fs-TAL依然能稳定地催化酪氨酸转化,体现了在高浓度底物下的强稳定性。
本研究发现来自顺天黄杆菌(Flavobacterium suncheonense) 的酪氨酸解氨酶(Fs-TAL) 具有高活性、高特异性和高底物耐受性,进一步丰富了酪氨酸解氨酶的酶资源,为微生物异源合成对香豆酸及其衍生物提供了重要参考。
| [1] |
Kilani-Jaziri S, Mokdad-Bzeouich I, Krifa M, et al. Immunomodulatory and cellular anti-oxidant activities of caffeic, ferulic, and p-coumaric phenolic acids: a structure-activity relationship study. Drug Chem Toxicol, 2017, 40(4): 416-424. DOI:10.1080/01480545.2016.1252919
|
| [2] |
Pragasam SJ, Venkatesan V, Rasool M. Immunomodulatory and anti-inflammatory effect of p-coumaric acid, a common dietary polyphenol on experimental inflammation in rats. Inflammation, 2013, 36(1): 169-176. DOI:10.1007/s10753-012-9532-8
|
| [3] |
Kong CS, Jeong CH, Choi JS, et al. Antiangiogenic effects of p-coumaric acid in human endothelial cells. Phytother Res, 2013, 27(3): 317-323. DOI:10.1002/ptr.4718
|
| [4] |
牛福星, 杜云平, 黄远斌, 等. 工程微生物合成苯丙酸类化合物及其衍生物的研究进展. 合成生物学, 2020, 1(3): 337-357. Niu FX, Du YP, Huang YB, et al. Recent advances in the production of phenylpropanoic acids and their derivatives by genetically engineered microorganisms. Synth Biol J, 2020, 1(3): 337-357 (in Chinese). |
| [5] |
张峰, 曾化伟, 廖祥儒, 等. 微生物酪氨酸解氨酶的研究进展. 食品与生物技术学报, 2010, 29(4): 496-499. Zhang F, Zeng HW, Liao XR, et al. A review in tyrosine ammonia lyase in microorganism. J Food Sci Biotechnol, 2010, 29(4): 496-499 (in Chinese). |
| [6] |
Vannelli T, Wei QW, Sweigard J, et al. Production of p-hydroxycinnamic acid from glucose in Saccharomyces cerevisiae and Escherichia coli by expression of heterologous genes from plants and fungi. Metab Eng, 2007, 9(2): 142-151. DOI:10.1016/j.ymben.2006.11.001
|
| [7] |
Li Y, Li J, Qian B, et al. De novo biosynthesis of p-coumaric acid in E. coli with a trans-cinnamic acid 4-hydroxylase from the Amaryllidaceae plant Lycoris aurea. Molecules, 2018, 23(12): 3185. DOI:10.3390/molecules23123185
|
| [8] |
Kyndt JA, Meyer TE, Cusanovich MA, et al. Characterization of a bacterial tyrosine ammonia lyase, a biosynthetic enzyme for the photoactive yellow protein. FEBS Lett, 2002, 512(1/3): 240-244.
|
| [9] |
Watts KT, Lee PC, Schmidt-Dannert C. Exploring recombinant flavonoid biosynthesis in metabolically engineered Escherichia coli. Chembiochem, 2004, 5(4): 500-507. DOI:10.1002/cbic.200300783
|
| [10] |
Berner M, Krug D, Bihlmaier C, et al. Genes and enzymes involved in caffeic acid biosynthesis in the actinomycete Saccharothrix espanaensis. J Bacteriol, 2006, 188(7): 2666-2673. DOI:10.1128/JB.188.7.2666-2673.2006
|
| [11] |
Jendresen CB, Stahlhut SG, Li M, et al. Highly active and specific tyrosine ammonia-lyases from diverse origins enable enhanced production of aromatic compounds in bacteria and Saccharomyces cerevisiae. Appl Environ Microbiol, 2015, 81(13): 4458-4476. DOI:10.1128/AEM.00405-15
|
| [12] |
Zhou S, Liu P, Chen J, et al. Characterization of mutants of a tyrosine ammonia-lyase from Rhodotorula glutinis. Appl Microbiol Biotechnol, 2016, 100(24): 10443-10452. DOI:10.1007/s00253-016-7672-8
|
| [13] |
Cui P, Zhong W, Qin Y, et al. Characterization of two new aromatic amino acid lyases from actinomycetes for highly efficient production of p-coumaric acid. Bioprocess Biosyst Eng, 2020, 43(7): 1287-1298. DOI:10.1007/s00449-020-02325-5
|
| [14] |
王艺颖, 董钰漫, 尹伟, 等. 全细胞生物催化过程强化的研究进展. 化学通报, 2020, 83(10): 875-882. Wang YY, Dong YM, Yin W, et al. Progress in the process intensification of whole-cell biocatalysis. Chemistry, 2020, 83(10): 875-882 (in Chinese). |
| [15] |
霍亚楠, 吴凤礼, 宋国田, 等. 定向进化改造酪氨酸解氨酶提高大肠杆菌合成对香豆酸产量. 生物工程学报, 2020, 36(11): 2367-2376. Huo YN, Wu FL, Song GT, et al. Directed evolution of tyrosine ammonia-lyase to improve the production of p-coumaric acid in Escherichia coli. Chin J Biotech, 2020, 36(11): 2367-2376 (in Chinese). |
| [16] |
Goldson-Barnaby A, Scaman CH. Purification and characterization of phenylalanine ammonia lyase from Trichosporon cutaneum. Enzyme Res, 2013, 2013: 670702.
|
| [17] |
Schroeder AC, Kumaran S, Hicks LM, et al. Contributions of conserved serine and tyrosine residues to catalysis, ligand binding, and cofactor processing in the active site of tyrosine ammonia lyase. Phytochemistry, 2008, 69(7): 1496-1506. DOI:10.1016/j.phytochem.2008.02.007
|
| [18] |
Louie GV, Bowman ME, Moffitt MC, et al. Structural determinants and modulation of substrate specificity in phenylalanine-tyrosine ammonia-lyases. Chem Biol, 2006, 13(12): 1327-1338. DOI:10.1016/j.chembiol.2006.11.011
|
| [19] |
Roychoudhury S, Sinha B, Choudhury BP, et al. Scavenging properties of plant-derived natural biomolecule para-coumaric acid in the prevention of oxidative stress-induced diseases. Antioxidants (Basel), 2021, 10(8): 1205. DOI:10.3390/antiox10081205
|
| [20] |
Zha J, Wu X, Gong GL, et al. Pathway enzyme engineering for flavonoid production in recombinant microbes. Metab Eng Commun, 2019, 9: e00104. DOI:10.1016/j.mec.2019.e00104
|
| [21] |
Rodriguez A, Kildegaard KR, Li M, et al. Establishment of a yeast platform strain for production of p-coumaric acid through metabolic engineering of aromatic amino acid biosynthesis. Metab Eng, 2015, 31: 181-188. DOI:10.1016/j.ymben.2015.08.003
|
| [22] |
Liu Q, Yu T, Li X, et al. Rewiring carbon metabolism in yeast for high level production of aromatic chemicals. Nat Commun, 2019, 10(1): 4976. DOI:10.1038/s41467-019-12961-5
|
 2022, Vol. 38
2022, Vol. 38





