中国科学院微生物研究所、中国微生物学会主办
文章信息
- 董世娟, 谢春芳, 司伏生, 陈冰清, 于瑞嵩, 李震
- Dong Shijuan, Xie Chunfang, Si Fusheng, Chen Bingqing, Yu Ruisong, Li Zhen
- 猪流行性腹泻病毒免疫及疫苗研制
- Immunization against porcine epidemic diarrhea virus and vaccine development
- 生物工程学报, 2021, 37(8): 2603-2613
- Chinese Journal of Biotechnology, 2021, 37(8): 2603-2613
- 10.13345/j.cjb.200524
-
文章历史
- Received: August 19, 2020
- Accepted: December 10, 2020
- Published: December 10, 2020
2. 上海市种猪育种工程中心,上海 201106
2. Shanghai Engineering Research Center of Breeding Pig, Shanghai 201106, China
猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV) 属冠状病毒科α冠状病毒属。该病原被发现于20世纪70年代,自发现以来多次呈地方和全球流行,给我国和世界养猪业造成重大经济损失。近些年来,对该病原的研究取得较大进展,有力推动了该病原的临床免疫防控。本文主要就PEDV免疫防控理论和技术进展、免疫防控技术的问题和难点以及相关疫苗研制等方面进行简要综述。
1 猪流行性腹泻的病原学和流行病学概述猪流行性腹泻(PED) 是困扰世界养猪业多年的严重动物疫病。该病最初发现于欧洲,后扩散至养猪业发达的亚洲东部地区。在亚洲地区造成的危害比原发地欧洲更加严重。因该疫病主要造成初生仔猪的大比例发病死亡,亚洲地区普遍用肠毒或细胞传代的毒株制成疫苗免疫母猪,通过母猪的初乳使仔猪获得被动免疫[1]。但从2010年起,我国大部分地区的猪场开始大规模暴发PED,这次暴发中初生仔猪死亡率达90%以上[2],原来的免疫方式和疫苗不能控制PED发生,学界共识是该病原发生了重要变异[3]。如Luo等通过比较流行毒株GD-B与参考毒株序列后认为中国南方流行毒株与国外毒株(DR13、CV777)和国内其他毒株(CH/FJND-3/2011、CH/S) 不同;他们认为南方流行的毒株在长期传播过程中经历逐渐的基因变异,造成了国内疫苗免疫失效[4]。不久,该疫病广泛流行至东南亚、美国以及欧洲等地区。
2016年,Wang等将中国60个PEDV毒株和其他国家的15个代表性毒株的全基因组序列进行遗传进化分析,中国2010年后流行的毒株与美国、韩国、墨西哥近几年流行的毒株同属于GⅡ基因型,经典的毒株与CV777、DR13分属于GⅠ-a亚型,而细胞适应的疫苗毒株属于GⅠ-b亚型[5]。四川省地区2016–2018年的猪腹泻病例均为GⅡ型[6]。我国自2010年以来,PEDV感染出现大面积暴发,王娟萍等[7]对山西省11个地区的30个规模化猪场的仔猪腹泻发病情况进行流行病学调查,PEDV阳性率为73.26%,猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)阳性率为7.36%,表明山西省猪群发生腹泻,主要由PEDV引起。近些年,PEDV与其他肠道病毒混合感染的趋势加剧,韩英明等[8]对2016–2018年山东省部分地区发病猪群进行检测,显示PEDV检出率为10.5%,单一感染检出率为7.6%,混合感染检出率为2.9%。Ding等[9]对分布于中国华北、华中、华南等9个省市的398份腹泻样品进行检测,发现PEDV检出份数78/398,分别与猪德尔塔冠状病毒(PDCoV)、猪嵴病毒(PKV) 有二重感染和三重混合感染情况。
PEDV属冠状病毒科α冠状病毒属,其基因组为单股正链RNA,全长28 000 nt。基因组包含5′端的1个非结构蛋白基因、3′端的4个结构蛋白基因以及1个附属蛋白基因。非结构蛋白基因包含两个相互重叠的阅读框1a和1ab,可转录合成1a和1ab两种复制酶多聚蛋白(Replicase polyprotein);4个结构蛋白分别为S蛋白(棘突蛋白)、E蛋白(小膜蛋白)、M蛋白(膜蛋白) 和N蛋白(核衣壳蛋白);附属蛋白基因紧接S蛋白3′端,因此被称为ORF3蛋白。S蛋白突出于病毒囊膜表面,负责病毒与细胞受体的结合以及启动病毒囊膜与细胞质膜的融合,因此,S蛋白所形成的病毒棘突是最易受到宿主免疫攻击的病毒结构。PEDV M蛋白也是疫苗设计的主要抗原,与PEDV同属的TGEV其结构蛋白S︰M︰E含量比例是20︰300︰1[10],因此存在于病毒囊膜上的M蛋白含量相对比较丰富,且M蛋白的N端有大约20–30个氨基酸暴露于囊膜之外[11],可以构成中和性抗体的识别表位;E蛋白虽也在病毒囊膜中,但含量相对较少,该蛋白N端有部分残基暴露于病毒粒子外[12]。可能因该蛋白含量低且抗原性差,E蛋白不能诱导特异抗体产生[13]。N蛋白主要作为免疫监测的目标蛋白,疫苗设计时一般不作为目标蛋白。
2 仔猪被动免疫的途径和初乳的巨大功效当前PEDV的主要危害在于造成初生仔猪的大量死亡,因此,面对PED流行如何保护仔猪是兽医临床急需解决的问题。仔猪发病大多在出生一周以内,此时仔猪自身免疫系统尚未成熟,在这个时间给仔猪进行PEDV疫苗免疫效果甚微。目前针对仔猪PED发病也没有有效的治疗药物。因此,大家不得不把防控重点放在免疫母猪上,即通过母猪初乳使仔猪获得PEDV的被动免疫保护。
2.1 仔猪的被动免疫途径刚出生仔猪体内无抵抗环境病原的各类抗体,需要通过初乳获得母源抗体所赋予的被动免疫。这样的被动免疫可以持续相当长的时间,如2周到2个月不等,直到其自身具有了主动免疫能力[14]。目前所知,仔猪获得被动免疫只有初乳途径。
2.2 母猪初乳中的免疫因子及转运方式初乳中最重要的免疫因子是IgG和IgA,其执行的免疫功能有所不同,IgG在分娩最初3 d内量比较大,被仔猪吸收后主要执行体液免疫功能;后期下降很快,有文献报道,母猪分娩6 d后IgG由98 mg/mL下降至4 mg/mL。IgA浓度相对下降速度也较快,由初乳中23 mg/mL下降至第6天的6 mg/mL[15-16]。但IgA在常乳中存在的时间较长,主要功能是保护仔猪肠道和其他黏膜组织不受病原微生物侵袭[17]。仔猪肠道吸收抗体开始2–3 d是通过胞饮(Enterocytosis) 作用,之后是通过FcRn (新生儿Fc受体) 介导的转运机制。猪的FcRn功能非常重要,其存在于猪肠道上皮细胞顶端,起着肠腔内外转运IgG的作用。在初生仔猪中,该受体将抗体由肠腔向血液转运;在免疫系统发育成熟后,该受体则可以将肠道派氏节合成的抗体向肠腔转运,执行肠道粘膜免疫功能[18-19]。初生仔猪小肠的抗体通道关闭后,多聚免疫球蛋白受体(Polymeric immunoglobulin receptor,pIgR) 也可以执行转运功能,能够把乳中部分多聚体IgA和IgM转运穿过上皮细胞进入血流,未被转运的多聚体免疫球蛋白执行警戒作用。初生仔猪肠道上皮细胞甚至可以转运初乳中的淋巴细胞,使其进入仔猪的肠系膜淋巴结或其他组织。初乳中含有大量的淋巴细胞,这些细胞进入仔猪体内后可以加强非特异性免疫反应[20]。在乳汁以及仔猪的肠道派氏节都发现了带有肠道归巢标记α4β7 (整合素) 和CCR9 (趋化因子受体) 的细胞毒性CD8 T细胞,也有B细胞和浆细胞[21-22]。母猪初乳中也含有一定量的免疫抑制性的细胞因子,如TGFβ1和IL-10,这些细胞因子可以使仔猪对共生性细菌以及食物中抗原性物质的敏感性降低[23]。这段时间初乳中细胞因子也可以被仔猪吸收入血。
3 母猪孕期免疫及肠道- 乳腺-sIgA轴 3.1 母猪孕期免疫及特点有人曾认为妊娠状态影响机体免疫,但该观点从物种进化论角度来考察是没有确实依据的。怀孕期是动物免疫的关键时期,母猪既要应对外界病原侵袭,也要调控免疫不会对胎猪产生排斥,同时还要在子畜出生后尽快获得被动免疫。从进化上来说,这几方面都不可或缺。因此,怀孕母猪的免疫系统在怀孕期要经过一系列调整:针对病原微生物的免疫机能得到维持或加强,对异体抗原的免疫机能会有一定程度调减。母猪怀孕期如果免疫时间和方法得当,应该可以实现理想的免疫效果并保护初生仔猪。
总体来说,哺乳动物免疫系统有很大的相似性,但也各有自身特点,如猪的抗体种类包括IgG、IgA、IgE和IgM,但没有IgD[24]。关于PEDV抗体持续期的研究报道很少,根据笔者实验室利用灭活疫苗的研究,母猪初免3周后血液抗体开始迅速升高,较高的抗体持续期为4–6周左右[25]。因此,为有效利用免疫后的抗体持续期,一般考虑在妊娠母猪产前4–6周免疫。但从目前PEDV孕期免疫效果来看,多数情况下效果不甚理想[1, 26]。究其原因,可能主要有以下几个方面:一是对母猪免疫机制没有充分了解,导致免疫时间和免疫方式有问题。一般临床PEDV免疫多放在妊娠后期,但最近有研究表明,在母猪怀孕中期用高毒力PEDV感染可使母猪分娩后有更高水平抗PEDV的IgA、IgG、中和抗体以及抗体分泌细胞(ASC)[27]。二是对仔猪获得免疫保护的机制不甚了解,缺乏合适的攻毒保护模型[28]。目前攻毒毒株毒力以及动物模型都没有标准化,限制了疫苗效果的客观评价。第三就是疫苗本身质量的问题,如抗原量、活疫苗的病毒毒力以及免疫佐剂的功效等。
3.2 肠道-乳腺-sIgA轴有文献介绍乳腺在解剖和功能上是胃肠道粘膜免疫系统的延伸,因此母体口服途径的免疫可以通过哺乳影响新生儿[23]。在1970年前,大家并没有把母体的胃肠道免疫和新生儿被动免疫保护联系起来。人们在研究传染性胃肠炎(Transmissible gastric enteritis,TGE) 免疫过程中逐渐发现肠道免疫所产生的分泌性IgA (sIgA) 成分对于新生仔猪防控TGEV侵染是至关重要的,并由此首次提出了肠道-乳腺-免疫轴的概念(Entero-mammary-immunologic axis)[29]。在此基础上,进一步验证了sIgA的作用及轴系的运转机理,进而完善为肠道-乳腺-sIgA轴[30]。这个轴系本质是指病原微生物侵染肠上皮细胞导致肠系膜淋巴结内产生了能够合成sIgA的淋巴浆母细胞,这些淋巴浆母细胞可回到肠道固有层,也可以转移至乳腺而发挥作用。被免疫的母猪乳腺上皮基底层的淋巴细胞可持续分泌sIgA,且不容易被乳汁和肠道中的酶类降解,因此可以赋予仔猪持久的免疫保护。
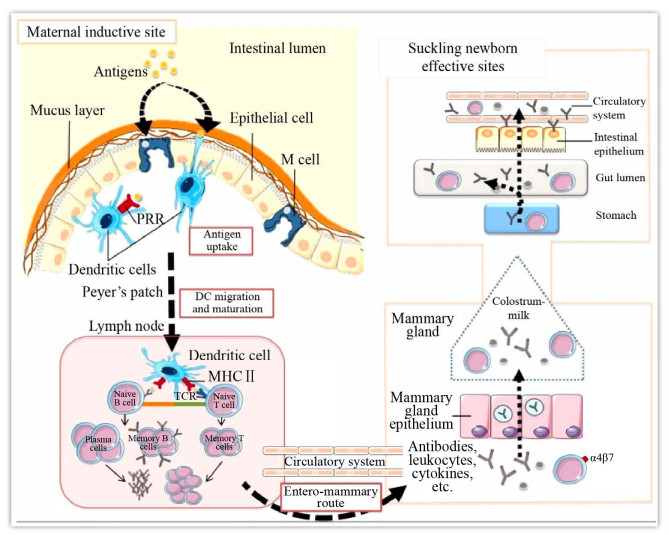
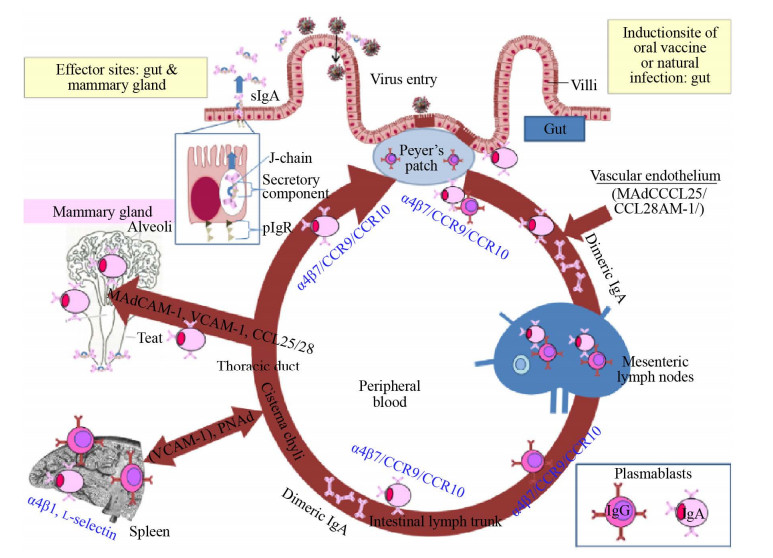
肠道-乳腺-sIgA轴机制的关键是相关淋巴细胞的激活、抗体分泌细胞(ASCs) 分化成熟以及ASCs归巢至乳腺上皮固有层。入侵肠道或口服的抗原成分一旦和肠粘膜有效接触,则被肠皱襞M细胞(Microfold cells) 或树突细胞通过模式识别受体(Pattern recognition receptor,PPR) 摄取,后经过加工处理转运至肠道派氏结,在此与B细胞相互作用或通过特异T细胞受体(TCR) 与T细胞相互作用(图 1)[23],使这些淋巴细胞活化。活化的B细胞增殖分化成为潜在分泌抗体的浆母细胞(Plasmablast),并进一步成熟为抗体分泌细胞(ASCs)。淋巴细胞能够依赖归巢分子(或转运分子) 系统的作用回到肠道或进入乳腺组织并定植。该分子系统包括整合素(Integrin)、趋化因子(Chemokines)、趋化因子受体(Chemokine receptor) 等(图 2)[31]。淋巴细胞向肠道组织转运依赖于淋巴细胞表达的整合素α4β7,这种因子能够与肠道相关淋巴组织(GALT) 中高内皮静脉(HEVs) 上面的粘膜血管地址素细胞黏附分子1 (MAdCAM-1) (α4β7配体) 发生相互作用[32]。带有整合素α4β7的淋巴细胞也可以从小肠派氏节转移至乳腺,这是由于在猪怀孕后期和泌乳早期,乳腺血管内皮细胞MAdCAM-1的表达量提高[33]。趋化因子CCL25和CCL28表达于肠道血管内皮细胞表面,通过与淋巴细胞表面表达的趋化因子受体CCR9和CCR10结合引导细胞向肠道转移[34-35]。CCR10与CCL28相互作用则主导了淋巴细胞向乳腺组织的转移[36]。
|
| 图 1 母源抗体和白细胞向仔猪传递示意图[23] Fig. 1 Transmission of maternal antibody and leukocyte to piglets[23]. Oral immunization of the sows causes mucosal and systemic immune responses, and the humoral and cellular components as their effector components can enter the intestinal tract of piglets through the enteromammary route. |
| |
|
| 图 2 肠道-乳腺-sIgA轴以及参与其中的转运分子作用示意图[31] Fig. 2 The gut-mammary gland-sIgA axis and trafficking molecules[31]. This figure shows the process of IgA secreting cells being activated in the Peyer's ganglion, differentiating through mesenteric lymph nodes, then maturing through the blood or lymphatic system (such as the spleen), and finally homing to the intestine and mammary gland. |
| |
理论上,肠道-乳腺-sIgA轴是仔猪获得性免疫的关键通路。但肠道免疫发生却依赖于许多条件,最重要的是免疫原与肠道免疫系统之间的关系以及肠道内环境影响。因此,在免疫设计时要综合考虑。以PEDV为例,如果尝试使用活疫苗,病毒毒力强弱要适中,毒力太低刺激不了足够强度免疫应答;毒力过强有生物安全风险;亚单位疫苗或细菌及病毒载体疫苗存在免疫耐受的问题,进化中为降低长期的过敏炎症反应,粘膜组织在接触环境抗原时会呈现耐受的倾向。因此,为建立成功的免疫反应,需要更强的免疫刺激原,如抗原相关分子模型(Pathogen-associated molecular patterns,PAMPs),疫苗设计时作为抗原的一部分或加入到佐剂之中。在肠道内环境方面,应充分重视对于母猪胃肠道物理、化学以及微生态环境的研究及调控。母猪与仔猪消化系统内环境有很大不同,如胃内的低pH、肠道内有着更复杂的微生物区系。因此,有活性免疫原被母猪摄入后极容易失活并被降解。无活性免疫原经历胃内酸性以及肠道弱碱性环境后也容易被改变表观化学性质。为此有的研究人员设计了可以过胃保护的PEDV微球疫苗[37]。
4 猪流行性腹泻疫苗及研制进展近年来,国内外的研究者在猪流行性腹泻疫苗方面已经作了大量的研究,研制了不同种类的疫苗,包括PED灭活苗、弱毒苗、基因工程苗等,我国的疫苗研制情况详见表 1。这些疫苗有的已经批量生产并在猪场应用,有的还在研发阶段,下面将对PED各类疫苗的研究及其应用现状进行概述。
| PEDV vaccine with new veterinary drug certificate | ||||
| Type of vaccine | Trade name | Strain | Characteristics and virus content | Date of approval |
| Live triple vaccine of transmissible gastroenteritis, porcine epidemic diarrhea and porcine rotavirus | No trade name | PEDV: CV777 TGEV: Hua PRV: NX |
PEDV content 105.0 TCID50/dose | 2014.12.26 |
| Live vaccine of transmissible gastroenteritis and porcine epidemic diarrhea | Wei le fu kang | PEDV: ZJ08 TGEV: HB08 |
Suspension culture PEDV content 107.5 TCID50/dose | 2015.11.18 |
| Ke fu jing | PEDV: AJ1102-R TGEV: WH-1R |
Flaky carrier suspension culture, PEDV content 5×105 TCID50/dose | 2017.12.27 | |
| Wei fu liu kang | PEDV: SCSZ-1 TGEV: SCJY-1 |
Microcarrier suspension culture, PEDV content 106.5 TCID50/dose |
2017.12.27 | |
| Fu jie | PEDV: LW/L TGEV: SD/L |
Freez drying of heat resistant protective agent PEDV content 105.7 TCID50/dose | 2018.7.3 | |
| Inactivated vaccine of transmissible gastroenteritis and porcine epidemic diarrhea | Ke xie ning | PEDV: AJ1102 TGEV: WH-1 |
Flaky carrier suspension culture PEDV content 107.5 TCID50/mL | 2016.10.25 |
| PEDV vaccine in clinical trial | ||||
| Project name | Strain | Applicant | Term of validity | |
| Clinical trial of inactivated vaccine against porcine epidemic diarrhea (fj2013 strain) | PEDV FJ2013 |
Present (Fuzhou) Biotechnology Co., Ltd, Jofunhwa (Nanjing) Biotechnology Co., Ltd | 2020.5.19–2022.5.18 | |
| Note: data retrieved from the national veterinary drug database of China veterinary drug information network in November 2020. | ||||
PEDV灭活疫苗包括细胞灭活苗和组织灭活苗。20世纪90年代国内几个研究单位研制了不同种类的灭活疫苗。马思奇等利用Vero细胞体外培养PEDV CV777毒株并基于该毒株的第28代次病毒制备了氢氧化铝细胞灭活苗,其主动免疫、被动免疫保护率达到85%以上[38]。王明等用上海PEDVS毒株对猪攻毒然后将猪肠组织悬液进行灭活制成了氢氧化铝组织灭活苗,经后海穴注射接种仔猪和妊娠母猪,仔猪在主动免疫中获得85%的攻毒保护率,被动免疫则得到97.06%的攻毒保护率,免疫期长达6个月[39]。因组织灭活苗使用的是疫病流行地区的强毒株,免疫母猪可以产生较好的免疫效果。但组织苗生产成本高,不易于大量制备,而且存在生物安全风险。相对而言,细胞灭活苗在利用细胞悬浮培养技术后可以大规模生产,具有广阔的发展空间。目前在肠道-乳腺-sIgA轴理论主导下,认为灭活PEDV疫苗及其肌肉或后海穴免疫途径主要产生执行体液免疫功能的IgG,执行肠道粘膜保护的IgA产生有限[40],因此保护不了仔猪感染PEDV。但有学者提出不同观点,认为灭活疫苗产生的IgG也一样使仔猪获得免疫保护[41]。考虑到PEDV感染仔猪过程中有短时的病毒血症[42-43],血液中IgG如能中和病毒无疑可以缓解病情,因此灭活疫苗有效的理论也有一定的根据。况且初乳或常乳中的IgG可以通过中和肠道病毒发挥防控作用。在我们研究中发现灭活疫苗免疫怀孕母猪后,其初生仔猪攻毒后比未免疫对照组存活率显著提高,发病症状明显减轻[25]。也有学者试验证明PEDV灭活疫苗免疫同样产生IgA,但不足以保护仔猪[26]。最近Chang的团队尝试用灭活疫苗结合趋化因子蛋白配体提高疫苗免疫效果[44],他们发现这种组合肌肉注射可以引导携带趋化因子CCR9或CCR10的淋巴细胞向注射部分聚集,因此诱导了超级PEDV特异IgG、IgA以及中和抗体。
4.2 弱毒疫苗由于学者对灭活PEDV疫苗保护肠道粘膜有争议,因此许多研究者致力于研究弱毒疫苗。传统的弱毒疫苗多是通过病毒细胞传代的方法制备。佟有恩等利用在Vero细胞上传代的CV777毒株适应到PK细胞上继续传代并克隆纯化,获得了免疫原性良好且毒力减弱的弱毒株。经临床验证被动免疫和主动免疫的保护率分别达到96.2%及95.2%[45]。韩国学者利用DR13强毒株在Vero细胞上传多代后得到了DR13弱毒株,并利用该弱毒株制成口服疫苗免疫怀孕母猪,仔猪经母乳饲喂后获得被动免疫保护,仔猪发病率和死亡率大大降低[46]。近两年,韩国科学家分离一个PEDV强毒株,通过Vero细胞传代65次获得了致弱毒株。用此致弱毒株免疫母猪获得了较理想的抗体,其仔猪攻毒试验证明可以保护仔猪减少死亡或减轻症状[47]。弱毒疫苗相对于灭活苗具有接种量少、抗体产生速度快等优势,但筛选一个合适的疫苗毒株有一定的偶然性,且需要系统验证,存在疫苗毒不稳定、返强、散毒的问题和风险。同时也要考虑疫苗接种方法、贮存和使用方式等问题。近期Sato等利用经典PEDV疫苗株制备的弱毒疫苗通过肌肉注射进行母猪免疫可以使仔猪获得攻毒保护[48]。
为克服灭活疫苗和弱毒疫苗的弱点,改善现有疫苗的免疫效果,目前临床上也有人尝试弱毒苗结合灭活苗的免疫方法。即首免用弱毒疫苗,二免用肌肉注射灭活疫苗。口服免疫弱毒疫苗可以诱导产生sIgA的浆细胞。同时,分泌sIgA的记忆B细胞归巢至脾脏、乳腺和回肠,肌肉注射二免可以继续激发这些细胞分化成熟并产生IgA。有研究证明,母猪产前40 d和产前20 d交替使用PEDV-TGEV-PoRV三联弱毒疫苗和PEDV-TGEV二联灭活疫苗,分娩后初乳中抗体滴度明显优于单一接种PTR或PT的抗体滴度[26]。因此,部分学者认为初次经肠道免疫(自然或人工) PEDV是非常重要的。如果母猪已感染过PEDV,再用肌肉注射也可以发挥作用。但这些研究还只是初步探索,缺乏足够的数据支持。围绕弱毒疫苗、灭活疫苗以及免疫途径等方面的问题和争议还需更多实验研究来澄清和解决。
4.3 基因工程疫苗基因工程疫苗是利用基因工程表达PEDV的结构蛋白,将表达蛋白纯化加工后免疫动物。或者直接将表达蛋白的微生物亦或基因疫苗接种动物,使动物获得主动免疫。如Chang等利用热敏感肠毒素作为佐剂制备了S蛋白的PEDV亚单位疫苗[49]。为增加抗原提呈的有效性,Wang等将抗原表位肽基因与树突状细胞或微皱细胞(M细胞) 目标多肽基因连接,利用益生菌表达该融合基因获得了较理想的免疫效果[50-51]。也有多个实验室利用嵌合病毒或重组病毒的方法获得基因工程疫苗。如王秋红团队利用基因工程方法把PEDV野毒株的NSP16和S蛋白内吞信号失活,成功拯救了PEDV cDNA克隆KDKE4A-SYA,将此cDNA克隆接种4日龄仔猪后可以得到较好的免疫保护[52]。西班牙科学家利用传染性胃肠炎病毒(TGEV) 作载体,构建成功表达PEDV S基因的TGEV嵌合病毒。用这种病毒感染5日龄仔猪不发病;感染3周龄仔猪,诱导产生了免疫保护[53]。Kao等制备了细胞适应的临床毒株的cDNA克隆iPEDVPT-P96,用其通过口服途径免疫5周龄仔猪,可产生一定的免疫保护,但该毒株比其来源毒株PEDVPT-P96更加弱化,保护力有所降低[54]。笔者实验室利用PEDV疫苗毒株DR13作载体,制备了表达流行PEDV毒株S基因的重组PEDV,利用该重组毒株制备灭活疫苗免疫怀孕母猪取得良好的免疫效果[25, 55]。这项技术融合了常规疫苗和基因工程疫苗的优势。同时可以针对新出现的毒株快速制备重组病毒研制疫苗,克服了临床毒株培养难以及基因工程疫苗抗原量不足等问题。以上基因工程疫苗因制备方法不同各有优势,但也存在种种不足。如重组病毒可能存在过度致弱的问题;菌类载体疫苗可能存在抗原递呈的问题。另外,基因工程弱毒疫苗比之常规弱毒疫苗还有生物安全方面的隐患,需要通过GMO的生物安全评价,增加了疫苗商品化困难。
5 展望综上所述,PEDV主要侵染初生仔猪并致病,目前针对仔猪发病无有效的免疫治疗方法,必须依赖母猪初乳获得被动免疫进行疫病防控;但当前对于母猪和仔猪PEDV免疫的研究还很薄弱,高质量的动物试验研究也很缺乏。所有这些问题造成母猪孕期免疫的效果不确定。因此,需要对包括母猪孕期免疫机理和PEDV免疫防控的诸多方面加强研究,为更加完善的PEDV免疫防控提供理论技术支撑。从当前发展趋势看,以下几个方面的深入研究会极大带动PEDV防控技术的进步。首先是猪感染PEDV及其免疫机制研究的拓展和深入。这方面研究包括母猪和仔猪的相关研究,这些研究有助于完善PEDV免疫方法和规程,建立母猪有效免疫标准和仔猪攻毒保护模型。要加强此项工作,还要克服诸多不利方面的影响,如缺乏PEDV双阴性猪、无确实的免疫因子的测定条件以及相同领域内科技信息交流不畅的问题。第二,PEDV疫苗研制科技的进步。当前PEDV研制还有不少技术难点,包括病毒培养、致弱和毒力控制方法、高滴度病毒的细胞培养方法以及抗原纯化工艺等。这些技术的突破无疑会在很大程度上提高疫苗质量和免疫效力,进一步改善PEDV的防控效果。第三,猪体免疫学基础研究的深入将会在很大程度上助推PEDV免疫技术的进步。从目前来说,猪的免疫基础研究还很薄弱,极大地限制了各种病原防控机制的建立。许多感染和免疫机制的理解都是从人或鼠类的研究推演过来,在猪体还缺乏足够的实验依据。最后,从中国养猪业提质增效的发展要求来看,将来最终解决问题的办法还是通过综合的生物安全防控措施和无特定疫病区建设。“无病无疫”才是动物疫病防控的终极目标。
| [1] |
姚龙涛. 如何控制猪口蹄疫和乳猪急性腹泻症. 兽医导刊, 2012(1): 17-18. Yao LT. How to control foot and mouth diease and acute diarrhea in suckling pigs. Vet Orientat, 2012(1): 17-18 (in Chinese). DOI:10.3969/j.issn.1673-8586.2012.01.012 |
| [2] |
Sun RQ, Cai RJ, Chen YQ, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China. Emerg Infect Dis, 2012, 18(1): 161-163. DOI:10.3201/eid1801.111259
|
| [3] |
施标, 董世娟, 朱于敏, 等. 我国猪流行性腹泻病毒分子流行病学研究进展. 中国农业科学, 2013, 46(20): 4362-4369. Shi B, Dong SJ, Zhu YM, et al. Advances in study of molecular epidemiology of porcine epidemic diarrhea virus in China. Sci Agric Sin, 2013, 46(20): 4362-4369 (in Chinese). DOI:10.3864/j.issn.0578-1752.2013.20.020 |
| [4] |
Luo YW, Zhang J, Deng XB, et al. Complete genome sequence of a highly prevalent isolate of porcine epidemic diarrhea virus in South China. J Virol, 2012, 86(17): 9551. DOI:10.1128/JVI.01455-12
|
| [5] |
Wang D, Fang LR, Xiao SB. Porcine epidemic diarrhea in China. Virus Res, 2016, 226: 7-13. DOI:10.1016/j.virusres.2016.05.026
|
| [6] |
德西措姆, 王印, 杨泽晓, 等. 2016-2018年四川地区猪流行性腹泻病毒流行病学调查与ORF3、S1部分基因序列分析. 浙江农业学报, 2019, 31(9): 1423-1428. Dexi CM, Wang Y, Yang ZX, et al. Epidemiological investigation of porcine epidemic diarrhea virus and sequence analysis of ORF3 and S1 genes in Sichuan from 2016 to 2018. Acta Agriculturae Zhejiangensis, 2019, 31(9): 1423-1428 (in Chinese). DOI:10.3969/j.issn.1004-1524.2019.09.04 |
| [7] |
王娟萍, 刘文俊, 米瑞娟, 等. 山西省猪流行性腹泻流行病学调查. 畜牧与兽医, 2016, 48(9): 116-118. Wang JP, Liu WJ, Mi RJ, et al. Epidemiological investigation of porcine epidemic diarrhea in Shanxi Province. Animal Husband Vet Med, 2016, 48(9): 116-118 (in Chinese). |
| [8] |
韩英明, 孙秋艳, 范作良, 等. 2016-2018年山东省部分地区猪流行性腹泻流行病学调查. 山东畜牧兽医, 2020, 41(6): 53-56. Han YM, Sun QY, Fan ZL, et al. Epidemiological survey of porcine epidemic diarrhea in some areas of Shandong Province from 2016 to 2018. Shandong J Animal Sci Vet Med, 2020, 41(6): 53-56 (in Chinese). DOI:10.3969/j.issn.1007-1733.2020.06.030 |
| [9] |
Ding GM, Fu YG, Li BY, et al. Development of a multiplex RT-PCR for the detection of major diarrhoeal viruses in pig herds in China. Transbound Emerg Dis, 2020, 67(2): 678-685. DOI:10.1111/tbed.13385
|
| [10] |
Godet M, L'Haridon R, Vautherot JF, et al. TGEV corona virus ORF4 encodes a membrane protein that is incorporated into virions. Virology, 1992, 188(2): 666-675. DOI:10.1016/0042-6822(92)90521-P
|
| [11] |
Rottier PJM. The coronavirus membrane glycoprotein//Siddell SG, Ed. The Coronaviridae. Boston, MA: Springer, 1995: 115-139.
|
| [12] |
Rottier PJM, Welling GW, Welling-Wester S, et al. Predicted membrane topology of the coronavirus protein E1. Biochemistry, 1986, 25(6): 1335-1339. DOI:10.1021/bi00354a022
|
| [13] |
Gimenez-Lirola LG, Zhang JQ, Carrillo-Avila JA, et al. Reactivity of porcine epidemic diarrhea virus structural proteins to antibodies against porcine enteric Coronaviruses: diagnostic implications. J Clin Microbiol, 2017, 55(5): 1426-1436. DOI:10.1128/JCM.02507-16
|
| [14] |
Swenson MJ. The mammary gland and lactation//Dukes' Physiology of Domestic Animals. Tenth, Ithaca and London: Cornell University Press, 1984, 863-876.
|
| [15] |
Markowska-Daniel I, Pomorska-mól M, Pejsak Z. Dynamic changes of immunoglobulin concentrations in pig colostrum and serum around parturition. Pol J Vet Sci, 2010, 13(1): 21-27.
|
| [16] |
Markowska-Daniel I, Pomorska-Mól M. Shifts in immunoglobulins levels in the porcine mammary secretions during whole lactation period. Bull Vet Inst Pulawy, 2010, 54(3): 345-349.
|
| [17] |
Salmon H, Berri M, Gerdts V, et al. Humoral and cellular factors of maternal immunity in swine. Dev Comparat Immunol, 2009, 33(3): 384-393. DOI:10.1016/j.dci.2008.07.007
|
| [18] |
Stirling CMA, Charleston B, Takamatsu H, et al. Characterization of the porcine neonatal Fc receptor — potential use for trans-epithelial protein delivery. Immunology, 2005, 114(4): 542-553. DOI:10.1111/j.1365-2567.2004.02121.x
|
| [19] |
Möller R, Hansen GH, Danielsen EM. IgG trafficking in the adult pig small intestine: one- or bidirectional transfer across the enterocyte brush border?. Histochem Cell Biol, 2017, 147(3): 399-411. DOI:10.1007/s00418-016-1492-x
|
| [20] |
Williams PP. Immunomodulating effects of intestinal absorbed maternal colostral leukocytes by neonatal pigs. Can J Vet Res, 1993, 57(1): 1-8.
|
| [21] |
Luissint AC, Parkos CA, Nusrat A. Inflammation and the intestinal barrier: leukocyte-epithelial cell interactions, cell junction remodeling, and mucosal repair. Gastroenterology, 2016, 151(4): 616-632. DOI:10.1053/j.gastro.2016.07.008
|
| [22] |
Cabinian A, Sinsimer D, Tang M, et al. Transfer of maternal immune cells by breastfeeding: maternal cytotoxic T lymphocytes present in breast milk localize in the peyer's patches of the nursed infant. PLoS ONE, 2016, 11(6): e0156762. DOI:10.1371/journal.pone.0156762
|
| [23] |
Matias J, Berzosa M, Pastor Y, et al. Maternal vaccination. Immunization of sows during pregnancy against ETEC infections. Vaccines, 2017, 6(5): 48.
|
| [24] |
杨汉春. 动物免疫学. 2版. 北京: 中国农业大学出版社, 2023: 48. Yang HC. Animal Immunology. 2nd Ed. Beijing: China Agricultural University Press, 2023: 48 (in Chinese). |
| [25] |
门程芳. 猪流行性腹泻病毒基因工程灭活疫苗的免疫试验研究[D]. 泰安: 山东农业大学, 2020. Men CF. Immunization test of genetically engineered inactivated vaccine of porcine epidemic diarrhea virus[D]. Taian: Shandong Agricultural University, 2020 (in Chinese). |
| [26] |
胡兴义, 张双翔, 冯旭芳, 等. 猪病毒性腹泻(PED)疫苗免疫后母猪乳汁中PEDV IgA消长动态. 中国兽医学报, 2017, 37(9): 1659-1663. Hu XY, Zhang SX, Feng XF, et al. Growth and decline of PEDV IgA antibody in sow milk after immunization with porcine viral diarrhea vaccine. Chin J Vet Sci, 2017, 37(9): 1659-1663 (in Chinese). |
| [27] |
Langel SN, Paim FC, Alhamo MA, et al. Stage of gestation at porcine epidemic diarrhea virus infection of pregnant swine impacts maternal immunity and lactogenic immune protection of neonatal suckling piglets. Ront Immunol, 2019, 10: 727.
|
| [28] |
Crawford K, Lager KM, Kulshreshtha V, et al. Status of vaccines for porcine epidemic diarrhea virus in the United States and Canada. Virus Res, 2016, 226: 108-116. DOI:10.1016/j.virusres.2016.08.005
|
| [29] |
Saif LJ, Bohl EH. Passive immunity to transmissible gastroenteritis virus: intramammary viral inoculation of sows. Ann N Y Acad Sci, 1983, 409(1): 708-723.
|
| [30] |
Saif LJ, Van Cott JL, Brim TA. Immunity to transmissible gastroenteritis virus and porcine respiratory coronavirus infections in swine. Vet Immunol Immunopathol, 1994, 43(1/3): 89-97.
|
| [31] |
Langel SN, Paim FC, Lager KM, et al. Lactogenic immunity and vaccines for porcine epidemic diarrhea virus (PEDV): historical and current concepts. Virus Res, 2016, 226: 93-107. DOI:10.1016/j.virusres.2016.05.016
|
| [32] |
Briskin M, Winsor-Hines D, Shyjan A, et al. Human mucosal addressin cell adhesion molecule-1 is preferentially expressed in intestinal tract and associated lymphoid tissue. Am J Pathol, 1997, 151(1): 97-110.
|
| [33] |
Bourges D, Meurens F, Berri M, et al. New insights into the dual recruitment of IgA+ B cells in the developing mammary gland. Mol Immunol, 2008, 45(12): 3354-3362. DOI:10.1016/j.molimm.2008.04.017
|
| [34] |
Stenstad H, Ericsson A, Johansson-Lindbom B, et al. Gut-associated lymphoid tissue-primed CD4+ T cells display CCR9-dependent and -independent homing to the small intestine. Blood, 2006, 107(9): 3447-3454. DOI:10.1182/blood-2005-07-2860
|
| [35] |
Wang W, Soto H, Oldham ER, et al. Identification of a novel chemokine (CCL28), which binds CCR10 (GPR2). J Biol Chem, 2000, 275(29): 22313-22323. DOI:10.1074/jbc.M001461200
|
| [36] |
Wilson E, Butcher EC. CCL28 controls immunoglobulin (Ig)A plasma cell accumulation in the lactating mammary gland and IgA antibody transfer to the neonate. J Exp Med, 2004, 200(6): 805-809. DOI:10.1084/jem.20041069
|
| [37] |
Wen ZF, Xu ZC, Zhou QF, et al. Oral administration of coated PEDV-loaded microspheres elicited PEDV-specific immunity in weaned piglets. Vaccine, 2018, 36(45): 6803-6809. DOI:10.1016/j.vaccine.2018.09.014
|
| [38] |
马思奇, 王明, 周金法, 等. 猪流行性腹泻病毒适应Vero细胞培养及以传代细胞毒制备氢氧化铝灭活疫苗免疫效力试验. 中国畜禽传染病, 1994(2): 15-19. Ma SQ, Wang M, Zhou JF, et al. Adaption of porcine epidemic diarrhea virus to growth in cell cultures and efficacy of the killed virus vaccine. China Infectious diseases of Livestock and Poultry, 1994(2): 15-19 (in Chinese). |
| [39] |
王明, 马思奇, 周金法, 等. 猪流行性腹泻灭活疫苗的研究. 中国畜禽传染病, 1993(5): 17-19. Wang M, Ma SQ, Zhou JF, et al. Study on inactivated vaccine against porcine epidemic diarrhea. China Infectious diseases of Livestock and Poultry, 1993(5): 17-19 (in Chinese). |
| [40] |
Chattha KS, Roth JA, Saif LJ. Strategies for design and application of enteric viral vaccines. Annu Rev Anim Biosci, 2015, 3: 375-395. DOI:10.1146/annurev-animal-022114-111038
|
| [41] |
Poonsuk K, Giménez-Lirola LG, Zhang JQ, et al. Does circulating antibody play a role in the protection of piglets against porcine epidemic diarrhea virus?. PLoS ONE, 2016, 11(4): e0153041. DOI:10.1371/journal.pone.0153041
|
| [42] |
Jung K, Wang QH, Scheuer KA, et al. Pathology of US porcine epidemic diarrhea virus strain PC21A in gnotobiotic pigs. Emerg Infect Dis, 2014, 20(4): 662-665.
|
| [43] |
Annamalai T, Saif LJ, Lu ZY, et al. Age-dependent variation in innate immune responses to porcine epidemic diarrhea virus infection in suckling versus weaned pigs. Vet Immunol Immunopathol, 2015, 168(3/4): 193-202.
|
| [44] |
Hsueh FC, Chang YC, Kao CF, et al. Intramuscular immunization with chemokine-adjuvanted inactive porcine epidemic diarrhea virus induces substantial protection in pigs. Vaccines, 2020, 8(1): 102. DOI:10.3390/vaccines8010102
|
| [45] |
佟有恩, 冯力, 李伟杰, 等. 猪流行性腹泻弱毒株的培育. 中国畜禽传染病, 1998, 20(6): 329-332. Tong YE, Feng L, Li WJ, et al. Development of porcine epidemic diarrhea attenuated virus. Chin J Prev Vet Med, 1998, 20(6): 329-332 (in Chinese). |
| [46] |
Song DS, Oh JS, Kang BK, et al. Oral efficacy of Vero cell attenuated porcine epidemic diarrhea virus DR13 strain. Res Vet Sci, 2007, 82(1): 134-140. DOI:10.1016/j.rvsc.2006.03.007
|
| [47] |
Park JE, Kang KJ, Ryu JH, et al. Porcine epidemic diarrhea vaccine evaluation using a newly isolated strain from Korea. Vet Microbiol, 2018, 221: 19-26. DOI:10.1016/j.vetmic.2018.05.012
|
| [48] |
Sato T, Oroku K, Ohshima Y, et al. Efficacy of genogroup 1 based porcine epidemic diarrhea live vaccine against genogroup 2 field strain in Japan. Virol J, 2018, 15: 28. DOI:10.1186/s12985-018-0940-8
|
| [49] |
Chang YC, Chang CY, Tsai PS, et al. Efficacy of heat-labile enterotoxin B subunit-adjuvanted parenteral porcine epidemic diarrhea virus trimeric spike subunit vaccine in piglets. Appl Microbiol Biotechnol, 2018, 102(17): 7499-7507. DOI:10.1007/s00253-018-9110-6
|
| [50] |
Wang XN, Wang L, Huang XW, et al. Oral delivery of probiotics expressing dendritic cell-targeting peptide fused with porcine epidemic diarrhea virus COE antigen: a promising vaccine strategy against PEDV. Viruses, 2017, 9(11): 312. DOI:10.3390/v9110312
|
| [51] |
Wang XN, Wang L, Zheng DZ, et al. Oral immunization with a Lactobacillus casei-based anti-porcine epidemic diarrhoea virus (PEDV) vaccine expressing microfold cell-targeting peptide Co1 fused with the COE antigen of PEDV. J Appl Microbiol, 2018, 124(2): 368-378. DOI:10.1111/jam.13652
|
| [52] |
Hou YX, Ke HZ, Kim J, et al. Engineering a live attenuated porcine epidemic diarrhea virus vaccine candidate via inactivation of the viral 2'-O-methyltransferase and the endocytosis signal of the spike protein. J Virol, 2019, 93(15): e00406-19.
|
| [53] |
Pascual-Iglesias A, Sanchez CM, Penzes Z, et al. Recombinant chimeric transmissible gastroenteritis virus (TGEV) — porcine epidemic diarrhea virus (PEDV) virus provides protection against virulent PEDV. Viruses, 2019, 11(8): 682. DOI:10.3390/v11080682
|
| [54] |
Kao CF, Chiou HY, Chang YC, et al. The characterization of immunoprotection induced by a cDNA clone derived from the attenuated Taiwan porcine epidemic diarrhea virus pintung 52 strain. Viruses, 2018, 10(10): 543. DOI:10.3390/v10100543
|
| [55] |
陈冰清. 猪流行性腹泻病毒(PEDV)基因工程疫苗载体构建及重组病毒拯救[D]. 上海: 东华大学, 2015. Chen BQ. Construction of PEDV vaccine transfer vector and rescue of recombinant virus[D]. Shanghai: Donghua University, 2015 (in Chinese). |
 2021, Vol. 37
2021, Vol. 37