中国科学院微生物研究所、中国微生物学会主办
文章信息
- 娄千, 浦香东, 宋经元
- Lou Qian, Pu Xiangdong, Song Jingyuan
- 胭脂素的生物合成及应用研究进展
- Advances in the biosynthesis and application of bixin
- 生物工程学报, 2021, 37(6): 1986-1997
- Chinese Journal of Biotechnology, 2021, 37(6): 1986-1997
- 10.13345/j.cjb.200724
-
文章历史
- Received: November 11, 2020
- Accepted: March 1, 2021
2. 中药资源教育部工程研究中心,北京 100193
2. Engineering Research Center of Chinese Medicine Resource, Ministry of Education, Beijing 100193, China
胭脂素(Bixin) 是一种脱辅基类胡萝卜素化合物,又名红木素,主要来源于红木科红木属植物红木(别称胭脂木) Bixa orellana L.。胭脂木原产于拉丁美洲,现分布于巴西、马来西亚、印度等地,拉丁美洲产量约占世界总产量的60%,非洲、亚洲次之[1]。在我国云南省、广东省、广西壮族自治区等地区均有栽培。胭脂木体内含有丰富的化学成分,包括类胡萝卜素、萜类、酸、挥发性成分等,其中类胡萝卜素成分含量最高。胭脂素是胭脂木体内含量最高的类胡萝卜素成分,在种子假种皮中积累最丰富,含量高达种子中类胡萝卜素总量的80%[2]。胭脂素是世界第二大天然色素胭脂树橙(E160b) 的主要成分,胭脂素的含量越高,色素价格越贵。胭脂树橙色泽鲜艳,可赋予食品颜色,在2007年被我国批准作为食品添加剂使用,国际食品法典委员会、欧盟委员会、美国食品药品管理局等均允许其作为食品着色剂。由于合成色素在人类健康问题上具有潜在风险,天然色素逐渐受到青睐,胭脂素的需求量日益增加。胭脂素全球年产量约为14 500 t,约有1/3用于提取色素[1]。作为天然色素,胭脂树橙广泛应用于干酪、人造黄油、果酱、巧克力、糖果、饮料等食品,也作为工业染料用于皮革、针织品染色。同时,根据文献记载,胭脂木叶片、树皮、种子提取物还可作为药物使用,是一种药用植物。因而,胭脂素受到广泛关注,世界各地学者对胭脂木的药理、化学等方面开展研究[3-4]。下一代测序技术如SMRT (Single molecule,real time sequencing)、Oxford Nanopore等和生物信息学技术的发展推动了药用植物全基因组、转录组、蛋白质组及代谢组等多组学研究[5-6]。同样,也有学者将这些前沿技术应用到胭脂素的研究中,实现胭脂木叶绿体基因组解析[7],分离鉴定出一系列参与胭脂素生物合成的关键酶基因。本文就胭脂素的化学特性与提取方法、合成途径研究及其应用价值进行综述,以期促进胭脂素生物合成途径完整解析,推动其资源开发及应用。
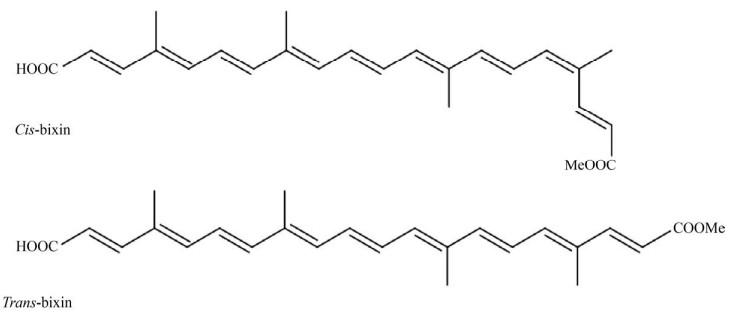
1 胭脂素的化学特性与提取方式 1.1 化学特性胭脂木中含有β-类胡萝卜素、叶黄素、玉米黄质等多种类胡萝卜素成分,胭脂素的含量最高。胭脂素为橙紫色晶体,分子式为C25H30O4,具有顺反异构体(图 1),在胭脂木中,主要以顺式结构存在。顺式胭脂素显橘红色,较不稳定,不易溶于植物油;反式胭脂素显红色,较稳定,更易溶于植物油。在光、热等因素作用下顺式胭脂素可转化成更稳定的反式结构[4, 8]。胭脂素极性较小、亲脂性强。另外,胭脂木中还存在一种水溶性强的色素——降胭脂素(Norbixin) (C24H28O4),含量仅次于胭脂素。Dias等[9]研究了胭脂素的紫外光谱特征峰,并首次发现胭脂素的荧光特征峰。Scotter[4]对胭脂素的分子特征、光、热稳定性及检测方法作了详细综述。
|
| 图 1 胭脂素的顺反异构体 Fig. 1 Chemical structure of cis-bixin and trans-bixin. |
| |
胭脂木叶片、树皮等部位均含有胭脂素,在种子假种皮中含量最高。因而,目前主要通过化学手段从胭脂木种子假种皮中提取胭脂素(表 1)。传统提取方法为溶剂提取法,根据使用的溶剂分为碱性溶剂提取和有机溶剂提取两种。碱性溶剂提取主要使用氢氧化钠或氢氧化钾溶液。使用碱性溶剂提取,可将胭脂素转化成盐,增加其水溶性,但是在后续应用中需去除碱性成分,导致操作繁琐[10-12]。采用有机溶剂提取胭脂素,因溶剂选择性较低,所得产物纯度低。同时,为防止污染环境需回收有机溶剂,导致成本增加[10-12]。传统方法也通过植物油提取胭脂素,可获得不同色调的胭脂素,但由于顺式胭脂素不易溶于植物油,因而所得产物含量较低。植物油提取过程温度较高,易导致胭脂素降解及其他化学成分产生[2]。随着科学技术的发展,微波、超声、喷射床、超临界流体萃取等新型提取技术逐渐应用于植物有效成分提取。微波辅助和超声辅助提取胭脂素与溶剂浸提法相比可显著减少提取时间,并且可提高产物中胭脂素含量[13-14]。此外,研究证实微波辅助提取法所得产物中胭脂素、多酚类成分含量增加可有效提高其抗氧化活性[15]。超临界流体萃取技术提取所得产物胭脂素含量较低,但该技术可除去种子中含有的大部分脂质,提高产物纯度[11]。近年来,有学者采用喷射床提取胭脂素,该法所得胭脂素含量最高能达到65%,远远超过其他提取方法[16]。综上所述,新技术在操作步骤、提取时间、提取物中胭脂素含量等方面均得到提高。其中,采用喷射床提取的方式极大地提高了胭脂素含量,而超临界流体萃取法提高了产物中胭脂素产物纯度,可以考虑将两种方法合用,同时提高产物含量与纯度,提高工业生产效率。虽然微波辅助萃取方式的提取效率不及喷射床提取法,但该法操作更简便,得到的产物含量比传统方法高,产物抗氧化活性显著增强,若提取产物用于抗氧化活性研究、治疗,则可以考虑使用微波辅助提取法。
| Methods | Characteristics | References |
| Aqueous alkali extraction (KOH, NaOH) | Enhanced water solubility; complicated purify operations | [10-12] |
| Organic solvent extraction | Low purity; high cost for solvent recovery | [10-12] |
| Vegetable oil extraction | Cause degradation; form by-products | [2] |
| Microwave-assisted extraction | High content; increased antioxidant activity; short time consuming | [13, 15] |
| Ultrasound-assisted extraction | Easy operation; short time consuming; high content | [14] |
| Supercritical fluid extraction | High purity; non-pollution; low content | [11] |
| Spouted bed extraction | High content | [16] |
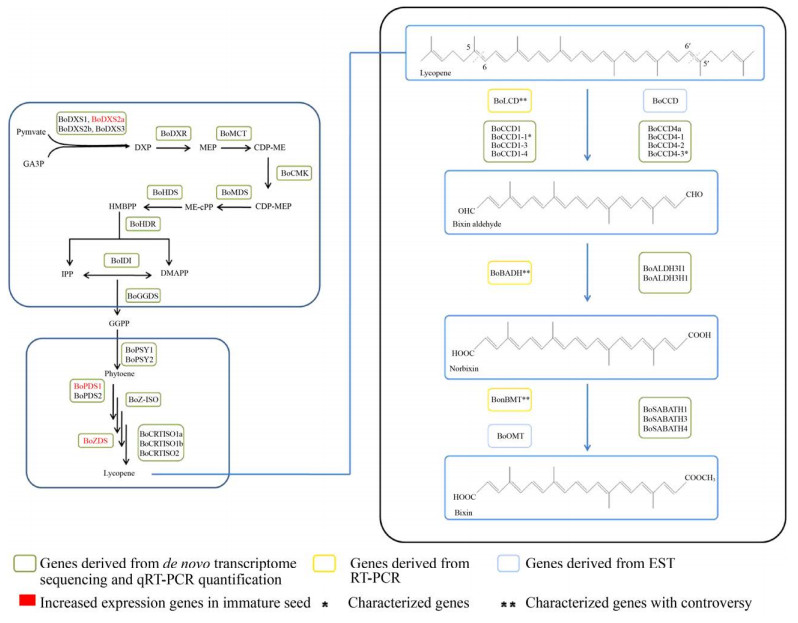
胭脂素是一种脱辅基类胡萝卜素,由类胡萝卜素氧化裂解产生。其合成途径由3部分组成:上游部分由2-甲基-D-赤藻糖醇-4-磷酸(2-methyl- D-erythritol-4-phosphate,MEP) 途径产生牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl pyrophosphate,GGPP);中游部分通过类胡萝卜素途径产生胭脂素合成的底物番茄红素;下游部分番茄红素经氧化裂解等步骤合成胭脂素。目前,对胭脂素合成途径上游、中游部分研究较少。Jako等[17]提取胭脂木未成熟种子外表皮RNA,构建cDNA文库,通过表达序列标签(Expressed sequence tag,EST) 发现部分参与胭脂素合成MEP途径和类胡萝卜素途径基因。Cárdenas-Conejo等[18]在转录组分析中发现胭脂素合成途径大部分基因,实时荧光定量聚合酶链式反应(Quantitative real-time polymerase chain reaction,qRT-PCR) 分析发现3个基因(BoDXS2a、BoPDS1、BoZDS) 在未成熟种子中显著表达,极有可能参与胭脂素合成(图 2)。此外,尚无其他胭脂素上游、中游合成途径相关研究,我们推测为上游、中游途径相对保守所致。因而,现有研究多关注胭脂素下游合成部分,挖掘催化下游合成途径关键酶基因,以完整解析胭脂素生物合成途径。2002年,Jako等[17]首次提出胭脂素下游合成途径,认为胭脂素合成途径由3种关键酶催化:氧化酶催化番茄红素氧化裂解生成胭脂素醛;醛脱氢酶催化胭脂素醛生成降胭脂素;甲基转移酶催化降胭脂素生成胭脂素。次年,Bouvier等[19]基于胭脂素和番红花酸结构的相似性提出胭脂素合成途径,与Jako提出的合成途径不谋而合。
|
| 图 2 推测的胭脂素生物合成途径 Fig. 2 Proposed biosynthetic pathway of bixin. |
| |
胭脂素下游合成途径首先由氧化酶催化底物番茄红素生成胭脂素醛。Bouvier等[19]基于西红花含有的玉米黄质裂解双加氧酶(Crocus sativus zeaxanthin cleavage dioxygenase,CsZCD),使用逆转录聚合酶链式反应(Reverse transcriptase polymerase chain reaction,RT-PCR) 技术分离得到催化该步反应的氧化酶基因——番茄红素双加氧裂解酶基因(Bixa orellana lycopene cleavage dioxygenase,BoLCD)。通过原核表达体系验证其功能发现该基因能催化番茄红素氧化生成胭脂素醛。随后研究分离鉴定的催化胭脂素合成的氧化酶基因多为类胡萝卜素裂解双加氧酶家族(Carotenoid cleavage dioxygenases,CCDs) 基因。CCDs是催化类胡萝卜素裂解的关键酶,主要分为CCD1、CCD4、CCD7、CCD8四个亚家族,从胭脂木分离得到的CCDs基因主要来自CCD1和CCD4亚家族。CCD1和CCD4亚家族的酶与植物颜色、香气的形成密切相关。CCD1亚家族的酶催化环状或链状反式类胡萝卜素双键(C5-C6、C7-C8、C9-C10) 裂解产生多种脱辅基类胡萝卜素,CCD4亚家族的酶参与植物挥发性化合物如β-紫罗兰酮的合成,也有报道表明该亚家族的酶参与植物抵抗干旱胁迫[20-21]。Rodríguez-Ávila等[22]从胭脂木未成熟种子中分离鉴定出首个编码CCD1家族酶的基因——BoCCD1,该基因在胭脂木叶片、花、种子器官中均有表达,在不同发育阶段种子中表达水平变化与胭脂素积累过程一致,表示该基因极有可能参与胭脂素合成。在其他植物如水稻、玉米中已发现CCD1亚家族的酶可催化无环状结构的类胡萝卜素5-6/5′-6′双键裂解产生挥发性物质,据此推测BoCCD1也可能具有该功能。Soares等[23]通过EST分析鉴定BoCCD基因,该基因在胭脂木种子发育过程中表达增加,可能参与胭脂素合成,与多种植物体内CCDs基因进行序列比对发现,BoCCD基因与CCD4亚家族基因亲缘关系较近,可能属于CCD4亚家族基因。在该研究建立的树状图中可以发现Bouvier等发现的BoLCD基因也与CCD4家族基因关系密切。Sankari等[24]从胭脂木叶片中分离鉴定CCD4a亚家族基因——BoCCD4a,并通过农杆菌转化检测到该基因表达。对该基因进行系统进化分析发现,该基因与西红花CCD4a亚家族基因具有同源性。Cárdenas-Conejo等[18]对胭脂木叶片、未成熟种子和成熟种子进行de novo转录组测序,鉴定到大部分胭脂素合成途径基因,包含4个CCD1亚家族基因(BoCCD1-1、BoCCD1-2、BoCCD1-3、BoCCD1-4) 和5个CCD4亚家族基因(BoCCD4-1、BoCCD4-2、BoCCD4-3、BoCCD4-4、BoCCD4-5)。结合胭脂素积累过程中各基因表达水平变化分析认为,BoCCD1-3、BoCCD1-4、BoCCD4-1、BoCCD4-2、BoCCD4-3可能参与胭脂素合成,催化番茄红素氧化裂解。Carballo-Uicab等[25]从2种红木5个不同发育阶段种子中分离得到Cárdenas- Conejo等鉴定的CCD家族基因,通过异源表达体系并结合液相、质谱等技术进行功能验证,成功证明BoCCD1-1、BoCCD4-3能够催化番茄红素5-6/5′-6′双键裂解,生成胭脂素醛。
现已发现的催化胭脂素下游合成途径第一步反应的关键酶基因多来自CCD1和CCD4亚家族,系统进化研究发现BoLCD与BoCCD均与CCD4亚家族基因表现出较近的亲缘关系,可通过进一步研究确认这两种基因是否为CCD4亚家族基因。然而,目前对于BoLCD存在争议,尽管已有研究验证该基因的功能,但有学者在转录组研究中未能成功发现该基因,在系统进化关系研究中发现该基因与西红花中CCD家族基因的亲缘关系更近,因而对该基因是否为胭脂木中的基因提出疑问[18]。文献报道西红花中也含有胭脂素[26],因此,应当设计实验确认该基因的来源。同时,也可对两个物种中胭脂素合成途径进行深入研究,挖掘催化胭脂素合成关键酶,解析胭脂素生物合成途径,揭示不同物种产生同一化学成分的机制。同时可以发现,对编码催化这一步反应的关键酶基因相关研究较多,但大部分都是通过生物信息学手段鉴定基因并研究该基因在胭脂素合成过程中表达水平变化及与其他物种含有氧化酶基因的系统进化关系,对已发现基因进行功能验证较少。为了完整解析胭脂素生物合成途径,实现胭脂素体外合成,可以考虑采取其他手段验证已鉴定基因的功能,筛选真正有功能的基因,并研究各基因对胭脂素合成的调控水平,为构建高产量异源合成体系奠定基础。
2.1.2 醛脱氢酶催化胭脂素醛生成降胭脂素氧化酶催化番茄红素裂解生成胭脂素醛后,由醛脱氢酶(Aldehyde dehydrogenases,ALDHs)催化胭脂素醛氧化脱氢生成降胭脂素。目前,植物中发现的醛脱氢酶来自13个家族,其中大部分醛脱氢酶来自ALDH2、3、5、6、7、10、11、12、18、22这10个家族。Jako等[17]类比脱落酸合成途径,通过表达序列标签在胭脂木种子假种皮中发现部分编码醛脱氢酶序列。Cárdenas-Conejo等[18]根据胭脂木全长转录组测序结果,以可可树Theobroma cacao和拟南芥Arabidopsis thaliana中的醛脱氢酶进行同源蛋白分析,鉴定到胭脂木中来自10个ALDH家族的20个醛脱氢酶基因,亚细胞定位及qRT-PCR结果显示BoALDH3I1与BoADLH3H1是催化胭脂素醛氧化裂解的关键酶。Bouvier等[19]从胭脂木中分离得到的胭脂素醛脱氢酶(Bixa orellana bixin aldehyde dehydrogenase,BoBADH) 是目前胭脂木中唯一一个催化活性得到验证的醛脱氢酶,通过异源表达体系以胭脂素醛为底物成功得到降胭脂素。但是该酶的真实性同样被后续研究质疑。
目前,催化胭脂素合成的醛脱氢酶相关研究较少,为推动胭脂素生物合成途径解析,可使用不同发育阶段的种子、叶片进行实验,筛选关键酶。同时,对真实性存在争议的酶应设计实验验证,对已鉴定的可能催化胭脂素合成的基因功能也应当进行验证,筛选真正有功能的基因。
2.1.3 甲基转移酶催化降胭脂素生成胭脂素甲基化反应是植物体内次生代谢产物合成的重要反应。胭脂素合成最后一步反应为降胭脂素在甲基转移酶作用下一端羧基甲基化生成胭脂素。根据底物的作用位点不同,可将植物甲基转移酶分为C-甲基转移酶(C-methyltransferases,CMTs)、N-甲基转移酶(N-methyltransferases,NMTs)、O-甲基转移酶(O-methyltransferases,OMTs) 等[27]。Soares等[23]通过表达序列标签筛选到BoOMT基因,该基因在胭脂素的主要合成器官种子发育成熟过程中显著表达,表明该酶可能是催化降胭脂素甲基化反应的关键酶,系统进化分析显示BoOMT与苹果桉Eucalyptus gunnii中的咖啡酸-O-甲基转移酶(Caffeic acid 3-O-methyltransferase,EgCOMT) 聚为一支。植物SABATH甲基转移酶是Ⅲ型OMTs,具有以S-腺苷-蛋氨酸(S-adenosylmethionine,SAM) 为甲基供体催化激素和小分子化合物羧基和氮原子甲基化的功能[27]。Cárdenas-Conejo等[18]对胭脂木叶片及种子进行转录组测序,通过可可树和拟南芥中含有的SABATH家族甲基转移酶进行蛋白同源性分析筛选到12个BoSABATH基因,结合亚细胞定位及qRT-PCR分析推测BoSABATH1、BoSABATH3、BoSABATH4是催化胭脂素合成最后一步的关键酶。同样,催化胭脂素最后一步反应的基因相关研究数量有限,且研究程度较浅。
胭脂素生物合成途径方面的研究已进行10余年。尽管早在2003年就有学者解析胭脂素合成通路,筛选并克隆3个关键酶基因(BoLCD、BoBADH、BonBMT),通过异源表达体系成功生产胭脂素。但是随着生物信息学技术的发展,后续研究筛选到更多可能参与胭脂素合成途径的基因,并对已进行功能验证的这3个基因的真实性产生怀疑。因而,到目前为止,具有权威性的完整胭脂素生物合成途径仍未被解析。本草基因组学理论[28]和前沿生物信息学技术将促进胭脂素合成通路研究,为其合成生物学研究奠定基础。
2.2 非生物胁迫影响胭脂素生物合成植物在生长发育过程中面临干旱、盐碱、紫外线等非生物胁迫,植物不能同动物一样通过移动躲避伤害,而是通过进化出生理及生化防御机制、合成特殊化学物质或调控自身化学成分合成等行为应对逆境,被称为自然界杰出的“化学家”。测序技术和组学技术的发展促进植物代谢机理研究,有利于从基因层面上揭示非生物胁迫下植物对次生代谢产物合成的调控,挖掘相关基因。如Xu等[29]通过单分子实时(SMRT) 测序技术对古老复苏植物卷柏Selaginella tamariscina基因组测序、组装、注释等,破译基因组,发现特殊基因组结构和耐旱相关基因。陈笛等[30]通过转录组分析挖掘调控开花相关激素信号转导基因、开花途径相关调控基因及转录因子家族基因,揭示不同光质调控茉莉花Jasminum sambac开花的差异表达机制。曹继敏等[31]通过转录组分析筛选旱柳Salix matsudana中与镉胁迫响应密切相关的基因,分析响应机制。类胡萝卜素物质是植物体内重要的次生代谢产物,具有吸收和传递电子的能力,是光吸收的辅助色素,非生物胁迫对此类化合物的合成也存在影响。Sankari等[32]将胭脂木幼苗暴露于不同波长紫外光下进行培养,检测到胭脂素合成下降,通过qRT-PCR及基因共表达网络分析揭示紫外线胁迫下胭脂素合成途径中基因表达水平及模式变化,发现CCD、LCY、PDS、ZDS与PSY蛋白相互作用较强,qRT-PCR分析结果显示编码这几种蛋白的基因在紫外光作用下表达水平均下降(ZDS基因表达水平未分析),表明这几种基因极有可能参与抵御光胁迫。最新研究发现光质也是影响胭脂素合成的重要因素,但尚未从基因层面上揭示其机理[33]。盐胁迫也是一种重要的非生物胁迫,影响植物次生代谢产物合成。Sankari等[34]对胭脂木已发芽种子进行不同程度盐胁迫处理,测定胭脂素含量,分析胭脂素合成途径相关基因表达水平变化及蛋白质相互作用,发现随着盐胁迫程度增加,胭脂素含量减少,胭脂素合成途径相关基因(PSY、DXS、PDS、β-LCY、ε-LCY、ADH、LCD、CCD、CMT) 表达水平下降。蛋白质相互作用结果表明LCY、PDS、PSY蛋白存在紧密共表达。
不难发现,当前对非生物胁迫影响胭脂素合成相关研究不够深入,未能揭示胭脂素合成通路应对非生物胁迫的响应机制,也未能挖掘到参与调控的关键酶基因。解析合成通路对非生物胁迫的响应机制可促进关键调控因子的挖掘,为合成生物学研究构建关键基因元件奠定基础,提升体外合成效率。
3 胭脂素的应用胭脂素应用历史悠久,范围广泛,主要包括食品、化工、医药3个方面。
3.1 在食品行业作为食品添加剂或着色剂(E160b)胭脂素色泽鲜艳明亮,是常用天然色素胭脂树橙的主要成分。我国于2007年批准该色素作为食品添加剂使用,欧盟、美国等地区均批准该色素作为食品着色剂。在食品行业,胭脂素广泛应用于乳制品、饮料、糖果、黄油、巧克力等,其中在奶油、乳酪中应用最为广泛[35-37]。近年来,由于合成色素可能存在的毒性及安全性问题,天然色素逐渐受到青睐。胭脂素是天然色素,作为食物着色剂使用,对食品的味道不造成影响。且有研究发现胭脂素对导致食品变质和腐败的细菌具有抑制作用,对肉制品具有天然抗氧化活性,可能是生产肉制品的天然抗氧化剂[38]。目前普遍认为天然色素较安全,胭脂素相关毒性研究均显示在规定限度下使用,胭脂素不具有毒性。如检测胭脂素给药小鼠的血浆、血液生化指标,未发现病理性变化[39]。2016年,欧洲食品安全局评估了不同类别食品中胭脂素对不同人群的暴露水平,均低于每日允许可摄入量,认为胭脂素是安全的[40]。但是也有报道显示食品中添加胭脂素导致过敏性疾病[41]。因而,为保证食品安全,应当深入研究胭脂素的毒性及其他安全性指标,避免影响生命健康。
3.2 应用于化工产业胭脂素色调包含红色至黄色,可作为染料,应用于皮革、针织品染色,以及制作口红、胭脂等美妆产品。因其在口红制作方面应用极广,也有部分地区将胭脂木称为“口红树”。同时,胭脂素具有抗氧化活性,能够减少紫外线对皮肤的伤害,比如采用胭脂素染料染色的针织物,可降低面料的紫外线辐射透射率,保护皮肤[42-43]。因此胭脂素也在防晒霜、防晒衣等产品生产中使用。
3.3 药用价值根据文献报道,胭脂木在不同国家和地区均有用于治疗疾病、缓解机体不良反应以及治疗蛇咬伤等应用。我国《中华本草》记载,胭脂木的根皮、果实、种子,具有退热、解毒、截疟的作用,用于治疗疟疾、痢疾、黄疸、疮疡、丹毒、蛇毒等证。在尼日利亚,用于治疗疟疾和抗风湿。在南美地区,用于治疗腹泻和哮喘。在哥伦比亚,其种子用于祛痰、治疗淋证。现代药理研究表明,胭脂木提取物具有良好的抗氧化、抗纤维化、抗菌、抗炎、抗癌、降血糖活性[44-45]。Xue等研究发现胭脂素可通过激活Nrf2 (NF-E2-related factor 2) 信号减轻炎症细胞积累,缓解二氧化硅引起的小鼠肺损伤;进一步研究发现Nrf2信号激活可减轻氧化应激反应,促进细胞增殖、迁移,减少细胞凋亡,从而明显改善肺部病理性炎症和纤维化发展[46-47]。Keita等[48]研究发现胭脂素可降低糖尿病小鼠血糖,分子对接和分子动力学模拟结果显示胭脂素降血糖机制与激活过氧化物酶体增殖剂激活受体γ (Peroxisome proliferatoractivated receptor gamma,PPAPγ) 有关。因此,胭脂素可能是一种新型Nrf2激动剂,其具体作用机制有待深入研究。此外,研究显示胭脂素具有抗癌特性,通过调节内源性及外源性分子诱导细胞凋亡或增加抗癌药物的敏感性,有潜力作为抗癌药物开发使用[49-50]。然而,目前尚无胭脂素成药,后续应当加快对其作用机制及临床使用安全性等的研究,以推动胭脂素的临床应用。
4 总结与展望胭脂素作为世界上第二大天然色素,受到世界各地研究者关注。目前,胭脂素相关研究主要集中在3个方面:(1) 使用新提取技术或优化提取方式提高胭脂木种子提取物中胭脂素含量,提升提取效率;(2) 解析胭脂素生物合成途径;(3) 研究胭脂素的药理活性及作用机制。然而,这3部分研究仍存在不足:(1) 使用新型提取技术或优化提取方式只能从已有的胭脂木资源中尽可能最大限度获取,并不能从源头上增加胭脂素产量,应当探寻获取资源的新方法。(2) 目前尚未得到确证的胭脂素生物合成途径。现有研究存在两方面问题:一方面已筛选的基因极少进行验证功能,仅通过转录组、表达水平变化预测其功能;另一方面研究内容集中在下游合成途径,催化上游、中游合成途径关键酶的研究较少。(3) 胭脂素的药理活性研究虽多,但尚未有胭脂素成药。因而,欲推动胭脂素资源开发及应用,可开展以下几方面工作。
4.1 胭脂素生物合成途径解析本草基因组学是利用组学技术研究中药基原物种遗传信息及调控网络的学科,其快速发展促进药用植物研究更加深入[28]。胭脂素生物合成途径的完整解析以本草基因组学理论为指导,结合生物信息学技术、植物化学等手段开展。对于已通过转录组、表达序列标签鉴定到的基因可采用基因突变、敲除、液相色谱-质谱联用(HPLC-MS)等进行功能验证,筛选真正有功能的基因。代谢组学技术可用于检测不同器官、不同发育阶段胭脂素含量的动态变化,辅助基因功能验证。有文献报道西红花Crocus sativus、葡萄Vitis vinifera、纹瓣闭鞘姜Costus pictus D. Don中也存在胭脂素[26, 51]。已有研究发现,参与胭脂素合成途径基因与西红花的基因具有较近亲缘关系。因而,可结合文献报道的植物深入研究胭脂素合成途径,促进合成通路解析。不同科属植物中同一代谢产物合成途径的解析也将为自然界物种趋同进化研究提供参考[52]。另外,也可开展催化胭脂素上游、中游合成途径关键酶研究,尽管这两个环节相对保守,但若能挖掘到胭脂素合成途径特有基因或深入研究胭脂素合成过程中显著表达的基因,将促进胭脂素合成通路调控因子发现。
4.2 胭脂素合成生物学研究合成生物学通过微生物细胞重建现有的生物合成路径,获得生产目标产物细胞工厂,实现目标产物规模化生产。目前,已有西红花苷[53]、青蒿酸[54-56]、罗汉果甜苷Ⅴ[57]等多种活性成分通过合成生物学手段实现合成,有效缓解资源紧张问题。生物合成途径的解析能够促进细胞工厂构建,为体外合成奠定基础。因此,一方面应当积极推动胭脂素生物合成途径解析,促进生物合成通路的构建。另一方面,应当对合成途径关键基因的调控作用进行深入研究,如采用二代、三代测序技术联用获得高质量全长转录组数据,挖掘重要调控因子,构成高效基因元器件。结合蛋白质组学技术深入研究非生物胁迫下胭脂素合成通路紧密共表达蛋白作用机制和功能变化,揭示响应机制,有可能发现关键调控因子,提高合成效率。
4.3 胭脂素成药研发胭脂素在食品、化工产业应用相对成熟,在医药方面,尽管有文献记载其使用,也通过细胞、动物实验研究其活性及作用机制,但尚未有成药出现。因此,可通过蛋白质组学技术进一步完善胭脂素的药理研究,寻找作用靶点,阐明作用机制,为胭脂素药物研发提供科学依据,推动其临床使用。同时,若作为药物使用,需重新评估胭脂素的毒性、三致作用(致畸、致癌、致突变) 等指标,保证安全性。
| [1] |
Giuliano G, Rosati C, Bramley PM. To dye or not to dye: biochemistry of annatto unveiled. Trends Biotechnol, 2003, 21(12): 513-516. DOI:10.1016/j.tibtech.2003.10.001
|
| [2] |
Preston HD, Rickard MD. Extraction and chemistry of annatto. Food Chem, 1980, 5(1): 47-56. DOI:10.1016/0308-8146(80)90063-1
|
| [3] |
Shahid-ul-Islam, Rather LJ, Mohammad F. Phytochemistry, biological activities and potential of annatto in natural colorant production for industrial applications——a review. J Adv Res, 2016, 7(3): 499-514. DOI:10.1016/j.jare.2015.11.002
|
| [4] |
Scotter M. The chemistry and analysis of annatto food colouring: a review. Food Addit Contam, 2009, 26(8): 1123-1145. DOI:10.1080/02652030902942873
|
| [5] |
高冉冉, 徐志超, 浦香东, 等. 基于多组学的黄芩活性成分生物合成及合成生物学研究进展. 中国科学: 生命科学, 2020, 51(2): 151-166. Gao RR, Xu ZC, Pu XD, et al. Research progress in biosynthesis and synthetic biology of active ingredients of Scutellaria baicalensis Georgi based on multi-omics approach. Sci Sin Vitae, 2020, 51(2): 151-166 (in Chinese). |
| [6] |
浦香东, 徐志超, 高冉冉, 等. 西红花苷生源途径解析及其合成生物学研究进展. 科学通报, 2021, 66(2): 219-232. Pu XD, Xu ZC, Gao RR, et al. Research progress on biosynthesis and synthetic biology of crocin. Chinese Sci Bull, 2021, 66(2): 219-232 (in Chinese). DOI:10.1360/TB-2020-0875. |
| [7] |
Pacheco TG, De Santana Lopes A, Viana GDM, et al. Genetic, evolutionary and phylogenetic aspects of the plastome of annatto (Bixa orellana L.), the Amazonian commercial species of natural dyes. Planta, 2018, 249(2): 563-582. DOI:10.1007/s00425-018-3023-6
|
| [8] |
Scotter MJ, Thorpe SA, Reynolds SL, et al. Characterization of the principal colouring components of annatto using high performance liquid chromatography with photodiode-array detection. Food Addit Contam, 1994, 11(3): 301-315. DOI:10.1080/02652039409374229
|
| [9] |
Dias VM, Pilla V, Alves LP, et al. Optical characterization in annatto and commercial colorific. J Fluoresc, 2011, 21(1): 415-421. DOI:10.1007/s10895-010-0730-1
|
| [10] |
Carvalho PRN, Da Silva MG, Fabri EG, et al. Bixin and lipids content in annato seeds from collection of the instituto agronômico (IAC). Bragantia, 2010, 69(3): 519-524. DOI:10.1590/S0006-87052010000300002
|
| [11] |
Albuquerque CLC, Meireles MAA. Defatting of annatto seeds using supercritical carbon dioxide as a pretreatment for the production of bixin: experimental, modeling and economic evaluation of the process. J Supercrit Fluid, 2012, 66: 86-95. DOI:10.1016/j.supflu.2012.01.004
|
| [12] |
Alcázar-Alay SC, Osorio-Tobón JF, Forster-Carneiro T, et al. Obtaining bixin from semi-defatted annatto seeds by a mechanical method and solvent extraction: process integration and economic evaluation. Food Res Int, 2017, 99(1): 393-402.
|
| [13] |
Soumya V, Palaniyappan V, Hariprasath KP, et al. Microwave facilitated extraction of bixin from Bixa orellana and it's in-vitro antioxidant activity. Der Pharm Lett, 2010, 2(2): 479-485.
|
| [14] |
Yolmeh M, Najaf MBH, Farhoosh R. Optimisation of ultrasound-assisted extraction of natural pigment from annatto seeds by response surface methodology (RSM). Food Chem, 2014, 155: 319-324. DOI:10.1016/j.foodchem.2014.01.059
|
| [15] |
Quiroz JQ, Torres AC, Ramirez LM, et al. Optimization of the microwave-assisted extraction process of bioactive compounds from annatto seeds (Bixa orellana L.). Antiox, 2019, 8(2): 37. DOI:10.3390/antiox8020037
|
| [16] |
Taham T, Silva DO, Barrozo MAS. Improvement of bixin extraction from annatto seeds using a screen-topped spouted bed. Sep Purif Technol, 2016, 158: 313-321. DOI:10.1016/j.seppur.2015.12.037
|
| [17] |
Jako C, Coutu C, Roewer I, et al. Probing carotenoid biosynthesis in developing seed coats of Bixa orellana (Bixaceae) through expressed sequence tag analysis. Plant Sci, 2002, 163(1): 141-145. DOI:10.1016/S0168-9452(02)00083-3
|
| [18] |
Cárdenas-Conejo Y, Carballo-Uicab V, Lieberman M, et al. De novo transcriptome sequencing in Bixa orellana to identify genes involved in methylerythritol phosphate, carotenoid and bixin biosynthesis. BMC Genomics, 2015, 16: 877. DOI:10.1186/s12864-015-2065-4
|
| [19] |
Bouvier F, Dogbo O, Camara B. Biosynthesis of the food and cosmetic plant pigment bixin (annatto). Science, 2003, 300(5628): 2089-2091. DOI:10.1126/science.1085162
|
| [20] |
Ohmiya A. Carotenoid cleavage dioxygenases and their apocarotenoid products in plants. Plant Biotechnol, 2009, 26(4): 351-358. DOI:10.5511/plantbiotechnology.26.351
|
| [21] |
Vogel JT, Tan BC, McCarty DR, et al. The carotenoid cleavage dioxygenase 1 enzyme has broad substrate specificity, cleaving multiple carotenoids at two different bond positions. J Biol Chem, 2008, 283(17): 11364-11373. DOI:10.1074/jbc.M710106200
|
| [22] |
Rodríguez-Ávila NL, Narváez-Zapata JA, Ramírez-Benítez JE, et al. Identification and expression pattern of a new carotenoid cleavage dioxygenase gene member from Bixa orellana. J Exp Bot, 2011, 62(15): 5385-5395. DOI:10.1093/jxb/err201
|
| [23] |
Soares VLF, Rodrigues SM, De Oliveira TM, et al. Uraveling new genes associated with seed development and metabolism in Bixa orellana L. by expressed sequence tag (EST) analysis. Mol Biol Rep, 2011, 38(2): 1329-1340. DOI:10.1007/s11033-010-0234-8
|
| [24] |
Sankari M, Hemachandran H, Anantharaman A, et al. Identifying a Carotenoid cleavage dioxygenase 4a gene and its efficient agrobacterium-mediated genetic transformation in Bixa orellana L. Appl Biochem Biotechnol, 2016, 179(5): 697-714. DOI:10.1007/s12010-016-2025-8
|
| [25] |
Carballo-Uicab VM, Cárdenas-Conejo Y, Vallejo-Cardona AA, et al. Isolation and functional characterization of two dioxygenases putatively involved in bixin biosynthesis in annatto (Bixa orellana L.). Peer J, 2019, 7(3): 7064.
|
| [26] |
Siva R, Doss FP, Kundu K, et al. Molecular characterization of bixin——an important industrial product. Ind Crop Prod, 2010, 32(1): 48-53. DOI:10.1016/j.indcrop.2010.03.001
|
| [27] |
郑二松, 周洁, 徐如梦, 等. 植物SABATH甲基转移酶家族生物学功能研究进展. 生物技术通讯, 2020, 31(2): 220-226. Zheng ES, Zhou J, Xu RM, et al. Research progress in biological functions of plant SABATH methyltransferases family. Biotechnol Lett, 2020, 31(2): 220-226 (in Chinese). DOI:10.3969/j.issn.1009-0002.2020.02.016 |
| [28] |
Xin TY, Zhang Y, Pu XD, et al. Trends in herbgenomics. Sci China Life Sci, 2019, 62(3): 288-308. DOI:10.1007/s11427-018-9352-7
|
| [29] |
Xu ZC, Xin TY, Bartels D, et al. Genome analysis of the ancient tracheophyte Selaginella tamariscina reveals evolutionary features relevant to the acquisition of desiccation tolerance. Mol Plant, 2018, 11(7): 983-994. DOI:10.1016/j.molp.2018.05.003
|
| [30] |
陈笛, 郭永春, 陈雪津, 等. 红蓝光调控茉莉开花的转录组分析. 生物工程学报, 2020, 36(9): 1869-1886. Chen D, Guo YC, Chen XJ, et al. Transcriptome analysis of flowering regulated by red and blue light in Jasminum sambac. Chin J Biotech, 2020, 36(9): 1869-1886 (in Chinese). |
| [31] |
曹继敏, 李双财, 何德. 镉胁迫后旱柳转录组变化分析. 生物工程学报, 2020, 36(7): 32-39. Cao JM, Li SC, He D. Transcriptome analysis of Saliz matsudana under cadmium stress. Chin J Biotech, 2020, 36(7): 32-39 (in Chinese). |
| [32] |
Sankari M, Hridya H, Sneha P, et al. Effect of UV radiation and its implications on carotenoid pathway in Bixa orellana L. J Photoch Photobiol Biol, 2017, 176: 136-144. DOI:10.1016/j.jphotobiol.2017.10.002
|
| [33] |
Faria DV, De Freitas Correia LN, Souza MVC, et al. Irradiance and light quality affect two annatto (Bixa orellana L.) cultivars with contrasting bixin production. J Photoch Photobiol Biol, 2019, 197: 111549. DOI:10.1016/j.jphotobiol.2019.111549
|
| [34] |
Sankari M, Hridya H, Sneha P, et al. Implication of salt stress induces changes in pigment production, antioxidant enzyme activity, and qRT-PCR expression of genes involved in the biosynthetic pathway of Bixa orellana L. Funct Integr Genomics, 2019, 19(4): 565-574. DOI:10.1007/s10142-019-00654-7
|
| [35] |
Raddatz-Mota D, Pérez-Flores LJ, Carrari F, et al. Achiote (Bixa orellana L.): a natural source of pigment and vitamin E. J Food Sci Technol, 2017, 54(6): 1729-1741. DOI:10.1007/s13197-017-2579-7
|
| [36] |
Mala KS, Rao PP, Prabhavathy MB, et al. Studies on application of annatto (Bixa orellena L.) dye formulations in dairy products. J Food Sci Technol, 2015, 52(2): 912-919. DOI:10.1007/s13197-013-1038-3
|
| [37] |
Kang EJ, Campbell RE, Bastian E, et al. Invited review: annatto usage and bleaching in dairy foods. J Dairy Sci, 2010, 93(9): 3891-3901. DOI:10.3168/jds.2010-3190
|
| [38] |
Cuong TV, Chin KB. Effects of annatto (Bixa orellana L.) seeds powder on physicochemical properties, antioxidant and antimicrobial activities of pork patties during refrigerated storage. Korean J Food Sci Anim Resour, 2016, 36(4): 476-486. DOI:10.5851/kosfa.2016.36.4.476
|
| [39] |
Bautista ARPL, Moreira ELT, Batista MS, et al. Subacute toxicity assessment of annatto in rat. Food Chem Toxicol, 2004, 42(4): 625-629. DOI:10.1016/j.fct.2003.11.007
|
| [40] |
EFSA Panel on Food Additives and Flavourings (EFSA FAF Panel), Younes M, Castle L, et al. Safety of annatto E and the exposure to the annatto colouring principles bixin and norbixin (E 160b) when used as a food additive. EFSA J, 2019, 17(3): e5626.
|
| [41] |
Mikkelsen H, Larsen JC, Tarding F. Hypersensitivity reactions to food colours with special reference to the natural colour annatto extract (butter colour)//Leonard BJ. Toxicological Aspects of Food Safety. Berlin, Heidelberg: Springer, 1978, 1: 141-143.
|
| [42] |
Tao S, Park SL, De La Vega MR, et al. Systemic administration of the apocarotenoid bixin protects skin against solar UV-induced damage through activation of NRF2. Free Rad Bio Med, 2015, 89: 690-700. DOI:10.1016/j.freeradbiomed.2015.08.028
|
| [43] |
Vidhya MS, Rekha VB. Effect of knitted bamboo structures dyed with natural colorants on ultraviolet radiation protection. J Textile Sci Eng, 2012, 2(4): 1000115.
|
| [44] |
Dike IP, Obembe OO, Adebiyi FE. Ethnobotanical survey for potential anti-malarial plants in south-western Nigeria. J Ethnopharmacol, 2012, 144(3): 618-626. DOI:10.1016/j.jep.2012.10.002
|
| [45] |
Rivera-Madrid R, Aguilar-Espinosa M, Cárdenas-Conejo Y, et al. Carotenoid derivates in achiote (Bixa orellana) seeds: synthesis and health promoting properties. Front Plant Sci, 2006, 7: 1406.
|
| [46] |
Xue L, Zhang H, Zhang J, et al. Bixin protects against particle-induced long-term lung injury in an NRF2-dependent manner. Toxicol Res, 2018, 7(2): 258-270. DOI:10.1039/C7TX00304H
|
| [47] |
Zhang H, Xue L, Li BY, et al. Therapeutic potential of bixin in PM2.5 particles-induced lung injury in an Nrf2-dependent manner. Free Radic Biol Med, 2018, 126: 166-176. DOI:10.1016/j.freeradbiomed.2018.08.015
|
| [48] |
Keita H, Dos Santos CBR, Ramos MM, et al. Assessment of the hypoglycemic effect of bixin in alloxan-induced diabetic rats: in vivo and in silico studies. J Biomol Struct Dyn, 2020, 1-12. DOI:10.1080/07391102.2020.1724567
|
| [49] |
Kumar Y, Phaniendra A, Periyasamy L. Bixin triggers apoptosis of human hep3B hepatocellular carcinoma cells: an insight to molecular and in silico approach. Nutr Cancer, 2018, 70(6): 971-983. DOI:10.1080/01635581.2018.1490445
|
| [50] |
De Oliveira Júnior RG, Bonnet A, Braconnier E, et al. Bixin, an apocarotenoid isolated from Bixa orellana L., sensitizes human melanoma cells to dacarbazine-induced apoptosis through ROS-mediated cytotoxicity. Food Chem Toxicol, 2019, 125: 549-561. DOI:10.1016/j.fct.2019.02.013
|
| [51] |
Annadurai RS, Jayakumar V, Mugasimangalam RC, et al. Next generation sequencing and de novo transcriptome analysis of Costus pictus D. Don, a non-model plant with potent anti-diabetic properties. BMC Genomics, 2012, 13: 663. DOI:10.1186/1471-2164-13-663
|
| [52] |
Xu ZC, Pu XD, Gao RR, et al. Tandem gene duplications drive divergent evolution of caffeine and crocin biosynthetic pathways in plants. BMC Biol, 2020, 18: 63. DOI:10.1186/s12915-020-00795-3
|
| [53] |
Pu XD, He CN, Yang Y, et al. In vivo production of five crocins in the engineered Escherichia coli. ACS Synth Biol, 2020, 9(5): 1160-1168. DOI:10.1021/acssynbio.0c00039
|
| [54] |
Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940-943. DOI:10.1038/nature04640
|
| [55] |
Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051
|
| [56] |
曾庆平, 鲍飞. 青蒿素合成生物学及代谢工程研究进展. 科学通报, 2011, 56(27): 2289-2297. Zeng QP, Bao F. Research achievements in the synthetic biology and metabolic engineering of artemisinin. Chin Sci Bull, 2011, 56(27): 2289-2297 (in Chinese). |
| [57] |
孙泽敏, 吕波, 冯永君. 罗汉果甜苷Ⅴ生物合成机制及合成生物学研究进展. 生物工程学报, 2020, 36(10): 1-12. Sun ZM, Lv B, Feng YJ. Research progress on biosynthesis mechanism and synthetic biology of the mogroside Ⅴ. Chin J Biotech, 2020, 36(10): 1-12 (in Chinese). |
 2021, Vol. 37
2021, Vol. 37