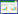中国科学院微生物研究所、中国微生物学会主办
文章信息
- 姜逢霖, 巩婷, 陈晶晶, 陈天娇, 杨金玲, 朱平
- Jiang Fenglin, Gong Ting, Chen Jingjing, Chen Tianjiao, Yang Jinling, Zhu Ping
- 植物来源药用天然产物的合成生物学研究进展
- Synthetic biology of plants-derived medicinal natural products
- 生物工程学报, 2021, 37(6): 1931-1951
- Chinese Journal of Biotechnology, 2021, 37(6): 1931-1951
- 10.13345/j.cjb.210138
-
文章历史
- Received: February 10, 2021
- Accepted: March 28, 2021
- Published: May 26, 2021
植物来源的药用天然产物通常是植物的次级代谢产物,这些次级代谢产物对维持植物基本生命活动并没有重要作用,但可以通过与环境的相互作用来提高植物生存和抵抗外界压力的能力[1]。植物次级代谢产物是动植物之间许多生态相互作用的基础[2],例如,某些萜类化合物可以充当化感物质吸引传粉动物、驱赶食草动物或诱惑食草动物的捕猎者[3-4]。植物之所以能够产生次级代谢产物与其进化过程有关[1, 5]。
植物中具有生物活性的次级代谢产物在药品及保健品领域应用广泛,在香水、农药、化妆品行业也具有重要价值[6]。目前投入临床使用的植物次级代谢产物有抗疟药青蒿素、镇痛药吗啡、抗肿瘤药紫杉醇及治疗心脑血管疾病的药物丹参酮等,它们的药理作用广泛、药效好,临床需求量极大,因此受到了越来越多的关注[7-8]。目前植物来源的药用天然产物主要是通过直接从植物中提取分离获得,但大量栽培药用植物会占用耕地,且有些药用植物具有生长周期长和连作障碍等问题,而且这些天然产物在植物中通常含量较低,提取步骤烦琐,收率低,因此需要开发新的方法生产这些药用天然产物来满足人们日益增长的需求。这些新的生产方法包括化学合成、化学半合成、从植物组织细胞培养中提取和利用微生物细胞工厂异源生产等。大多数天然产物结构复杂,有些具有手性中心,这给化学全合成带来了很大的挑战。虽然部分药用天然产物已经实现化学全合成,但通常由于过程复杂、产率低和成本太高,而不能投入商业生产,而且通过化学方法合成天然产物也会带来环境污染。化学半合成方法是指从植物中提取产量较多的前体化合物,再结合化学合成方法获得天然产物,这也是目前部分植物源药物供应的重要方法。从植物组织细胞培养中提取也是植物来源药物重要的获取方式。迄今为止,已有多种植物组织培养系统被报道,包括愈伤组织、悬浮细胞、不定根和毛状根等,但组织细胞培养生产周期长、操作步骤复杂、成本过高,也不利于扩大生产。目前,科研人员也通过调控植物的次级代谢产物合成途径来提高产量,但是植物代谢途径调控的难度远大于微生物[9]。随着基因组学和蛋白质组学的发展,药用天然产物生物合成途径逐渐被解析,通过合成生物学方法,即利用微生物细胞工厂异源生产天然药物已成为研究热点。微生物繁殖速度快,生长周期短,发酵工艺成熟,且产物易于提取分离,生产成本低,因此通过微生物细胞工厂生产药物被认为是解决药物稀缺问题的可行方法。本文总结了植物来源的药用萜类化合物(人参皂苷、紫杉醇、青蒿素、丹参酮)、生物碱类化合物(长春新碱、吗啡) 及黄酮类化合物(灯盏花素) 的生物合成途径及合成生物学研究进展,介绍了药用植物次级代谢产物合成生物学研究策略,对通过合成生物学技术生产天然药物具有重要的指导意义。
1 萜类化合物生物合成植物次级代谢产物生物合成的起始部分通常是莽草酸途径、糖酵解途径、甲羟戊酸(Mevalonic acid,MVA) 途径等,随后经过各自特定的步骤产生独特的产物。萜类化合物的生物合成通常经历3个阶段:(1) 异戊烯基焦磷酸(Isopentenyl diphosphate,IPP) 及其异构体二甲基烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP) 的生成;(2) 萜类化合物前体牻牛儿基焦磷酸(Geranyl diphosphate,GPP)、法尼基焦磷酸(Farnesyl diphosphate,FPP) 和牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl diphosphate,GGPP)等的生成;(3) 萜类合酶环化及CYP450酶等的修饰。在植物中,有两条途径可以生成IPP和DMAPP,分别是存在于细胞质中的MVA途径和存在于质体中的甲基-赤藓醇-4-磷酸(Methylerythritol phosphate,MEP) 途径[10]。MVA途径中的关键酶是3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy- 3-methylglutaryl coenzyme A reductase,HMGR),MEP途径的关键酶是1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS) 和1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose 5-phosphate reductoisomerase,DXR)。不同数目的IPP和一分子DMAPP在异戊烯基转移酶的催化下形成萜类化合物的前体GPP、FPP和GGPP。其中,牻牛儿基焦磷酸合酶(Geranyl diphosphate synthase,GPPS) 催化一分子IPP和一分子DMAPP形成GPP,作为单萜的前体;两分子IPP和一分子DMAPP在法尼基焦磷酸合酶(Farnesyl diphosphate synthase,FPPS)的催化下生成FPP,作为倍半萜和三萜前体;牻牛儿基牻牛儿基焦磷酸合酶(Geranylgeranyl diphosphate synthase,GGPPS) 催化三分子IPP和一分子DMAPP生成GGPP,作为二萜和四萜的前体(图 1)[11]。GPP、FPP和GGPP通过不同的萜类合酶的催化及细胞色素P450单加氧酶(Cytochrome P450 monooxygenase,CYP450) 的修饰形成多种多样的萜类化合物[12]。本文对几类重要的植物来源的药用萜类化合物的生物合成途径及合成生物学研究进展进行了综述。

|
| 图 1 萜类化合物共同前体的生物合成途径 Fig. 1 Biosynthetic pathways of common precursors of terpenoids. |
| |
人参皂苷是我国传统名贵药材人参Panax ginseng的主要活性成分,它具有广泛的药理活性,在调节免疫力、抗疲劳、抗炎、抗氧化、抗肿瘤、降血糖等方面具有显著的功效[13]。人参皂苷作为药物和保健品深受人们喜爱,市场需求极大,但人参资源稀少,生长周期长(5-7年),人工栽培具有连作障碍,且人参皂苷在人参中的含量较低[14],导致其供应量远远不能满足人们的需求。
人参皂苷属于三萜化合物,其生物合成途径已被解析。以FPP作为直接前体,鲨烯合酶(Squalene synthase,ERG9) 催化两分子的FPP形成鲨烯(Squalene),然后被鲨烯环氧酶(Squalene epoxidase,ERG1) 催化生成2, 3-氧化鲨烯(2, 3-oxidosqualene),2, 3-氧化鲨烯在β-香树脂合酶(β-amyrin synthase,β-AS) 和达玛烯二醇-Ⅱ合酶(Dammarenediol-Ⅱ synthase,DS) 的催化下,分别形成五环三萜β-香树脂(β-amyrin) 和四环三萜达玛烯二醇-Ⅱ (Dammarenediol-Ⅱ,DM)。β-香树脂经齐墩果酸合酶(Oleanolic acid synthase,OAS) 催化生成齐墩果酸(Oleanolic acid),随后经过糖基转移酶的催化生成相应的齐墩果烷型糖苷;DM依次经过原人参二醇合酶(Protopanaxadiol synthase,PPDS) 和原人参三醇合酶(Protopanaxatriol synthase,PPTS) 的催化生成原人参二醇(Protopanaxadiol,PPD)和原人参三醇(Protopanaxatriol,PPT),随后经过UDP-糖基转移酶(UDP-glycosyltransferase,UGT) 的催化形成相应的达玛烷型人参皂苷。PPD型皂苷有Rbl、Rb2、Rc、Rd、F2、Rg3、Rh2等,PPT型皂苷有Re、Rgl、Rg2、Rf、Rhl等(图 2)[15]。
|
| 图 2 人参皂苷生物合成途径 Fig. 2 Biosynthetic pathways of ginsenosides. |
| |
酵母细胞能够产生人参皂苷的关键前体2, 3-氧化鲨烯,这为利用酵母细胞异源生产人参皂苷提供了便利。Dai等在酿酒酵母中引入人参来源的DS、PPDS和拟南芥来源的CYP450还原酶(Cytochrome P450 reductase,CPR) 生产PPD,通过过表达关键酶(tHMGR、FPPS、ERG9等) 提高2, 3-氧化鲨烯前体供应,并对PPDS进行密码子优化以促进其表达,利用两相发酵技术使工程菌中PPD的产量达到1 189 mg/L,同时DM产量达到1 548 mg/L[16]。Dai等通过在酿酒酵母中转入PPD、PPT和齐墩果酸合成所需基因并过表达关键酶,构建的工程菌中PPD、PPT和齐墩果酸的产量分别为17.2 mg/L、15.9 mg/L和21.4 mg/L[17]。在催化过程中,CYP450酶及CYP450还原酶会因低耦合而产生一种代谢副产物活性氧(Reactive oxygen species,ROS),对细胞产生毒性作用,从而影响宿主细胞的正常生长[18-19]。Zhao等通过表达与细胞壁完整性相关的基因SSD1提高了细胞对乙醇的耐受性,且通过调节氧化应激调节基因YBP1的表达降低了ROS的水平,使酿酒酵母工程菌中PPD的产量提高至4.25 g/L[20]。Wang等从人参中克隆并鉴定了两种UDP依赖性的糖基转移酶UGTPg45和UGTPg29,前者使PPD的C3位糖基化生成稀有人参皂苷Rh2,后者可以延长Rh2的糖链而产生稀有人参皂苷Rg3,将两种糖基转移酶引入产PPD的底盘细胞中实现了Rh2和Rg3在酿酒酵母中的合成,产量分别为0.90 mg/g和2.74 mg/g[21]。Zhuang等发现酿酒酵母来源的糖基转移酶UGT51具有杂泛性,可以催化PPD的C3位糖基化生成Rh2,通过对UGT51的关键氨基酸进行突变以提高其催化活性,同时,通过敲除糖基水解酶EGH1基因以减少Rh2的水解,提高糖基供体UDP-葡萄糖(UDPG) 的供应等方法对工程菌进行优化,在5 L发酵罐中Rh2的产量达到300 mg/L[22]。Wang等通过模块化工程,将PPD生物合成基因分为两个模块,包括上游途径模块(ERG10、ERG13、ERG12、ERG8、ERG19、IDI和tHMGR) 和下游模块(ERG1、ERG20、ERG9、DS、PPDS和PgCPR1),将这13个基因进行过表达,构建了高产PPD的酿酒酵母工程菌,使10 L发酵罐中PPD产量达到11.02 g/L。利用上述底盘细胞,构建了产Rh2的工程菌,通过优化启动子、提高基因拷贝数以及对C3位糖基转移酶进行蛋白质工程改造等策略,使工程菌中Rh2的产量达到2.25 g/L[23]。Yan等鉴定了可以催化PPD的C20位糖基化生成Compound K (CK) 的糖基转移酶UGTPg1,并将CK生物合成所需基因转入酿酒酵母,通过优化启动子、过表达tHMGR和转录因子UPC2-1,使CK的产量达到1.4 mg/L[24]。Li等将CK的生物合成基因引入解脂耶氏酵母中,并通过过表达MVA途径关键酶ERG1、ERG8、ERG9、ERG10和tHMGR等,融合表达PPDS及其还原酶,通过补料分批发酵在5 L发酵罐中使CK产量达到161.8 mg/L[25]。Wang等构建了产PPD的酿酒酵母工程菌,其中过表达了MVA途径基因、FPP合酶基因、鲨烯合酶基因、2, 3-氧化角鲨烯合酶基因以及SynPgDDS基因、SynPgPPDS基因和来源于葡萄Vitis vinifera的CPR基因,在此基础上,将三七糖基转移酶Pn3-29和UDPG合成途径关键酶PGM1、PGM2和UGP1整合入酵母基因组中的LPP1位点,构建了产CK的酵母工程菌,又通过高拷贝质粒提高Pn3-29的拷贝数,最终通过高密度发酵在5 L发酵罐中使CK的产量达到1.17 g/L[26]。Wei等发现UGTPg1不仅能催化PPD的C20位羟基糖基化,还可以催化PPT的C20位羟基糖基化生成人参皂苷F1,并证明了UGTPg100可以使PPT的C6位羟基糖基化生成人参皂苷Rh1;他们将PPT生物合成相关基因以及UGTPg1或UGTPg100引入酵母细胞,实现了PPT型人参皂苷F1和Rh1在酿酒酵母中的从头合成[27]。Liang等鉴定了枯草芽孢杆菌的一种糖基转移酶UGT109A1,该酶可以催化DM、PPD、PPT分别生成非天然人参皂苷3β-O-Glc-DM、3β, 20S-Di-O-Glc-DM、3β, 12β-Di-O-Glc-PPD和3β, 12β-Di-O-Glc-PPT。通过在酿酒酵母中引入具有抗肺癌活性的3β, 12β-Di-O-Glc-PPD生物合成所需基因并过表达关键酶tHMGR,使工程菌中3β, 12β-Di-O-Glc-PPD的产量达到9.05 mg/L[28]。Hu等利用人参来源的糖基转移酶PgUGT74AE2和UGTPg1催化DM的C3位和C20位糖基化,生成了具有抗结肠癌活性的非天然人参皂苷3β-O-Glc-DM和20S-O-Glc-DM,并在酿酒酵母中实现了这两种皂苷的从头合成;进一步通过底盘细胞优化、CRISPR/Cas9技术实现外源基因多拷贝整合、过表达上游关键酶及补料分批发酵等方法对工程菌进行优化,最终使3β-O-Glc-DM和20S-O-Glc-DM在3 L发酵罐中的产量分别达到2.4 g/L和5.6 g/L[29]。
1.2 紫杉醇紫杉醇(Paclitaxel,TaxolⓇ) 是一种二萜类化合物,最早于1967年从太平洋红豆杉Taxus brevifolia树干中分离得到[11],具有抗肿瘤、抗瘢痕形成、抗血管生成等多种药理活性,目前临床主要用于治疗卵巢癌和乳腺癌[30]。1979年首次发现紫杉醇的抗肿瘤作用机制,它通过稳定微管的形成,使细胞周期阻滞在G2/M期,最终导致肿瘤细胞凋亡[31]。紫杉醇临床需求极大,但红豆杉中紫杉醇的含量极低,供应严重不足[32]。1994年,两个实验室采用不同的方法几乎同时报道完成了紫杉醇的化学全合成,但是由于其合成过程复杂且产率极低,无法扩大生产[33-36]。当前临床使用的紫杉醇主要通过原植物提取和利用前体化合物——巴卡亭Ⅲ (Baccatin Ⅲ) 或10-去乙酰巴卡亭Ⅲ (10-deacetylbaccatin Ⅲ) 化学半合成的方法获得[11]。
目前紫杉醇的部分生物合成途径已经被解析,其生物合成过程的第一步是GGPP由紫杉烯合酶(Taxadiene synthase,TS) 催化环化为紫杉烯(Taxa-4, 11-diene),TS是紫杉醇合成途径中的第一个关键酶。随后,CYP450酶紫杉烯5α羟化酶(Taxadiene-5α-hydroxylase,T5αH) 催化紫杉烯5位羟基化生成Taxadiene-5α-ol,催化产物可经过紫杉烯醇-5α-乙酰氧基转移酶(Taxadiene- 5α-ol-O-acetyl transferase,TDAT) 和紫杉烯13α羟化酶(Taxadiene-13α-hydroxylase,T13αH) 的催化分别生成Taxadiene-5α-yl-acetate和Taxadiene- 5α-13α-diol。前者经紫杉烯10β羟化酶(Taxadiene- 10β-hydroxylase,T10βH) 的催化生成Taxadiene- 5α-yl-acetate-10β-ol,随后在一系列羟化酶及氧化酶的作用下生成推测的前体2-去苯甲酰紫杉烷(2-debenzoyltaxane),而这些酶尚未被完全鉴定。接着紫杉烷2α-O-苯甲酰基转移酶(Taxane 2α-O-benzoyltransferse,TBT) 催化2-debenzoyltaxane生成10-去乙酰巴卡亭Ⅲ,随后经10-去乙酰巴卡亭Ⅲ 10-O-乙酰转移酶(10-deacetylbaccatin Ⅲ-10- O-acetyltransferse,DBAT) 催化生成巴卡亭Ⅲ,再由巴卡亭Ⅲ-13-O-苯基丙酰基转移酶(Baccatin Ⅲ- 13-O-phenylpropanoyl transferase,BAPT) 催化,在其13位添加侧链,形成β-phenylalanoyl baccatin Ⅲ。其中13位侧链的合成过程为:α-苯丙氨酸(α-phenylalanine) 经苯丙氨酸氨基变位酶(Phenylalanine aminomutase,PAM) 催化形成β-苯丙氨酸(β-phenylalanine),β-苯丙氨酸被一未鉴定的酶催化形成β-苯丙氨酸辅酶A (β-phenylalanine CoA)。合成的侧链在BAPT的作用下连接至巴卡亭Ⅲ的13位上。随后,β-phenylalanoyl baccatin Ⅲ经一未知的CYP450羟化酶催化,将其13位侧链的C2位羟基化,再经过3′-N-脱苯甲酰基-2′-脱氧紫杉醇-N-苯甲酰基转移酶(3′-N-debenzoyl-2′- deoxytaxol-N-benzoyl transferase,DBTNBT) 催化生成紫杉醇(图 3)[37-38]。

|
| 图 3 紫杉醇生物合成途径 Fig. 3 Biosynthetic pathway of paclitaxel. |
| |
Huang等在大肠杆菌中过表达IPP异构酶(Isoprenyl diphosphate isomerase,IDI) 和GGPPS,同时表达TS,实现了紫杉烯在大肠杆菌中的生物合成,产量为1.3 mg/L[39]。Ajikumar等应用一种代谢途径工程的多元模块化方法,将紫杉烯生物合成途径分为两部分:一部分是天然的MEP途径形成IPP和DMAPP;另一部分是下游的萜类合成途径。通过优化平衡两个模块,成功地将工程化大肠杆菌中的紫杉烯产量提高了15 000倍,约1 g/L[40]。Biggs等在大肠杆菌表达氧化紫杉烯合成所需要的基因,通过调整质粒拷贝数及启动子优化CYP450酶的表达,对CPR进行优化以及对膜结合蛋白的N末端进行修饰以提高蛋白表达及可溶性,在2 L发酵罐中工程化大肠杆菌中氧化紫杉烯的产量达到570 mg/L[41]。紫杉醇生物合成途径中涉及多个CYP450酶,真核生物酵母更适合表达膜结合蛋白,为紫杉醇及其中间体的异源生产提供了便利[42]。Engels等在酿酒酵母中引入紫杉烯合成相关基因,并过表达关键酶tHMGR、TS、GGPPS及转录因子UPC2-1,抑制支路基因,表达嗜酸硫杆菌来源的GGPPS,并对TS进行密码子优化,最终获得的酿酒酵母工程菌中紫杉烯产量达到8.7 mg/L。同时紫杉烯前体牻牛儿基牻牛儿醇产量达33.1 mg/L,这也暗示可能可以通过促进前体转化,使紫杉烯的产量进一步提高[43]。Reider等利用CRISPR/Cas9技术建立了一种无克隆的工具盒,可以解决代谢工程中的一些常见问题,比如选择染色体整合位点和启动子,加入蛋白定位、改善稳定性和溶解度的标签等。将该工具盒应用于产紫杉烯工程菌的构建,探索了多种蛋白标签及启动子对TS在酿酒酵母中表达的影响,最终使工程菌中紫杉烯产量达到20 mg/L[44]。Ding等在酿酒酵母中过表达基因ERG20和tHMGR,并引入TS基因,构建了紫杉烯生物合成途径。通过酶-底物分子对接策略分析了6种不同来源的GGPPS与FPP的结合能力,其中南方红豆杉和东北红豆杉杂交种来源的GGPPS在对接分析及体内验证都表现出了最高的活性,最终使工程菌中紫杉烯产量达到72.8 mg/L[45]。红豆杉中7-β-木糖-10-去乙酰紫杉醇(7-β-xylosyl-10-deacetyltaxol,XDT) 及其类似物的含量较高,它可以被生物转化为10-去乙酰紫杉醇(10-deacetyltaxol,DT) 用于紫杉醇的半合成。Cheng等从真菌香菇Lentinula edodes中克隆到一个糖基水解酶LXYL-P1-2,可以水解XDT的木糖基使其转化为DT[46]。Yu等利用转入LXYL-P1-2的毕赤酵母工程菌将XDT转化为DT,转化率达到80%[47]。Liu等通过对反应体系中上述工程菌的量、DMSO的浓度和底物的浓度进行优化,使XDT到DT的转化率提高到93%-95%,同时建立了一种大量纯化产物的方法[48]。Chen等通过蛋白质工程手段进一步提高了该糖基水解酶的活性,并通过共表达透明颤菌血红蛋白VHB和分子伴侣蛋白质二硫键异构酶PDI,提高突变体在毕赤酵母中的表达水平,获得的酵母工程菌可以用于XDT的高效生物催化和紫杉醇半合成[49]。Li等通过丙氨酸扫描、半饱和突变和组合突变的方法获得双突变体DBATG38R/F301V,提高了DBAT对DT的催化效率,并结合LXYL-P1-2,成功构建了从XDT到紫杉醇转化的双酶催化一锅法反应体系,15 h时50 mL体系中紫杉醇产量达到0.64 mg/mL[50]。目前对于利用微生物异源生产紫杉醇还停留在前体的生成阶段,在微生物中从头全合成紫杉醇的研究还依赖于其生物合成途径的进一步解析。
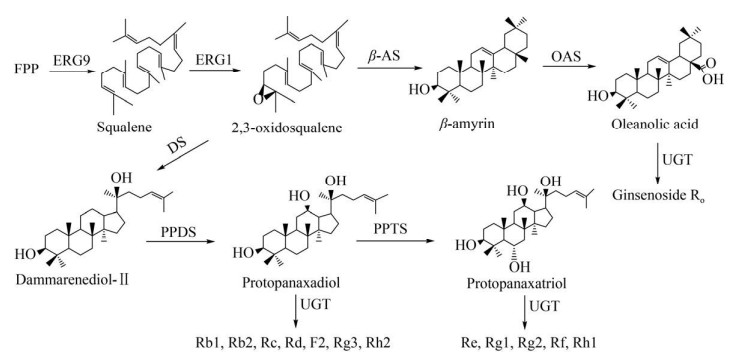
1.3 青蒿素青蒿素(Artemisinin) 是从草本植物黄花蒿Artemisia annua中提取到的倍半萜类化合物,具有显著的抗疟疾活性。在过去的10多年里,以青蒿素为基础的综合疗法(Artemisinin-based combination therapies,ACTs) 降低了全球疟疾的发病率和死亡率,对于青蒿素及其衍生物的研究在国际上掀起了热潮[51]。青蒿素的生物合成途径已经基本解析清楚。作为一种倍半萜类化合物,青蒿素的生物合成属于类异戊二烯途径,FPP是主要的前体化合物。紫穗槐二烯合酶(Amorpha- 4, 11-diene synthase,ADS) 催化FPP环化生成紫穗槐二烯(Amorphadiene),随后,紫穗槐二烯经过三步氧化逐次生成青蒿醇(Artemisinic alcohol)、青蒿醛(Artemisinic aldehyde)、青蒿酸(Artemisinic acid),该步骤由单一的CYP450酶(CYP71AV1)催化完成。目前,商业上以青蒿酸为前体,化学半合成青蒿素来满足市场供应。而天然的青蒿素生物合成是在形成青蒿醛后,被关键酶青蒿醛还原酶(Artemisinic aldehyde reductase,DBR2) 催化,生成双氢青蒿醛(Dihydroartemisinic aldehyde),再由醛脱氢酶(Artemisinic aldehyde dehydrogenase,ALDH1) 催化,生成青蒿素的直接前体双氢青蒿酸(Dihydroartemisinic acid),最后经过一步非酶促的光氧化步骤生成青蒿素。青蒿酸经过光氧化最终生成青蒿素B (图 4)[52]。
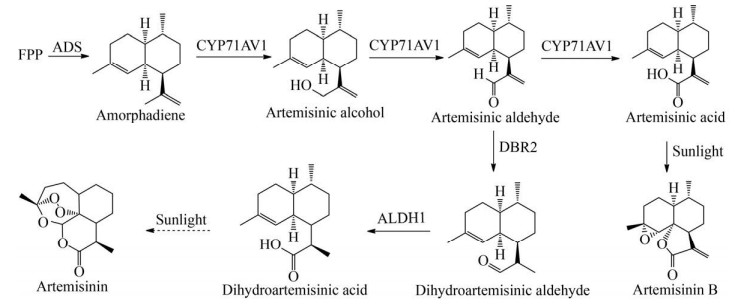
|
| 图 4 青蒿素生物合成途径 Fig. 4 Biosynthetic pathway of artemisinin. |
| |
ATCs疗法价格昂贵,全球对于青蒿素的需求量极大,仅仅依赖从植物中提取不能满足需求。Ro等通过在酿酒酵母中引入ADS、CYP71AV1等青蒿酸生物合成基因,实现了青蒿酸在酿酒酵母中的合成;通过上调MVA途径的基因tHMGR、ERG20、ERG12、ERG8等,使青蒿酸产量提高至100 mg/L;青蒿酸在酵母体内合成后被转运至体外,简化了其纯化步骤[53]。Westfall等在酿酒酵母中过表达了MVA途径的每个基因,与Ro等的结果相比,青蒿酸的产量提高了2倍,紫穗槐二烯的产量提高了10倍。通过对酿酒酵母发酵过程进行优化,包括降低磷酸盐浓度、使用葡萄糖/乙醇混合碳源饲喂等方法,最终使工程菌中青蒿素前体紫穗槐二烯的产量达到40 g/L。同时,该研究探索了紫穗槐二烯化学转化为双氢青蒿酸的方法,双氢青蒿酸可以进一步转化为青蒿素[54]。Paddon等鉴定了两种参与青蒿酸生物合成的酶——植物脱氢酶和细胞色素CYB5,将它们引入产青蒿酸的酿酒酵母中,并且过表达MVA途径相关基因,下调支路途径中ERG9的表达,提高了工程菌中青蒿酸的产量。在此基础上,通过在培养基中加入肉豆蔻酸异丙酯,采用两相发酵,最终使青蒿酸产量达到25 g/L。此外,他们还设计了一种经济高效的化学方法将青蒿酸转化成青蒿素,以此来生产青蒿素,最终总收率达到40%-50%,且纯度高于植物中提取的青蒿素。该方法在一定程度上可以稳定青蒿素的供应,具有重要的应用价值[55]。
1.4 丹参酮丹参酮(Tanshinones) 是一类松香烷二萜化合物,来源于传统中药材丹参Salvia miltiorrhiza,主要存在于丹参的根茎中。丹参酮是丹参酮ⅡA、丹参酮ⅡB、丹参酮Ⅰ、隐丹参酮等一类化合物的总称,目前临床上主要用于治疗心血管疾病。另外,丹参酮还具有抗菌消炎、抗氧化、抗肿瘤、抗心肌缺氧等药理活性[56-58]。目前丹参酮主要从植物丹参中提取,但丹参生长周期长,丹参酮提取步骤复杂,因而影响了对它的进一步开发[59]。
与其他萜类化合物一样,丹参酮的前体IPP和DMAPP来源于两条代谢途径,即MVA途径和MEP途径,其中MEP途径被认为是丹参酮C5前体的主要来源[60]。二萜合酶一般为双功能酶,如紫杉醇生物合成途径中的紫杉烯合酶,可以将GGPP直接催化为二萜烯,即紫杉烯。而丹参酮的前体GGPP先经科巴基焦磷酸合酶(Copalyl diphosphate synthase,CPS) 的催化生成科巴基焦磷酸(Copalyl diphosphate,CPP),然后CPP在类贝壳杉烯合酶(Kaurene synthase-like,KSL) 的催化下生成次丹参酮二烯(Miltiradiene),需要经过两步反应。次丹参酮二烯后续再经过杂环化、芳香化、去甲基化等形成相应的丹参酮类化合物。CYP76AH1是丹参酮生物合成下游途径中一个非常重要的酶,催化次丹参酮二烯生成铁锈醇(Ferruginol)。Guo等鉴定了两个参与丹参酮生物合成的CYP450酶CYP76AH3和CYP76AK1,两者均具有一定的底物宽泛性。其中,CYP76AH3催化铁锈醇生成11-羟基铁锈醇(11-hydroxy ferruginol)、柳杉酚(Sugiol) 和11-羟基柳杉酚(11-hydroxy sugiol),CYP76AK1催化11-羟基铁锈醇和11-羟基柳杉酚生成11, 20-二羟基铁锈醇(11, 20-dihydroxy ferruginol) 和11, 20-二羟基柳杉酚(11, 20-dihydroxy sugiol),随后经过未知酶的催化生成丹参酮类化合物(图 5)[61]。

|
| 图 5 丹参酮生物合成途径 Fig. 5 Biosynthetic pathways of tanshinones. |
| |
Zhou等通过使用模块化途径工程(Modular pathway engineering,MOPE) 方法在酿酒酵母中组装了次丹参酮二烯的合成途径,并预测和分析了CPS和KSL之间的分子相互作用,构建了CPS和KSL融合蛋白,使它们的活性位点紧密相邻,同时将GGPPS和ERG20融合,最终使次丹参酮二烯产量提高至365 mg/L[62]。Dai等过表达FPPS和内源性GGPPS的融合蛋白以及来源于嗜酸硫杆菌的异源GGPPS基因,增加流向FPP和GGPP的碳流量,同时过表达基因tHMGR-UPC2.1,再通过补料分批培养使次丹参酮二烯的产量提高至488 mg/L[63]。Hu等通过构建高产GGPP的底盘细胞,筛选并利用来源于毛喉鞘蕊花的基因CfTPS1和来源于丹参的基因SmKSL1以提高次丹参酮二烯的产量,又通过融合CfTPS1和SmKSL1及蛋白截短的蛋白质工程策略进一步提高了次丹参酮二烯的产量,最终其摇瓶水平产量达到550.7 mg/L,5 L发酵罐水平产量达到3.5 g/L[64]。Guo等鉴定了次丹参酮二烯转化为铁锈醇所需的酶CYP76AH1,并利用酿酒酵母异源表达丹参酮生物合成途径中所需要的酶,构建了产铁锈醇的酵母工程菌,产量为10.5 mg/L[65]。随后,他们又鉴定了两个CYP450酶CYP76AH3和CYP76AK1,并实现了其在酿酒酵母中的异源表达,获得了相应的氧化丹参酮中间体[61]。目前为止,后续丹参酮生物合成过程中涉及的基因还未被鉴定,据推测可能涉及CYP450酶、脱氢酶及其他酶[66]。只有完成对丹参酮生物合成途径的完全解析,才能通过合成生物学技术实现丹参酮的大量生产。
2 生物碱类化合物生物合成生物碱类化合物在自然界中广泛存在,是一类含氮的碱性有机物。目前已知的生物碱约有12 000种[67],按照结构可以分为有机胺类生物碱、异喹啉类生物碱、吡啶类生物碱、吲哚类生物碱和莨菪烷类生物碱等。生物碱的化学结构复杂多样,用于医药领域已经有上千年的历史,但是对于生物碱类化合物的生物合成、调节和转运的了解相对较少[68]。目前对于抗肿瘤药长春新碱(Vincristine) (吲哚类生物碱) 及镇痛药吗啡(Morphine) (异喹啉类生物碱) 生物合成途径的研究有了一定的进展,基于合成生物学在微生物中合成这两类生物碱的技术也得到了广泛的研究。
2.1 长春新碱药用、观赏植物长春花Catharanthus roseus可以产生大量次级代谢产物,大多属于萜类生物碱。迄今为止,已经从长春花中分离和鉴定了130多种萜类吲哚生物碱(Terpenoid indole alkaloids,TIAs),主要包括单萜类阿玛碱、文多灵(Vindoline),二氢吲哚类的长春质碱(Catharanthine)、蛇根碱以及二萜类长春碱(Vinblastine)、长春新碱等[69-71]。其中长春新碱是著名的抗肿瘤药物,临床上用于治疗恶性淋巴瘤、何杰金氏病、急性淋巴细胞性白血病等;阿玛碱和蛇根碱具有降血压及抗神经性炎症的作用[70-72]。长春新碱在长春花中的含量非常低,商业化生产通常使用含量较高的长春质碱和文多灵进行化学半合成。长春花生物碱药用价值大,但在植物中含量较低,生产成本高,这促进了科学家们对长春花中TIAs合成的基本途径和调控机制的研究。
TIAs的生物合成途径分为上游和下游两个阶段。上游阶段有两条途径,分别是莽草酸途径(又称为吲哚途径) 和类甲羟戊酸途径(又称类萜途径)。前者经过一系列酶促反应生成色氨酸,然后经过色氨酸脱羧酶(Tryptophan decarboxylase,TDC) 的催化生成色胺(Tryptamine);后者产生的GPP在多步酶催化后产生裂环马钱子苷(Secologanin)。色胺和裂环马钱子苷再由异胡豆苷合酶(Strictosidine synthase,STR) 催化缩合产生异胡豆苷(Strictosidine)。STR是TIAs生物合成过程中的第一个非常关键的酶。下游阶段则以异胡豆苷为底物,经过不同的酶催化生成相应的终产物。
异胡豆苷经异胡豆苷-β-D-葡萄糖苷酶(Strictosidine-β-D-glucosidase,SGD) 催化生成异胡豆苷苷元(Strictosidine aglycone),异胡豆苷苷元可自发生成4, 21-脱氢缝籽木榛(4, 21-dehydrogeissoschizine),然后经缝籽木榛合酶(Geissoschizine synthase,GS) 催化后生成缝籽木榛(19E-geissoschizine),催化产物经过多步氧化还原催化生成花冠木碱(Stemmadenine),随后经花冠木碱-O-酰基转移酶(Stemmadenine O-acetyltransferase,SAT) 催化生成O-乙酰基花冠木碱(O-acetylstemmadenine),在O-乙酰基花冠木碱氧化酶(O-acetylstemmadenine oxidase,ASO)、GS、长春质碱合酶(Catharanthine synthase,CS) 及水甘草碱合酶(Tabersonine synthase,TabS) 的催化下分别生成长春质碱和水甘草碱(Tabersonine)[73]。Caputi等证明Precondylocarpine acetate synthase (PAS) 和Dihydroprecondylocarpine synthase (DPAS) 两个酶也参与了异胡豆苷合成长春质碱及水甘草碱的过程,其中前者与ASO一致,后者属于一种不同的类肉桂醇脱氢酶[74]。文多灵的生物合成途径如下:异胡豆苷通过一系列反应生成水甘草碱,随后被其羟化酶(Tabersonine 16-hydroxylase,T16H) 催化生成16-羟基水甘草碱(16-hydroxytabersonine),然后在16-O-甲基转移酶(16-O-methyhransferase,16OMT) 的作用下生成16-甲氧基水甘草碱,16-甲氧基水甘草碱在水甘草碱-3-氧化酶(Tabersonine-3-oxygenase,T3O) 和水甘草碱-3-还原酶(Tabersonine-3-reductase,T3R) 的共同作用下生成16-甲氧基-2, 3-二氢-3-羟基水甘草碱(16-methoxy-2, 3-dihydro-3-hydroxytabersonine),随后经过N-甲基转移酶(N-methyhransferase,NMT)、去乙酰氧基文多灵羟化酶(Deacetoxyvindoline-4-hydroxylase,D4H) 和去乙酰文多灵-4-O-乙酰转移酶(Deacetylvindoline- 4-O-acetyhransferase,DAT) 的催化,依次生成去乙酰氧基文多灵、乙酰文多灵及终产物文多灵[75]。单萜类生物碱长春质碱和文多灵经过过氧化物酶α-3', 4'-脱水长春碱合酶(Peroxidase α-3′, 4′-anhydrovinblastine synthase,PRX1) 的催化缩合生成3′, 4′-脱水长春碱(3′, 4′-anhydrovinblastine,AVLB)[76],随后经过未知酶的催化依次生成长春碱和长春新碱(图 6)。

|
| 图 6 长春新碱生物合成途径[参考文献] Fig. 6 Biosynthetic pathway of vincristine. |
| |
Geerlings等将长春花STR和SGD基因转入酿酒酵母中,加入外源的色胺和裂环马钱子苷后,首次实现异胡豆苷和Cathenamine在酿酒酵母中的合成,异胡豆苷大部分存在于培养基中,其产量为2 g/L,Cathenamine的产生量则较少(< 10 μg/g湿重)[77]。Brown等实现了异胡豆苷在酿酒酵母体内的从头合成,通过敲除旁路代谢的3个基因ERG20、ATF1和OYE2,表达15种植物来源的基因(AgGPPS2、GES、G8H、GOR、ISY、IO、7-DLGT、7-DLH、LAMT、SLS、TDC、STR、CYB5、CPR和CYPADH)、1个动物来源的基因(禽类FPPS:mFPSN144W) 和过表达酵母自身的5个基因(tHMGR、MAF1、IDI1、SAM2和ZWF1),最终使工程菌中异胡豆苷产量达到0.5 mg/L,这为TIAs在酿酒酵母中的合成奠定了基础[78]。Campbell等综合一系列策略优化了TIAs生物合成的前期步骤,包括过表达酿酒酵母MVA途径相关基因以及植物来源的合成荆芥内酯的基因(GES、G10H、CPR等),突变ERG20基因以减少向FPP的流量等,使工程菌中异胡豆苷前体牻牛儿醇的产量达到11.4 mg/L[79]。Qu等鉴定了T3O和T3R,并且将水甘草碱合成文多灵所需的7个酶在酿酒酵母中异源表达,实现了文多灵在酵母中的异源合成[80]。
2.2 吗啡吗啡属于苄基异喹啉类生物碱(Benzylisoquinoline alkaloids,BIAs),来自罂粟科植物罂粟Papaver somniferum,是用于治疗中、重度和慢性疼痛最有效的麻醉镇痛药[81]。目前,对吗啡等阿片类生物碱的需求量极大,每年需要种植约100 000 hm2的罂粟,生产800 t以上的阿片类化合物(主要是吗啡和蒂巴因) 才能满足合法的医疗和科研需求[82]。
吗啡的生物合成是从L-酪氨酸衍生物多巴胺(Dopamine) 和4-羟苯乙酯(4-hydroxyphenylaceta1dehyde,4-HPAA) 起始,二者由去甲乌药碱合酶(S-norcoclaurine synthase,NCS) 催化缩合生成(S)-去甲乌药碱(S-norcolaurine)。随后(S)-去甲乌药碱依次被去甲乌药碱6-O-甲基转移酶(Norcoclaurine 6-O-methyltransferase,6OMT)、乌药碱N-甲基转移酶(Coclaurine N-methyltransferase,CNMT)、N-甲基乌药碱羟化酶(N-methylcoclaurine hydroxylase,NMCH)、3′-羟基-N-甲基乌药碱-4′-O-甲基转移酶(3′-hydroxy-N-methylcoclaurine 4′-O-methyltransferase,4′OMT) 催化生成(S)-乌药碱(S-coclaurine)、(S)-N-去甲乌药碱(S-N-methlcolaurine)、(S)-3′-羟基-N-甲基乌药碱(S-3′-hydroxy-N-methlcolaurine)、(S)-牛心果碱(S-reticuline)。(S)-牛心果碱不能被后续的酶识别,而是需要异构化为(R)-牛心果碱(R-reticuline),该反应首先由脱氢牛心果碱合酶(1, 2-dehydroreticuline synthase,DRS) 催化(S)-牛心果碱生成1, 2-脱氢牛心果碱,随后被脱氢牛心果碱还原酶(1, 2-dehydroreticuline reductase,DRR) 催化生成(R)-牛心果碱。DRS和DRR属于一种P450氧化还原融合蛋白[83]。(R)-牛心果碱被沙罗泰里啶合酶(Salutaridine synthase,SalSyn)催化生成沙罗泰里啶(Salutaridine),再由沙罗泰里啶还原酶(Salutaridine reductase,SalR) 催化生成氢化沙罗泰里啶,催化产物随后被沙罗泰里啶乙酰基转移酶(Salutaridinol 7-O-acetyltransferase,SalAT) 催化,生成氢化沙罗泰里啶-7-O-乙酸(Salutaridinol-7-O-acetate)。氢化沙罗泰里啶-7-O-乙酸经过自发反应脱去乙酰氧基生成蒂巴因(Thebaine)。蒂巴因是植物中可待因和吗啡生物合成的前体,也是止痛药羟考酮、丁丙诺啡化学合成的前体。由蒂巴因转化为吗啡有两条途径:第一条是蒂巴因被可待因-O-脱甲基酶(Codeine-O-demethylase,CODM) 催化生成奥派文(Oripavine),再由蒂巴因-6-O-甲基转移酶(Thebaine 6-O-demethylase,T6ODM) 催化生成新吗啡酮(Neomorphinone)[84],新吗啡酮在尼奥平酮异构酶(Neopinone isomerase,NISO) 的催化下生成吗啡酮(Morphinone),吗啡酮在可待因还原酶(Codeinone reductase,COR) 的催化下生成吗啡,该步骤为NADPH依赖性的可逆反应;第二条途径是主要途径,蒂巴因在T6ODM的催化下生成尼奥平酮(Neopinone),随后由NISO催化生成可待因酮(Codeinone),再由COR和CODM催化依次生成可待因(Codeine) 和吗啡(图 7)。尼奥平酮异构化为可待因酮及新吗啡酮异构化为吗啡酮的步骤在之前一直被认为是自发反应,直到2019年,Dastmalchi等发现该过程实际上是由NISO催化而发生的[85]。

|
| 图 7 吗啡生物合成途径 Fig. 7 Biosynthetic pathway of morphine. |
| |
目前主要通过从植物中提取吗啡类生物碱来满足需求,也正在开发其他的微生物生产系统来生产吗啡及其他BIAs。牛心果碱是BIAs生物合成的重要中间体。Hawkins等在酿酒酵母工程菌中外源加入底物构建了牛心果碱及后续的BIAs (血根碱和小檗碱) 的生物合成途径[86]。Nakagawa等通过分步发酵的方法构建了产牛心果碱的大肠杆菌工程菌,产量达到48.0 mg/L,高于酵母工程菌的产量[87]。Thodey等证明了酿酒酵母可以实现由蒂巴因生产包括吗啡、可待因、氢吗啡酮、羟考酮等一系列的BIAs,并通过调节基因拷贝数、提高底物供应、均衡表达COR和CODM等功能酶以及定位表达COR于内质网等方法提高了吗啡及其他阿片类生物碱的产量,总产量可达131 mg/L[88]。Fossati等在酿酒酵母中构建了由(R)-牛心果碱生成可待因和吗啡的生物合成途径,他们将SalSyn、SalR和SalAT基因在酿酒酵母中共表达,同时优化了发酵液pH值,使氢化沙罗泰里啶-7-O-乙酸到蒂巴因的自发重排反应更容易进行,最终通过共表达7个基因及饲喂底物(R)-牛心果碱实现了可待因和吗啡的生物合成[81]。随着DRS和DRR的鉴定,解析了(S)-牛心果碱到(R)-牛心果碱的合成途径。Galanie等在酵母中实现了阿片类化合物的从头生物合成,在这个过程中利用了来自植物、哺乳动物、细菌及酵母本身的20多个基因,在酿酒酵母工程菌中产生了蒂巴因和氢可酮,产量分别为6.4 μg/L和0.3 μg/L[82]。
3 黄酮类化合物生物合成黄酮类化合物广泛存在于高等植物中,具有C6-C3-C6的基本骨架,化学结构多样。目前已知的黄酮类化合物约9 000种,按照结构可分为黄酮类、异黄酮类、黄酮醇类、二氢黄酮类和花色素类等[89]。黄酮类化合物通常以糖苷的形式存在,多为O-糖苷,也有C-糖苷,它们具有多种多样的生物学功能,如调节植物生长、保护植物免受紫外线损伤、信号转导等[90]。同时,黄酮类化合物也具有多种药理活性,如治疗高血压、糖尿病、冠心病、心绞痛等。黄酮类化合物的生物合成近年来报道较多[91-93],尤其是灯盏花素的生物合成研究取得了较大的进展。
灯盏花Erigeron breviscapus是中国传统药材,黄酮类化合物灯盏花素是其有效成分。灯盏花素主要包括灯盏花乙素(Scutellarin),还有少量的灯盏花甲素(芹菜素-7-O-葡糖醛酸苷,apigenin-7-O-glucuronide) 等[94-95]。灯盏花素具有扩张血管、抑制血小板聚集、降低血粘度、促进血液循环等药理作用,临床上广泛用于治疗心脑血管疾病。灯盏花素临床需求极大,从植物中提取不能满足市场需求,需要开发新的方法补充市场供应,因此应用合成生物学技术生产灯盏花素得到了广泛的研究。
灯盏花素的生物合成途径已基本被解析清楚。L-苯丙氨酸(L-phenylalanine) 是莽草酸途径(植物初级代谢途径) 的产物,它在苯丙氨酸解氨酶(Phenylalanine ammonia lyase,PAL) 的催化下生成肉桂酸(Cinnamic acid)。随后依次经过肉桂酸-4-羟化酶(Cinnamate 4-hydroxylase, C4H)、4-香豆酸CoA连接酶(4-coumaroyl-CoA ligase,4CL)、查尔酮合成酶(Chalcone synthase,CHS)和查尔酮异构酶(Chalcone isomerase,CHI) 的催化生成p-香豆酸(p-coumaric acid)、香豆酰辅酶A (Coumaroyl-CoA)、柚皮苷查尔酮(Naringenin chalcone) 和柚皮苷(Naringenin)。p-香豆酸也可由酪氨酸解氨酶(Tyrosine ammonia lyase,TAL)催化酪氨酸(Tyrosine) 直接生成。黄酮合酶Ⅱ (Flavone synthase Ⅱ,FSⅡ) 催化柚皮苷生成芹菜素(Apigenin),芹菜素经过黄酮6-羟化酶(Flavone-6-hydroxylase,F6H) 和类黄酮7-O-葡糖醛酸转移酶(Flavonoid-7-O-glucuronosyltransferase,F7GAT) 的催化生成灯盏花乙素(图 8)[95-96]。
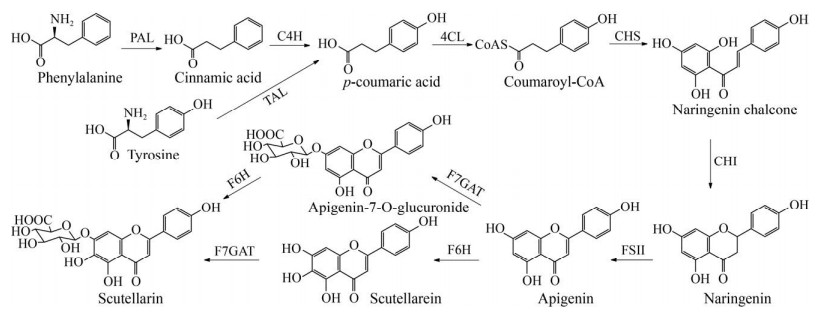
|
| 图 8 灯盏花素生物合成途径 Fig. 8 Biosynthetic pathway of breviscapine. |
| |
Watts等将红球菌来源的TAL基因、拟南芥来源的4CL和CHS基因转入大肠杆菌,在大肠杆菌中合成了柚皮苷,产量达到20.8 mg/L[97]。Koopman等将拟南芥来源的柚皮苷合成所需基因转入酿酒酵母中,构建产柚皮苷的酿酒酵母工程菌。通过下调基因Aro3和Aro4减轻反馈抑制作用,敲除基因Aro10、Pdc5和Pdc6以减少副产物生成等方法,提高酿酒酵母底盘细胞中芳香族氨基酸的产量,同时增加CHS的拷贝数、引入荚膜红细菌来源的TAL,使摇瓶水平柚皮苷的产量与对照相比提高了40倍,2 L发酵罐水平柚皮苷产量达到112.9 mg/L[98]。Wu等开发了一种CRISPR-dCas9干扰系统,通过干扰三羧酸循环、糖酵解等过程相关基因(fumC、sucC和adhE) 以及脂肪酸合成相关基因(fabF和fabB) 的表达,增加乙酰辅酶A的供应,工程菌中柚皮苷的产量达到421.6 mg/L[99]。Miyahisa等在大肠杆菌中表达基因PAL、CHS、4CL和香菇来源的CHI,实现了芹菜素在大肠杆菌中的生物合成,产量为13 mg/L[100]。Thuan等将拟南芥来源的糖基转移酶AGT引入大肠杆菌中,加入外源的芹菜素,通过补料分批发酵获得芹菜素-7-O-葡糖醛酸苷,产量为39.28 mg/L[101]。Liu等从灯盏花基因组中鉴定了灯盏花素生物合成途径中的两个关键酶F7GAT和F6H,将它们与芹菜素合成所需酶基因共同转入酿酒酵母底盘细胞中,获得了产灯盏花素的酿酒酵母工程菌。为提高工程菌中灯盏花素的产量,他们敲除基因MLS1和CIT2降低乙酰辅酶A的消耗,过表达基因ALD6、ADH2和ACSSEL641P增加乙酰辅酶A的供应,并优化工程菌的发酵条件,在3 L发酵罐中灯盏花乙素和芹菜素-7-O-葡糖醛酸苷的产量分别达到108 mg/L和185 mg/L[95]。
4 总结与展望合成生物学的发展实现了利用微生物生产有价值的天然产物,也有效地克服了植物次级代谢产物大规模生产的障碍。最近几十年,利用基因工程改造微生物使其生产植物来源药用天然产物取得了巨大进步,这些进步主要是通过目标化合物生物合成途径的解析及其微生物细胞工厂的建立而实现的[102]。
随着先进的生物信息学工具、DNA测序、蛋白质工程、代谢途径优化和尖端发酵技术的开发,药用天然产物的工业化生产技术快速发展[103]。通过对微生物细胞工厂的优化可以显著提高目标化合物的产量,主要的优化方法如下:(1) 适度提高基因拷贝数可以提高目标化合物产量。基因拷贝数与目标化合物产量并不完全呈正相关,过度增加基因的拷贝数可能会增加细胞生理负担,从而影响细胞生长而使目标化合物产量降低[29]。(2) 采用宿主偏爱的密码子,避免使用稀有密码子,提高酶异源表达水平,从而提高目标化合物产量。Shao等将3-类固醇脱氢酶进行了密码子优化,提高了其在枯草芽孢杆菌中的酶活性,与未优化时相比提高了7倍,达到12.3 U/mg[104]。(3) 通过灵活应用强或弱启动子以及不同启动子的组合来调整代谢通量,可以提高目标化合物的产量。Liu等通过重置关键基因的启动子来优化糖酵解和芳香族氨基酸生物合成中的碳分布,并引入一种磷酸酮醇酶(PHK) 途径,构建了一株高产芳香族氨基酸p-HCA的酿酒酵母菌株,其产量高达12.5 g/L[105]。(4) 过表达途径酶、表达转录因子、通过敲除或者反义RNA技术下调支路代谢等方法使代谢通量更多地流向目标化合物。(5) 调整化合物生物合成过程中代谢酶复合物的空间亚细胞位置。Farhi等在酿酒酵母中引入线粒体靶向的FPPS和ADS基因,结合截短的HMG1基因,将紫穗槐二烯的产量提高了20倍[106]。Thodey等将吗啡生物合成基因COR定位到内质网,与对照组相比(2.5 mg/L),吗啡产量提高到3.1 mg/L[88]。(6) 微生物培养条件的优化对于提高目标化合物产量进而扩大生产也至关重要,如培养基pH值、温度控制、前体饲喂、添加诱导剂等[54, 107-108]。
通过合成生物学技术利用微生物大量生产药用天然产物虽然已经取得了很大的进展,但仍有一些关键问题需要进一步探索:(1) 对药用天然产物生物合成途径的解析是构建微生物细胞工厂的重要前提。传统的技术,如RT-PCR、RNAi、RACE、VIGS等通常耗时费力[109],而测序技术、组学的发展以及蛋白底物对接、蛋白垂钓等新方法新技术的出现,促进了生物合成途径中新基因的发现,特别是下游途径关键基因的鉴定,如CYP450酶、糖基转移酶等[102, 110]。(2) 在微生物中引入大量外源基因会导致代谢不平衡以及中间体积累,从而影响细胞生长及目标化合物产量。通过对基因表达进行调整以及动态调节策略可以优化细胞生长和产物合成之间的平衡[111]。(3) 选择合适的宿主细胞十分关键。在选择宿主之前应考虑很多因素,所选宿主细胞的基因组序列最好已知,宿主细胞最好能够产生目标化合物的前体等[89],用于生产药品或食品添加剂时还要考虑宿主细胞的安全性。(4) 生产成本是利用微生物细胞工厂大规模生产药用天然产物的主要障碍,可以通过使用更加经济的原料、提高工程化宿主细胞的鲁棒性等来降低成本。(5) 在宿主细胞中表达基因簇或来源于不同物种的多个基因的组合来实现目标化合物的合成,并且可以通过具有明确功能的异源酶的组合扩展目标化合物的天然合成途径。(6) 新的分子生物学工具以及合成生物学技术的开发与应用可以为微生物细胞工厂的构建及优化提供便利[97]。用于基因组挖掘的计算工具的开发可以加速基因的发现,用于工程菌培养的生物反应器的开发也将有利于扩大培养规模和提高产物回收效率。
相比于传统的植物提取、化学合成等生产方式,利用合成生物学技术通过微生物细胞工厂生产药用天然产物具有不受外界环境影响、生长速度快、遗传操作简单、易于大规模培养以及环境友好等多种优势。随着分子生物学以及生物信息学的发展,对宿主细胞的改造及生物合成基因表达调控将越来越容易,越来越多的药用天然产物将会通过微生物细胞工厂实现大量生产。
| [1] |
Kennedy DO, Wightman EL. Herbal extracts and phytochemicals: plant secondary metabolites and the enhancement of human brain function. Adv Nutr, 2011, 2(1): 32-50. DOI:10.3945/an.110.000117
|
| [2] |
Rasmann S, Köllner TG, Degenhardt J, et al. Recruitment of entomopathogenic Nematodes by insect-damaged maize roots. Nature, 2005, 434(7034): 732-737. DOI:10.1038/nature03451
|
| [3] |
Reymond P, Weber H, Damond M, et al. Differential gene expression in response to mechanical wounding and insect feeding in Arabidopsis. Plant Cell, 2000, 12(5): 707-720. DOI:10.1105/tpc.12.5.707
|
| [4] |
Gershenzon J, Dudareva N. The function of terpene natural products in the natural world. Nat Chem Biol, 2007, 3(7): 408-414. DOI:10.1038/nchembio.2007.5
|
| [5] |
Wink M. Modes of action of herbal medicines and plant secondary metabolites. Medicines (Basel), 2015, 2(3): 251-286.
|
| [6] |
Srivastava S, Srivastava AK. Hairy root culture for mass-production of high-value secondary metabolites. Crit Rev Biotechnol, 2007, 27(1): 29-43. DOI:10.1080/07388550601173918
|
| [7] |
Oh SH, Lee BH. A ginseng saponin metabolite-induced apoptosis in HepG2 cells involves a mitochondria-mediated pathway and its downstream caspase-8 activation and Bid cleavage. Toxicol Appl Pharmacol, 2004, 194(3): 221-229. DOI:10.1016/j.taap.2003.09.011
|
| [8] |
Yadav S, Singh M, Singh SN, et al. Tanshinone ⅡA pretreatment promotes cell survival in human lung epithelial cells under hypoxia via AP-1-Nrf2 transcription factor. Cell Stress Chaperones, 2020, 25(3): 427-440. DOI:10.1007/s12192-020-01083-3
|
| [9] |
Tatsis EC, O'Connor SE. New developments in engineering plant metabolic pathways. Curr Opin Biotechnol, 2016, 42: 126-132. DOI:10.1016/j.copbio.2016.04.012
|
| [10] |
Liao P, Hemmerlin A, Bach TJ, et al. The potential of the mevalonate pathway for enhanced isoprenoid production. Biotechnol Adv, 2016, 34(5): 697-713. DOI:10.1016/j.biotechadv.2016.03.005
|
| [11] |
Li Y, Zhang G, Pfeifer BA. Current and emerging options for taxol production. Adv Biochem Eng Biotechnol, 2015, 148: 405-425.
|
| [12] |
时敏, 王瑶, 周伟, 等. 药用植物萜类化合物的生物合成与代谢调控研究进展. 中国科学: 生命科学, 2018, 48(4): 352-364. Shi M, Wang Y, Zhou W, et al. Research progress in terms of the biosynthesis and regulation of terpenoids from medicinal plants. Sci Sin Vitae, 2018, 48(4): 352-364 (in Chinese). |
| [13] |
Yang JL, Gao LL, Zhu P. Advances in the biosynthesis research of ginsenosides. Acta Pharm Sin, 2013, 48(2): 170-178.
|
| [14] |
Sivakumar G, Yu KW, Paek KY. Production of biomass and ginsenosides from adventitious roots of Panax ginseng in bioreactor cultures. Eng Life Sci, 2005, 5(4): 333-342. DOI:10.1002/elsc.200520085
|
| [15] |
Kim YJ, Zhang DB, Yang DC. Biosynthesis and biotechnological production of ginsenosides. Biotechnol Adv, 2015, 33(6): 717-735. DOI:10.1016/j.biotechadv.2015.03.001
|
| [16] |
Dai Z, Liu Y, Zhang X, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides. Metab Eng, 2013, 20: 146-156. DOI:10.1016/j.ymben.2013.10.004
|
| [17] |
Dai Z, Wang B, Liu Y, et al. Producing aglycons of ginsenosides in bakers' yeast. Sci Rep, 2014, 4: 3698.
|
| [18] |
Zhao F, Bai P, Liu T, et al. Optimization of a cytochrome P450 oxidation system for enhancing protopanaxadiol production in Saccharomyces cerevisiae. Biotechnol Bioeng, 2016, 113(8): 1787-1795. DOI:10.1002/bit.25934
|
| [19] |
Winterbourn CC. Reconciling the chemistry and biology of reactive oxygen species. Nat Chem Biol, 2008, 4(5): 278-286. DOI:10.1038/nchembio.85
|
| [20] |
Zhao F, Du Y, Bai P, et al. Enhancing Saccharomyces cerevisiae reactive oxygen species and ethanol stress tolerance for high-level production of protopanoxadiol. Bioresour Technol, 2017, 227: 308-316. DOI:10.1016/j.biortech.2016.12.061
|
| [21] |
Wang P, Wei Y, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts. Metab Eng, 2015, 29: 97-105. DOI:10.1016/j.ymben.2015.03.003
|
| [22] |
Zhuang Y, Yang GY, Chen X, et al. Biosynthesis of plant-derived ginsenoside Rh2 in yeast via repurposing a key promiscuous microbial enzyme. Metab Eng, 2017, 42: 25-32. DOI:10.1016/j.ymben.2017.04.009
|
| [23] |
Wang P, Wei W, Ye W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency. Cell Discov, 2019, 5: 5. DOI:10.1038/s41421-018-0075-5
|
| [24] |
Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast. Cell Res, 2014, 24(6): 770-773. DOI:10.1038/cr.2014.28
|
| [25] |
Li D, Wu Y, Zhang C, et al. Production of triterpene ginsenoside compound K in the non-conventional yeast Yarrowia lipolytica. J Agric Food Chem, 2019, 67(9): 2581-2588. DOI:10.1021/acs.jafc.9b00009
|
| [26] |
Wang D, Wang J, Shi Y, et al. Elucidation of the complete biosynthetic pathway of the main triterpene glycosylation products of Panax notoginseng using a synthetic biology platform. Metab Eng, 2020, 61: 131-140. DOI:10.1016/j.ymben.2020.05.007
|
| [27] |
Wei W, Wang P, Wei Y, et al. Characterization of Panax ginseng UDP-glycosyltransferases catalyzing protopanaxatriol and biosyntheses of bioactive ginsenosides F1 and Rh1 in metabolically engineered yeasts. Mol Plant, 2015, 8(9): 1412-1424. DOI:10.1016/j.molp.2015.05.010
|
| [28] |
Liang H, Hu Z, Zhang T, et al. Production of a bioactive unnatural ginsenoside by metabolically engineered yeasts based on a new UDP-glycosyltransferase from Bacillus subtilis. Metab Eng, 2017, 44: 60-69. DOI:10.1016/j.ymben.2017.07.008
|
| [29] |
Hu ZF, Gu AD, Liang L, et al. Construction and optimization of microbial cell factories for sustainable production of bioactive dammarenediol-Ⅱ glucosides. Green Chem, 2019, 21(12): 3286-3299. DOI:10.1039/C8GC04066D
|
| [30] |
孔建强, 王伟, 朱平, 等. 紫杉醇生物合成的研究进展. 药学学报, 2007, 42(4): 358-365. Kong JQ, Wang W, Zhu P, et al. Recent advances in the biosynthesis of taxol. Acta Pharm Sin, 2007, 42(4): 358-365 (in Chinese). DOI:10.3321/j.issn:0513-4870.2007.04.003 |
| [31] |
Tabata H. Paclitaxel production by plant-cell- culture technology. Adv Biochem Eng Biotechnol, 2004, 87: 1-23.
|
| [32] |
Malik S, Cusidó RM, Mirjalili MH, et al. Production of the anticancer drug taxol in Taxus baccata suspension cultures: a review. Process Biochem, 2011, 46(1): 23-34. DOI:10.1016/j.procbio.2010.09.004
|
| [33] |
Holton RA, Somoza C, Kim HB, et al. First total synthesis of taxol. 1. Functionalization of the B ring. J Am Chem Soc, 1994, 116(4): 1597-1598. DOI:10.1021/ja00083a066
|
| [34] |
Holton RA, Kim HB, Somoza C, et al. First total synthesis of taxol. 2. Completion of the C and D rings. J Am Chem Soc, 1994, 116(4): 1599-1600. DOI:10.1021/ja00083a067
|
| [35] |
Nicolaou KC, Yang Z, Liu JJ, et al. Total synthesis of taxol. Nature, 1994, 367(6464): 630-634. DOI:10.1038/367630a0
|
| [36] |
Hezari M, Croteau R. Taxol biosynthesis: an update. Planta Med, 1997, 63(4): 291-295. DOI:10.1055/s-2006-957684
|
| [37] |
Howat S, Park B, Oh IS, et al. Paclitaxel: biosynthesis, production and future prospects. N Biotechnol, 2014, 31(3): 242-245. DOI:10.1016/j.nbt.2014.02.010
|
| [38] |
Nazhand A, Durazzo A, Lucarini M, et al. Rewiring cellular metabolism for heterologous biosynthesis of Taxol. Nat Prod Res, 2020, 34(1): 110-121. DOI:10.1080/14786419.2019.1630122
|
| [39] |
Huang Q, Roessner CA, Croteau R, et al. Engineering Escherichia coli for the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol. Bioorg Med Chem, 2001, 9(9): 2237-2242. DOI:10.1016/S0968-0896(01)00072-4
|
| [40] |
Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-74. DOI:10.1126/science.1191652
|
| [41] |
Biggs BW, Lim CG, Sagliani K, et al. Overcoming heterologous protein interdependency to optimize P450-mediated taxol precursor synthesis in Escherichia coli. Proc Natl Acad Sci USA, 2016, 113(12): 3209-3214. DOI:10.1073/pnas.1515826113
|
| [42] |
Gruchattka E, Hädicke O, Klamt S, et al. In silico profiling of Escherichia coli and Saccharomyces cerevisiae as terpenoid factories. Microb Cell Fact, 2013, 12(1): 84. DOI:10.1186/1475-2859-12-84
|
| [43] |
Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards taxol (Paclitaxel) production. Metab Eng, 2008, 10(3/4): 201-206.
|
| [44] |
Reider Apel A, d'Espaux L, Wehrs M, et al. A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae. Nucleic Acids Res, 2017, 45(1): 496-508. DOI:10.1093/nar/gkw1023
|
| [45] |
Ding MZ, Yan HF, Li LF, et al. Biosynthesis of taxadiene in Saccharomyces cerevisiae: selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy. PLoS ONE, 2014, 9(10): e109348(10): 1122-1132.
|
| [46] |
Cheng HL, Zhao RY, Chen TJ, et al. Cloning and characterization of the glycoside hydrolases that remove xylosyl groups from 7-β-xylosyl-10- deacetyltaxol and its analogues. Mol Cell Proteomics, 2013, 12(8): 2236-2248. DOI:10.1074/mcp.M113.030619
|
| [47] |
Yu WB, Liang X, Zhu P. High-cell-density fermentation and pilot-scale biocatalytic studies of an engineered yeast expressing the heterologous glycoside hydrolase of 7-β-xylosyltaxanes. J Ind Microbiol Biotechnol, 2013, 40(1): 133-140. DOI:10.1007/s10295-012-1212-z
|
| [48] |
Liu WC, Zhu P. Pilot studies on scale-up biocatalysis of 7-β-xylosyl-10-deacetyltaxol and its analogues by an engineered yeast. J Ind Microbiol Biotechnol, 2015, 42(6): 867-876. DOI:10.1007/s10295-015-1617-6
|
| [49] |
Chen JJ, Liang X, Wang F, et al. Combinatorial mutation on the β-glycosidase specific to 7-β-xylosyltaxanes and increasing the mutated enzyme production by engineering the recombinant yeast. Acta Pharm Sin B, 2019, 9(3): 626-638. DOI:10.1016/j.apsb.2018.11.003
|
| [50] |
Li BJ, Wang H, Gong T, et al. Improving 10-deacetylbaccatin Ⅲ-10-β-O-acetyltransferase catalytic fitness for Taxol production. Nat Commun, 2017, 8(1): 15544. DOI:10.1038/ncomms15544
|
| [51] |
Badshah SL, Ullah A, Ahmad N, et al. Increasing the strength and production of artemisinin and its derivatives. Molecules, 2018, 23(1): E100. DOI:10.3390/molecules23010100
|
| [52] |
Tang KX, Shen Q, Yan TX, et al. Transgenic approach to increase artemisinin content in Artemisia annua L. Plant Cell Rep, 2014, 33(4): 605-615. DOI:10.1007/s00299-014-1566-y
|
| [53] |
Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086): 940-943. DOI:10.1038/nature04640
|
| [54] |
Westfall PJ, Pitera DJ, Lenihan JR, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proc Natl Acad Sci USA, 2012, 109(3): E111-118. DOI:10.1073/pnas.1110740109
|
| [55] |
Paddon CJ, Westfall PJ, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051
|
| [56] |
Zhou YY, Sun W, Chen JF, et al. SmMYC2a and SmMYC2b played similar but irreplaceable roles in regulating the biosynthesis of tanshinones and phenolic acids in Salvia miltiorrhiza. Sci Rep, 2016, 6(1): 22852. DOI:10.1038/srep22852
|
| [57] |
Zhou LM, Zuo Z, Chow MS. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics, and clinical use. J Clin Pharmacol, 2005, 45(12): 1345-1359. DOI:10.1177/0091270005282630
|
| [58] |
Wei T, Gao YH, Deng KJ, et al. Enhancement of tanshinone production in Salvia miltiorrhiza hairy root cultures by metabolic engineering. Plant Methods, 2019, 15(1): 53. DOI:10.1186/s13007-019-0439-3
|
| [59] |
Ding K, Pei T, Bai Z, et al. SmMYB36, a novel R2R3-MYB transcription factor, enhances tanshinone accumulation and decreases phenolic acid content in Salvia miltiorrhiza hairy roots. Sci Rep, 2017, 7(1): 5104. DOI:10.1038/s41598-017-04909-w
|
| [60] |
Yang DF, Du XH, Liang X, et al. Different roles of the mevalonate and methylerythritol phosphate pathways in cell growth and tanshinone production of Salvia miltiorrhiza hairy roots. PLoS ONE, 2012, 7(11): e46797. DOI:10.1371/journal.pone.0046797
|
| [61] |
Guo J, Ma XH, Cai Y, et al. Cytochrome P450 promiscuity leads to a bifurcating biosynthetic pathway for tanshinones. New Phytol, 2016, 210(2): 525-534. DOI:10.1111/nph.13790
|
| [62] |
Zhou YJ, Gao W, Rong Q, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. J Am Chem Soc, 2012, 134(6): 3234-3241. DOI:10.1021/ja2114486
|
| [63] |
Dai ZB, Liu Y, Huang LQ, et al. Production of miltiradiene by metabolically engineered Saccharomyces cerevisiae. Biotechnol Bioeng, 2012, 109(11): 2845-2853. DOI:10.1002/bit.24547
|
| [64] |
Hu TY, Zhou JW, Tong YR, et al. Engineering chimeric diterpene synthases and isoprenoid biosynthetic pathways enables high-level production of miltiradiene in yeast. Metab Eng, 2020, 60: 87-96. DOI:10.1016/j.ymben.2020.03.011
|
| [65] |
Guo J, Zhou YJ, Hillwig ML, et al. CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts. Proc Natl Acad Sci USA, 2013, 110(29): 12108-12113. DOI:10.1073/pnas.1218061110
|
| [66] |
Chang YJ, Wang MZ, Li J, et al. Transcriptomic analysis reveals potential genes involved in tanshinone biosynthesis in Salvia miltiorrhiza. Sci Rep, 2019, 9(1): 14929. DOI:10.1038/s41598-019-51535-9
|
| [67] |
Facchini PJ, Bohlmann J, Covello PS, et al. Synthetic biosystems for the production of high-value plant metabolites. Trends Biotechnol, 2012, 30(3): 127-131. DOI:10.1016/j.tibtech.2011.10.001
|
| [68] |
Glenn WS, Runguphan W, O'Connor SE. Recent progress in the metabolic engineering of alkaloids in plant systems. Curr Opin Biotechnol, 2013, 24(2): 354-365. DOI:10.1016/j.copbio.2012.08.003
|
| [69] |
van Der Heijden R, Jacobs DI, Snoeijer W, et al. The Catharanthus alkaloids: pharmacognosy and biotechnology. Curr Med Chem, 2004, 11(5): 607-628. DOI:10.2174/0929867043455846
|
| [70] |
Rischer H, Oresic M, Seppänen-Laakso T, et al. Gene-to-metabolite networks for terpenoid indole alkaloid biosynthesis in Catharanthus roseus cells. Proc Natl Acad Sci USA, 2006, 103(14): 5614-5619. DOI:10.1073/pnas.0601027103
|
| [71] |
Verma P, Mathur AK, Srivastava A, et al. Emerging trends in research on spatial and temporal organization of terpenoid indole alkaloid pathway in Catharanthus roseus: a literature update. Protoplasma, 2012, 249(2): 255-268. DOI:10.1007/s00709-011-0291-4
|
| [72] |
Chen QH, Zhang WP, Zhang YL, et al. Identification and quantification of active alkaloids in Catharanthus roseus by liquid chromatography-ion trap mass spectrometry. Food Chem, 2013, 139(1/2/3/4): 845-852.
|
| [73] |
Qu Y, Safonova O, De Luca V. Completion of the canonical pathway for assembly of anticancer drugs vincristine/vinblastine in Catharanthus roseus. Plant J, 2019, 97(2): 257-266. DOI:10.1111/tpj.14111
|
| [74] |
Caputi L, Franke J, Farrow SC, et al. Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle. Science, 2018, 360(6394): 1235-1239. DOI:10.1126/science.aat4100
|
| [75] |
Liu JQ, Cai JJ, Wang R, et al. Transcriptional regulation and transport of terpenoid indole alkaloid in Catharanthus roseus: exploration of new research directions. Int J Mol Sci, 2016, 18(1): E53. DOI:10.3390/ijms18010053
|
| [76] |
Costa MMR, Hilliou F, Duarte P, et al. Molecular cloning and characterization of a vacuolar class Ⅲ peroxidase involved in the metabolism of anticancer alkaloids in Catharanthus roseus. Plant Physiol, 2008, 146(2): 403-417. DOI:10.1104/pp.107.107060
|
| [77] |
Geerlings A, Redondo FJ, Contin A, et al. Biotransformation of tryptamine and secologanin into plant terpenoid indole alkaloids by transgenic yeast. Appl Microbiol Biotechnol, 2001, 56(3/4): 420-424.
|
| [78] |
Brown S, Clastre M, Courdavault V, et al. De novo production of the plant-derived alkaloid strictosidine in yeast. Proc Natl Acad Sci USA, 2015, 112(11): 3205-3210. DOI:10.1073/pnas.1423555112
|
| [79] |
Campbell A, Bauchart P, Gold ND, et al. Engineering of a nepetalactol-producing platform strain of Saccharomyces cerevisiae for the production of plant seco-iridoids. ACS Synth Biol, 2016, 5(5): 405-414. DOI:10.1021/acssynbio.5b00289
|
| [80] |
Qu Y, Easson ML, Froese J, et al. Completion of the seven-step pathway from tabersonine to the anticancer drug precursor vindoline and its assembly in yeast. Proc Natl Acad Sci USA, 2015, 112(19): 6224-6229. DOI:10.1073/pnas.1501821112
|
| [81] |
Fossati E, Narcross L, Ekins A, et al. Synthesis of morphinan alkaloids in Saccharomyces cerevisiae. PLoS ONE, 2015, 10(4): e0124459. DOI:10.1371/journal.pone.0124459
|
| [82] |
Galanie S, Thodey K, Trenchard IJ, et al. Complete biosynthesis of opioids in yeast. Science, 2015, 349(6252): 1095-1100. DOI:10.1126/science.aac9373
|
| [83] |
Winzer T, Kern M, King AJ, et al. Morphinan biosynthesis in opium poppy requires a P450-oxidoreductase fusion protein. Science, 2015, 349(6245): 309-312. DOI:10.1126/science.aab1852
|
| [84] |
Hagel JM, Facchini PJ. Dioxygenases catalyze the O-demethylation steps of morphine biosynthesis in opium poppy. Nat Chem Biol, 2010, 6(4): 273-275. DOI:10.1038/nchembio.317
|
| [85] |
Dastmalchi M, Chen X, Hagel JM, et al. Neopinone isomerase is involved in codeine and morphine biosynthesis in opium poppy. Nat Chem Biol, 2019, 15(4): 384-390. DOI:10.1038/s41589-019-0247-0
|
| [86] |
Hawkins KM, Smolke CD. Production of benzylisoquinoline alkaloids in Saccharomyces cerevisiae. Nat Chem Biol, 2008, 4(9): 564-573. DOI:10.1038/nchembio.105
|
| [87] |
Nakagawa A, Matsuzaki C, Matsumura E, et al. (R, S)-tetrahydropapaveroline production by stepwise fermentation using engineered Escherichia coli. Sci Rep, 2014, 4(1): 6695.
|
| [88] |
Thodey K, Galanie S, Smolke CD. A microbial biomanufacturing platform for natural and semisynthetic opioids. Nat Chem Biol, 2014, 10(10): 837-844. DOI:10.1038/nchembio.1613
|
| [89] |
Ferrer JL, Austin MB, Stewart C, et al. Structure and function of enzymes involved in the biosynthesis of phenylpropanoids. Plant Physiol Biochem, 2008, 46(3): 356-370. DOI:10.1016/j.plaphy.2007.12.009
|
| [90] |
方从兵, 宛晓春, 江昌俊. 黄酮类化合物生物合成的研究进展. 安徽农业大学学报, 2005(4): 498-504. Fang CB, Wan XC, Jiang CJ. Research progress on biosynthesis of flavonoids. J Anhui Agric Univ, 2005(4): 498-504 (in Chinese). |
| [91] |
Trantas E, Panopoulos N, Ververidis F. Metabolic engineering of the complete pathway leading to heterologous biosynthesis of various flavonoids and stilbenoids in Saccharomyces cerevisiae. Metab Eng, 2009, 11(6): 355-366. DOI:10.1016/j.ymben.2009.07.004
|
| [92] |
Zhu S, Wu J, Du G, et al. Efficient synthesis of eriodictyol from L-tyrosine in Escherichia coli. Appl Environ Microbiol, 2014, 80(10): 3072-3080. DOI:10.1128/AEM.03986-13
|
| [93] |
Shah FLA, Ramzi AB, Baharum SN, et al. Recent advancement of engineering microbial hosts for the biotechnological production of flavonoids. Mol Biol Rep, 2019, 46(6): 6647-6659. DOI:10.1007/s11033-019-05066-1
|
| [94] |
Qu J, Wang YM, Luo GA, et al. Identification and determination of glucuronides and their aglycones in Erigeron breviscapus by liquid chromatography- tandem mass spectrometry. J Chromatogr A, 2001, 928(2): 155-162. DOI:10.1016/S0021-9673(01)01111-6
|
| [95] |
Liu XN, Cheng J, Zhang GH, et al. Engineering yeast for the production of breviscapine by genomic analysis and synthetic biology approaches. Nat Commun, 2018, 9(1): 448. DOI:10.1038/s41467-018-02883-z
|
| [96] |
Pandey RP, Parajuli P, Koffas MAG, et al. Microbial production of natural and non-natural flavonoids: pathway engineering, directed evolution and systems/synthetic biology. Biotechnol Adv, 2016, 34(5): 634-662. DOI:10.1016/j.biotechadv.2016.02.012
|
| [97] |
Watts KT, Lee PC, Schmidt-Dannert C. Exploring recombinant flavonoid biosynthesis in metabolically engineered Escherichia coli. Chembiochem, 2004, 5(4): 500-507. DOI:10.1002/cbic.200300783
|
| [98] |
Koopman F, Beekwilder J, Crimi B, et al. De novo production of the flavonoid naringenin in engineered Saccharomyces cerevisiae. Microb Cell Fact, 2012, 11: 155. DOI:10.1186/1475-2859-11-155
|
| [99] |
Wu J, Du G, Chen J, et al. Enhancing flavonoid production by systematically tuning the central metabolic pathways based on a CRISPR interference system in Escherichia coli. Sci Rep, 2015, 5(1): 13477. DOI:10.1038/srep13477
|
| [100] |
Miyahisa I, Funa N, Ohnishi Y, et al. Combinatorial biosynthesis of flavones and flavonols in Escherichia coli. Appl Microbiol Biotechnol, 2006, 71(1): 53-58. DOI:10.1007/s00253-005-0116-5
|
| [101] |
Thuan NH, Park JW, Sohng JK. Toward the production of flavone-7-O-β-D-glucopyranosides using Arabidopsis glycosyltransferase in Escherichia coli. Process Biochem, 2013, 48(11): 1744-1748. DOI:10.1016/j.procbio.2013.07.005
|
| [102] |
Madhavan A, Arun KB, Sindhu R, et al. Tailoring of microbes for the production of high value plant-derived compounds: from pathway engineering to fermentative production. Biochim Biophys Acta Proteins Proteom, 2019, 1867(11): 140262. DOI:10.1016/j.bbapap.2019.140262
|
| [103] |
Lee JW, Na D, Park JM, et al. Systems metabolic engineering of microorganisms for natural and non-natural chemicals. Nat Chem Biol, 2012, 8(6): 536-546. DOI:10.1038/nchembio.970
|
| [104] |
Shao M, Sha Z, Zhang X, et al. Efficient androst-1, 4-diene-3, 17-dione production by co-expressing 3-ketosteroid-Δ1-dehydrogenase and catalase in Bacillus subtilis. J Appl Microbiol, 2017, 122(1): 119-128. DOI:10.1111/jam.13336
|
| [105] |
Liu QL, Yu T, Li XW, et al. Rewiring carbon metabolism in yeast for high level production of aromatic chemicals. Nat Commun, 2019, 10(1): 4976. DOI:10.1038/s41467-019-12961-5
|
| [106] |
Farhi M, Marhevka E, Masci T, et al. Harnessing yeast subcellular compartments for the production of plant terpenoids. Metab Eng, 2011, 13(5): 474-481. DOI:10.1016/j.ymben.2011.05.001
|
| [107] |
Cheigh CI, Choi HJ, Park H, et al. Influence of growth conditions on the production of a nisin-like bacteriocin by Lactococcus lactis subsp. lactis A164 isolated from kimchi. J Biotechnol, 2002, 95(3): 225-235. DOI:10.1016/S0168-1656(02)00010-X
|
| [108] |
Sassi H, Delvigne F, Kar T, et al. Deciphering how LIP2 and POX2 promoters can optimally regulate recombinant protein production in the yeast Yarrowia lipolytica. Microb Cell Fact, 2016, 15(1): 159. DOI:10.1186/s12934-016-0558-8
|
| [109] |
Liu XN, Ding WT, Jiang HF. Engineering microbial cell factories for the production of plant natural products: from design principles to industrial-scale production. Microb Cell Fact, 2017, 16(1): 125. DOI:10.1186/s12934-017-0732-7
|
| [110] |
Dai ZB, Liu Y, Guo J, et al. Yeast synthetic biology for high-value metabolites. FEMS Yeast Res, 2015, 15(1): 1-11. DOI:10.1093/femsyr/fou003
|
| [111] |
Xu XH, Li XL, Liu YF, et al. Pyruvate-responsive genetic circuits for dynamic control of central metabolism. Nat Chem Biol, 2020, 16(11): 1261-1268. DOI:10.1038/s41589-020-0637-3
|
 2021, Vol. 37
2021, Vol. 37