中国科学院微生物研究所、中国微生物学会主办
文章信息
- 柳晓东, 朱海珍, 姜民志, 武学军, 姜成英, 刘双江
- Liu Xiaodong, Zhu Haizhen, Jiang Minzhi, Wu Xuejun, Jiang Chengying, Liu Shuang-Jiang
- 北京龙形水系三种沉水植物根际及叶际微生物群落特征
- Characteristics of the rhizosphere and phyllosphere microbial community of three submerged plants in the dragon-shaped water system of Beijing
- 生物工程学报, 2021, 37(10): 3663-3674
- Chinese Journal of Biotechnology, 2021, 37(10): 3663-3674
- 10.13345/j.cjb.210415
-
文章历史
- Received: June 21, 2021
- Accepted: August 12, 2021
2. 延安大学 生命科学学院,陕西 延安 716000;
3. 山东大学 微生物技术国家重点实验室,山东 青岛 266237;
4. 北京爱尔斯环保工程有限责任公司,北京 100101
2. School of Life Sciences, Yan'an University, Yan'an 716000, Shaanxi, China;
3. State Key Laboratory of Microbial Technology, Shandong University, Qingdao 266237, Shandong, China;
4. I & Earth Ecology Environment Co., Ltd, Beijing 100101, China
龙形水系是北京奥林匹克公园核心景观之一,其南北长约2.7 km,东西宽为25–150 m,总面积约为16.5万m2,是亚洲最大的人工水系[1]。龙形水系水源主要为北小河再生水厂的高品质中水,另有日常降水、绿地汇流及备用水源等。龙形水系不仅承担了体现“绿色奥运、科技奥运、人文奥运”三大理念的功能,也兼具人工湿地对中水进行再次净化的作用,即进一步降低中水中的氮磷含量,减少下游水体富营养化程度[2]。水生植物在人工湿地系统中扮演重要角色,不仅提升了水体观赏性,而且发挥了重要的生态功能[3]。水生植物具有提高氧含量、促进氮循环、吸附沉积物、抑制藻类和富集微生物等作用。在水生植物尤其是沉水植物的茎叶上能够富集大量微生物,这些微生物的生长代谢同样能够促进水体中无机氮磷向有机氮磷转化,进而提升水体的自净能力[4]。
水生植物及其表面附着的微生物构成了水体自净能力的主要组成部分,对维持水体营养平衡及生态平衡具有重要作用。水生植物不仅可以通过茎叶光合作用产生氧气,使水生植物根叶部分在水体中形成一个富氧环境,而且能够通过茎叶及根系分泌物富集部分对有机物及无机氮具有较强代谢能力的微生物类群;而微生物通过代谢作用为水生植物提供二氧化碳和一些次级代谢产物,甚至抑制部分有害微生物的生长,进而促进水生植物的生长[5-6]。因此水生植物与其表面附着微生物的相互作用,是提高水体自净能力的重要因素。
在人工湿地系统中,往往需要搭配种植不同的水生植物种类,以较好地维持水体生态平衡。不同水生植物在维持水生生物多样性、预防大面积植物病害等方面具有重要作用。有研究表明,多种植物组合的水体净化效果往往要高于单一植物[7]。植物组合对水体净化效果的提高,除了植物本身因素外,植物表面富集的微生物也起到十分重要的作用。尽管对人工湿地植物本身已有较多的研究,但缺乏对植物表面附着微生物的研究,人工湿地构建及污染水体修复仍有诸多问题需要解决[5]。
本研究以龙形水系及其中的3种沉水植物为研究对象,通过高通量测序技术,对水体及植物叶际微生物、底泥及植物根际微生物群落结构及潜在功能进行研究,旨在解析3种沉水植物表面微生物区系特征,增加对沉水植物表面微生物群落的了解,为人工湿地系统构建过程中不同植物的搭配提供指导。
1 材料与方法 1.1 材料龙形水系位于北京北四环路至科荟路之间,自南向北由人为或者道路隔断分为A–I共9个区域,各区域相对独立并有地下涵洞相连(图 1A)。水样、无植物底泥样品及植物样品(苦草Vallisneria natans、狐尾藻Myriophyllum verticillatum、龙须眼子菜Potamogeton pectinatus)采自F区(图 1C),采样时间为2017年5月中旬。采样点共3个,其中西岸2个,东岸1个,呈三角形分布,采样点离岸边2 m左右(图 1B)。样品采集方法如下:首先使用无菌采样瓶采集水体样品1 L;然后使用铁铲在每个样点采集3种植物各3–5株,将采集出水的植物小心清理,尽量保证根系的完整;在植物采集点附近选择无植物区域,采集底泥约1 kg。各个样点分别采集水样、底泥样品、植物样品3份,将各样品置于无菌采样袋并放入冰盒中,立即运回实验室进行后续处理。各样点不同水体、底泥及植物各3份样品分别混合后作为该样点的代表样品,用于后续高通量测序。各样品编号见表 1。
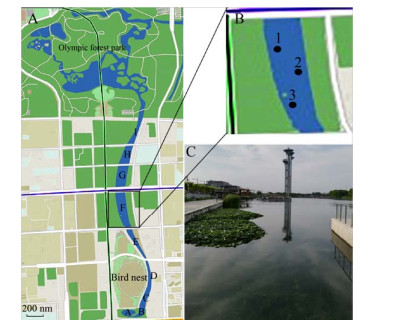
|
| 图 1 龙形水系平面图(A) 及F区采样位点分布(B) 及景观(C) Fig. 1 The geographic map of the dragon-shaped water system (A), the sampling sites (B), and the landscape (C) of section F. |
| |
| Sample ID | Sample description | Sample ID | Sample description |
| FS | Sediment sample of F section | FHR | Rhizosphere sample of M. verticillatum in F section |
| FW | Water sample of F section | FHL | Phyllosphere sample of M. verticillatum in F section |
| FKR | Rhizosphere sample of V. natans in F section | FLR | Rhizosphere sample of P. pectinatus in F section |
| FKL | Phyllosphere sample of V. natans in F section | FLL | Phyllosphere sample of P. pectinatus in F section |
植物样品首先在超净工作台中使用无菌剪刀进行根茎分离,然后根和茎叶样品分别用无菌水漂洗1遍,然后放入含有250 mL无菌磷酸盐缓冲液(Phosphate buffered saline,PBS) 缓冲液(pH 7.0) 的三角瓶中,进行超声处理(超声波清洗仪,功率400 W,超声1 min,振荡30 s,5个循环)。超声处理后用无菌镊子取出植物样品,使用孔径0.22 μm的无菌滤膜对剩余液体进行抽滤,然后使用无菌剪刀将滤膜剪碎,用DNA提取试剂盒(OMEGA Soil DNA Kit) 提取滤膜DNA用于高通量测序,提取步骤按照试剂盒说明操作。
水体样品直接使用孔径0.22 μm的无菌滤膜进行抽滤,然后使用DNA提取试剂盒提取滤膜上的微生物DNA用于高通量测序。
底泥样品首先去掉其中的植物根叶残渣及石子等大颗粒,然后称取0.5 g底泥样品使用DNA提取试剂盒进行DNA提取。
1.3 高通量测序DNA样品送至北京博奥汇玖生物科技有限公司进行测序分析,高通量测序选取16S rRNA基因V4–V5区进行测序,长度为412 bp。选用的正向引物为515FB:5′-GTGYCAGCMGCCGCG GTAA-3′,反向引物为926R:5′-CCGYCAATTYM TTTRAGTTT-3′。使用KAPA HiFi Hot Start Kit (KAPA Biosystems,USA) 对提取的DNA产物进行扩增,程序如下:95 ℃ 180 s,98 ℃ 20 s,55 ℃ 15 s,72 ℃ 15 s,25个循环;72 ℃ 1 min。PCR产物经过凝胶电泳检测后,回收440 bp左右的片段用于高通量测序。高通量测序平台为Illumina HiSeq 2500。测序完成后的原始数据首先使用Mothur软件[8]按照默认参数进行处理,经过质控、去嵌合体、组装、抽平过程后,获得的序列以97%相似性生成OTU (Operational taxonomic units) 表格,然后使用SILVA细菌16S rRNA数据库进行比对[9],获得各序列的分类学地位。
1.4 数据分析使用Mothur软件计算各样品细菌群落的α-多样性指数,包括Ace、Observed OUT和Shannon指数。通过R软件使用Tax4Fun进行功能预测[10-11]。PCoA分析、LEfSe分析使用深圳微生态科技有限公司提供的生物信息云平台进行(https://www.bioincloud.tech)。
2 结果与分析 2.1 龙形水系样品的细菌群落结构通过对16S rRNA基因V4–V5区进行高通量测序,共获得了5 875个OTUs,其中FW3获得OTU最少,为569个,FHR1最多为2 360个。所获得的OTU共分布于59个门,1 410个属。其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes) 在大部分样品中都具有较高丰度;厚壁菌门(Firmicutes)在底泥样品中丰度较低(0.43%),在苦草叶际样品中丰度较高(31.93%);而绿弯菌门(Chloroflexi) 在底泥中具有最高的丰度(18.29%),在其他样品中丰度较低;放线菌门(Actinobacteria)在水体中具有最高的丰度(10.85%);蓝细菌门(Cyanobacteria)、浮霉菌门(Planctomycetes) 在狐尾藻叶际和龙须眼子菜叶际具有相对较高的丰度(表 2)。变形菌门分为α-变形菌纲、β-变形菌纲、γ-变形菌纲、δ-变形菌纲,其中β-变形菌纲在所有样品中丰度最高,其次为γ-变形菌纲;α-变形菌纲在底泥及水体样品中的丰度要低于根际及叶际样品中的丰度,δ-变形菌纲在水体及叶际样品中的丰度要低于其在底泥及根际样品中的丰度(表 2)。
| Taxonomy | Sediment and rhizosphere samples (%) | Water and phyllosphere samples (%) | |||||||
| FS | FKR | FHR | FLR | FW | FKL | FHL | FLL | ||
| α-proteobacteria | 1.83 | 11.79 | 9.60 | 8.07 | 5.38 | 10.97 | 15.42 | 18.76 | |
| β-proteobacteria | 29.06 | 45.27 | 51.57 | 38.86 | 28.81 | 29.83 | 40.84 | 19.35 | |
| γ-proteobacteria | 6.55 | 11.56 | 10.07 | 19.08 | 18.74 | 14.08 | 19.64 | 17.85 | |
| δ-proteobacteria | 4.04 | 0.93 | 2.09 | 6.41 | 0.10 | 0.24 | 0.55 | 0.88 | |
| Firmicutes | 0.43 | 17.04 | 12.64 | 4.55 | 6.32 | 31.93 | 2.01 | 20.32 | |
| Bacteroidetes | 12.77 | 7.65 | 4.41 | 4.45 | 21.38 | 9.35 | 5.42 | 5.08 | |
| Chloroflexi | 18.29 | 0.42 | 1.52 | 2.07 | 0.16 | 0.20 | 0.12 | 0.38 | |
| Actinobacteria | 0.32 | 0.19 | 0.25 | 0.15 | 10.85 | 0.13 | 0.22 | 0.24 | |
| Cyanobacteria | 1.19 | 0.22 | 1.06 | 1.37 | 3.97 | 0.39 | 4.98 | 9.50 | |
| Planctomycetes | 3.88 | 1.08 | 1.99 | 1.71 | 1.29 | 1.48 | 7.54 | 3.58 | |
| Verrucomicrobia | 5.00 | 0.94 | 1.45 | 4.19 | 1.89 | 0.41 | 1.52 | 1.79 | |
| Acidobacteria | 3.98 | 1.49 | 1.22 | 2.38 | 0.06 | 0.32 | 0.41 | 0.35 | |
| Euryarchaeota | 3.89 | 0.02 | 0.11 | 1.18 | 0.00 | 0.02 | 0.01 | 0.12 | |
| Ignavibacteriae | 3.58 | 0.30 | 0.31 | 0.85 | 0.02 | 0.06 | 0.10 | 0.14 | |
| Nitrospirae | 0.82 | 0.19 | 0.33 | 0.18 | 0.04 | 0.12 | 0.05 | 0.07 | |
| Gemmatimonadetes | 0.67 | 0.19 | 0.24 | 0.09 | 0.11 | 0.14 | 0.66 | 0.25 | |
| Spirochaetae | 0.58 | 0.17 | 0.35 | 2.37 | 0.01 | 0.01 | 0.10 | 0.28 | |
| Latescibacteria | 0.36 | 0.07 | 0.06 | 0.15 | 0.01 | 0.02 | 0.01 | 0.03 | |
| WSA2 | 0.35 | 0.00 | 0.00 | 0.02 | 0.00 | 0.00 | 0.00 | 0.00 | |
| Others | 2.42 | 0.48 | 0.74 | 1.87 | 0.85 | 0.30 | 0.39 | 1.04 | |
在属水平上,厌氧绳菌科中未知属(f_Anaerolineaceae;g_uncultured)、硫杆菌属(Thiobacillus)在底泥中的相对丰度明显高于植物根际;而植物根际丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured)、乳球菌属(Lactococcus)、红环菌科未知属(f_Rhodocyclaceae;g_uncultured) 的相对丰度明显高于底泥样品;FKR-2中的乳球菌属相对丰度明显高于FKR-1和FKR-3;气单胞菌属Aeromonas在FHR-1和FLR-2中的相对丰度明显高于相应的其他4个根际样品;FLR-2中的希瓦氏菌属Shewanella的相对丰度明显高于其他样品(图 2A)。在FW-2中,水栖菌属Enhydrobacter异常高,其相对丰度为54.26%,远高于其他两个水体样品;在FKL-2和FLL-2中,乳球菌属Lactococcus的相对丰度非常高,分别为44.86%和43.58%,明显高于其他样品;FHL-1中的气单胞菌属相对丰度最高,达到45.00%,高于其他所有样品。

|
| 图 2 属水平丰度排名前20的细菌群落柱状图(A:底泥及各植物根际样品;B:水体及各植物叶际样品) Fig. 2 Histogram of the top 20 genus in the bacterial community. (A) The sediment and rhizosphere samples. (B) The water and phyllosphere samples. |
| |
水体样品的微生物组成与植物叶际样品具有较大差异,水体样品中的鱼胞菌科未知属(f_Sporichthyaceae;g_hgcI clade)、Diaphorobacter属、Pseudarcicella属、噬氢菌属Hydrogenophaga、栖湖菌属Limnohabitans、海环菌科下未知属(f_Cyclobacteriaceae;g_uncultured) 等相对丰度明显高于植物叶际样品(FW-2除外)。在大部分植物根际及叶际样品中,乳球菌属、丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured) 都具有相对较高的丰度(图 2B)。
2.2 龙形水系样品的细菌群落多样性底泥与3种植物根际微生物的Ace指数和OTU数目没有显著差异,表明微生物丰富度没有显著差异,而底泥样品的香农指数(Shannon index) 则显著高于3种植物的根际样品;3种植物根际样品之间的香农指数并没有显著差异(表 3)。水体的Ace指数要显著低于植物叶际样品,表明水体中微生物的丰富度要显著低于植物叶际样品;水样、苦草叶际、狐尾藻叶际、龙须眼子菜叶际4个样品的香农指数依次增高,但是增高并不显著,说明4个样品的微生物多样性虽然有差异,但是差异并不显著。另外底泥及3种植物根际的Ace指数及香农指数都要高于水体及植物叶际样品,表明底泥及植物根际样品的微生物丰富度及多样性要高于水体及植物叶际样品(表 3)。
| Sediment and rhizosphere samples | Water and phyllosphere samples | ||||||||
| FS | FKR | FHR | FLR | FW | FKL | FHL | FLL | ||
| Ace | 3 107±190a | 2 914±372a | 3 237±419a | 2 882±19a | 1 064±103a | 2 230±366b | 2 105±246b | 2 466±237b | |
| Observed OTUs | 2 143±205a | 1 784±199a | 2 005±279a | 1 848±46a | 600±23a | 1 225±176b | 1 261±123b | 1 524±182b | |
| Shannon | 8.62±0.34a | 6.96±0.51b | 7.25±0.28b | 7.28±0.61b | 5.09±0.71a | 5.40±0.61a | 6.19±0.67a | 6.53±0.83a | |
| Note: different lowercase letters of the same row in each part of sediment, rhizosphere samples, water and phyllosphere samples indicate significant difference at P < 0.05 level, respectively. | |||||||||
对底泥及植物根际样品进行基于Bray-Curtis距离的主坐标分析(PCoA),结果见图 3A。从图中可以看出,第一主坐标轴的解释度为44.18%,第二主坐标轴的解释度为20.39%;底泥样品与植物根际样品可以分为3个部分,其中底泥样品聚在一起,龙须眼子菜根际聚在一起,苦草根际和狐尾藻根际不能很好地区分,表明狐尾藻根际与苦草根际的微生物群落构成较为相似,与龙须眼子菜根际和底泥具有较大差异。对水体及植物叶际样品的PCoA分析结果如图 3B所示。第一主坐标和第二主坐标的解释度分别为37.53%和20.63%。FW-2样品与FW-1和FW-3样品的微生物多样性差异较大,根据图 2可以推测可能是FW-2中水栖菌属丰度异常造成的。从第一主坐标轴上可以明显区分水体样品和其他植物叶际样品,水体样品位于左侧,而其他植物叶际样品位于右侧。与根际样品不同的是,狐尾藻叶际3个样品聚在一起,龙须眼子菜叶际和苦草叶际共6个样品不能很好地区分,表明龙须眼子菜叶际和苦草叶际的微生物群落结构差异要小于其与狐尾藻叶际的微生物多样性差异。

|
| 图 3 PCoA分析(A:底泥及各植物根际样品,B:水体及各植物叶际样品) Fig. 3 PCoA analysis of the sediment and rhizosphere samples (A) and water and phyllosphere samples (B). |
| |
为了探究各种类型样品富集的特征类群,选取相对丰度位于前200的属进行LEfSe分析(LDA阈值为4),结果见图 4。从图 4A中可以看出,硫杆菌属Thiobacillus、厌氧绳菌科未知属(f_Anaerolineaceae;g_uncultured)、嗜纤维菌科未知属(f_Cytophagaceae;g_uncultured) 为底泥样品的生物标记物(Biomarker),即这些属在底泥中的相对丰度显著高于其他植物根际样品。狐尾藻根际中丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured)、Sideroxydans属为其生物标记物。苦草根际中丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured)、噬氢菌属Hydrogenophaga、黄杆菌属Flavobacterium、乳球菌属Lactococcus为其生物标记物。龙须眼子菜根际中希瓦氏菌属Shewanella、噬氢菌科未知属(f_Hydrogenophilaceae;g_uncultured)、红环菌科未知属(f_Rhodocyclaceae;g_uncultured)、脱氮单胞菌属Denitratisoma为其生物标记物。
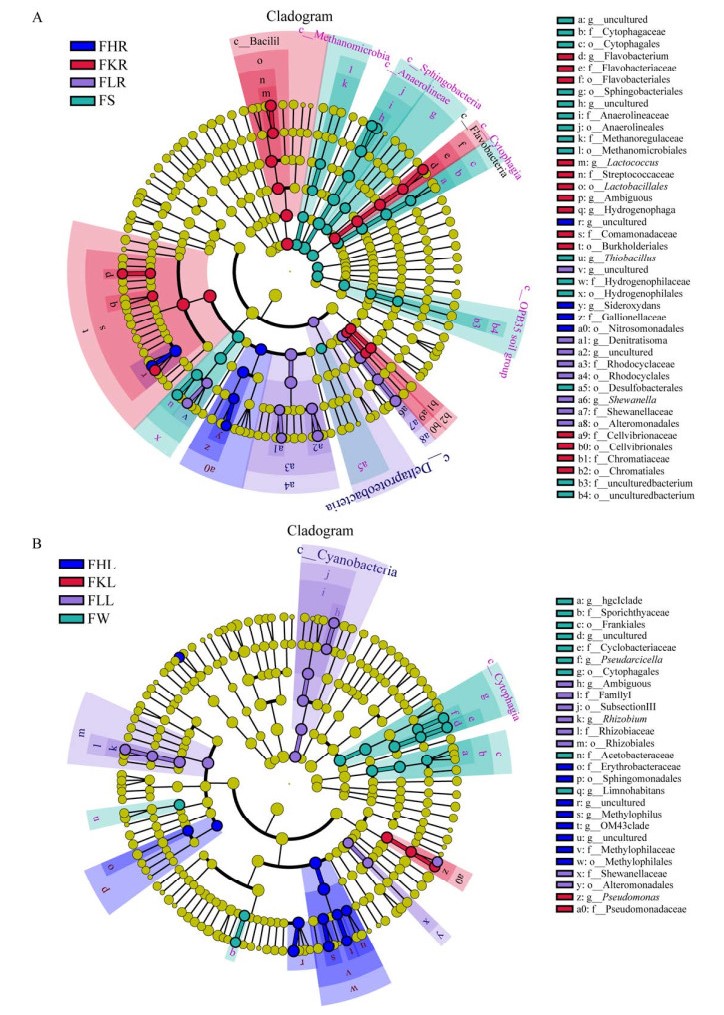
|
| 图 4 LEfSe分析(A:底泥及各植物根际样品,B:水体及各植物叶际样品) Fig. 4 LEfSe analysis of the sediment and rhizosphere samples (A), and water and phyllosphere samples (B). |
| |
水样中Pseudarcicella属、栖湖菌属、海环菌科未知属(f_Cyclobacteriaceae;g_uncultured)、鱼胞菌科(Sporichthyaceae;g_hgcIclade)为其生物标记物。苦草叶际中假单胞菌属为其生物标记物。龙须眼子菜叶际中蓝细菌科未知属(c_Cyanobacteria;o_SubsectionIII;f_FamilyI;g_Ambiguous;s_Ambiguous)、根瘤菌属Rhizobium为其生物标记物。狐尾藻叶际中丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured)、嗜甲基菌Methylophilus、小梨形菌属Pirellula、嗜甲基菌科OM43clade属(f_Methylophilaceae;g_OM43clade)为其生物标记物。
2.4 龙形水系细菌功能预测根据高通量测序结果,在R软件中使用Tax4Fun程序进行功能预测,获得各个样品的KEGG Orthology (KO) 的丰度。为了简化分析,筛选了47个与碳氮硫代谢相关的标志基因[12]并将其丰度通过热图形式展示(图 5)。与氮同化(Nitrogen assimilation) 相关的标志基因(Marker gene) K00265与K01915在所有样品中都具有较高丰度。底泥与龙须眼子菜根际样品中厌氧碳固定(Anaerobic C fixation) 相关标志基因K00174与K00175的相对丰度要高于其他样品,同时这二者与好氧呼吸(Aerobic respiration) 相关的标志基因K02274与K02276的丰度要低于其他样品。狐尾藻叶际与龙须眼子菜叶际样品的反硝化(Denitrification) 相关标志基因K00376的丰度要高于其他样品;而龙须眼子菜根际样品的氮固定(Nitrogen fixation) 相关标志基因K02586、K02588、K02591的丰度要高于其他样品。水样、苦草根际、苦草叶际3个样品的同化型硫还原标志基因K00957的丰度要高于其他样品,而底泥、龙须眼子菜根际样品的异化型硫还原相关标志基因K00394的丰度要高于其他样品。而与硫矿化相关的标志基因K01011在所有样品中都具有相对较高的丰度(在龙须眼子菜根际中最低)。

|
| 图 5 碳氮硫代谢标志基因在各样品中的含量 Fig. 5 The heatmap of the marker genes involved in carbon, nitrogen and sulfur metabolism. |
| |
通过高通量测序结果可以看出,龙形水系中主要的细菌为变形菌门、拟杆菌门和厚壁菌门,其中变形菌门中主要为α-变形菌纲、β-变形菌纲、γ-变形菌纲和δ-变形菌纲(表 2)。Ibekwe等[13]通过对不同因素(农业、城市径流和污水处理厂排水等) 影响下水体及底泥微生物群落的研究发现,污水处理厂出水口的变形菌门(30.92%) 和拟杆菌门(42.75%) 为主要的微生物类群,而在自然水体中变形菌门的丰度相对较高,能够达到42.28%,拟杆菌门的丰度有一定下降,为28.86%。龙形水系F区水体中变形菌门丰度为53.03%,拟杆菌门丰度为21.38%,与Ibekwe等研究结果中的自然水体微生物群落丰度更为相似,说明污水处理厂排出的中水经过A–E区自然净化,至F区时其微生物群落结构已经与自然水体相似。Crump等通过变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE) 技术对苦草叶际及根际微生物群落进行研究,发现苦草叶际附着更多的具有聚合物降解功能的拟杆菌门细菌;而根际除了拟杆菌门外,还有较多的β-变形菌纲、α-变形菌纲和γ-变形菌纲细菌[14]。这与笔者的结果具有一定相似性,苦草根际样品(FKR)的β-变形菌纲和α-变形菌纲细菌丰度要高于叶际样品(FKL),苦草叶际拟杆菌门细菌丰度要高于苦草根际样品;但是也有一定的差异,如苦草根际及叶际拟杆菌门的丰度都要远低于变形菌门的丰度,且苦草根际γ-变形菌纲丰度要低于叶际样品(表 2)。He等通过高通量测序技术对苦草及狐尾藻叶际微生物群落结构进行研究,结果表明苦草与狐尾藻叶际微生物类群在门水平较为相似,主要为β-变形菌纲、α-变形菌纲、γ-变形菌纲及拟杆菌门细菌[15],这一结果与文中的研究结果较为相似。
沉水植物所附着微生物的群落结构不仅与植物种类有关,而且与周围环境如温度、pH、溶解氧和光照等也有一定关系[16]。另外由于采样方法限制(采集过程中对水体扰动较大),往往导致同一植物组内差异较大,如FKR-2中的乳球菌属、FHR-1中的气单胞菌属及FLR-2中的希瓦氏菌属的丰度远高于组内其他样品;FW-2中的水栖菌属、FHL-1中的气单胞菌属、FLL-2中的乳球菌属的丰度要远高于组内其他样品(图 2)。后续可以通过扩大采样面积、增加采样数量、增加采样点等方式来减弱水体扰动给采样带来的影响。
在龙形水系中,底泥相对处于厌氧环境,水体处于好氧流动环境,沉水植物根际处于微好氧环境,叶际处于好氧环境,由于植物根际及叶际分泌物能够为微生物提供养分,而且植物叶片也能够作为微生物附着物,因此植物叶际及根际微生物与水体和底泥的微生物多样性具有较大区别(表 2,图 3),而不同的微生物类群往往意味着不同的代谢功能。由于底泥处于厌氧环境,所以其生物标记物也多属于厌氧菌,如硫杆菌属Thiobacillus和厌氧绳菌科未知属(f_Anaerolineaceae;g_uncultured) (图 4)。有报道显示硫杆菌属的细菌能够利用硝态氮氧化还原态的硫进行生长,同时进行反硝化作用,属于自养反硝化细菌[17-18],因此硫杆菌属细菌的富集,可能有利于底泥反硝化过程的进行。同时功能预测结果也显示了底泥样品中厌氧碳固定相关基因的丰度也远高于水体及植物叶际样品(图 5)。水体中富集的栖湖菌属细菌广泛存在于淡水环境中,该属细菌大部分为异养微生物,同时最近研究表明部分该属细菌具有好氧不产氧光合作用[19]。苦草叶际富集的假单胞菌属、龙须眼子菜叶际富集的根瘤菌属、狐尾藻叶际富集的丛毛单胞菌科未知属(f_Comamonadaceae;g_uncultured)、嗜甲基菌属Methylophilus、小梨形菌属Pirellula等多为好氧菌或者兼性厌氧菌;而且在对水体及植物叶际样品的功能预测结果显示好氧呼吸相关基因丰度较高(图 5),这也与水体及植物叶际所处好氧环境一致。而在根际样品中,不仅富集了好氧微生物如黄杆菌属、希瓦氏菌属、噬氢菌属等,也富集了厌氧菌及兼性厌氧菌如乳球菌属、Sideroxydans等,其中噬氢菌属的微生物具有碳水化合物降解功能[20],黄杆菌属的部分微生物则具有硝化功能[21],而Sideroxydans则具有二价铁离子氧化及硝酸盐还原功能[22]。
从本研究可以推测,狐尾藻和龙须眼子菜叶际样品所富集的微生物类群反硝化能力较强,更适合用于硝态氮含量较高的水体脱氮。不同植物样品根际及叶际能够富集具有不同功能的微生物类群,进而可以对水体营养循环产生不同的作用。通过对不同植物富集微生物类群及功能的深入了解,能够为合理安排不同水生植物种植提供重要的指导意义,促进水体自净能力的提高,进而降低人工维护成本。
| [1] |
冯长松, 文剑平, 蒋飞跃, 等. 奥运龙形水系人工生态系统建设与管理. 湿地科学与管理, 2008, 4(2): 33-36. Feng CS, Wen JP, Jiang FY, et al. Construction and management of artificial ecosystem of the dragon-shaped Olympic water system in Beijing city. Wetl Sci & amp; Manag, 2008, 4(2): 33-36 (in Chinese). DOI:10.3969/j.issn.1673-3290.2008.02.008 |
| [2] |
孟繁龙, 梁辉, 暴伟. 奥运公园龙形水系高效过滤技术研究与应用. 北京水务, 2010(4): 38-41. Meng FL, Liang H, Bao W. Study and application of highly effective filtration technology in dragon style water system of the Olympic Park. Beijing Water, 2010(4): 38-41 (in Chinese). |
| [3] |
姜建华. 水生植物用于水体富营养化防治的技术分析. 绿色科技, 2019(4): 96-98. Jiang JH. Technical analysis of aquatic plants used in water eutrophication control. J Green Sci Technol, 2019(4): 96-98 (in Chinese). |
| [4] |
刘淑娇. 水生植物联合微生物强化修复技术治理水体富营养化. 分子植物育种, 2018, 16(8): 2747-2752. Liu SJ. Treatment of water eutrophication by aquatic plants combined with microbial enhanced remediation. Mol Plant Breed, 2018, 16(8): 2747-2752 (in Chinese). |
| [5] |
刘凯辉, 张松贺, 吕小央, 等. 南京花神湖3种沉水植物表面附着微生物群落特征. 湖泊科学, 2015, 27(1): 103-112. Liu KH, Zhang SH, Lü XY, et al. The characteristics of epiphytic microbes of three submerged macrophytes in Lake Huashen. J Lake Sci, 2015, 27(1): 103-112 (in Chinese). |
| [6] |
Pang S, Zhang SH, Lv X, et al. Characterization of bacterial community in biofilm and sediments of wetlands dominated by aquatic macrophytes. Ecol Eng, 2016, 97: 242-250. DOI:10.1016/j.ecoleng.2016.10.011
|
| [7] |
刘敏, 吴铁明, 刘菡, 等. 3种水生植物的不同组合对富营养水体的净化效果研究. 中国农业科技导报, 2019, 21(7): 155-160. Liu M, Wu TM, Liu H, et al. Study on purification of eutrophic water by different combinations of three aquatic plants. J Agric Sci Technol, 2019, 21(7): 155-160 (in Chinese). |
| [8] |
Schloss PD, Westcott SL, Ryabin T, et al. Introducing mothur: open-source, platform- independent, community-supported software for describing and comparing microbial communities. Appl Environ Microbiol, 2009, 75(23): 7537-7541.
|
| [9] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools. Nucleic Acids Res, 2013, 41(database issue): D590-D596.
|
| [10] |
Team RC. R: a Language and Environment for Statistical Computing. Vienna: R Foundation for Statistical Computing, 2013.
|
| [11] |
Aßhauer KP, Wemheuer B, Daniel R, et al. Tax4Fun: predicting functional profiles from metagenomic 16S rRNA data. Bioinformatics, 2015, 31(17): 2882-2884.
|
| [12] |
Llorens-Marès T, Yooseph S, Goll J, et al. Connecting biodiversity and potential functional role in modern euxinic environments by microbial metagenomics. ISME J, 2015, 9(7): 1648-1661.
|
| [13] |
Ibekwe AM, Ma J, Murinda SE. Bacterial community composition and structure in an Urban River impacted by different pollutant sources. Sci Total Environ, 2016, 566/567: 1176-1185.
|
| [14] |
Crump BC, Koch EW. Attached bacterial populations shared by four species of aquatic angiosperms. Appl Environ Microbiol, 2008, 74(19): 5948-5957.
|
| [15] |
He D, Ren LJ, Wu QL. Growing season drives the compositional changes and assembly processes of epiphytic bacterial communities of two submerged macrophytes in Taihu Lake. FEMS Microbiol Ecol, 2020, 96(4): fiaa025.
|
| [16] |
何聃, 任丽娟, 邢鹏, 等. 沉水植物附着细菌群落结构及其多样性研究进展. 生命科学, 2014, 26(2): 161-168. He D, Ren LJ, Xing P, et al. Research progress of diversity and community structure of epiphytic bacteria on submerged macrophytes. Chin Bull Life Sci, 2014, 26(2): 161-168 (in Chinese). |
| [17] |
Yang Y, Gerrity S, Collins G, et al. Enrichment and characterization of autotrophic Thiobacillus denitrifiers from anaerobic sludge for nitrate removal. Process Biochem, 2018, 68: 165-170.
|
| [18] |
Zhang Z, Han Y, Xu C, et al. Microbial nitrate removal in biologically enhanced treated coal gasification wastewater of low COD to nitrate ratio by coupling biological denitrification with iron and carbon micro- electrolysis. Bioresour Technol, 2018, 262: 65-73.
|
| [19] |
Kasalický V, Zeng YH, Piwosz K, et al. Aerobic anoxygenic photosynthesis is commonly present within the genus Limnohabitans. Appl Environ Microbiol, 2018, 84(1): e02116-e02117.
|
| [20] |
Deshpande RS, Sundaravadivelu D, Techtmann S, et al. Microbial degradation of Cold Lake Blend and Western Canadian select dilbits by freshwater enrichments. J Hazard Mater, 2018, 352: 111-120.
|
| [21] |
Ibekwe AM, Gonzalez-Rubio A, Suarez DL. Impact of treated wastewater for irrigation on soil microbial communities. Sci Total Environ, 2018, 622/623: 1603-1610.
|
| [22] |
Nordhoff M, Tominski C, Halama M, et al. Insights into nitrate-reducing Fe(Ⅱ) oxidation mechanisms through analysis of cell-mineral associations, cell encrustation, and mineralogy in the chemolithoautotrophic enrichment culture KS. Appl Environ Microbiol, 2017, 83(13): e00752-17. DOI:10.1128/aem.00752-17
|
 2021, Vol. 37
2021, Vol. 37




