中国科学院微生物研究所、中国微生物学会主办
文章信息
- 牛晓倩, 周胜虎, 邓禹
- Niu Xiaoqian, Zhou Shenghu, Deng Yu
- 脱氮微生物及脱氮工艺研究进展
- Advances in denitrification microorganisms and processes
- 生物工程学报, 2021, 37(10): 3505-3519
- Chinese Journal of Biotechnology, 2021, 37(10): 3505-3519
- 10.13345/j.cjb.210407
-
文章历史
- Received: May 31, 2021
- Accepted: August 12, 2021
2. 江南大学 江苏省生物活性制品加工工程技术研究中心,江苏 无锡 214122
2. Jiangsu Provincial Research Center for Bioactive Product Processing Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
随着人类日益频繁的生产活动,含有高氮素的污水被不断排放到江河湖泊等水体中,导致生物圈中活性氮不断积累,引起水环境污染和水质富营养化等问题,这不但对生态环境造成了破坏,也影响着人类的用水安全。因此,快速降解污水中的氮素是解决这一难题的关键。目前,脱氮技术主要包括:1) 化学脱氮法:化学沉淀和折点氯化法[1];2) 物理脱氮法:离子交换和吹脱法[2];3) 生物脱氮法:硝化-反硝化、短程硝化反硝化和厌氧氨氧化等。化学脱氮法需要加入额外的化学物质,容易造成二次污染;而物理脱氮法需要曝气或吸附,需要消耗大量能源;相比而言,生物脱氮技术具有经济、高效和无二次污染的优势,近年来受到了越来越多的关注[3]。
根据污染源和水质环境的不同,需要选择适合的脱氮微生物和脱氮工艺。氮素从NH4+转变成NO2–和NO3–最终转化为N2的过程中,往往需要多种微生物体内酶的组合催化,这些微生物除了所需的生长环境不同之外,硝化和反硝化反应所需的氧气环境以及pH环境也不相同,这增加了生物脱氮工艺的复杂度和控制难度[4-7]。本文根据脱氮微生物的特性和脱氮机制的不同,综述了近年来微生物脱氮工艺的研究进展,对比了不同脱氮微生物的脱氮机制和不同脱氮工艺的优势与劣势,最后以合成生物学的视角提出强化微生物脱氮能力的发展方向。
1 脱氮微生物及其脱氮机制环境中的氮素主要通过氨化、硝化和反硝化三步反应实现脱氮。其中,氨化过程是将含氮有机物分解最终释放氨;硝化反应是将氨氧化为硝酸盐,这一步属于化能自养反应,需要在好氧条件下进行;反硝化反应是将硝酸盐还原为N2,反硝化菌大多属于兼性异养型菌,故反硝化反应需在缺氧或低氧条件下进行。因此,在传统的活性污泥脱氮策略中需要为硝化和反硝化反应创造不同的氧气环境,从而实现氨氮向N2的连续转化。随着人们对脱氮微生物的筛选和研究,发现了多种类型的新型脱氮微生物,主要包括异养型硝化菌、厌氧氨氧化菌和好氧反硝化菌等,均可实现单级脱氮反应。不同微生物具有不同的生理特性和脱氮性能,为了高效去除不同污水环境中的氮素需要选择适宜的脱氮微生物,本节中对比了不同脱氮微生物的特性以及其脱氮机制,为脱氮工艺的菌种多样化需求提供参考。
1.1 硝化菌及其脱氮机制参与硝化反应的微生物大多都属于自养菌,在硝化反应过程中它们利用氮素的氧化来为自身提供生长代谢所必需的能量,并利用无机碳源构筑生命元件。如图 1所示,硝化过程通常分为两个阶段进行,氨氧化过程主要由氨氧化细菌(Ammonium-oxidizing bacteria,AOB) 和氨氧化古菌(Ammonia-oxidizing archaea,AOA) 共同催化完成,将NH4+依次被氧化成NH2OH和NO2-,参与该反应的最常见的微生物是变形菌纲β-proteobacteria的亚纲;随后,亚硝酸盐氧化菌(Nitrite-oxidizing bacteria,NOB) 将NO2-氧化成NO3-,参与该反应的菌的种类众多,主要包括α-变形菌纲、拟杆菌门、绿色非硫细菌和放线菌门等[8-9]。其中研究发现自然界中很少有大量亚硝酸盐的积累[10],表明第一阶段作为硝化过程中的限制性步骤,对硝化过程的速率起主要的控制作用。在第一步反应中起直接作用的是amo基因表达的氨单加氧酶,其催化NH4+转化为NH2OH。AMO是一种铜依赖型膜结合蛋白,与其功能相关的还有另外2个辅助蛋白AmoD和AmoE,这2种蛋白均含有2个铜原子构成的活性中心结构[11]。为了强化脱氮性能,李君文等[12]将来自亚硝酸菌的amoA基因克隆至大肠杆菌中,发现重组菌株获得了氧化氨氮的功能,在6 d时NH4+-N的含量已由1.3 mg/L降至0.6 mg/L。因此,通过基因工程技术在脱氮微生物中过表达氨单加氧酶将有助于提升脱氮性能,然而目前amoA基因多用于研究硝化菌的进化和生理学机制,鲜有在脱氮微生物中通过过表达amoA基因强化脱氮功能的报道。
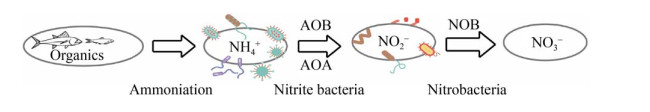
|
| 图 1 硝化菌脱氮机制图 Fig. 1 Nitrogen removal mechanism of nitrifying bacteria. AOB: Ammonium-oxidizing bacteria; AOA: Ammonia- oxidizing archaea; NOB: Nitrite-oxidizing bacteria. |
| |
随着深入的研究,人们发现了能够进行异养硝化的微生物。19世纪末,Sohmidt[13]在土壤的硝化过程中发现了异养硝化现象,但相关研究较少且当时缺乏合适的检测方法,人们普遍认为自然界的硝化过程多为自养硝化菌承担。后来Quastel等[14]通过丙酮酸肟选择性分离出具有产亚硝酸盐的菌株,引发众多学者对于异养硝化的重视,从而展开相关猜想并进行后续的探索研究。Verstraete等[15]从污水中分离出1株异养硝化菌株Arthrobacter sp.,发现在几种能完全抑制自养硝化的化合物存在的环境下,其异养硝化功能仍能保持。随后,Willrstraete等[16]发现在有机碳源乙酸或琥珀酸存在时,污水中的氨氮能被氧化为羟胺、亚硝酸盐和硝酸盐,这显然是属于异养硝化反应。目前已发现的异养硝化菌主要包括恶臭假单胞菌(Pseudomona sputida)[17]、粪产碱杆菌(Alcaligees faecalis)[18]、泛养硫球菌(Thiosphaera pantotropha)[19]、节细菌属(Arthtobacter sp.)[15]和Paracoccous denitrificans[20]等。
与自养硝化菌相似,异养硝化菌催化脱氮的酶也是由AMO催化氨转化为羟胺,再由羟胺氧化酶(HAO) 氧化为亚硝酸。不同之处在于异养硝化菌的AMO以NADPH为辅酶且Mg2+能激活其活性,受到羟胺的强烈抑制[21]。除此之外,研究发现1 Pa或更多的乙炔能完全抑制自养硝化菌欧洲亚硝化单胞菌(Nitrosomonas europaea) 产生NO2– [22]。还测试将洗涤过的细胞悬浮液暴露在104 Pa乙炔中,10–15 min可以迅速而完全地抑制菌株对O2的摄取。而1 mmol/L的乙炔不能抑制来自P. denitrificans的AMO,推测该抑制剂不能进入该酶的活性部位。故P. denitrificans的AMO与N. europaea的AMO之间的这种差异可能有助于确定异养和自养硝化作用在环境中的相对重要性。硝化反应的另一关键酶HAO结构相对简单,活性中心的血红素被非血红素Fe取代可能是异养硝化菌不同于自养硝化菌的主要特征。另外,两者的电子传递链也有所差别,研究主要集中在常见的菌株上。以Nitrosomonas europaea为例,自养硝化菌的羟胺氧化过程中电子依次经过细胞色素c554、泛醌、bcl复合体,最终传递到细胞色素[23]。而异养硝化细菌P. denitrificans在NH4+被氧化为NO2–的过程中电子首先传递给细胞色素c550,随后一半电子通过FeS蛋白传递给氧化态泛醌,另一半电子传递给细胞色素c氧化酶,氧化态泛醌转变为还原态泛醌后作为电子供体再氧化NH4+[20]。
1.2 反硝化菌及其脱氮机制反硝化菌可以将硝态氮(NO3–) 逐渐还原为N2释放到大气中。传统的脱氮系统中反硝化菌都是厌氧或兼性微生物,组合自养硝化菌从而实现两级脱氮反应。这种反应体系需要控制不同区域的氧气含量,因此对于实际脱氮工艺限制极大。而随着对反硝化菌的不断挖掘,研究者们发现了好氧反硝化菌,它们能够在有氧条件下进行反硝化作用,避免了脱氮过程中氧气环境的复杂控制过程。20世纪末,Robertson等[24]首次报道了好氧反硝化菌的存在。近年来,大量好氧反硝化菌被鉴定和报道出来,如副球菌属、气单胞菌属、不动杆菌属杆和假单胞菌属等。Lu等[25]分离的假单胞菌Pseudomonas sp. HS-2在C/N比大于10的条件下,该菌群能完全降解300 mg/L的双酚物质BPF,并观察到NH4+-N还原为N2,表明通过异养硝化和好氧反硝化偶联同时去除NH4+-N和BPF等双酚类物质是处理含这些化合物废水的一种潜在途径。He等[26]分离到1株Pseudomonas mendocina TJPU04,该菌对无机氮有较强的去除能力,对NH4+-N、NO3–-N和NO2–-N的去除率分别为4.69、5.60和4.99 mg/(L·h)。Zhang等[27]研究发现Pseudomonas putida ZN1对氨氮、硝酸盐和亚硝酸盐有较好的祛除效果,最大去除率分别为97.47%、86.08%和71.57%。此外,由于抗铜基因CoB-I的存在,菌株ZN1对重金属特别是铜具有良好的抗性。Yang等[28]从制药废水中新分离出Acinetobacter sp JR1,其在pH 4.5–10.0范围内生长良好,在酸性和碱性条件下均能降解氨氮。这些结果表明,菌株JR1能耐受较宽的pH范围,培养48 h后氨氮去除率可达90.0%以上。大量研究表明,好氧反硝化菌在高盐度、低温、高氨和营养贫乏的条件下都能够表现出良好的脱氮效果,为好氧反硝化菌应用于实际污水处理提供了理论基础和依据。
不同种属反硝化菌的生长及脱氮特性一般不同。一般而言,好氧反硝化菌脱氮过程都需要依次经过硝酸还原酶(Nar和Nap)、亚硝酸还原酶(Nir)、NO还原酶(Nor) 和N2O还原酶(Nos),最终将硝态氮还原为N2[29] (图 2)。其中硝酸盐还原酶活性受到氧气调控,在有氧条件下Nar活性被抑制,而Nap受抑制较弱。亚硝酸盐还原酶包含nirS和nirK两种同工酶,分别以铜离子和细胞色素为电子传递中心,其活性不受氧气调控[30]。NO还原酶锚定在细胞内膜上,在微氧条件下被诱导,起到呼吸末端氧化酶的作用,包含NorB和NorC两个亚基,对NO的亲和力非常高,几乎可将所有的NO转化为N2O[31-32]。N2O还原酶(NOS) 是一种位于周质空间的同源二聚体蛋白,通过细胞色素c实现N2O的还原和电子跨膜传递,其对氧气调控不敏感[33]。
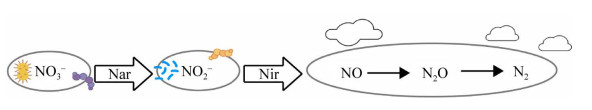
|
| 图 2 反硝化菌脱氮机制图 Fig. 2 Nitrogen removal mechanism of denitrifying bacteria. |
| |
随着对脱氮微生物的深入了解,研究人员发现有些脱氮菌中存在异养硝化和好氧反硝化的偶联过程,此类菌被称为异养硝化-好氧反硝化菌(Heterotrophic nitrifying and aerobic denitrifying bacteria,HN-AD)。就功能而言,异养硝化-好氧反硝化菌与好氧反硝化菌在反硝化阶段是相同的。HN-AD菌的发现为单级脱氮工艺提供了基础,突破了硝化菌与反硝化菌共培养脱氮的传统脱氮工艺。1983年,Robertson等[24]首次发现了HN-AD细菌泛养副球菌Paracoccus pantotrophus,并提出了HN-AD概念。已鉴定的大约有20种不同属的HN-AD菌[34],主要包括不动杆菌(Acinetobacter)[35]、假单胞菌(Pseudomonas)[36]、克雷伯氏菌(Klebsiella pneumoniae)[37]、Microvirgula aerodenitrificans[38]、农杆菌(Agrobacterium)[39]和红球菌(Rhodococcus)[40]等。
目前,绝大多数关于HN-AD菌的研究主要集中在分离筛选、生理鉴定和特性表征方面,关于这些筛选出的菌株脱氮机制的解析则鲜有报道。HN-AD菌具有分布广泛性和多样性,由于不同微生物的代谢过程显著不同,致使对HN-AD菌氨氮降解代谢途径和代谢机理的普遍性规律研究较困难。目前大多数代谢途径研究主要集中于相关酶系研究和根据测定代谢产物推测氮代谢途径。大多学者参照硝化菌株和反硝化菌株进行HN-AD菌相关酶的研究,推测其脱氮过程中可能参与的酶主要有氨单加氧酶、羟胺氧化酶、硝酸盐还原酶、亚硝酸盐还原酶、NO还原酶和N2O还原酶(图 3)。近日,Xu等[41]从养猪场饲料滤液中分离出了1株HN-AD菌,经鉴定命名为苏云金杆菌(Bacillus thuringiensis) WXN-23,根据氮降解、氮平衡、酶活性测定和功能基因扩增的特点,确定了该菌好氧条件下的硝化-反硝化代谢途径(NH4+-N→NH2OH→NO2–-N→NO3–-N→ NO2–-N→NO→N2O→N2)。其在较低C/N比(5/6)和碱性条件下铵态氮去除率可达82%,对猪场废水有较好的处理效果。此外,Deng等[42]从养殖场中分离鉴定出1株HN-AD菌被命名为Pseudomonas sp. DM02,该菌株具有多种有机碳来源,在中性和弱碱性环境下均能达到较高的脱氮效率。当C/N比分别增加到8和12时,总氮、硝酸氮和亚硝酸氮的去除率几乎达到100%。同时,napA、nirK和nosZ基因的成功扩增证明菌株DM02能够进行好氧反硝化作用。为研究枯草芽孢杆菌的脱氮机制,Yang等[43]研究了Bacillus subtilis JD-014的全基因组序列,发现43个基因与脱氮过程有潜在的关联,并通过基因敲除验证了其中的9个基因napA0、napA1、napA2、napA3、nirs、norD、norQ、nosD1和nosD2的脱氮功能。研究发现,过表达Nap的末端还原酶napA基因,可有效促进好氧反硝化过程[44-45]。对脱氮机制的研究和脱氮基因的发掘为通过合成生物技术构建高效降解氮素的菌株提供了理论基础。

|
| 图 3 异养硝化好氧反硝化菌脱氮机制图 Fig. 3 Nitrogen removal mechanism of heterotrophic nitrifying and aerobic denitrifying bacteria. |
| |
二十世纪末,Broda[46]预测自然界可能存在以NO2–或NO3–为电子受体把氨氮直接氧化成氮气的自养型微生物,后来学者[47]在反硝化流化床反应器内观察到NH4+可以随着NO3–一起被去除的现象,并在此过程中检测到氮气产生的现象,验证了厌氧氨氧化的理论。厌氧氨氧化(Anaerobic ammonia oxidation,ANAMMOX) 是指在厌氧条件下,氨以亚硝酸盐为电子受体直接被氧化为N2的脱氮过程,它是目前最为经济高效的脱氮技术[48]。ANAMMOX菌属于革兰氏阴性菌,在自然界广泛存在,目前已经发现的ANAMMOX菌有6个属[49-50]。ANAMMOX菌含有一个厌氧氨氧化体,占细胞体积的50%–80%,在其膜表面含有大量的ANAMMOX反应相关酶类[51-52]。为阐明厌氧氨氧化的脱氮途径,Graff等在1997年用15N示踪法研究并建立了ANAMMOX的可能代谢模型[53],初步猜测ANAMMOX过程的电子受体是亚硝酸盐。首先亚硝酸盐被nirS还原为NO,被HZS (肼合成酶) 通过两步反应转换为羟胺并与NH4+反应形成肼中间代谢产物,最后被HZO (肼氧化酶) 或HAO氧化为N2[54]。后续研究在此基础上从基因组学和酶学方面进行了修正,最终构建出了准确的ANAMMOX菌的细胞结构模型和催化模型(图 4)[55]。厌氧氨氧化体的功能类似于真核生物的线粒体,通过氨氧化在膜内外形成质子势能,通过驱动质子泵形成ATP,最终满足细胞正常的生理需求[51]。相比于传统的硝化-反硝化的脱氮过程,厌氧氨氧化代谢途径更短,脱氮效率更高,脱氮过程需要的能量更少,从反应机制方面更有优势。然而,厌氧氨氧化菌脱氮过程需要维持在厌氧环境下,细胞生长缓慢。且只有在细胞密度 > 1010个/mL时才能具有脱氮活性,导致启动脱氮过程缓慢,同时富集培养时需选择有高效污泥滞留能力的富集培养装置[56],此外还需要严格控制温度、pH、有机物浓度、氨和亚硝酸盐基质浓度等条件参数。Dosta等[57]发现温度在35–40 ℃时厌氧氨氧化活性最高,当温度超过45 ℃时厌氧氨氧化出现不可逆的失活。而厌氧氨氧化菌对温度的耐受性取决于细菌的种类[58]。此外,厌氧氨氧化菌对pH较敏感,研究显示厌氧氨氧化细菌具有活性的pH范围是6.5–8.8[59],另外游离氨和游离亚硝酸浓度过高会抑制厌氧氨氧化细菌生长[60],羟胺也是HZO的竞争性抑制剂[54]。
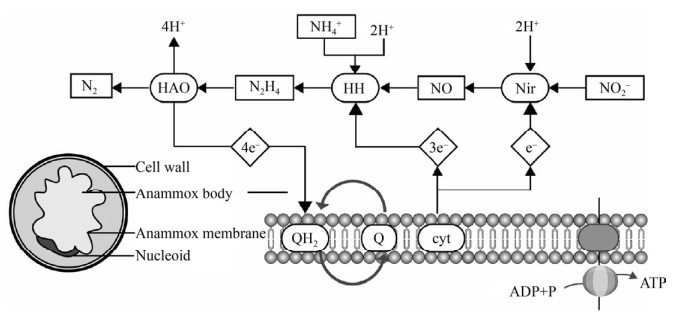
|
| 图 4 厌氧氨氧化菌脱氮机制图 Fig. 4 Nitrogen removal mechanism of anammox bacteria. |
| |
几十年来研究者们从自然界中筛选出了数以百计的脱氮微生物,其中受到广泛认可的脱氮途径为硝化、反硝化和厌氧氨氧化。这些降解途径都有各自的优缺点,如自养硝化菌由于其自身原因生长缓慢,并且细胞浓度不高,致使反应速率较低;研究者虽然分离出了大量好氧反硝化细菌,但不同菌种对环境的要求与耐受度差异较大。因此需要发掘出更为简洁高效的氮素降解途径。近日,国内刘双江教授课题组在异养硝化菌Alcaligenes sp. HO-1中发现1个新型的羟胺氧化酶DnfA,在FAD、NADH和O2存在的条件下可直接催化羟胺转化为N2[61]。这种新型的脱氮机制突破了传统认知,与氨单加氧酶组合后将实现两步催化降解氨氮的目标,极大地缩减了脱氮步骤,提高了脱氮效率,在生物脱氮领域具有划时代的意义。
2 生物脱氮工艺生物脱氮工艺依托天然脱氮微生物菌群和其他辅助微生物实现脱氮目标,脱氮生物体系复杂。不同的脱氮微生物菌群对氮素含量和形式、溶氧、温度、pH、C/N比和有机质含量的需求不同,而污水来源和成分复杂多样,要实现高效的脱氮过程必须建立适宜的生物脱氮工艺。本节根据脱氮微生物及其脱氮机制综述了目前已有的4种脱氮工艺研究进展,并对比了它们之间的优劣势,为脱氮的多元化需求提供参考。
2.1 自养硝化和厌氧反硝化偶联脱氮工艺利用自养硝化菌和厌氧反硝化菌进行多级脱氮反应是目前应用最多的传统生物脱氮技术。这种技术将硝化反应和反硝化反应固定在两个独立的反应器或同一反应器的不同空间进行,从而实现厌氧和缺氧环境的有效控制(图 5)。传统脱氮工艺面临诸多挑战,首先硝化细菌中的亚硝酸盐氧化与NAD的还原是偶联的,然而其生成和消耗ATP的比例却是1︰3,导致能量消耗入不敷出,生长速率慢,很难在脱氮菌群中形成优势菌群而发挥作用。在环境耐受性方面,硝化菌适宜在中性和弱碱性条件下生长。然而,硝化过程中产酸会降低污水pH,当pH < 5.0时便会中断硝化反应,维持pH需要外加大量的碱,这将会增加成本[6]。另外,有机物会显著影响自养硝化菌的增殖,从而无法成为优势菌种最终降低硝化能力。最后,自养硝化菌生长缓慢,因此要保持高细胞浓度处理污水时会不可避免地降低污水处理效率。
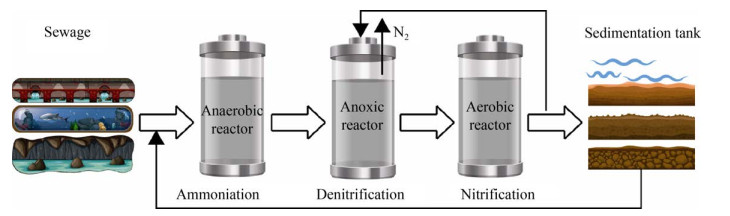
|
| 图 5 自养硝化厌氧反硝化偶联脱氮的工艺图 Fig. 5 Nitrogen removal by autotrophic nitrification anaerobic denitrification coupled process. |
| |
与自养硝化菌受有机物抑制不同,厌氧反硝化菌需要以有机物质或还原态化合物作为电子供体[7],将硝酸盐还原成N2。作为反硝化过程的中间体,N2O也是一种温室气体,其单分子增温潜势是CO2的298倍[62]。因此,反硝化过程中产生的N2O可能成为温室气体的重要来源。然而,实际上由于N2O在水中的溶解度高,难以排放到空气中,且N2O在反硝化过程中很快速地就会被转变为氮气。据统计,污水处理厂释放的N2O仅占总排放量的3%[63]。
2.2 异养硝化和好氧反硝化同步脱氮工艺异养硝化与好氧反硝化(HN-AD) 同步脱氮是指在异养硝化-好氧反硝化菌作用下不仅可以将氨氮转化为气态产物,且无NO2–-N/NO3–-N积累现象,实现同时硝化反硝化而且还能够去除污水中的COD的过程。异养硝化-好氧反硝化脱氮工艺以简单高效的优点成为了目前生物脱氮的研究热点。这主要是因为异养硝化菌具有生长速率快、需氧低和耐受酸性环境[64-67]等优异性能。生长速率快保证了脱氮微生物菌群中HN-AD菌可以迅速成为优势菌株,需氧量低可以减少脱氮反应器中的曝气量,而高耐酸性则使得菌株在脱氮过程中能耐受更低的pH减少了碱的加入量。已有研究表明,好氧反硝化菌在SBR反应器中可以实现95%的总氮去除率[6] (图 6)。关于HN-AD同步脱氮工艺的研究目前依然处于实验室研究阶段,工业化应用的报道较少。Joo等[68]以Alcaligenes faecalis No. 4菌株为基础,发现在实验室规模上C/N比为10和间歇曝气条件下,NH4+的最大消除速度为28.9 mg/(L·h),这些被去除的NH4+中有一半作为氮源被细胞吸收,剩余约40%–50%进入反硝化途径被转换成N2释放。随后,Joo等[69]将A. faecalis No. 4应用于实际猪场污水的好氧脱氮处理,他们发现在污水中2 000 mg/L的NH4+-N和12 000 mg/L的COD几乎全部被去除,NH4+去除速率可以达到30 mg/(L·h),其中超过65%的NH4+进入反硝化途径,表明A. faecalis No. 4在猪场污水实际处理中的高效性。
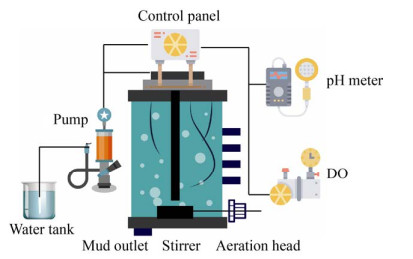
|
| 图 6 异养硝化和好氧反硝化同步脱氮工艺图 Fig. 6 Nitrogen removal by simultaneous heterotrophic nitrification and aerobic denitrification process. |
| |
大量研究表明,HN-AD菌具有良好的耐高氨、耐盐、耐低C/N比和耐低温的特性[35, 70-71],这为HN-AD同步脱氮工艺在特种污水的脱氮处理中的应用打下良好基础。与传统自养硝化和厌氧反硝化偶联脱氮工艺相比,异养硝化-好氧反硝化同步脱氮工艺具有以下几个优点:低温耐受性更好,有助于冬季脱氮;几乎没有NO3–和NO2–的积累;异养微生物生长迅速,在污水处理系统中更容易留存;自养硝化和厌氧反硝化偶联脱氮工艺适合低盐浓度的污水,异养硝化-好氧反硝化同步脱氮工艺常用来处理高氨、高碳的污水。
2.3 短程硝化反硝化脱氮工艺在硝化过程中NH4+被氧化为NO2–后又被进一步氧化为NO3–。反硝化反应则首先将NO3–还原为NO2–,再逐步还原为N2。研究硝化和反硝化的脱氮过程发现,NO2–在硝化过程中被过度氧化为了NO3–,从而导致反硝化过程需要多进行一步还原反应,导致了额外的能量消耗,且降低了脱氮效率。为避免这一缺陷,Voets等[72]首次提出了短程硝化反硝化(Shortcut nitrification denitrification,SCND) 生物脱氮技术。SCND是指将NH4+氧化成NO2–为止,通过控制脱氮环境来调控硝酸盐菌的活性,使硝化过程最后一步反应受到抑制从而积累NO2–,进而直接进行反硝化反应。SCND技术避免了硝化和反硝化脱氮工艺中将NO2–转化为NO3–、NO3–又转变为NO2–的过程。最具代表性的短程反硝化脱氮工艺是SHARON工艺[73] (图 7)。该工艺通过运用亚硝酸菌和硝酸菌不同的生理特性和环境适应性的特点将氨氧化控制在亚硝化阶段。尚会来等[74]报道了在28 ℃条件下控制活性污泥泥龄在10 d可以建立稳定的SCND反应。在此基础上实施逐渐减低温度,维持了稳定的常温、低温短程硝化反硝化,且亚硝化率始终维持在78.8%以上。此外,还有大量研究表明调节脱氮反应池中的pH可以有效抑制NOB的活性,将硝化反应稳定在NO2–阶段[75-76]。与硝化-反硝化相比,SCND减少了25%的硝化需氧量和40%的反硝化碳源,大大缩短了反应进程,同时可削减污泥产量进一步减少反硝化池的容积,在现代脱氮工艺中占有一席之地。但是,SCND工艺中产生的NO2–是一种致畸致癌的有毒物质,对人体健康有较大危害,在污水处理过程中应当高度关注。

|
| 图 7 短程硝化反硝化脱氮工艺图 Fig. 7 Nitrogen removal by short-cut nitrification and denitrification process. |
| |
根据厌氧氨氧化反应原理,Kuai等[77]开发了OLAND (Oxygen limited autotrophic nitrification denitrifications) 脱氮工艺。OLAND主要是通过控制DO使硝化反应进行到亚硝酸阶段,随后在限氧条件下进行ANAMMOX反应产生N2[78]。Winday等[79]利用AOB和ANAMMOX菌在生物转盘表面形成一层生物膜,它们分别位于生物膜的表层和底层。在脱氮过程中,AOB消耗污水中的溶解氧将NH4+氧化为NO2–,而底层ANAMMOX菌所处位置呈厌氧状态,它可以利用进入生物膜底层的NO2–和NH4+进行厌氧氨氧化反应,最终达到脱氮的目的(图 8)。在混合菌群进行OLAND工艺中,控制DO和pH是脱氮的难点。除此之外,与OLAND工艺相似的脱氮工艺还有全程自养短程脱氮(Completely autotrophic nitrogen removal nitrite,CANON) 工艺,该工艺全程只有一个反应器,其中只有亚硝化菌和ANAMMOX菌两类自养菌。限制DO条件下,这两类菌能同步催化将亚硝酸和氨直接转化为N2。在CANON工艺中,氧气、pH值和温度等都是影响工艺效果的重要因素。窦元等[80]发现DO浓度为0.1–0.2 mg/L时,全程自养脱氮颗粒污泥的脱氮效果最佳,对氨氮和总氮的平均去除率分别为90.6%和72.3%,平均总氮去除负荷达1.216 kg·N/(m3·d)。Strous等[81]研究发现当DO浓度为0.5%–2.0%的空气饱和度下,ANAMMOX菌活性完全被抑制;但消除氧后,被抑制的ANAMMOX活性能够恢复,即氧浓度对于ANAMMOX抑制是可逆的。郑平等[82]在研究厌氧氨氧化菌混培物的动力学特性时,发现厌氧氨氧化的最适温度为30 ℃。Dosta等[57]发现,温度在35–40 ℃时,厌氧氨氧化活性最高;当温度超过45 ℃时,厌氧氨氧化出现不可逆的失活。而厌氧氨氧化菌对温度的耐受性取决于细菌的种类[58];pH值能影响微生物的生长,在CANON工艺中氨氧化细菌和厌氧氨氧化细菌都要求适宜的酸碱度,研究显示厌氧氨氧化细菌具有活性的pH范围是6.5–8.8[59];Puyol等[83]在密封瓶中接种厌氧氨氧化污泥,发现进水pH值为7.2–7.6时污泥活性较大。而氨氧化细菌受pH的影响相对较低,但pH还会对污水中游离氨和游离亚硝酸浓度产生影响[60],从而影响氨氧化过程,所以在CANON工艺的运行过程中,通过调节pH来提高脱氮效果是很有必要的。OLAND工艺和CANON工艺最大的区别在于前者是在2个反应器中进行,而后者则在单一反应器中完成。
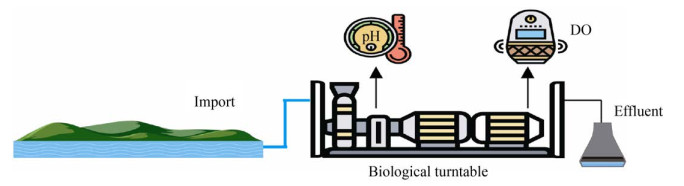
|
| 图 8 厌氧氨氧化脱氮工艺图 Fig. 8 The process of anaerobic ammonia oxidation denitrification. |
| |
目前最常用的厌氧氨氧化脱氮工艺是SHARON-ANAMMOX (Single reactor for high activity ammonia removal over nitrite-ANAMMOX) 结合工艺。以SHARON作为硝化反应器,其中污水中一半的NH4+被氧化成NO2–;用ANAMMOX反硝化反应器,把SHARON中的出水转接进入ANAMMOX反应器中实现脱氮反应。由于ANAMMOX反应需要在厌氧条件下,在该工艺中要重点控制反应器中的污水停留时间、温度和碱度。SHARON-ANMAMOX工艺脱氮过程中不需要添加额外的碳源避免了出水COD过高,还能减少50%的氧气用量,污泥产量不高,因此能省去90%以上的成本,具有较好的应用前景。与传统生物脱氮工艺相比,厌氧氨氧化脱氮工艺具有脱氮途径更短、运行成本低、温室气体产量低等优势[84]。但是厌氧氨氧化易受高浓度氨氮和亚硝酸盐抑制,同时pH和温度也会严重影响反应进程。厌氧氨氧化脱氮工艺的最适温度为30–40 ℃[85],导致在北方地区以及绝大多数地域的秋冬季节的应用具有较大局限性。
3 总结与展望由于菌种生存条件的差异和生产生活用水的性质不同,在实际工程应用中还需要根据不同的污水性质选择合适的脱氮菌株和脱氮工艺。已有的污水生物法脱氮工艺均有其自身的优缺点。例如,自养硝化和厌氧反硝化偶联工艺对环境条件和有机物非常敏感;异养硝化-好氧反硝化同步脱氮工艺对碳源需求较高(COD/N > 10);短程硝化反硝化可节约大量能源和碳源;厌氧氨氧化脱氮效率高且无需外加碳源,但细菌的生长环境要求较高。随着现代化和城市化的加剧,生产生活污水水质愈加复杂,迫切需要开发一种经济高效、自动便捷和可持续使用的脱氮新工艺。现阶段工艺由于各种原因制约了其发展,当下学会结合不同工艺优点和运用自动化模拟最佳条件,优化脱氮工艺,建立经济高效的脱氮工艺是至关重要的。例如,Wu等[86]在SBR反应器中通过一系列的优化实现了短程硝化、厌氧氨氧化和全程氨氧化过程的高效耦合,最终氨氮去除效率达到98.82%,而3种脱氮微生物的相对含量分别为Chitinophagaceae (18.89%)、Candidatus Kuenenia (0.10%) 和Nitrospira (0.2%)。
另一方面,为了降解复杂污水环境中的氮素,获得高效的氮素降解微生物也是至关重要的,这将可能从根本上解决目前脱氮工程中面临的困难。目前高效脱氮微生物的获得主要依赖于自然界筛选,然而自然界已经发现的微生物较少能够高效降解氨氮,远远无法达到人们对于脱氮工业的需求。近年来合成生物技术和系统生物技术的快速发展为脱氮微生物育种提供了新的思路。利用CRISPR/Cas9[87]的基因组编辑技术,针对脱氮微生物进行功能强化,有望获得超出自然界进化的超级脱氮微生物,例如通过蛋白质工程重新设计脱氮关键酶,进一步提高脱氮性能,或基因组编辑使硝化菌和厌氧氨氧化菌的功能在同一株工程菌上得以实现,或通过原生质体杂交等技术获得新型微生物。然而,利用合成生物技术构建高效的脱氮工程菌株的前提是对脱氮微生物遗传背景和代谢机理有清楚的认知,并且要有成熟的遗传操作手段。目前已有的脱氮微生物种类众多,且都是非常规微生物,尚缺乏满足上述两个要求的底盘微生物。因此,利用菌种的分子生物学特性,结合合成生物学,构建新型的环境工程菌种极具有挑战意义。
| [1] |
Ryu HD, Kim D, Lee SI. Application of struvite precipitation in treating ammonium nitrogen from semiconductor wastewater. J Hazard Mater, 2008, 156(1/2/3): 163-169.
|
| [2] |
杨成荫, 陈杨, 欧阳坤, 等. 氨氮废水处理技术的研究现状及展望. 工业水处理, 2018, 38(3): 1-5. Yang CY, Chen Y, Ouyang K, et al. Current research situation and prospect of ammonia nitrogen wastewater treatment technology. Ind Water Treat, 2018, 38(3): 1-5 (in Chinese). |
| [3] |
乔森, 刘雪洁, 周集体. 异养硝化-好氧反硝化在生物脱氮方面的研究进展. 安全与环境学报, 2014, 14(2): 128-135. Qiao S, Liu XJ, Zhou JT. Research progress of heterotrophic nitrification-aerobic denitrification in biological denitrification. J Saf Environ, 2014, 14(2): 128-135 (in Chinese). |
| [4] |
Prakasam TBS, Loehr RC. Microbial nitrification and denitrification in concentrated wastes. Water Res, 1972, 6(7): 859-869. DOI:10.1016/0043-1354(72)90038-3
|
| [5] |
Murray I, Parsons JW, Robinson K. Inter-relationships between nitrogen balance, pH and dissolved oxygen in an oxidation ditch treating farm animal waste. Water Res, 1975, 9(1): 25-30. DOI:10.1016/0043-1354(75)90148-7
|
| [6] |
Pochana K, Keller J, Lant P. Model development for simultaneous nitrification and denitrification. Water Sci Technol, 1999, 39(1): 235-243. DOI:10.2166/wst.1999.0050
|
| [7] |
Park JY, Yoo YJ. Biological nitrate removal in industrial wastewater treatment: which electron donor we can choose. Appl Microbiol Biotechnol, 2009, 82(3): 415-429. DOI:10.1007/s00253-008-1799-1
|
| [8] |
Woese CR, Stackebrandt E, Weisburg WG, et al. The phylogeny of purple bacteria: the alpha subdivision. Syst Appl Microbiol, 1984, 5(3): 315-326. DOI:10.1016/S0723-2020(84)80034-X
|
| [9] |
Woese CR, Weisburg WG, Hahn CM, et al. The phylogeny of purple bacteria: the gamma subdivision. Syst Appl Microbiol, 1985, 6(1): 25-33. DOI:10.1016/S0723-2020(85)80007-2
|
| [10] |
Troelstra SR, Wagenaar R, Boer W. Nitrification in Dutch heathland soils. Plant Soil, 1990, 127(2): 179-192. DOI:10.1007/BF00014424
|
| [11] |
Musiani F, Broll V, Evangelisti E, et al. The model structure of the copper-dependent ammonia monooxygenase. J Biol Inorg Chem, 2020, 25(7): 995-1007. DOI:10.1007/s00775-020-01820-0
|
| [12] |
李君文, 周娟, 王新为, 等. 亚硝酸细菌amoA基因的克隆、测序与表达. 应用与环境生物学报, 2004, 10(3): 345-348. Li JW, Zhou J, Wang XW, et al. Cloning, sequencing and expression of AmoA gene of nitrosbacteria. Chin J Appl Environ Biol, 2004, 10(3): 345-348 (in Chinese). DOI:10.3321/j.issn:1006-687X.2004.03.019 |
| [13] |
Schmidt FJ. Nitrogen in agricultural soils. J Am Soc Agron, 1982, 253-288.
|
| [14] |
Quastel JH, Scholefield PG, Stevenson JW. Oxidation of pyruvic-oxime by soil organisms. Nature, 1950, 166(4231): 940-942. DOI:10.1038/166940a0
|
| [15] |
Verstraete W, Alexander M. Heterotrophic nitrifiction by Arthrobacter sp... J Bacteriol, 1972, 110(3): 955-961. DOI:10.1128/jb.110.3.955-961.1972
|
| [16] |
Verstraete W, Alexander M. Heterotrophic nitrification in samples of natural ecosystems. Environ Sci Technol, 1973, 7(1): 39-42. DOI:10.1021/es60073a007
|
| [17] |
Daum M, Zimmer W, Papen H, et al. Physiological and molecular biological characterization of ammonia oxidation of the heterotrophic nitrifier Pseudomonas putida. Curr Microbiol, 1998, 37(4): 281-288. DOI:10.1007/s002849900379
|
| [18] |
Anderson IC, Poth M, Homstead J, et al. A comparison of NO and N2O production by the autotrophic nitrifier Nitrosomonas europaea and the heterotrophic nitrifier Alcaligenes faecalis. Appl Environ Microbiol, 1993, 59(11): 3525-3533. DOI:10.1128/aem.59.11.3525-3533.1993
|
| [19] |
Robertson LA, van Niel EW, Torremans RA, et al. Simultaneous nitrification and denitrification in aerobic chemostat cultures of thiosphaera pantotropha. Appl Environ Microbiol, 1988, 54(11): 2812-2818. DOI:10.1128/aem.54.11.2812-2818.1988
|
| [20] |
Stouthamer AH, de Boer APN, van der Oost J, et al. Emerging principles of inorganic nitrogen metabolism in Paracoccus denitrificans and related bacteria. Antonie Van Leeuwenhoek, 1997, 71(1/2): 33-41. DOI:10.1023/A:1000113824961
|
| [21] |
Robertson LA, Kuenen JG. Heterotrophic nitrification in thiosphaera pantotropha: oxygen uptake and enzyme studies. Microbiology, 1988, 134(4): 857-863. DOI:10.1099/00221287-134-4-857
|
| [22] |
Hynes RK, Knowles R. Inhibition by acetylene of ammonia oxidation in Nitrosomonas europaea. FEMS Microbiol Lett, 1978, 4(6): 319-321. DOI:10.1111/j.1574-6968.1978.tb02889.x
|
| [23] |
Wehrfritz JM, Reilly A, Spiro S, et al. Purification of hydroxylamine oxidase from Thiosphaera pantotropha: identification of electron acceptors that couple heterotrophic nitrification to aerobic denitrification. FEBS Lett, 1993, 335(2): 246-250. DOI:10.1016/0014-5793(93)80739-H
|
| [24] |
Robertson LA, Kuenen JG. Thiosphaera pantotropha gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium. Microbiology, 1983, 129(9): 2847-2855. DOI:10.1099/00221287-129-9-2847
|
| [25] |
Lu H, Weng ZH, Wei H, et al. Simultaneous bisphenol F degradation, heterotrophic nitrification and aerobic denitrification by a bacterial consortium. J Chem Technol Biotechnol, 2017, 92(4): 854-860. DOI:10.1002/jctb.5069
|
| [26] |
He X, Sun Q, Xu T, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel halotolerant bacterium Pseudomonas mendocina TJPU04. Bioprocess Biosyst Eng, 2019, 42(5): 853-866. DOI:10.1007/s00449-019-02088-8
|
| [27] |
Zhang N, Chen H, Lyu YK, et al. Nitrogen removal by a metal-resistant bacterium, Pseudomonas putida ZN1, capable of heterotrophic nitrification-aerobic denitrification. J Chem Technol Biotechnol, 2019, 94(4): 1165-1175. DOI:10.1002/jctb.5863
|
| [28] |
Yang JR, Wang Y, Chen H, et al. Ammonium removal characteristics of an acid-resistant bacterium Acinetobacter sp. JR1 from pharmaceutical wastewater capable of heterotrophic nitrification-aerobic denitrification. Bioresour Technol, 2019, 274: 56-64. DOI:10.1016/j.biortech.2018.10.052
|
| [29] |
闫苗苗, 张海涵, 钊珍芳, 等. 生物脱氮技术中好氧反硝化细菌的代谢及应用研究进展. 环境科学研究, 2020, 33(3): 668-676. Yan MM, Zhang HH, Zhao ZF, et al. Research progress of metabolism and application of aerobic denitrifying bacteria in biological denitrification technology. Res Environ Sci, 2020, 33(3): 668-676 (in Chinese). |
| [30] |
Houlton BZ, Bai E. Imprint of denitrifying bacteria on the global terrestrial biosphere. PNAS, 2009, 106(51): 21713-21716. DOI:10.1073/pnas.0912111106
|
| [31] |
Simon J, Klotz MG. Diversity and evolution of bioenergetic systems involved in microbial nitrogen compound transformations. Biochim Biophys Acta, 2013, 1827(2): 114-135. DOI:10.1016/j.bbabio.2012.07.005
|
| [32] |
Fujiwara T, Fukumori Y. Cytochrome cb-type nitric oxide reductase with cytochrome c oxidase activity from Paracoccus denitrificans ATCC 35512. J Bacteriol, 1996, 178(7): 1866-1871. DOI:10.1128/jb.178.7.1866-1871.1996
|
| [33] |
Kraft B, Strous M, Tegetmeyer HE. Microbial nitrate respiration — genes, enzymes and environmental distribution. J Biotechnol, 2011, 155(1): 104-117. DOI:10.1016/j.jbiotec.2010.12.025
|
| [34] |
苏婉昀, 高俊发, 赵红梅. 异养硝化-好氧反硝化菌的研究进展. 工业水处理, 2013, 33(12): 1-5. Su WY, Gao JF, Zhao HM. Research progress in heterotrophic nitrification-aerobic denitrification bacteria. Ind Water Treat, 2013, 33(12): 1-5 (in Chinese). |
| [35] |
Yao S, Ni J, Ma T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp.. HA2. Bioresour Technol, 2013, 139: 80-86. DOI:10.1016/j.biortech.2013.03.189
|
| [36] |
Zhang JB, Wu PX, Hao B, et al. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001. Bioresour Technol, 2011, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118
|
| [37] |
Padhi SK, Tripathy S, Sen R, et al. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater. Int Biodeterior Biodegrad, 2013, 78: 67-73. DOI:10.1016/j.ibiod.2013.01.001
|
| [38] |
Patureau D, Godon JJ, Dabert P, et al. Microvirgula aerodenitrificans gen. nov., sp. nov., a new Gram-negative bacterium exhibiting co-respiration of oxygen and nitrogen oxides up to oxygen-saturated conditions. Int J Syst Bacteriol, 1998, 48(Pt 3): 775-782.
|
| [39] |
Chen Q, Ni JR. Ammonium removal by Agrobacterium sp. LAD9 capable of heterotrophic nitrification-aerobic denitrification. J Biosci Bioeng, 2012, 113(5): 619-623. DOI:10.1016/j.jbiosc.2011.12.012
|
| [40] |
Chen P, Ji L, Li QX, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24. Bioresour Technol, 2012, 166: 266-270.
|
| [41] |
Xu N, Liao M, Liang Y, et al. Biological nitrogen removal capability and pathways analysis of a novel low C/N ratio heterotrophic nitrifying and aerobic denitrifying bacterium (Bacillus thuringiensis strain WXN-23). Environ Res, 2021, 195: 110797. DOI:10.1016/j.envres.2021.110797
|
| [42] |
Deng M, Zhao XL, Senbati Y, et al. Nitrogen removal by heterotrophic nitrifying and aerobic denitrifying bacterium Pseudomonas sp. DM02: removal performance, mechanism and immobilized application for real aquaculture wastewater treatment. Bioresour Technol, 2021, 322: 124555. DOI:10.1016/j.biortech.2020.124555
|
| [43] |
Yang T, Yang Q, Shi Y, et al. Insight into the denitrification mechanism of Bacillus subtilis JD-014 and its application potential in bioremediation of nitrogen wastewater. Process Biochem, 2021, 103: 78-86. DOI:10.1016/j.procbio.2021.02.007
|
| [44] |
Feng WW, Liu JF, Gu JD, et al. Nitrate-reducing community in production water of three oil reservoirs and their responses to different carbon sources revealed by nitrate-reductase encoding gene (NapA). Int Biodeterior Biodegrad, 2011, 65(7): 1081-1086. DOI:10.1016/j.ibiod.2011.05.009
|
| [45] |
Ji B, Yang K, Zhu L, et al. Aerobic denitrification: a review of important advances of the last 30 years. Biotechnol Bioprocess Eng, 2015, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0
|
| [46] |
Broda E. Two kinds of lithotrophs missing in nature. Z Allg Mikrobiol, 1977, 17(6): 491-493. DOI:10.1002/jobm.19770170611
|
| [47] |
Mulder A, van de Graaf AA, Robertson LA, et al. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiol Ecol, 1995, 16(3): 177-183. DOI:10.1111/j.1574-6941.1995.tb00281.x
|
| [48] |
Li J, Li J, Gao R, et al. A critical review of one-stage anammox processes for treating industrial wastewater: optimization strategies based on key functional microorganisms. Bioresour Technol, 2018, 265: 498-505. DOI:10.1016/j.biortech.2018.07.013
|
| [49] |
郑平, 张蕾. 厌氧氨氧化菌的特性与分类. 浙江大学学报(农业与生命科学版), 2009, 35(5): 473-481. Zheng P, Zhang L. Characterization and classification of anaerobic ammonium oxidation (anammox) bacteria. J Zhejiang Univ Agric Life Sci, 2009, 35(5): 473-481 (in Chinese). |
| [50] |
胡倩怡, 郑平, 康达. 厌氧氨氧化菌的种类、特性与检测. 应用与环境生物学报, 2017, 23(2): 384-391. Hu QY, Zheng P, Kang D. Taxonomy, characteristics, and biotechniques used for the analysis of anaerobic ammonium oxidation bacteria. Chin J Appl Environ Biol, 2017, 23(2): 384-391 (in Chinese). |
| [51] |
van Niftrik L, Geerts WJ, van Donselaar EG, et al. Linking ultrastructure and function in four genera of anaerobic ammonium-oxidizing bacteria: cell plan, glycogen storage, and localization of cytochrome C proteins. J Bacteriol, 2008, 190(2): 708-717. DOI:10.1128/JB.01449-07
|
| [52] |
van Niftrik LA, Fuerst JA, Damsté JSS, et al. The anammoxosome: an intracytoplasmic compartment in anammox bacteria. FEMS Microbiol Lett, 2004, 233(1): 7-13. DOI:10.1016/j.femsle.2004.01.044
|
| [53] |
van de Graaf AA, de Bruijn P, Robertson LA, et al. Metabolic pathway of anaerobic ammonium oxidation on the basis of 15N studies in a fluidized bed reactor. Microbiology, 1997, 143(7): 2415-2421. DOI:10.1099/00221287-143-7-2415
|
| [54] |
Gao DW, Wang XL, Liang H, et al. Anaerobic ammonia oxidizing bacteria: ecological distribution, metabolism, and microbial interactions. Front Environ Sci Eng, 2018, 12(3): 1-15. DOI:10.1007/s11783-018-1018-y
|
| [55] |
Strous M, Pelletier E, Mangenot S, et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome. Nature, 2006, 440(7085): 790-794. DOI:10.1038/nature04647
|
| [56] |
Fernández I, Vázquez-Padín JR, Mosquera-Corral A, et al. Biofilm and granular systems to improve anammox biomass retention. Biochem Eng J, 2008, 42(3): 308-313. DOI:10.1016/j.bej.2008.07.011
|
| [57] |
Dosta J, Fernández I, Vázquez-Padín JR, et al. Short-and long-term effects of temperature on the anammox process. J Hazard Mater, 2008, 154(1/2/3): 688-693.
|
| [58] |
Magrí A, Béline F, Dabert P. Feasibility and interest of the anammox process as treatment alternative for anaerobic digester supernatants in manure processing — an overview. J Environ Manag, 2013, 131: 170-184. DOI:10.1016/j.jenvman.2013.09.021
|
| [59] |
Oshiki M, Shimokawa M, Fujii N, et al. Physiological characteristics of the anaerobic ammonium-oxidizing bacterium 'Candidatus Brocadia sinica'. Microbiology, 2011, 157(6): 1706-1713. DOI:10.1099/mic.0.048595-0
|
| [60] |
Zhou Y, Oehmen A, Lim M, et al. The role of nitrite and free nitrous acid (FNA) in wastewater treatment plants. Water Res, 2011, 45(15): 4672-4682. DOI:10.1016/j.watres.2011.06.025
|
| [61] |
Wu MR, Miao LL, Liu Y, et al. A novel oxidase from Alcaligenes sp.. HO-1 oxidizes hydroxylamine to N2, 2020.
|
| [62] |
Chapuis-Lardy L, Wrage N, Metay A, et al. Soils, a sink for N2O? A review. Glob Chang Biol, 2007, 13(1): 1-17. DOI:10.1111/j.1365-2486.2006.01280.x
|
| [63] |
Kampschreur MJ, Temmink H, Kleerebezem R, et al. Nitrous oxide emission during wastewater treatment. Water Res, 2009, 43(17): 4093-4103. DOI:10.1016/j.watres.2009.03.001
|
| [64] |
Schimel JP, Firestone MK, Killham KS. Identification of heterotrophic nitrification in a sierran forest soil. Appl Environ Microbiol, 1984, 48(4): 802-806. DOI:10.1128/aem.48.4.802-806.1984
|
| [65] |
Adams JA. Identification of heterotrophic nitrification in strongly acid larch humus. Soil Biol Biochem, 1986, 18(3): 339-341. DOI:10.1016/0038-0717(86)90072-6
|
| [66] |
Duggin JA, Voigt GK, Bormann FH. Autotrophic and heterotrophic nitrification in response to clear-cutting northern hardwood forest. Soil Biol Biochem, 1991, 23(8): 779-787. DOI:10.1016/0038-0717(91)90149-E
|
| [67] |
杜睿, 王庚辰, 吕达仁. 内蒙古典型草原土壤N2O产生的机理探讨. 中国环境科学, 2000, 20(5): 387-391. Du R, Wang GC, Lü DR. Study on the mechanism of N2O production in typical grassland soils of Inner Mongolia. China Environ Sci, 2000, 20(5): 387-391 (in Chinese). DOI:10.3321/j.issn:1000-6923.2000.05.002 |
| [68] |
Joo HS, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4.. J Biosci Bioeng, 2005, 100(2): 184-191. DOI:10.1263/jbb.100.184
|
| [69] |
Joo HS, Hirai M, Shoda M. Piggery wastewater treatment using Alcaligenes faecalis strain No. 4 with heterotrophic nitrification and aerobic denitrification. Water Res, 2006, 40(16): 3029-3036. DOI:10.1016/j.watres.2006.06.021
|
| [70] |
Duan J, Fang H, Su B, et al. Characterization of a halophilic heterotrophic nitrification-aerobic denitrification bacterium and its application on treatment of saline wastewater. Bioresour Technol, 2015, 179: 421-428. DOI:10.1016/j.biortech.2014.12.057
|
| [71] |
Khanichaidecha W, Nakaruk A, Ratananikom K, et al. Heterotrophic nitrification and aerobic denitrification using pure-culture bacteria for wastewater treatment. J Water Reuse Desal, 2019, 9(1): 10-17. DOI:10.2166/wrd.2018.064
|
| [72] |
Voets P, Vanstaen H, Verstraete W. Removal of nitrogen from highly nitrogenous wastewaters. Journal of the Water Pollution Control Federation, 1975, 47: 394-398.
|
| [73] |
Chigwada G, Jash P, Jiang DD, et al. Fire retardancy of vinyl ester nanocomposites: synergy with phosphorus-based fire retardants. Polym Degrad Stab, 2005, 89(1): 85-100. DOI:10.1016/j.polymdegradstab.2005.01.005
|
| [74] |
尚会来, 彭永臻, 张静蓉, 等. 温度对短程硝化反硝化的影响. 环境科学学报, 2009, 29(3): 516-520. Shang HL, Peng YZ, Zhang JR, et al. The effect of temperature on short-cut nitrification and denitrification. Acta Sci Circumstantiae, 2009, 29(3): 516-520 (in Chinese). DOI:10.3321/j.issn:0253-2468.2009.03.008 |
| [75] |
Turk O, Mavinic DS. Maintaining nitrite build-up in a system acclimated to free ammonia. Water Res, 1989, 23(11): 1383-1388. DOI:10.1016/0043-1354(89)90077-8
|
| [76] |
Anthonisen AC, Loehr RC, Prakasam TB, et al. Inhibition of nitrification by ammonia and nitrous acid. J Water Pollut Control Fed, 1976, 48(5): 835-852.
|
| [77] |
Kuai L, Verstraete W. Ammonium removal by the oxygen-limited autotrophic nitrification-denitrification system. Appl Environ Microbiol, 1998, 64(11): 4500-4506. DOI:10.1128/AEM.64.11.4500-4506.1998
|
| [78] |
王薇, 蔡祖聪, 钟文辉, 等. 好氧反硝化菌的研究进展. 应用生态学报, 2007, 18(11): 2618-2625. Wang W, Cai ZC, Zhong WH, et al. Research advances in aerobic denitrifiers. Chin J Appl Ecol, 2007, 18(11): 2618-2625 (in Chinese). |
| [79] |
Windey K, De Bo I, Verstraete W. Oxygen-limited autotrophic nitrification-denitrification (OLAND) in a rotating biological contactor treating high-salinity wastewater. Water Res, 2005, 39(18): 4512-4520. DOI:10.1016/j.watres.2005.09.002
|
| [80] |
窦元. DO浓度对全程自养脱氮颗粒污泥脱氮效能的影响研究. 哈尔滨: 哈尔滨工业大学, 2015. Dou Y. Study on the impact of DO concentration on the denitrification effect of completely autotrophic nitrogen removal granular sludge. Harbin: Harbin Institute of Technology, 2015 (in Chinese). |
| [81] |
Strous M, Van Gerven E, Kuenen JG, et al. Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing (anammox) sludge. Appl Environ Microbiol, 1997, 63(6): 2446-2448. DOI:10.1128/aem.63.6.2446-2448.1997
|
| [82] |
郑平, 胡宝兰. 厌氧氨氧化菌混培物生长及代谢动力学研究. 生物工程学报, 2001, 17(2): 193-198. Zheng P, Hu BL. Kinetics of anaerobic ammonia oxidation. Chin J Biotechnol, 2001, 17(2): 193-198 (in Chinese). DOI:10.3321/j.issn:1000-3061.2001.02.018 |
| [83] |
Puyol D, Carvajal-Arroyo JM, Li GB, et al. High pH (and not free ammonia) is responsible for anammox inhibition in mildly alkaline solutions with excess of ammonium. Biotechnol Lett, 2014, 36(10): 1981-1986. DOI:10.1007/s10529-014-1564-8
|
| [84] |
翁皓琳, 张玉荣, 李强, 等. 厌氧氨氧化脱氮技术的研究进展. 净水技术, 2012, 31(3): 5-9. Weng HL, Zhang YR, Li Q, et al. Advances in research of anaerobic ammonium oxidation (ANAMMOX) for nitrogen removal. Water Purif Technol, 2012, 31(3): 5-9 (in Chinese). DOI:10.3969/j.issn.1009-0177.2012.03.002 |
| [85] |
朱杰, 黄涛, 范兴建, 等. 厌氧氨氧化工艺处理高氨氮养殖废水研究. 环境科学, 2009, 30(5): 1442-1448. Zhu J, Huang T, Fan XJ, et al. Treatment of ANAMMOX technique on treating high concentration poultry wastewater. Environ Sci, 2009, 30(5): 1442-1448 (in Chinese). DOI:10.3321/j.issn:0250-3301.2009.05.032 |
| [86] |
Wu L, Shen M, Li J, et al. Cooperation between partial-nitrification, complete ammonia oxidation (comammox), and anaerobic ammonia oxidation (anammox) in sludge digestion liquid for nitrogen removal. Environ Pollut, 2019, 254(pt a): 112965.
|
| [87] |
Ma M, Ye AY, Zheng W, et al. A guide RNA sequence design platform for the CRISPR/Cas9 system for model organism genomes. Biomed Res Int, 2013, 2013: 270805.
|
 2021, Vol. 37
2021, Vol. 37




