中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李丛娜, 姜顺, 杜超, 周玉玲, 蒋思婧, 张桂敏
- Li Congna, Jiang Shun, Du Chao, Zhou Yuling, Jiang Sijing, Zhang Guimin
- 凝结芽孢杆菌耐热β-N-乙酰氨基葡萄糖苷酶在大肠杆菌的分泌表达及其在制备GlcNAc中的应用
- Expression and characterization of β-N-acetylglucosaminidases from Bacillus coagulans DSM1 for N-acetyl-β-D glucosamine production
- 生物工程学报, 2021, 37(1): 218-227
- Chinese Journal of Biotechnology, 2021, 37(1): 218-227
- 10.13345/j.cjb.200190
-
文章历史
- Received: April 7, 2020
- Accepted: June 3, 2020
- Published: September 3, 2020
N-乙酰-β-D氨基葡萄糖(GlcNAc)是细菌细胞壁肽聚糖的结构元件,是虾壳蟹壳、大多数真菌细胞壁的主要成分[1-3],具有保护软骨组织及骨关节的作用,在治疗关节和肠道炎症等方面表现出显著的效果[4];GlcNAc可以帮助透明质酸的合成和胶原蛋白的表达,改善皮肤皱纹和色素沉积,可以添加在护肤品中,因而它在化妆品领域也有广泛的应用[5]。生产GlcNAc的方法主要有3种,即微生物发酵法、酸水解法及酶解法。如Li等[6]从中国台湾土壤样品中分离到一株气单胞菌DYU-BT4,以几丁质颗粒为底物进行发酵实验,最终培养基中GlcNAc的浓度为0.88 g/L。而酸水解法,主要是通过强酸水解几丁质生产GlcNAc单体,但该方法会产生大量废水,副产物多且设备损耗严重。对于酶法制备GlcNAc,由于酶水解反应专一性强、条件温和,因而具有产物纯度高、得率高、分离纯化容易和环境友好等优点,是GlcNAc产业发展的技术方向。
几丁质酶包括内切几丁质酶、外切几丁质酶和N-乙酰-β-D氨基葡萄糖苷酶(NAGases,EC 3.2.1.30),广泛存在于微生物、甲壳动物和某些植物中。其中NAGases能特异催化水解β-1, 4-糖苷键,从壳二糖及其聚合物和衍生物等的末端水解产生N-乙酰氨基葡萄糖[7]。NAGases虽然能将几丁质直接水解为GlcNAc,但是由于其外切的水解机制和低酶活力,其水解效率很低。因此要实现几丁质到GlcNAc的高效转化,需要NAGases与其他酶的协同作用:如与内切几丁质酶协同作用,几丁质在内切几丁质酶的作用下变成几丁寡糖,随后被NAGases水解成GlcNAc;或者在外切几丁质酶将几丁质水解为几丁二糖的基础上,NAGases进一步将几丁二糖水解为GlcNAc。目前内切几丁质酶和外切几丁质酶的研究工作非常成熟,已有商品化的内切几丁质酶和外切几丁质酶,但是NAGases的活性均不高,这限制了酶法制备GlcNAc的工业化应用。
目前已发现的NAGases分别属于糖苷水解酶GH 3、20、73和84这4个家族(http://www.cazy.org/),多个NAGases的酶学性质和结构被解析[8-9],其中,GH 3家族的NAGases成员最多,特别是来自枯草芽孢杆菌的BsNagZ,其酶学性质和结构都得到了解析,并鉴定了其催化活性位点[10]。我们前期通过密码子优化及多拷贝构建,首次在毕赤酵母中实现了BsNagZ的表达[11],但是BsNagZ的活性不高、稳定性不好,因此需要挖掘新的NAGases资源,获得稳定性更好的NAGases。凝结芽孢杆菌Bacillus coagulans是美国FDA批准可以用于饲料的安全菌株,由于能生成芽孢,除具有一般乳酸菌的有益性质外,凝结芽孢杆菌可在30–65 ℃生长,所产芽孢耐90 ℃高温,因此具有较好的耐热性。从B. coagulans DSM 1菌株的全基因组数据库中,我们找到了一个基因功能注释为GH 3家族的N-乙酰-β-D氨基葡萄糖苷酶BcNagZ,与BsNagZ的同源性只有32.3%。本研究以B. coagulans DSM1的全基因组作为模板,通过PCR反应得到BcNagZ,将其转入大肠杆菌中,实现了BcNagZ的分泌表达,并对该酶进行了表征和水解几丁质制备GlcNAc的研究。
1 材料与方法 1.1 材料大肠杆菌Escherichia coli XL10-Gold克隆菌株和E. coli BL21(DE3)表达菌株购自Transgene公司;pET-26b质粒购自Stratagene公司。
Pfu DNA聚合酶、T4 DNA连接酶、BamH Ⅰ和NotⅠ酶购自TaKaRa公司;Yeast Extract、Tryptone、pNP-β-GlcNAc、IPTG和Tris试剂购自Sigma公司,SDS-PAGE检测试剂、质粒DNA抽提试剂盒、DNA凝胶回收试剂盒、卡那霉素以及其他常规试剂和药品购自国药集团。
1.2 氨基酸序列分析与蛋白结构模拟分析用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP)分析BcNagZ有无信号肽序列。通过ClustalX进行氨基酸多序列比对分析,并用ESPript分析蛋白的氨基酸保守区域。
1.3 重组表达质粒构建以B. coagulans DSM1的基因组DNA为模板,以BcNagZ-F (5′-TCGAGCTCCAAACAGGA TGGGCATTGGAGAACAA-3′)和BcNagZ-R (5′-G TGCGGCCGCGTAATGAAGACCGTGGCCGAACG-3′)为引物(引物序列中下划线碱基表示限制性内切酶酶切位点),PCR扩增目的基因BcNagZ。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30个循环;终延伸72 ℃ 5 min。PCR产物用DNA凝胶回收试剂盒回收后,用限制性内切酶BamH Ⅰ和NotⅠ双酶切,并与经同样酶切的pET-26b载体在T4 DNA连接酶的介导下连接,连接产物转化E. coli XL100-Gold,涂布于含50 µg/mL卡那霉素的LB平板上培养;经菌落PCR和提取质粒酶切分析,筛选得到重组质粒,测序验证正确。
1.4 BcNagZ在大肠杆菌中的表达与纯化将重组表达质粒转化E. coli BL21(DE3),得到了表达菌株。将该菌株单菌落接种于5 mL含50 μg/mL卡那霉素的LB培养基中,37 ℃振荡培养过夜,然后按1%的接种量转接到25 mL含50 μg/mL卡那霉素的TB培养基中,相同条件下培养,培养至OD600达到2.2时,加入IPTG (终浓度0.5 mmol/L),28 ℃继续培养30 h后,4 ℃离心收集发酵上清液。将发酵上清液加入到用溶液A (25 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.0)预先平衡的5 mL HisTrap中,随后用含10 mmol/L咪唑的溶液A洗脱,最后用500 mmol/L的溶液A将目的蛋白洗脱下来。洗脱下来的蛋白用Amicon Ultracentricon超滤浓缩,然后用脱盐柱(琼葡糖凝胶G25 FF)经AKATA进行脱盐,去除咪唑。纯化后的BcNagZ用于酶学性质分析和几丁质降解研究。
1.5 BcNagZ的性质分析酶活力测定方法:以4-硝基-N-乙酰-β-D氨基葡萄糖(pNP-β-GlcNAc)为底物测定酶活力,取10 μL稀释的酶液,加入90 μL 0.5 µmol/L的pNP-β-GlcNAc底物,在合适的条件下反应10 min,然后加入200 μL 0.2 mol/L Na2CO3终止反应,在405 nm处检测反应物的吸光度。酶活力单位(U)定义为:在适宜条件下,每分钟水解底物产生1 μmol的pNP所需的酶量。
最适反应温度的测定:在30–100 ℃间选择了15个不同的温度,在pH 5.5条件下测定酶的活力。
热稳定性的测定:将纯化的酶液分别置于65 ℃、70 ℃、75 ℃,分别孵育10、20、30 min,立即置于冰水混合物中,在最适条件下测定残余的酶活力,以未经热处理的酶活力作为100%对照。
最适pH的测定:选择4.0–8.0之间9个不同的pH (100 mmol/L的磷酸盐缓冲液,pH 4.0–8.0),在75 ℃测定酶活力。
pH稳定性测定:先将酶液分别用不同pH的缓冲液稀释,4 ℃静置12 h,然后在75 ℃、pH 5.5条件下测定残余的酶活力,以未经不同pH条件下处理的酶液为100%对照。
金属离子对酶活性的影响:在酶解反应体系中分别加入5 mmol/L不同的金属离子溶液,在最适反应条件下测定NagZ的酶活力,以不加金属离子测得的酶活力为100%对照。
动力学参数测定:以浓度分别为1、2、3、4、5、6、7、8 mmol/L的pNP-β-GlcNA为底物,在75 ℃、pH 5.5条件下反应,利用酶标仪记录OD405处吸光值,绘制曲线,计算出每个底物浓度对应的酶反应初速度,然后用双倒数法作图,计算动力学参数。
1.6 GlcNAc标准曲线绘制用HPLC法绘制GlcNAc浓度的标准曲线。用去离子水配制0、100、200、300、400、500 μg/mL的GlcNAc标准品溶液。取20 μL过滤液进行HPLC (安捷伦高效液相色谱站)检测,检测流动相为70%乙腈(乙腈︰水=70︰30,V/V),检测流速为1 mL/min,检测温度为30 ℃,检测波长为190 nm。记录标准品的浓度和对应的峰面积,作出标准品的浓度和峰面积的标准曲线。
1.7 水解产物检测及GlcNAc得率计算参照Hsu等[12]制备胶体几丁质的方法,制备胶体几丁质底物。在350 μL酶解体系中,加入300 μL 5%的胶体几丁质底物和50 μL纯化的BcNagZ酶液(10 U/mL),在60 ℃、pH 5.5条件下水解2 h。在联合酶解时,在10 mL酶解体系中,加入8 mL 5%的胶体几丁质底物和2 mL AMcase (0.252 U/mL),在55 ℃、pH 2.0条件下水解2 h,水解完成后,100 ℃灭活10 min,并调节pH至5.5,取300 μL水解产物,加入BcNagZ 50 μL (10 U/mL)在60 ℃继续水解10、20、30 min。样品在100 ℃加热10 min后经高速离心,上清用0.45 μm滤膜过滤,取20 μL过滤液进行HPLC检测,分析水解产物。
GlcNAc得率计算:酶解完成后,HPLC检测水解产物,并通过标准曲线计算得出水解产物中GlcNAc的浓度,从而计算出水解体系总生成的GlcNAc的质量。再采用干燥法计算5%胶体几丁质底物中几丁质的总含量,具体操作是取1 mL 5%胶体几丁质,烘干后称取固体的质量即为几丁质的质量。最后将生成GlcNAc的质量除以所用几丁质的质量乘百分之百就得到GlcNAc的得率。
2 结果与分析 2.1 NagZ保守结构域和催化活性中心的分析BcNagZ基因由1 686 bp组成,编码561个氨基酸;BcNagZ计算分子量是61.3 kDa,等电点为9.02。SignalP 4.1 Server分析显示BcNagZ N端有28个氨基酸的信号肽序列。以去掉N端信号肽的BcNagZ氨基酸序列进行Blast比对,发现其与已经报道的来源于嗜热链霉菌Streptomyces thermoviolaceus的NagA (GenBank登录号:AB0087771.1)、短小芽孢杆菌Bacillus pumilus的BpNagZ (GenBank登录号:MK559425)、枯草芽孢杆菌Bacillus subtilis 168的BsNagZ (GenBank登录号:CAB11942.1)、假坚强芽孢杆菌Bacillus pseudofirmus OF4的NagZ703 (GenBank登录号:ADC51622.1)和交替单胞菌属Alteromonas sp. strain O-7的Cht 60 (GenBank登录号:D17399.1)氨基酸序列同源性分别为43.32%、34.96%、32.3%、30.24%和29.95%。将BcNagZ与这5个酶进行多序列氨基酸同源比对,发现该蛋白有NAGases特有的高度保守的N端序列KH(F/I)PG(H/L)GX(4)D(S/T)H,这是NAGases识别底物中乙酰氨基基团的特征序列,其中第225位的天冬氨酸(D)与第227位的组氨酸(H)构成催化二联体,与后面300位天冬氨酸(D)构成酶的催化活性中心(图 1)。

|
| 图 1 BcNagZ与GH3家族的βN乙酰葡糖胺糖苷酶的氨基酸序列比对分析 Fig. 1 Multiple sequences alignments of BcNagZ with GH 3 NAGases. Strictly conserved residues are indicated in white letters on a black background, and conservatively substituted residues are boxed. The highly conserved sequence segment KH(F/I)PG(H/L)GX(4)D(S/T)H are shown in black boxes. The catalytic active sites (D225, H227, D300) are indicated by black solid triangle. |
| |
将构建好的重组质粒pET-26b-BcNagZ转入E. coli BL21(DE3)中,挑取正确的转化子BL21(DE3)-pET-26b-BcNagZ进行摇瓶诱导发酵,加入终浓度0.5 mmol/L的IPTG,于28 ℃诱导30 h后,取发酵上清液,进行酶活性测定和蛋白质纯化。SDS-PAGE分析显示发酵上清中有一条明显的61.3 kDa大小的蛋白带,与BcNagZ计算分子量的大小一致,重组BcNagZ的表达量达到了0.76 mg/mL,占发酵上清总蛋白的65.8%,但是,约有50%的BcNagZ仍滞留在细胞内(图 2)。将重组BcNagZ进行纯化,其比活力达5.918 U/mg (表 1)。

|
| 图 2 表达和纯化的BcNagZ的SDS-PAGE分析 Fig. 2 SDS-PAGE analysis of the BcNagZ after fermentation and purification. M: prestained protein ladder (250, 150, 100, 75, 50, 37, 25 and 20 kDa); 1: the lysis supernatant of induced E. coli BL21(DE3)/ pET-26b-BcNagZ cells; 2: fermentation supernatant of induced E. coli BL21(DE3)/pET-26b-BcNagZ cells; 3: BcNagZ after purification via Ni-NTA affinity column; 4: BcNagZ after purification through desalting column. |
| |
| Purification | Total protein (mg) | Total activity (U) | Specific activity (U/mg) | Purification (-fold) |
| Crude enzyme | 164 | 323 | 1.953 | 1 |
| Ni-column | 37.40 | 212.77 | 5.689 | 2.913 |
| Desalting column | 11.94 | 70.66 | 5.918 | 3.030 |
在pH 5.5 (50 mmol/L磷酸钠缓冲液)条件下测定最适温度,结果显示BcNagZ的最适温度为75 ℃,在60–80 ℃之间有60%以上的相对活性。但是BcNagZ在75 ℃的热稳定性不好,75 ℃处理10 min后,只有10%的残余酶活力;在70 ℃、65 ℃下孵育30 min,分别还有60%和85%的残余酶活力(图 3);60 ℃孵育30 min,还有90%以上的残余酶活力,延长时间至1 h,酶的活性依旧保持90%以上(数据未显示)。

|
| 图 3 反应温度对BcNagZ酶活性(A)和稳定性(B)的影响 Fig. 3 Effect of temperature on the activity (A) and stability (B) of BcNagZ. |
| |
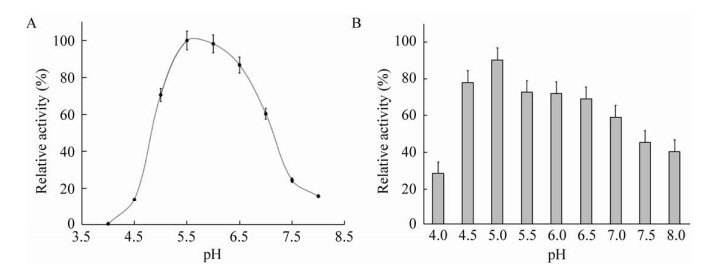
在最适温度75 ℃条件下测定BcNagZ的最适反应pH,表明BcNagZ的最适pH为5.5,在pH 5.0–7.0之间有60%以上的相对活性。BcNagZ在pH 4.5–6.5范围内保持稳定,维持70%以上的残余活力,而在pH 7.5–8.0条件下,BcNagZ只有40%的残余酶活力。这说明BcNagZ在弱酸性的环境下更稳定(图 4)。
|
| 图 4 pH对BcNagZ酶活性(A)和稳定性(B)的影响 Fig. 4 Effect of pH on the activity (A) and stability (B) of BcNagZ. |
| |
在酶反应体系中,加入不同的金属离子,在pH 5.5、75 ℃条件下反应10 min,同时以不加金属离子的反应组作为对照,测定不同金属离子对BcNagZ活性的影响。研究表明,5 mmol/L的Cu2+和Hg2+几乎完全抑制了BcNagZ的活性,Co2+对BcNagZ酶活力也有很强的抑制作用,而其他离子的影响较小。5 mmol/L的EDTA对酶活力几乎没有影响,说明BcNagZ不是金属依赖性酶。有机试剂甲醛也使BcNagZ几乎完全丧失酶活力,醇对酶活力也有一定的抑制作用(表 2)。
| Metal ions or chemical reagents | Concentration (mmol/L) | Relative enzyme activity (%) | Metal ions or chemical reagents | Concentration | Relative enzyme activity (%) |
| Control | 0 | 100.00±1.54 | Co2+ (CoCl2) | 5 mmol/L | 34.80±10.54 |
| Li+ (LiCl) | 5 | 94.20±1.52 | EDTA | 5 mmol/L | 95.89±4.63 |
| K+ (KCl) | 5 | 91.26±2.90 | Methanol | 5% | 79.98±0.19 |
| Na+ (NaCl) | 5 | 92.29±1.58 | Alcohol | 5% | 59.68±3.81 |
| Mg2+ (MgCl2) | 5 | 102.15±0.92 | Isopropanol | 5% | 60.88±1.27 |
| Mn2+ (MnCl2) | 5 | 93.52±2.31 | Glycerol | 5% | 102.33±2.13 |
| Ca2+ (CaCl2) | 5 | 94.62±0.18 | Formaldehyde | 5% | 7.14±0.04 |
| Cu2+ (CuCl2) | 5 | 2.88±0.91 | DSMO | 5% | 106.66±1.08 |
| Hg2+ (HgCl2) | 5 | 1.06±0.56 |
控制pNP-β-GlcNAc底物浓度为1、2、3、4、5、6、7、8 mmol/L,得到不同底物浓度下酶促反应的初速度,采用双倒数法,计算得到Km和Vmax的值分别为0.23 mmol/L和0.043 1 mmol/(L·min)。
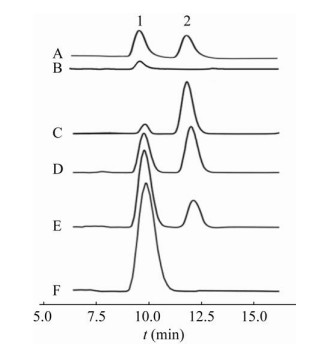
2.4 BcNagZ水解胶体几丁质产生GlcNAc虽然BcNagZ的最佳反应温度为75 ℃,但是在75 ℃孵育10 min后,该酶的酶活力下降了83.5%;在60 ℃时,该酶有90%以上的相对活性,并且处理30 min还保持稳定(图 3),因此我们选择在60 ℃进行水解反应。以N-乙酰氨基葡萄糖(GlcNAc)和N-N′-乙酰氨基壳二糖(GlcNAc)作为标准品(图 5A),通过HPLC分析BcNagZ单独水解胶体几丁质的酶解产物,发现有少量的GlcNAc单糖产生(图 5B),这说明BcNagZ确实具有外切乙酰氨基葡萄糖苷酶的活性,可以从胶体几丁质末端逐个水解产生GlcNAc单体。为了提高BcNagZ的水解效率,我们将胶体几丁质先用外切几丁质酶AMcase[10]处理2 h,通过HPLC检测发现胶体几丁质大部分都转化为二糖(图 5C),随后加入BcNagZ继续水解,在30 min内,二糖被迅速转化为单糖(图 5D–F)。根据单糖浓度和峰面积的标准曲线,计算得到单糖的得率为86.93%。
|
| 图 5 BcNagZ的水解产物分析 Fig. 5 Enzymatic production of GlcNAc by BcNagZ. A: standard of GlcNAc (peak 1) and N, N′-diacetylchitobiose (peak 2). B: the hydrolysis product of colloidal chitin by recombinant BcNagZ for 2 h at 60 ℃. C: the hydrolysis product of colloidal chitin by AMcase for 2 h. D–F: the hydrolysis product of colloidal chitin by AMcase for 2 h at 55 ℃ and then recombinant BcNagZ for 10, 20, 30 min at 60 ℃. |
| |
本研究从凝结芽孢杆菌B. coagulans DSM1中克隆得到一个新的NAGase基因BcNagZ,并在大肠杆菌表达系统中实现了分泌表达,在此之前,异源表达NAGases的宿主虽然主要也是大肠杆菌[8, 13],但都是在细胞内表达的[14-15],纯化蛋白时需要裂解细胞,这增加了纯化的步骤,不利于酶的工业应用。在本研究中,我们将BcNagZ基因构建到pET-26b载体上,利用载体的pelB信号肽将蛋白带到周质空间,并且通过延长诱导时间,使约一半的BcNagZ分泌至胞外。通过SDS-PAGE发现上清中有些许杂蛋白,而BcNagZ占上清蛋白总量的65.8%左右,这可能是因为诱导时间增加,同时BcNagZ对细胞壁也有水解能力导致的。虽然Jiang等[11]利用毕赤酵母也实现了BsNagZ的分泌表达,但是酵母培养周期长。与酵母表达系统相比,大肠杆菌表达系统具有遗传背景清楚、繁殖快、成本低、表达量高、表达产物容易纯化、稳定性好、抗污染能力强以及适用范围广等优点[16]。因此本研究工作在大肠杆菌中实现了BcNagZ蛋白的分泌表达,不仅缩短了表达周期,同时也大大简化了蛋白纯化的工艺。
重组BcNagZ的最适pH为5.5,最适温度为75 ℃,属于高温酶。到目前为止,只有少数NAGases报道在60 ℃及以上有较高的酶活力,如来源于B. substilis的BsNagZ[11]、B. pumilus的BpNagZ[8]、新阿波罗栖热袍菌Thermotoga neapolitana的CbsA[9]、嗜热共生小杆菌Symbiobacterium thermophilum的NahA[17]和海栖热袍菌Thermotoga maritima的NagA[18]。其中,BpNagZ的热稳定性最好,其在70 ℃孵育30 min后,还有40%的残余酶活力。而BcNagZ在70 ℃孵育30 min后,还有60%的残余酶活力。因此,BcNagZ是目前报道的在70 ℃热稳定性最好的NAGase。有报道称脯氨酸和缬氨酸可以通过减少蛋白去折叠时的骨架熵和增强蛋白间的疏水相互作用来增加蛋白质的热稳定性[19]。在Du等[8]的研究中通过定点突变,也证明了脯氨酸对BpNagZ热稳定性的影响;Suzuki等也提出了一个脯氨酸影响热稳定性的规律,即球状蛋白质的热稳定性可以通过增加β-turns第二个转角、α-helix第一个转角或位于蛋白质线圈区的脯氨酸残基含量来提高[20]。我们比较BcNagZ和BpNagZ中这两种氨基酸含量时发现,BcNagZ的脯氨酸和缬氨酸的含量分别为5.88%和8.38%,而BpNagZ的脯氨酸和缬氨酸含量分别为5.38%和7.99%,这可能是BcNagZ比BpNagZ热稳定性好的原因之一。
动力学数据显示BcNagZ的Km和kcat的值分别为230 μmol/L和0.091 s–1,比BpNagZ[8] (90.74 μmol/L)的Km值高,但是比其他的NAGases如NagZ703 (276 μmol/L)[21]和rNag3HWLB1 (1 120 μmol/L)[22]的Km值都低,说明BcNagZ对4-NPGlcNAc的亲和力比大多数NAGases蛋白都高。目前已经报道的GH3家族的NAGases的比酶活最高的是来自海栖热袍菌Thermotoga maritima的NagA[18],有64.4 U/mg,但是Km达到425 μmol/L,Vmax为0.025 mmol/(L·min)。而本研究的BcNagZ的比酶活虽然只有5.918 U/mg,但是Km比NagA低,Vmax比NagA高,这说明BcNagZ的催化能力很有可能比NagA高,而比酶活比NagA低很可能是由于不同实验室在酶活测定中的误差。但是和本实验室发表的另外3个芽孢杆菌属来源的βN乙酰氨基葡萄糖苷酶相比,BcNagZ的酶活力是最低的,推测可能是由于BcNagZ的热稳定性高,导致酶的灵活性不足,从而影响了酶的催化活性。
几丁质是一种结构很稳定的大分子多糖聚合物,βN乙酰氨基葡萄糖苷酶的作用特点决定了它对几丁质的水解效率十分低下,因此需要几丁质酶的帮助[23]。Fu等报道了将几丁质酶C与N-乙酰己糖胺酶一起水解几丁质,反应24 h后,得到了27.8 mg/mL的GlcNAc,其转化率为92.6%[24]。Zhou等将几丁质酶CtnSg和N-乙酰氨基葡萄糖苷酶rNag3HWLB1一起使用,与单独添加酶相比,胶体几丁质的水解效率增加了3.74倍[22]。同样,Wang等将几丁质酶BsChi与N-乙酰氨基葡萄糖苷酶Of Hex1联合水解10 g预先处理过的蟹壳12 h后,得到1.63 g纯度为95%的GlcNAc,并假定蟹壳中几丁质的含量为26.6%,计算出得率大约为60%[25]。在本研究中,我们尝试将几丁质酶与BcNagZ协同作用来水解几丁质,首先利用本实验室在P. pastoris中表达的几丁质二糖酶AMCase (未发表)水解胶体几丁质,2 h可以将胶体几丁质几乎完全水解为(GlcNAc)2;然后加入BcNagZ继续反应,30 min即可将(GlcNAc)2完全水解成GlcNAc;通过计算,GlcNAc得率可达86.93%。这个数值虽然低于Fu等[24]的92.6%的转化率,但整个反应过程只需要2.5 h,大大缩短了酶水解的时间,为工业上酶法水解胶体几丁质制备GlcNAc奠定了基础。
| [1] |
Hamid R, Khan MA, Ahmad M, et al. Chitinases: an update. J Pharm Bioallied Sci, 2013, 5(1): 21-29. DOI:10.4103/0975-7406.106559 |
| [2] |
Konopka JB. N-acetylglucosamine functions in cell signaling. Scientifica, 2012, 2012: 489208. |
| [3] |
Adrangi S, Ail Faramarzi M. From bacteria to human: A journey into the world of chitinases. Biotechnol Adv, 2013, 31(8): 1786-1795. DOI:10.1016/j.biotechadv.2013.09.012 |
| [4] |
Zhou JP, Song ZF, Zhang R, et al. A Shinella β-N-acetylglucosaminidase of glycoside hydrolase family 20 displays novel biochemical and molecular characteristics. Extremophiles, 2017, 21(4): 699-709. DOI:10.1007/s00792-017-0935-1 |
| [5] |
Chen JK, Shen CR, Liu CL. N-acetylglucosamine: production and applications. Mar Drugs, 2010, 8(9): 2493-2516. DOI:10.3390/md8092493 |
| [6] |
Li YL, Wu T, Yu ST, et al. Screening of a microbe to degrade chitin. Taiwanese J Agric Chem Food Sci, 2005, 43(6): 410-418. |
| [7] |
Litzinger S, Duckworth A, Nitzsche K, et al. Muropeptide rescue in Bacillus subtilis involves sequential hydrolysis by β-N-acetylglucosaminidase and N-acetylmuramyl-L-alanine amidase. J Bacteriol, 2010, 192(12): 3132-3143. DOI:10.1128/JB.01256-09 |
| [8] |
Du C, Jiang S, Zhou YL, et al. A Bacillus pumilus originated β-N-acetylglucosaminidase for chitin combinatory hydrolysis and exploration of its thermostable mechanism. Int J Biol Macromol, 2019, 132: 1282-1289. DOI:10.1016/j.ijbiomac.2019.04.054 |
| [9] |
Kim JS, Yoon BY, Ahn J, et al. Crystal structure of β-N-acetylglucosaminidase CbsA from Thermotoga neapolitana. Biochem Biophys Res Commun, 2015, 464(3): 869-874. DOI:10.1016/j.bbrc.2015.07.053 |
| [10] |
Litzinger S, Fischer S, Polzer P, et al. Structural and kinetic analysis of Bacillus subtilis N-acetylglucosaminidase reveals a unique Asp-His dyad mechanism. J Biol Chem, 2010, 285(46): 35675-35684. DOI:10.1074/jbc.M110.131037 |
| [11] |
Jiang S, Jiang HY, Zhou YL, et al. High-level expression of β-N-Acetylglucosaminidase BsNagZ in Pichia pastoris to obtain GlcNAc. Bioproc Biosyst Eng, 2019, 42(4): 611-619. DOI:10.1007/s00449-018-02067-5 |
| [12] |
Chen JK, Shen CR, Yeh CH, et al. N-acetylglucosamine obtained from chitin by chitin degrading factors in Chitinbacter tainanesis. Int J Mol Sci, 2011, 12(2): 1187-1195. DOI:10.3390/ijms12021187 |
| [13] |
Finch AJ, Kim JR. Thermophilic proteins as versatile scaffolds for protein engineering. Microorganisms, 2018, 6(4): E97. DOI:10.3390/microorganisms6040097 |
| [14] |
Kumar V, Dangi AK, Shukla P. Engineering thermostable microbial xylanases toward its industrial applications. Mol Biotechnol, 2018, 60(3): 226-235. DOI:10.1007/s12033-018-0059-6 |
| [15] |
Yang SQ, Song S, Yan QJ, et al. Biochemical characterization of the first fungal glycoside hydrolyase family 3 β-N-acetylglucosaminidase from Rhizomucor miehe. J Agric Food Chem, 2014, 62(22): 5181-5190. DOI:10.1021/jf500912b |
| [16] |
Lee PS, Lee KH. Escherichia coli: A model system that benefits from and contributes to the evolution of proteomics. Biotechnol Bioeng, 2003, 84(7): 801-814. DOI:10.1002/bit.10848 |
| [17] |
Ogawa M, Kitagawa M, Tanaka H, et al. A β-N-acetylhexosaminidase from Symbiobacterium thermophilum; gene cloning, overexpression, purification and characterization. Enzyme Microb Technol, 2006, 38(3/4): 457-464. |
| [18] |
Choi KH, Seo JY, Park KM, et al. Characterization of glycosyl hydrolase family 3 β-N-acetylglucosaminidases from Thermotoga maritima and Thermotoga neapolitana. J Biosci Bioeng, 2009, 108(6): 455-459. DOI:10.1016/j.jbiosc.2009.06.003 |
| [19] |
Zscherp C, Aygün H, Engels JW, et al. Effect of proline to alanine mutation on the thermal stability of the all-β-sheet protein tendamistat. Biochim Biophys Acta Prot Proteom, 2003, 1651(1/2): 139-145. |
| [20] |
Suzuki Y. The proline rule: A strategy for protein thermal stabilization. Proc Jpn Acad, 1999, 75(6): 133-137. DOI:10.2183/pjab.75.133 |
| [21] |
Jiang S, Hao SH, Xiang L, et al. A new N-acetylglucosaminidase from facultative alkaliphilic Bacillus pseudofirmus 703. Acta Microbiol Sin, 2020, 60(1): 69-80 (in Chinese). 姜顺, 郝少华, 向腊, 等. 一种来源于兼性嗜碱菌Bacillus pseudofirmus 703的β-N-乙酰氨基葡萄糖苷酶. 微生物学报, 2020, 60(1): 69-80. |
| [22] |
Zhou JP, Song ZF, Zhang R, et al. Characterization of a NaCl-tolerant β-N-acetylglucosaminidase from Sphingobacterium sp. HWLB1. Extremophiles, 2016, 20(4): 547-557. DOI:10.1007/s00792-016-0848-4 |
| [23] |
Nguyen-Thi N, Doucet N. Combining chitinase C and N-acetylhexosaminidase from Streptomyces coelicolor A3(2) provides an efficient way to synthesize N-acetylglucosamine from crystalline chitin. J Biotechnol, 2016, 220: 25-32. DOI:10.1016/j.jbiotec.2015.12.038 |
| [24] |
Fu X, Yan QJ, Yang SQ, et al. An acidic, thermostable exochitinase with β-N-acetylglucosaminidase activity from Paenibacillus barengoltzii converting chitin to N-acetylglucosamine. Biotechnol Biofuels, 2014, 7: 174-185. |
| [25] |
Wang D, Li AJ, Han HY, et al. A potent chitinase from Bacillus subtilis for the efficient bioconversion of chitin-containing wastes. Int J Biol Macromol, 2018, 116: 863-868. DOI:10.1016/j.ijbiomac.2018.05.122 |
 2021, Vol. 37
2021, Vol. 37