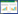中国科学院微生物研究所、中国微生物学会主办
文章信息
- 曾伟主, 谭润卿, 周景文
- Zeng Weizhu, Tan Runqing, Zhou Jingwen
- 齐整小核菌内源小核菌胶水解酶的挖掘及其功能验证
- Discovery and functional verification of endogenous glucanases for scleroglucan hydrolysis in Sclerotium rolfsii
- 生物工程学报, 2021, 37(1): 207-217
- Chinese Journal of Biotechnology, 2021, 37(1): 207-217
- 10.13345/j.cjb.200236
-
文章历史
- Received: April 28, 2020
- Accepted: July 23, 2020
2. 江南大学 生物工程学院,江苏 无锡 214122;
3. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
小核菌胶(又称硬葡聚糖,scleroglucan)是一种非离子型的水溶性微生物胞外多糖,由β-1, 3-吡喃葡萄糖和β-1, 6-吡喃葡萄糖残基连接而成,平均每3个β-1, 3糖苷键连接的主链单元连接1个β-1, 6糖苷键的侧链。这种重复单元结构使小核菌胶分支度达0.33左右[1-2]。小核菌胶除了具有大多数β-1, 3葡聚糖共有的生物活性特征外,高分支化频率使其具有高水溶性特点[3]。由于独特的化学结构和高分子量特性,小核菌胶具有良好的水溶性、假塑性、保湿性、耐盐性和粘度稳定性,广泛应用于食品、生物医药、石油化工和化妆品等行业[4-5]。
目前,小核菌胶主要以微生物发酵的方式生产。齐整小核菌Sclerotium rolfsii是最主要的生产菌株,其可以利用葡萄糖、蔗糖、果糖、木糖和糖蜜等进行发酵生产[6-7]。针对齐整小核菌生产小核菌胶的研究主要集中在提高小核菌胶产量和产率等方面[8-9]。小核菌属真菌发酵法生产的小核菌胶分子量较高,从而导致其溶解性、流动性、分散性较差,为其工业应用带来困难[10]。小核菌胶的活性通常与粘度及分子量密切有关,分子量过大时水溶性差,分子量过低则会使小核菌胶失去生理活性。如何选择合适的降解方法对小核菌胶进行改性,获得理想的分子量,在保持活性的基础上提高其水溶性,从而扩大其工业应用是目前亟待解决的问题[3, 11]。
笔者团队在前期工作中筛选到一株高产小核菌胶的齐整小核菌WSH-G01,优化后小核菌胶产量达42.0 g/L。在底物葡萄糖充足的情况下,当小核菌胶产量达到最高值后延长发酵周期,会使小核菌胶产量下降,而发酵液中可检测出微弱的β-葡聚糖酶酶活[9]。研究报道,齐整小核菌自身能表达相关水解酶,可降解小核菌胶生成葡萄糖,为菌株生长代谢提供能量[12]。本研究通过对齐整小核菌WSH-G01进行全基因组测序,从基因组层面对齐整小核菌WSH-G01中葡聚糖降解酶基因进行功能注释,通过设计β-葡聚糖酶差异表达的培养体系,结合转录组学分析,挖掘齐整小核菌WSH-G01中内源β-葡聚糖水解酶基因,对可能的糖水解酶基因进行分子克隆、重组表达以及功能验证。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒齐整小核菌WSH-G01为本实验室筛选的小核菌胶高产菌株,保藏于武汉大学中国典型培养物保藏中心,保藏编号为CCTCC NO:M2017646[13]。大肠杆菌Escherichia coli JM109用于重组酶表达时质粒的复制。毕赤酵母GS115用于重组酶的表达与发酵,质粒pPIC9K用于毕赤酵母中蛋白的分泌表达。
1.1.2 培养基齐整小核菌种子培养基(g/L):葡萄糖30.0,KH2PO4 1.0,NaNO3 3.0,酵母粉1.0,KCl 0.5,MgSO4·7 H2O 0.5,pH 4.0。
齐整小核菌发酵培养基(g/L):葡萄糖55.0,KH2PO4 1.0,NaNO3 3.0,酵母粉0.5,KCl 0.5,MgSO4·7 H2O 0.5,柠檬酸1.5,pH 4.0。
毕赤酵母MD培养基(1 L):琼脂20 g,10×YNB溶液100 mL (YNB溶液终浓度为13.4 g/L),10×葡萄糖溶液100 mL (葡萄糖终浓度为20 g/L),500×生物素2 mL (生物素终浓度为4×10–4 g/L)。
毕赤酵母诱导表达BMGY培养基(1 L):酵母提取物10 g,蛋白胨20 g,K2HPO4 3 g,KH2PO4 11.8 g,10×YNB溶液100 mL (YNB溶液终浓度为13.4 g/L),500×生物素1 mL (生物素终浓度为4×10–4 g/L),甘油10 mL。
毕赤酵母诱导表达BMMY培养基(1 L):酵母提取物10 g,蛋白胨20 g,K2HPO4 3 g,KH2PO4 11.8 g,100×YNB溶液100 mL (YNB溶液终浓度为13.4 g/L),500×生物素1 mL (生物素终浓度为4×10–4 g/L),甲醇5 mL。
1.1.3 主要试剂柱式RNA快速抽提试剂盒、柱式质粒小量提取试剂盒、PCR产物回收试剂盒、T4 DNA连接酶及所有限制性内切酶、卡纳抗生素、氨苄抗生素和G418硫酸盐等购于生工生物工程(上海)股份有限公司。其他化学试剂均购自上海国药集团。
1.2 方法 1.2.1 培养方法齐整小核菌培养:挑取单个菌核接种于PDA平板,30 ℃静置培养4 d至长出丰富菌丝。刮取1 cm2的菌丝接种于装有50 mL小核菌种子培养基的250 mL摇瓶中,28 ℃、220 r/min条件下培养72 h获得一级种子液。将一级种子液以5%的接种量转接至装有100 mL种子培养基的500 mL摇瓶中,30 ℃、220 r/min条件下培养72 h获得二级种子液。将二级种子液以5%的接种量接种至发酵培养基中发酵[9]。
毕赤酵母的诱导表达:将筛选到的重组菌株接种于装有2 mL YPD培养基的试管中,30 ℃、220 r/min培养24 h,以2%接种量转接至含50 mL BMGY培养基的250 mL摇瓶中,30 ℃、220 r/min培养至OD600为2–6,离心收集菌体,生理盐水洗涤2次后,全部接入至含50 mL BMMY培养基的250 mL摇瓶中,30 ℃、220 r/min培养,每24 h向培养基中添加甲醇至终浓度为0.5%,取样、离心,分别收集上清和菌体,分析目的蛋白的表达量和蛋白最佳收获时间,用SDS-PAGE及活性实验检测并鉴定重组蛋白的表达。
1.2.2 分子生物学操作齐整小核菌基因组提取:将菌株接种于马铃薯葡萄糖琼脂培养基(Potato dextrose agar,PDA)[14]活化4 d,刮取新鲜菌丝转接至覆盖有玻璃纸的PDA培养基,5 d后刮取玻璃纸上的新鲜菌丝进行DNA提取。由于齐整小核菌产生大量胞外多糖,DNA提取较困难,本实验参考刘丽等改良的十六烷基三甲基溴化铵法(Cetyltrimethylammonium ammonium bromide,CTAB)进行DNA提取[15]。
齐整小核菌RNA提取:参照生工生物工程(上海)股份有限公司柱式RNA提取试剂盒的提取方法进行提取。
齐整小核菌cDNA文库的构建:以高质量的齐整小核菌WSH-G01 RNA为模板,参照TaKaRa公司的反转录试剂盒的方法进行反转录操作。
毕赤酵母的转化及转化子筛选:将含有目标多糖水解酶基因的毕赤酵母表达载体pPIC9K线性化,采用电转化方式转化至毕赤酵母GS115感受态细胞中,在MD平板上进行筛选,30 ℃培养3 d。将生长良好的单菌落挑选至最高2 mg/mL G418的YPD平板进行筛选,筛选抗高浓度G418的重组毕赤酵母,经Mut+型筛选后,PCR验证阳性转化子。
1.2.3 分析方法齐整小核菌菌体干重和粗多糖的提取及产量测定见参考文献[15]。
重组蛋白SDS-PAGE检测:取1 mL重组蛋白发酵液,12 000 r/min离心5 min,去上清,加入适量蒸馏水使菌液OD600为5.0左右,超声破碎,取30 µL蛋白破碎液与10 µL上样缓冲液混合,99 ℃加热15 min。使用10%的Bis-Tris Protein Gels与MES缓冲液进行电泳,电压120 V。
β-葡聚糖酶粗酶液酶活的检测:量取一定量的发酵液,4 ℃、4 000 r/min离心10 min,收集上清液,即粗酶液。1 mL反应液含粗酶液500 μL、0.5%昆布多糖500 μL和20 mmol HAc-NaAc缓冲液(pH 6.0),30 ℃水浴30 min,加入1 mL DNS溶液终止反应,100 ℃加热5 min,冷却至室温,取上清测定OD540,以灭活的酶作为对照计算酶活力。1个酶活力单位定义为在反应条件下每分钟释放1.0 μmol还原糖(以葡萄糖为标准)所需要的酶量。
小核菌胶水解能力的检测:1 mL反应液含粗酶液500 μL和500 μL小核菌胶,30 ℃水浴6 h,100 ℃沸水浴5 min灭活,以灭活酶作对照,用高效液相色谱(HPGPC)测定多糖分子量。利用Shodex SB-806M HQ凝胶色谱柱检测,检测条件为:示差检测器,流动相为0.1 mol/L NaNO3溶液,流速0.6 mL/min,柱温40 ℃,进样量为50 µL。
2 结果与分析 2.1 发酵过程中小核菌胶分子量的变化真菌多糖的分子量在很大程度上决定了多糖的生理活性和理化性质。前期结果显示齐整小核菌 WSH-G01发酵生产小核菌胶的产量通常在72–84 h达到最高[9]。检测发酵过程中小核菌胶的分子量变化发现,小核菌胶的分子量随着发酵时间的延长呈先升高后下降的趋势,在小核菌胶积累的过程当中,小核菌胶的分子量缓慢上升,继续延长发酵时间,从第4天开始小核菌胶分子量逐渐降低(图 1)。研究报道,从小核菌Sclerotium glucanicum发酵液中分离出两种β-葡聚糖酶和一种β-1, 3-葡聚糖酶,对发酵后期多糖具有降解作用[16]。可以推测发酵后期小核菌胶分子量降低可能是由于菌株分泌了葡聚糖水解酶所引起。
|
| 图 1 小核菌胶发酵过程中的分子量变化 Fig. 1 Changes of molecular weight of scleroglucan during fermentation process. |
| |
近年来,基因组学和转录组学等分析技术成为理解微生物生理特性的重要手段[17-18]。选取浓度范围在50–150 μg/μL之间,OD260/OD280范围在1.8–2.0之间的DNA样品进行基因组测序。利用PacBio平台进行全基因组测序,结合Illumina平台测序结果进行基因组拼接,获得大小为38 Mb的齐整小核菌WSH-G01基因组,包括116个Contigs和42个Scaffolds,GC含量为46.51%。基于获得的全基因组序列,根据NCBI检索与数据处理,分析出了齐整小核菌WSH-G01与其他典型白腐菌的近源关系(图 2)。

|
| 图 2 齐整小核菌WSH-G01的进化树分析 Fig. 2 Phylogenetic analysis of S. rolfsii WSH-G01. |
| |
对比典型的具有多糖降解活性的白腐菌发现,齐整小核菌WSH-G01与裂褶菌Schizophyllum commune和灰盖鬼伞菌Coprinopsis cinerea okayama亲缘关系较近,裂褶菌产生的胞外多糖在结构上与小核菌胶高度相似。对菌株WSH-G01葡聚糖降解酶相关基因进行功能注释后,发现其拥有与葡聚糖降解酶相关的基因200个,包括碳水化合物结合域(Carbohydrate-binding modules)家族基因68个、碳水化合物酯酶(Carbohydrate esterase)基因14个、糖苷水解酶(Glycoside hydrolase)基因82个、糖苷转移酶(Glycosyl transferase)基因30个、糖苷裂解酶(Polysaccharide lyase)基因6个(表 1)。结果表明齐整小核菌WSH-G01具有小核菌胶降解潜力。
| Sample name | CBMs No. | CEs No. | GHs No. | GTs No. | PLs No. |
| Sr.WSH-G01 | 68 | 14 | 82 | 30 | 6 |
| CBMs: carbohydrate-binding modules; Ces: carbohydrate esterases; GHs: glycoside hydrolase; GTs: glycosyl transferase; PLs: polysaccharide lyase. | |||||
前期研究发现,在小核菌胶发酵过程中,在碳源充足的情况下延长发酵周期,小核菌胶产量达到最大值后亦会出现明显下降,并从发酵液中检测出微弱的β-葡聚糖酶活性。基于此,设计了两种齐整小核菌的培养体系(表 2),以获得相似的生长情况及差异显著的产酶情况。
| High enzyme system | Low enzyme system | ||
| Scleroglucan | 10.0 g/L | Glucose | 10.0 g/L |
| NH4Cl | 3.0 g/L | NH4Cl | 3.0 g/L |
| Yeast extract | 0.5 g/L | Yeast extract | 0.5 g/L |
| KH2PO4 | 1.0 g/L | KH2PO4 | 1.0 g/L |
| MgSO4·7H2O | 0.5 g/L | MgSO4·7H2O | 0.5 g/L |
| Citric acid | 1.5 g/L | Citric acid | 1.5 g/L |
| KCl | 0.5 g/L | KCl | 0.5 g/L |
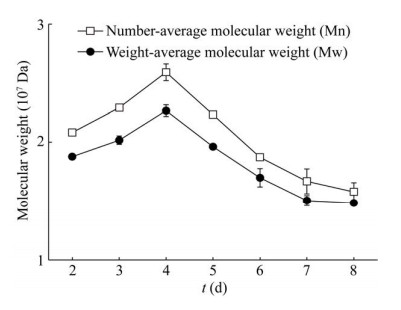
检测发酵过程β-葡聚糖酶活性发现,在保证不同培养体系中生物量相同的前提下,培养至3 d时,胞外β-葡聚糖水解酶的酶活差异显著,低产酶培养体系中几乎未检测出酶活,高产培养体系中β-葡聚糖酶酶活达8.62 U/mL (图 3)。表明在高产酶培养体系中,菌体在以多糖为唯一碳源时易被诱导表达多糖水解酶以获得足够的能源物质。两种产酶活性具有明显差异的培养体系的设计为小核菌胶水解酶基因挖掘提供了理论依据。
|
| 图 3 两种产酶培养基体系中的胞外酶活 Fig. 3 Extracellular enzyme activity under two enzyme- producing conditions. |
| |
选取培养3 d时产酶差异显著的高酶活(HE)与低酶活(LE)样本,分别提取总RNA并构建原始cDNA文库。测序并对数据进行优化,以得到的基因组为参照进行序列分析,HE和LE样本的比对率分别达69.28%和70.95%。通过比对HE和LE样本的基因表达水平差异性,最终从9 086个基因中,筛选出2 584个具有显著差异的基因(P < 0.01 & |log2FC|≥1),其中显著上调的表达基因1 054个,显著下调的表达基因1 530个。
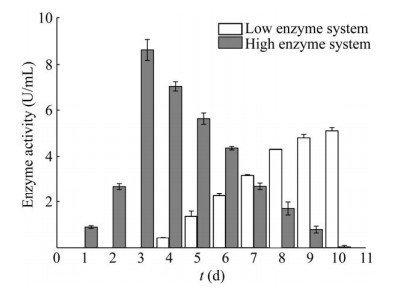
应用GO富集对获得的2 584个显著差异基因进行功能注释,获得GO富集词条32个。由图 4A可知,具有最显著富集差异的基因具有分子活性功能,富集率最高的两类基因具有分子催化功能与分子结合功能。葡聚糖水解酶通常在结构上同时具备糖苷键水解的催化活性以及底物结合活性,这两类基因的显著差异富集说明两种不同培养体系的样本中具有差异表达的小核菌胶水解酶基因。应用KEGG进行分析,发现差异基因富集到KEGG的Pathway共130条,显著富集的有21条,其中最显著富集的代谢途径为碳水化合物代谢途径(图 4B)。说明不同培养体系中齐整小核菌WSH-G01碳源代谢途径发生改变,可能是HE样品中的菌丝产生了更多的小核菌胶水解酶所引起的。
|
| 图 4 差异基因GO富集和KEGG数据库富集 Fig. 4 Enrichment of differential genes in GO database and KEGG database. |
| |
基于齐整小核菌WSH-G01转录组测序结果,对比基因组多数据库的基因注释以及两种产酶条件下的转录组差异性分析,从转录组数据中分析得到的具有显著差异的2 584个基因中,挖掘出了14个疑似的小核菌胶糖苷水解酶基因,包括1个外切葡聚糖酶(Exo-glucanase)基因和13个内切葡聚糖酶(Endo-glucanase)基因(表 3)。
| Gene ID | LE FPKM | HE FPKM | log2 (HE/LE) | FDR (LE-vs-HE) | P value (LE-vs-HE) | Type |
| GME7035_g | 0.00 | 65.33 | 12.67 | 0 | 0 | endo- |
| GME9076_g | 2.61 | 85.14 | 5.03 | 0 | 0 | endo- |
| GME8597_g | 3.02 | 50.11 | 4.05 | 0 | 0 | exo- |
| GME397_g | 3.80 | 18.33 | 2.27 | 1.03E-121 | 1.53E-122 | endo- |
| GME5220_g | 1.66 | 6.36 | 1.94 | 1.08E-37 | 3.30E-38 | endo- |
| GME5221_g | 0.87 | 3.18 | 1.87 | 1.95E-20 | 8.04E-21 | endo- |
| GME2686_g | 0.49 | 1.74 | 1.83 | 6.96E-4 | 4.84E-4 | endo- |
| GME9860_g | 9.54 | 31.48 | 1.72 | 9.38E-46 | 2.59E-46 | endo- |
| GME9263_g | 1.52 | 4.92 | 1.69 | 1.32E-15 | 6.06E-16 | endo- |
| GME1000_g | 5.51 | 17.57 | 1.67 | 4.82E-51 | 1.24E-51 | endo- |
| GME3016_g | 14.48 | 39.29 | 1.44 | 3.25E-61 | 7.48E-62 | endo- |
| GME2879_g | 3.85 | 9.90 | 1.36 | 1.20E-38 | 3.65E-39 | endo- |
| GME10818_g | 15.69 | 37.96 | 1.27 | 8.81E-77 | 1.76E-77 | endo- |
| GME9629_g | 8.29 | 16.60 | 1.00 | 3.14E-23 | 1.23E-23 | endo- |
| FPKM: Fragments per kilobase per million. | ||||||
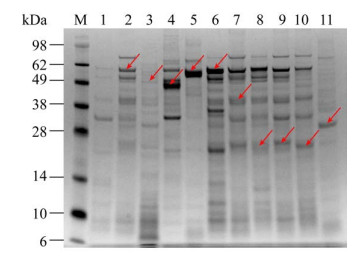
提取高产酶培养体系中菌株的总RNA,利用反转录酶构建cDNA文库。根据预测获得的14个水解酶的CDS序列,设计引物扩增14个水解酶的基因片段,成功扩增出10个基因片段。将得到的10个片段DNA同源重组至毕赤酵母表达载体pPIC9K,重组载体线性化后,电转化法转化毕赤酵母GS115。His和Mut缺陷型平板筛选阳性转化子,经PCR鉴定的阳性转化子均为甲醇高效利用型。挑取阳性转化子进行液体发酵,甲醇诱导发酵120 h,对发酵液上清进行SDS-PAGE检测,共获得10个具有表达能力的重组菌株(图 5)。将所有获得的胞外表达蛋白以昆布多糖为底物进行水解酶活性的测定,发现10个可溶表达的重组酶中有5个具有昆布多糖水解活性,均为β-1, 3-葡聚糖酶(表 4)。
|
| 图 5 目标多糖水解酶的SDS-PAGE凝胶图 Fig. 5 SDS-PAGE of predicted polysaccharide hydrolases. 1: pPIC9K; 2: GME9629_g; 3: GME9263_g; 4: GME2879_g; 5: GME10818_g; 6: GME8597_g; 7: GME7035_g; 8: GME9860_g; 9: GME3016_g; 10: GME9076_g; 11: GME2686_g. |
| |
| Gene ID | Enzyme activity |
| GME9629_g | N.A |
| GME9263_g | 4.20 U/mL |
| GME2879_g | N.A |
| GME10818_g | N.A |
| GME8597_g | N.A |
| GME7035_g | 5.24 U/mL |
| GME9860_g | 8.64 U/mL |
| GME3016_g | N.A |
| GME9076_g | 9.30 U/mL |
| GME2686_g | 9.13 U/mL |
| N.A means no enzyme activity was detected. | |
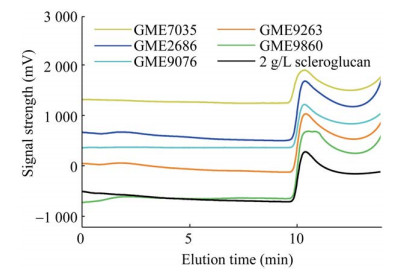
利用前期挖掘获得的5个具有昆布多糖水解活性的内源葡聚糖酶对小核菌胶进行水解,结果如图 6所示。水解酶GME9860对小核菌胶水解后,小核菌胶的平均分子量有一定降低,出峰时间由10.382 min推迟至11.036 min,数均分子量由2.748×107 Da降低至1.923×107 Da,而其他4个水解酶对小核菌胶没有降解作用。
|
| 图 6 内源β-1, 3-葡聚糖酶对小核菌胶分子量的影响 Fig. 6 Effects of endogenous β-1, 3-glucanase on the molecular weight of scleroglucan. |
| |
此外,GME9860水解后的小核菌胶的分散度较处理前更高,表明酶反应体系中发生了高分子量多糖的降解和部分低分子量多糖的产生,使得多糖的分子量分布变得更宽。通过对GME9860水解酶基因进行Blast分析发现,在公开基因组中未找到与基因GME9860非常相似的序列。其中,最接近的序列是来源污叉丝孔菌Dichomitus squalens的5-氧脯氨酸酶(5-oxoprolinase)基因,其覆盖率为88%,相似性为73%;其次是来源异担子菌Heterobasidion irregular的糖苷水解酶基因,其覆盖率为83%,相似性为72%。比对氨基酸序列发现,最接近的为来源于污叉丝孔菌D. squalens的糖苷水解酶,其覆盖率为94%,相似性为83%。已将基因GME9860序列上传至NCBI数据,GenBank登录号为BankIt2357229 BSeq#1 MT651207。
3 讨论小核菌胶作为一种高稳定的水溶性微生物胞外多糖,在石油化工、食品、医药以及化妆品等行业具有重要的应用价值[19]。齐整小核菌等真菌发酵生产的小核菌胶分子量较高,限制了其大规模应用。选择合适的方式对小核菌胶进行改性,降低其分子量,增加其生理活性对扩大小核菌胶的工业应用具有重要意义。目前对小核菌胶的研究主要集中在发酵过程优化提高小核菌胶的产量,对分子量改性等方面的研究较少。而对其他多糖如普鲁兰糖、透明质酸、果聚糖和木聚糖等的水解有较多的研究报道[20]。
目前多糖水解方法有物理水解、酸水解和酶水解等。物理水解是一种快速而干净的水解方式,包括自发水解、微波、γ射线、超声波、紫外线和动态高压微流化等,但物理水解方法在多糖行业的应用非常有限[21-22]。酸水解主要通过控制酸浓度或pH值实现多糖的降解,是目前多低聚糖获取的主要方式,但酸水解存在有毒物质糠醛和5-羟甲基糠醛等生成、获得的低聚糖产量低以及低聚糖链长度变化大等缺点[23]。酶具有高度的区域选择性和立体选择性,酶水解往往被认为是生产低聚糖的最佳选择,低聚果糖和低聚木糖等已实现了酶水解法的工业化生产[24-25]。小核菌胶的水解由β-葡聚糖酶催化完成,研究发现小核菌在低葡萄糖条件下能表达β-葡聚糖酶和β-1, 3-葡聚糖酶[3]。我们在前期研究过程中亦从齐整小核菌发酵生产小核菌胶发酵后期的发酵液中检测出微弱的β-葡聚糖酶酶活。
小核菌胶以平均每3个β-1, 3-糖苷键连接的主链单元连接1个β-1, 6-糖苷键的侧链组成,理论上其分子量的降低可通过水解β-1, 3或β-1, 6-糖苷键两种方法实现。虽然水解β-1, 6-糖苷键能起到降低分子量的作用,但在一定程度上可能会影响小核菌胶的活性,所以通常通过水解β-1, 3-糖苷键来实现小核菌胶的改性[26-27]。在前期研究中,来源于环状芽孢杆菌Bacillus circulans、类芽孢杆菌Paenibacillus、酿酒酵母Saccharomyces cerevisiae和嗜碱拟诺卡氏菌Alkaliphilic nocardiopsis的β-1, 3-葡聚糖酶基因BGLM、PGLA、EXG1和BGLF在大肠杆菌和毕赤酵母中的重组表达,经4个酶粗酶液处理过后对小核菌胶降解效果并不明显[28]。考察商品化的来源于里氏木霉的β-1, 3-葡聚糖酶对小核菌胶的降解作用,发现加入β-1, 3-葡聚糖酶,小核菌胶的数均分子量有一定降低,但出现了一个分子量8.96×103 Da的物质峰,说明该酶的主要酶切位点应为分子量在9 000 Da左右的多糖片段。研究报道,一般具备三螺旋空间构象的小核菌胶分子量在100 kDa以上,分子量小于50 kDa就难以形成这种三螺旋结构,从而使其抗肿瘤等生物免疫活性消失[29]。因此,外源性添加商品化的β-1, 3-葡聚糖酶未能起到有效调控小核菌胶的分子量的作用。
本研究通过基因组和转录组分析,从齐整小核菌中挖掘出14个潜在的β-葡聚糖酶基因,在毕赤酵母中对潜在的水解酶基因进行异源表达并进行功能验证,最终得到10个可溶性蛋白,其中5个具有昆布多糖水解活性,并发现GME9860对小核菌胶具有正向水解效果。小核菌胶在水中溶解会形成刚性的三重螺旋结构,侧链的葡萄糖基均匀分布于螺旋结构的外侧,通过静电力作用防止螺旋聚集。这种三维结构使糖苷连接键被包裹,大大影响了葡聚糖酶的结合和水解作用效率,常规的β-葡聚糖酶不能起到水解小核菌胶从而改善其分子量的效果[29-30]。本研究基于发酵过程中小核菌胶水解现象对小核菌胶的内源水解酶进行挖掘,获得的GME9860能够在pH 6.0的条件下对小核菌胶进行初步水解,表明在酸性条件下该酶能克服小核菌胶三维结构的束缚直接对糖苷键进行切割。上述结果表明,利用内源β-葡聚糖糖酶调控小核菌胶分子量的方案是可行的。由于获得的内源β-葡聚糖酶GME9860对小核菌胶的水解效果并不显著,后期可在酶作用时间、酶量、酶学性质分析以及酶分子改造等方面进行深入研究,以达到进一步精确调控小核菌胶分子量的目标。基于新的水解酶的发现和改造,还可以结合代谢工程手段强化β-葡聚糖酶的表达,实现齐整小核菌直接发酵生产中低分子量小核菌胶。由于齐整小核菌是非模式丝状真菌,针对齐整小核菌的有效转化方法和遗传操作工具尚需完善。本研究为应用酶水解法改性小核菌胶的分子量以及代谢工程改造齐整小核菌,以调控发酵生产的小核菌胶分子量提供了重要参考。
| [1] |
Fariña JI, Siñeriz F, Molina OE, et al. High scleroglucan production by Sclerotium rolfsii: Influence of medium composition. Biotechnol Lett, 1998, 20(9): 825-831. DOI:10.1023/A:1005351123156 |
| [2] |
Song J, Jia YX, Su Y, et al. Initial analysis on the characteristics and synthesis of exopolysaccharides from Sclerotium rolfsii with different sugars as carbon sources. Polymers, 2020, 12(2): 348. DOI:10.3390/polym12020348 |
| [3] |
Castillo NA, Valdez AL, Fariña JI. Microbial production of scleroglucan and downstream processing. Front Microbiol, 2015, 6: 1106. |
| [4] |
Viñarta SC, Molina OE, Figueroa LIC, et al. A further insight into the practical applications of exopolysaccharides from Sclerotium rolfsii. Food Hydrocolloid, 2006, 20(5): 619-629. DOI:10.1016/j.foodhyd.2005.05.006 |
| [5] |
Giavasis I. Bioactive fungal polysaccharides as potential functional ingredients in food and nutraceuticals. Curr Opin Biotechnol, 2014, 26: 162-173. DOI:10.1016/j.copbio.2014.01.010 |
| [6] |
Valdez AL, Babot JD, Schmid J, et al. Scleroglucan production by Sclerotium rolfsii ATCC 201126 from amylaceous and sugarcane molasses-based media: promising insights for sustainable and ecofriendly scaling-up. J Polym Environ, 2019, 27(12): 2804-2818. DOI:10.1007/s10924-019-01546-4 |
| [7] |
Survase SA, Saudagar PS, Singhal RS. Use of complex media for the production of scleroglucan by Sclerotium rolfsii MTCC 2156. Bioresource Technol, 2007, 98(7): 1509-1512. DOI:10.1016/j.biortech.2006.05.022 |
| [8] |
Survase SA, Saudagar PS, Singhal RS. Enhanced production of scleroglucan by Sclerotium rolfsii MTCC 2156 by use of metabolic precursors. Bioresource Technol, 2007, 98(2): 410-415. DOI:10.1016/j.biortech.2005.12.013 |
| [9] |
Tan RQ, Lyu YB, Zeng WZ, et al. Enhancing scleroglucan production by Sclerotium rolfsii WSH-G01 through a pH-shift strategy based on kinetic analysis. Bioresource Technol, 2019, 293: 122098. DOI:10.1016/j.biortech.2019.122098 |
| [10] |
Farina JI, Viñarta SC, Cattaneo M, et al. Structural stability of Sclerotium rolfsii ATCC 201126 β-glucan with fermentation time: a chemical, infrared spectroscopic and enzymatic approach. J Appl Microbiol, 2009, 106(1): 221-232. DOI:10.1111/j.1365-2672.2008.03995.x |
| [11] |
Fariña JI, Siñeriz F, Molina OE, et al. Isolation and physicochemical characterization of soluble scleroglucan from Sclerotium rolfsii. rheological properties, molecular weight and conformational characteristics. Carbohyd Polym, 2001, 44(1): 41-50. DOI:10.1016/S0144-8617(00)00189-2 |
| [12] |
Martin K, McDougall BM, McIlroy S, et al. Biochemistry and molecular biology of exocellular fungal beta-(1, 3)- and β-(1, 6)-glucanases. FEMS Microbiol Rev, 2007, 31(2): 168-192. DOI:10.1111/j.1574-6976.2006.00055.x |
| [13] |
Gao RW, Zhou JW, Xu GQ. Strategies for feeding control in microbial production of scleroglucan by Sclerotium rolfsii WSH-G01. Food Fermen Ind, 2018, 44(10): 51-56 (in Chinese). 高荣伟, 周景文, 徐国强. 齐整小核菌发酵产硬葡聚糖的补料控制策略. 食品与发酵工业, 2018, 44(10): 51-56. |
| [14] |
Iyyappan J, Baskar G, Bharathiraja B, et al. Enhanced malic acid production using Aspergillus niger coupled with in situ product recovery. Bioresource Technol, 2020, 308: 123259. DOI:10.1016/j.biortech.2020.123259 |
| [15] |
Liu L, Zang YJ, Xu CZ, et al. A modified CTAB method for isolating genome DNA from fungus with abundant polysaccharose. Chin Biotechnol, 2014, 34(5): 75-79 (in Chinese). 刘丽, 张永军, 许长征, 等. 一种改良的CTAB法提取产多糖真菌DNA. 中国生物工程杂志, 2014, 34(5): 75-79. |
| [16] |
Rapp P. 1, 3-β-glucanase, 1, 6-β-glucanase and glucosidase activities of Sclerotium glucanicum: synthesis and properties. J Gen Microbiol, 1989, 135(11): 2847-2858. |
| [17] |
Schmid J, Müller-Hagen D, Bekel T, et al. Transcriptome sequencing and comparative transcriptome analysis of the scleroglucan producer Sclerotium rolfsii. BMC Genomics, 2010, 11: 329. DOI:10.1186/1471-2164-11-329 |
| [18] |
Lu Y, Ye C, Che JX, et al. Genomic sequencing, genome-scale metabolic network reconstruction, and in silico flux analysis of the grape endophytic fungus Alternaria sp. MG1. Microb Cell Fact, 2018, 18: 13. |
| [19] |
Schmid J, Meyer V, Sieber V. Scleroglucan: biosynthesis, production and application of a versatile hydrocolloid. Appl Microbiol Biotechnol, 2011, 91(4): 937-947. DOI:10.1007/s00253-011-3438-5 |
| [20] |
de Moura FA, Macagnan FT, Da Silva LP. Oligosaccharide production by hydrolysis of polysaccharides: a review. Int J Food Sci Technol, 2015, 50(2): 275-281. DOI:10.1111/ijfs.12681 |
| [21] |
Vázquez MJ, Garrote G, Alonso JL, et al. Refining of autohydrolysis liquors for manufacturing xylooligosaccharides: evaluation of operational strategies. Bioresource Technol, 2005, 96(8): 889-896. DOI:10.1016/j.biortech.2004.08.013 |
| [22] |
Chen J, Liang RH, Liu W, et al. Pectic-oligosaccharides prepared by dynamic high-pressure microfluidization and their in vitro fermentation properties. Carbohyd Polym, 2013, 91(1): 175-182. DOI:10.1016/j.carbpol.2012.08.021 |
| [23] |
Lin QX, Li HL, Ren JL, et al. Production of xylooligosaccharides by microwave-induced, organic acid-catalyzed hydrolysis of different xylan-type hemicelluloses: optimization by response surface methodology. Carbohyd Polym, 2017, 157: 214-225. DOI:10.1016/j.carbpol.2016.09.091 |
| [24] |
Vallejo-García LC, Rodriguez-Alegría ME, Munguía AL. Enzymatic process yielding a diversity of inulin-type microbial fructooligosaccharides. J Agr Food Chem, 2019, 67(37): 10392-10400. DOI:10.1021/acs.jafc.9b03782 |
| [25] |
Zheng FZ, Song LN, Basit A, et al. An endoxylanase rapidly hydrolyzes xylan into major product xylobiose via transglycosylation of xylose to xylotriose or xylotetraose. Carbohyd Polym, 2020, 237: 116121. DOI:10.1016/j.carbpol.2020.116121 |
| [26] |
Kulicke WM, Lettau AI, Thielking H. Correlation between immunological activity, molar mass, and molecular structure of different (1→3)-β-D-glucans. Carbohyd Res, 1997, 297(2): 135-143. DOI:10.1016/S0008-6215(96)00273-X |
| [27] |
Stokke BT, Elgsaeter A, Hara C, et al. Physicochemical properties of (1→6)-branched (1→3)-β-D-glucans. 1. physical dimensions estimated from hydrodynamic and electron microscopic data. Biopolymers, 1993, 33(4): 561-573. DOI:10.1002/bip.360330406 |
| [28] |
Gao RW. Optimozation of fermentation process for production of scleroglucan by Sckerotium rolfsii[D]. Wuxi: Jiangnan University, 2018 (in Chinese). 高荣伟.齐整小核菌积累硬葡聚糖的发酵过程优化[D].无锡: 江南大学, 2018. |
| [29] |
Viñarta SC, Delgado OD, Figueroa LIC, et al. Effects of thermal, alkaline and ultrasonic treatments on scleroglucan stability and flow behavior. Carbohydr Polym, 2013, 94(1): 496-504. DOI:10.1016/j.carbpol.2013.01.063 |
| [30] |
Yoshiba K, Okamoto S, Dobashi T, et al. Effects of carboxylation of the side chains on the order-disorder transition in aqueous solution of schizophyllan, a triple helical polysaccharide. Carbohydr Polym, 2017, 168: 79-85. DOI:10.1016/j.carbpol.2017.03.038 |
 2021, Vol. 37
2021, Vol. 37