中国科学院微生物研究所、中国微生物学会主办
文章信息
- 曾振, 王海宁, 张志芳, 易咏竹
- Zeng Zhen, Wang Haining, Zhang Zhifang, Yi Yongzhu
- 新型疫苗佐剂的研究进展
- Research progress of new vaccine adjuvants
- 生物工程学报, 2021, 37(1): 78-87
- Chinese Journal of Biotechnology, 2021, 37(1): 78-87
- 10.13345/j.cjb.200220
-
文章历史
- Received: April 20, 2020
- Accepted: June 28, 2020
- Published: July 7, 2020
2. 中国农业科学院生物技术研究所, 北京 100081
2. Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
接种疫苗作为迄今为止较为成功的一种公共卫生干预措施, 对有效预防传染病及其传播起到了重要的作用。传统疫苗包括灭活疫苗和弱毒疫苗, 其主要是通过灭活或减毒病原体来制备疫苗, 但灭活或减毒的病原体, 因为其成分比较复杂并存在毒力返强等问题, 所以安全性一直令人们担忧。为了突破传统疫苗发展的限制, 新型疫苗不断被开发和应用, 如核酸疫苗、重组亚单位疫苗、合成肽疫苗等。核酸疫苗主要是将病原微生物的保护性抗原基因克隆于质粒或其他载体上转导至动物体内表达出天然形式的抗原, 从而诱导机体产生免疫应答;重组亚单位疫苗是利用基因工程手段表达出的病原微生物的保护性抗原蛋白;合成肽是利用化学合成技术或基因技术合成病原体的保护性多肽。利用基因工程技术和分子克隆技术制备的新型疫苗具有相对分子量小、抗原纯度高、生物安全性高等特点, 但相对传统疫苗, 新型疫苗往往存在着免疫原性较弱、难以穿过细胞膜、在细胞微环境容易被迅速降解等缺点。因此要增强这些抗原在机体内的免疫应答能力, 延长其存在时间, 提高抗原的免疫效力, 就必须同抗原一起或预先注射佐剂。佐剂可以作为免疫增强剂来增强抗原的免疫应答反应, 也可以作为载体来递送抗原到相应的免疫细胞, 降低抗原的降解, 由此增强机体的免疫保护[1]。在疫苗的研发应用中, 佐剂是必不可少的。常用的佐剂主要有铝佐剂、弗氏佐剂等。但为适应新型疫苗的需求, 就需要开发新型和多元化的佐剂。近几年广大学者不断对新型疫苗佐剂进行研究, 佐剂的种类也不断增多, 本文根据佐剂的作用, 从免疫调节分子类佐剂、抗原递送类佐剂、复合佐剂这3个分类对近年来新型佐剂的研究进展进行了综述。
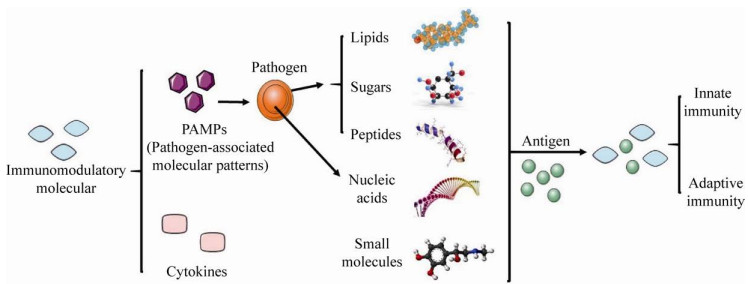
1 免疫调节分子类佐剂近年来, 新型疫苗如核酸疫苗、多肽疫苗、重组亚单位疫苗等疫苗不断被研制应用, 但新型疫苗普遍存在免疫原性较低的缺点, 不能有效引起机体的免疫反应, 从而达不到保护机体的作用。因此, 选择具有免疫调节作用, 能够增强免疫反应的佐剂对新型疫苗更好地发挥作用具有重要意义。其中病原体相关分子模式和细胞分泌的某些分子物质等可以对免疫进行激活调节, 作为一种免疫增强剂参与抗原的免疫应答过程(图 1)。
|
| 图 1 免疫调节分子的类型 Fig. 1 Types of immunomodulatory molecules. The immune system can recognize different components of pathogens and activate the innate immune system, then induce multiple immune responses. These components are called pathogen-associated molecular patterns. Small molecular polypeptide proteins secreted by immune cells and some non-immune cells under certain stimulation conditions, which play a crucial role in the regulatory mechanisms of immune system. These small molecular proteins are called cytokines. Pathogen-associated molecular patterns and cytokines can be used as adjuvants to regulate the immune response to foreign antigens and further enhance innate and adaptive immunity. |
| |
CpG寡核苷酸(CpG oligodeoxynucleoties, CpG ODN)是指人工合成的以未甲基化CG二核苷酸为核心的寡聚核苷酸序列[2]。作为TLR9受体激动剂的CpG ODN, 可以通过与TLR9受体结合来激活TLR9受体, 从而增强对特定抗原的体液免疫和细胞免疫反应。CpG ODN可以激活自然杀伤细胞、B细胞、T细胞等细胞, 并能诱导产生多种细胞因子如IFN-γ、IL-1、IL-2、IL-12。Moldoveanu等[3]最早研究了流感病毒灭活疫苗与CpG ODN联合使用进行鼻内免疫小鼠, 结果表明, 相对于未添加CpG ODN的对照组, 实验组免疫后诱导产生的血清特异性抗体增加了7倍。之后经过对CpG ODN作为佐剂的不断研究发现CpG ODN能够增强多种抗原的免疫反应。例如在利什曼原虫感染的小鼠模型中, 将CpG ODN与低剂量的亚环前鞭毛组成的疫苗结合, 结果发现, 产生IFN-γ的CD4+和CD8+T细胞的数量增加了2–3倍[4]。使用猪伪狂犬病弱毒疫苗与CpG ODN联合接种的新生仔猪, 与单独接种猪伪狂犬病弱毒疫苗的仔猪相比, 血清IgG滴度提高了18倍, 粘膜IgA水平提高了10倍[5]。类似地, CpG ODN提高了鸡新城疫的疫苗活性, 与常规疫苗相比, 与CpG ODN联合使用的疫苗使抗原特异性IgG反应增加了3倍, 同时能够保护鸡免受其他致命剂量的鸡新城疫病毒的攻击[6]。CpG ODN具有较强的免疫刺激活性, 可作为一种免疫增强剂与亚单位疫苗或多肽疫苗联合使用来提高疫苗的免疫效力, 由此可见, CpG ODN是具有广阔应用前景的一类佐剂。
1.2 聚肌胞苷酸聚肌胞苷酸(Polyinosinic:polycytidylic acid, Poly (I:C))作为一种人工合成的病毒dsRNA类似物, 可以被TLR3和MDA-5受体特异性识别来激活机体的天然免疫, 因此可以作为免疫增强类药物用于病毒性炎症。Wei等将Poly (I:C)与O型口蹄疫病毒(FMDV)合成肽抗原进行混合乳化并分组免疫Balb/c小鼠, 结果发现, 添加Poly (I:C)的实验组小鼠血清VP1抗体水平得到显著提高, 小鼠血清中IFN-γ和IL-4水平也明显升高[7]。Cao等也通过研究证明与Poly (I:C)联合使用的口蹄疫重组亚单位疫苗可以产生更高水平的特异性中和抗体和IFN-γ[8]。还有研究评估了8个CD4+HIV衍生表位(HIVBr8)在体内靶向DEC205+DCs时不同佐剂调节特异性细胞免疫应答的能力, 发现与其他疫苗佐剂制剂相比, 在Poly (I:C)存在下T细胞的反应程度更高, cDC1和cDC2 DCs亚群中共刺激分子的表达也得到上调[9]。Sadeghi等[10]实验设计了布鲁氏菌的多表位抗原, 通过对有无添加Poly (I:C)进行分析测定发现添加Poly (I:C)佐剂的实验组中检测到的IgG2a/IgG1比率明显较高, 因此, Poly (I:C)与多表位蛋白结合可以有效诱导小鼠的免疫应答, 保护小鼠免受布鲁氏菌的感染。
综上所述, Poly (I:C)对疫苗的免疫效力具有增强作用, 尤其对于合成肽疫苗、亚单位疫苗来说, 与Poly (I:C)联合使用对体液免疫和细胞免疫都有明显的提升作用, 由此可以看出Poly (I:C)是一个具有潜力的免疫增强剂。
1.3 细胞因子细胞因子是由免疫细胞和一些非免疫细胞在一定刺激条件下分泌的小分子可溶性多肽蛋白质, 常在细胞间和细胞内发挥调控作用, 是目前应用较广的一类分子佐剂。其中研究比较广泛的有干扰素(Interferon, IFN)、白细胞介素(Interleukin, IL)、肿瘤坏死因子(Tumor necrosis factor, TNF)、粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor, GM-CSF)、趋化因子等。细胞因子能够增强自然杀伤细胞的免疫调节功能, 促进T淋巴细胞的分化, 对机体的免疫应答起着广泛上调的作用, 同时可以保护机体避免细菌、病毒和寄生虫的侵袭, 是一类有效的免疫增强剂。Min等评估了IL-1β、IL-2、IL-8、IL-15、IFN-α、IFN-γ、TNF-B4和趋化因子这8种细胞因子发现, 与只注射DNA疫苗的小鼠相比, 添加细胞因子佐剂的实验组小鼠体内寄生虫的数量显著减少, 局部免疫效果也有了明显的增强[11]。Ma等利用GM-CSF和IL-5作为mZP3DNA疫苗佐剂时发现, GM-CSF和DNA疫苗共免疫能够有效地刺激抗原递呈细胞(APCs)的成熟, 并促进其向抗原投送部位有效富集, 从而使体液免疫反应得以增强[12]。
通过对细胞因子的不断研究证明, 细胞因子作为佐剂是调节重组DNA或蛋白疫苗诱导宿主免疫的有力工具, 在特异性免疫反应中起到重要作用, 是一种潜力巨大的疫苗佐剂。
1.4 细菌鞭毛蛋白细菌鞭毛蛋白作为一种病原体相关分子模式(Pathogen-associated molecular patterns, PAMPs), 可以与Toll样受体5 (Toll-like receptor 5, TLR5)和NOD样受体C4 (NLRC4)结合激活机体的先天免疫和适应性免疫, 并能够有效诱导机体产生细胞因子和一氧化氮等天然免疫效应物, 是一种特殊的炎性刺激分子。鞭毛蛋白有4个结构域:D0、D1、D2、D3结构域, 其中D0和D1是保守区, D2和D3为其高变区。其独特的结构特征赋予其有效而灵活的佐剂活性, 从而可以利用这个特点设计不同类型的疫苗来预防各种疾病。
在佐剂的研究中, 是通过抗原与鞭毛蛋白结合构建重组疫苗来阐述其佐剂效应的。例如, Honko等通过在沙门菌鞭毛蛋白高变区插入鼠疫耶尔森菌Yersinia pestis F1与V抗原构建重组疫苗对小鼠进行注射, 结果表明, 小鼠体内的抗F1血浆免疫球蛋白G (IgG)滴度显著增加, 并随时间保持稳定, 攻毒后90%以上的小鼠能够存活[13]。还有研究选择将鞭毛蛋白(S. typhimurium agellin type 2, STF2)与流感病毒保守的基质蛋白胞外域(Matrix protein 2 extracellular domain, M2e)的4个串联重复重组对小鼠进行注射, 与添加铝佐剂的免疫组相比, 免疫重组蛋白的Balb/c小鼠产生更高的M2e特异性抗体水平, 鼻腔免疫0.3 μg重组蛋白就能防止甲型流感病毒的致死性感染[14]。
细菌鞭毛蛋白既可以与外源抗原混合使用, 也可以与外源抗原融合表达, 以此制备的重组疫苗可以有效地诱导天然免疫应答和获得性免疫应答, 还可以通过活化树突状细胞, 促使诱导产生的细胞因子迁移至次级淋巴器官来增强免疫反应[15]。因此鞭毛蛋白能够有效增强外源抗原的免疫原性, 在重组疫苗研制中具有巨大的应用前景。
1.5 皂苷皂苷是螺旋甾烷类化合物或三萜的天然糖苷, 能够表现出许多不同的生物学和药理活性。值得注意的是, 皂苷对哺乳动物的免疫系统具有激活作用, 这引起了人们对其作为疫苗佐剂的巨大兴趣。最广泛使用的基于皂苷的佐剂是Quil A及其衍生物QS-21, 它们可修饰T细胞和抗原呈递细胞, 诱导促炎性Th1/Th2免疫或抗炎性Th2免疫。Sun等指出从合欢皮总皂苷(AJST)分离出来的AJS75组分, 能显著提高卵蛋白和重组鸡痘病毒载体禽流感疫苗免疫小鼠血清抗原特异性IgG、IgG1、IgG2a和IgG2b抗体效价, 通过在注射部位诱导细胞因子和趋化因子的表达来诱导Th1/Th2应答, 从而提高抗原特异性细胞免疫和体液免疫应答[16]。Qu等研究分析了弓形虫重组蛋白ROP18与人参皂苷Re (一种从人参中分离出来的重要成分)联合应用对小鼠免疫的有效保护作用, 结果表明, 添加人参皂苷Re可使ROP18诱导产生更强的体液和细胞免疫反应[17]。皂苷类佐剂最初应用于癌症疫苗(即黑色素瘤、乳腺癌和前列腺癌), 随后开始应用于阿尔茨海默氏病和传染性疾病的疫苗, 包括艾滋病、流感、单纯性疱疹、疟疾和乙型肝炎疾病等[18]。
皂苷作为疫苗佐剂, 能够增强免疫刺激作用。对于抗病毒、抗肿瘤等的新型疫苗, 不同种类的皂苷及其衍生物有着良好的佐剂效果, 因此新型皂苷佐剂的研究对于现代疫苗的开发有着重要作用。
1.6 脂多糖脂多糖(Lipopolysaccharide, LPS)天然存在于革兰氏阴性菌的外膜中, 是天然免疫系统的强激活剂, 是细菌感染后引起适应性免疫反应的关键因素。脂多糖及其衍生物可以添加到抗原疫苗中起免疫增强剂的作用, 但天然脂多糖往往会增加疫苗的反应性, 具有一定的内毒素活性。因此可以通过对脂多糖的结构进行修饰来降低其毒性, 同时触发针对特定病原体所需的适当免疫反应。脂多糖通常由3个部分组成:多糖O抗原、核心寡糖和疏水性脂质A。哺乳动物免疫细胞通过模式识别受体复合体Toll样受体4 (TLR4)/髓样分化蛋白2 (MD-2)识别脂质A来激活免疫细胞并释放炎症细胞因子, 脂质A是天然免疫的有效诱导剂和免疫应答的有效增强剂。LPS是已知最活跃的病原体相关分子模式之一, 针对LPS进行化学或遗传修饰以降低其毒性是其在佐剂应用中的关键。例如单磷脂A (Monophosphoryl lipid A, MPLA)是通过对脂质A进行修饰, 降低其内毒素活性并保留其佐剂效应。Geurtsen等将含有纯化的百日咳杆菌蛋白的无细胞百日咳疫苗与MPLA一起免疫小鼠, 结果发现MPLA不仅可增强疫苗的效力, 还可避免Ⅰ型超敏反应的发生[19]。Kundi研究发现含脱酰化单磷脂A的佐剂系统与乙型肝炎表面抗原联合使用, 可以以更快的速度诱导更高的抗体效价, 并能持续更长时间的保护[20]。MPLA因其低毒性和良好的免疫刺激性, 可以有效地提高免疫原性较差的重组蛋白或多肽抗原疫苗的免疫反应。在未来, 通过对脂多糖进行修饰制备佐剂具有巨大的潜力。
2 抗原递送类佐剂针对新型安全的亚单位疫苗存在的免疫原性弱、稳定性差、细胞微环境中易降解等问题, 利用载体递送疫苗可以作为一种可行的解决方案。载体可以控制抗原在免疫系统中的时空呈现, 从而促进疫苗的持续释放和靶向性, 低剂量的弱免疫原也可以有效地刺激免疫。目前脂质体、纳米粒子、微球、胶束系统等抗原递送载体不断被开发和应用。
2.1 脂质体脂质体是由天然产物中的非免疫原性、无毒性和可生物降解的磷脂组成的能够包裹抗原的球体, 可作为抗原递送类佐剂, 充当递送疫苗的工具。脂质体可作为疫苗载体系统的一个关键优势是它的多功能性和可塑性。利用其化学性质, 水溶性抗原(蛋白质、肽、核酸、碳水化合物、半抗原)被包埋在脂质体的水性内部空间中, 而亲脂化合物(脂肽、抗原、佐剂、连接分子)被嵌入到脂质双层中, 同时抗原或其他佐剂可以通过吸附或稳定的化学连接附着到脂质体表面。DNA疫苗被包裹在脂质体中, 可以更有效地穿过细胞膜到细胞内进行表达, 脂质体在这个过程中起到保护和缓释作用[21]。脂质体可以被免疫刺激分子和靶向分子进行修饰, 作为一种多功能疫苗佐剂传递系统参与免疫过程, 它们能靶向免疫细胞甚至细胞器, 产生溶酶体逃逸, 促进抗体的交叉表达, 从而极大地提高了疫苗的免疫效果。Qu等评估了阳离子二甲基十八烷基铵/海藻糖6, 6, 9-二苯甲酸(DDA/TDB)脂质体与流感抗原A (H3N2)联合鼻腔给药来诱导黏膜和全身抗体反应, 结果表明, 阳离子DDA/TDB脂质体具有显著的免疫刺激活性, 经鼻腔给药后可显著提高黏膜IgA、全身IgG、IgG1和IgG2b抗体滴度[22]。
但作为佐剂, 脂质体也存在一些不足, 例如在储存过程中, 磷脂中的不饱和脂肪酸会逐渐氧化;脂质体易发生融合, 在相互融合过程中可以导致包裹的抗原释放出来;同时脂质体制备的技术性较高, 费用也较高。目前通过对脂质体不断研究, 已经设计出几种新型脂质体, 例如超可变形囊泡(Transfersome)、双层间交联的多层囊泡和固体核心脂质体等来用于疫苗递送[23]。
2.2 纳米颗粒纳米颗粒(Nanoparticles, NPs)一般为粒径小于100 nm的超微粒子。它的比表面积大, 具有较多表面活性中心, 可以更多更好地吸附和催化抗原, 且纳米粒子具有很好的生物相容性, 能够持续释放抗原, 使机体抗原维持在有效浓度。目前, 有机纳米颗粒和无机纳米颗粒被广泛应用于佐剂递送系统的研究。例如, 最常用的有磷酸钙、壳聚糖、纳米硅等。
磷酸钙是最常用的无机纳米佐剂之一, 早期研究表明, 磷酸钙可以产生强大的辅助作用, 基于磷酸钙制备的纳米颗粒, 具有pH依赖性溶解、体外无菌性和稳定性等特性, 使得其更易于生产和储存。有研究通过将猪瘟多肽疫苗与磷酸钙纳米颗粒联合使用, 使猪瘟多肽疫苗附着到纳米磷酸钙上, 结果表明, 相对于游离猪瘟多肽, 附着到纳米颗粒上的猪瘟多肽诱导更高的免疫效果[24]。许多临床研究也表明, 添加磷酸钙纳米颗粒可以引发更均衡的免疫应答, 同时其还具有可生物降解性和良好的生物相容性, 被认为是疫苗制剂中各种免疫原的可用佐剂[25]。
壳聚糖(Chitosan, CS)化学名为β-(1-4)-2-氨基葡聚糖, 是一类天然多糖。壳聚糖纳米颗粒具有良好的生物相容性, 可用作抗原载体, 促使大分子顺利通过上皮组织屏障, 减少抗原降解同时延长抗原在体内的停留时间, 促进抗原提呈, 加强抗原的免疫反应[26]。研究显示壳聚糖通过诱导Ⅰ型干扰素, 促进树突状细胞成熟, 并以Ⅰ型干扰素受体依赖性方式增强抗原特异性Th1细胞反应[27]。
介孔二氧化硅(Mesoporous Silica, MSs)是一种重要的无机纳米颗粒, 它具有高比表面积和介孔结构等特点, 被用作多种生物分子传输介质。异于传统的钙、铝佐剂作用于胃肠后引起的不稳定性, 可控合成的介孔二氧化硅具有更稳定的安全性, 负载抗原后的介孔二氧化硅纳米颗粒在生物体内酶环境变化和pH波动下具有较好的稳定性。同时介孔二氧化硅纳米颗粒还易于合成, 易于表面多功能化, 具有良好的生物相容性以及优良的理化和热稳定性等特点, 因此作为优良的载体的介孔二氧化硅纳米颗粒受到了广泛关注[28-30]。第一次基于硅元素被用作口服免疫的疫苗佐剂是SBA-15型介孔二氧硅, Carvalho等将SBA-15二氧化硅介孔分子筛作为佐剂与BSA牛血清蛋白结合, 发现抗原蛋白的免疫原性明显增强[31];Mercuri等也将SBA-15二氧化硅介孔分子筛作为佐剂与蛇毒重组蛋白Int1β结合后, 抗原蛋白的免疫原性也明显增强[32]。Guo等利用中空结构的介孔二氧化硅装载猪圆环病毒2型ORF2蛋白免疫小鼠, 结果发现, 利用介孔二氧化硅作载体, 可以提高细胞免疫和体液免疫应答, 尤其是持续性免疫应答[33]。刘志军将新型的病毒样颗粒(Virus like particles, VLPs)疫苗与介孔二氧化硅纳米颗粒进行结合免疫豚鼠, 结果发现, 相对于VLPs组, MSNs+VLPs组诱导产生的抗体水平更高, 抗体水平在体内可以维持较长时间, 可以产生更好的免疫保护[34]。介孔二氧化硅纳米颗粒作为佐剂可以有效将抗原呈递到APCs, 诱导产生体液免疫和细胞免疫应答, 该无机纳米颗粒在亚单位疫苗、多肽疫苗、重组疫苗等新型疫苗研制过程中越来越重要。当蛋白抗原与MSs结合时, 与单独的可溶性蛋白抗原相比, 联合使用能产生更强的免疫应答, 因此介孔二氧化硅纳米颗粒在作为抗原递送类佐剂具有潜在的巨大应用前景。
3 复合佐剂随着新型疫苗的发展, 单一功能的佐剂往往不能满足人们需要, 因此就要利用不同成分佐剂之间的协同作用。复合佐剂就是为了最大程度地发挥佐剂效应, 将起不同免疫效果的两种或多种的佐剂进行搭配使用, 佐剂的复合可以进一步地调节或增强免疫应答, 起到更强的免疫保护作用。复合佐剂主要分为两类:一是以载体为基础的复合, 二是非载体佐剂的复合。
3.1 以载体为基础的复合抗原递送类的佐剂, 往往具有易修饰的特点, 可以将其与免疫增强剂或靶向分子进行结合, 以此提高抗原的靶向性并延长抗原存在时间, 诱导有效而持久的免疫效应和记忆抗体。免疫刺激分子的组合AS01佐剂, 是一种基于脂质体的疫苗佐剂系统, 其中包含两种免疫刺激剂:3-o-去酰基-4-4-单磷酰基脂质A (MPL)和皂苷QS-21。它不仅可以递送抗原, 还可以增强抗原的体液免疫和细胞免疫[35]。免疫刺激复合物(Immune stimulating complex, ISCOM)是由皂苷、胆固醇和磷脂混合形成的空心笼状结构, 其粒径在30–40 nm之间。抗原可以被包裹在空心笼状结构内部被递送, 同时皂苷作为一种免疫调节分子, 还可以诱导机体产生更强的免疫应答反应。Wee等[36]评估了添加ISCOMATRIX佐剂的流感疫苗发现低剂量的抗原也能有效地诱导免疫应答, 且抗体水平显著高于未添加佐剂的对照组。Pandey等[37]将重组乙型肝炎表面抗原(HBsAg)纳入免疫刺激复合物(ISCOMs)中, 通过鼻腔给药小鼠, 实验结果发现, 药物可以有效诱导小鼠的体液免疫、细胞免疫和粘膜免疫, 小鼠的细胞因子水平和粘膜分泌物中的分泌型SIgA反应显著高于对照组。ISCOMs具有高效的抗原递送和免疫刺激特性, 与其他佐剂相比, ISCOMs的安全性更高, 能够形成长效的生物活性反应, 刺激产生粘膜免疫。病毒体是指在体外由脂质和纯化的病毒包膜蛋白组装而成的重组病毒被膜[38], 它是没有病毒基因组和内部蛋白质的病毒包膜, 因此不会在细胞中进行复制, 安全性较高。目前, 病毒体已经发展成为了一种药物载体和佐剂系统。病毒体的结构类似于单层脂质体, 可以通过与内体膜融合或内吞作用将抗原递送到细胞质中。目前广泛使用的病毒体系统是免疫增强型重组流感病毒体(Immunopotentiating reconstituted influenza virosomes, IRIV), 该病毒体包含插入在脂质膜内的血凝素(HA)和神经氨酸酶(NA)蛋白[39]。流感病毒体现已应用于药物或疫苗递送系统。一项关于流感病毒体的研究结果表明, 在BALB/c小鼠中, 流感病毒体与粘膜佐剂热不稳定毒素(Heat-labile toxin, HLT)联合免疫呼吸道合胞病毒F蛋白(RSV-F), 相比于RSV-F和RSV-F+HLT实验组, 用RSV-F/IRIV+HLT免疫小鼠后不仅出现粘膜IgA反应和高水平的血清IgG, 而且Th1/Th2细胞因子表达达到平衡, 流感病毒体能显著增强动物的免疫应答[40]。病毒体系统不仅可以通过激活固有的传感器和释放细胞因子来增强抗原摄取、加工和呈递的能力, 同时还具有免疫刺激功能。因此病毒体可以作为一种良好的佐剂应用于疫苗开发。
以载体为基础的佐剂复合化, 使免疫刺激分子与疫苗同时经过抗原递送系统呈递到免疫细胞, 使佐剂与疫苗最大程度的发挥作用。
3.2 非载体佐剂的复合一般佐剂是使用单一免疫激动剂在水包油乳液中配制。近年来, 由多种免疫激动剂组成的复合佐剂显示出良好的前景。免疫系统可以通过识别病原体的不同组成成分来激活先天免疫系统, 诱导多种免疫反应, 这些组成成分被称为病原体相关分子模式(PAMP)。不同的PAMP常被用作佐剂来激活特异性模式识别受体(Pattern recognition receptors, PRRs), 以此提高疫苗的免疫原性。天然或合成优化的PAMP衍生物作为TLR的配体, 可引起强烈的Th1反应, 这是许多疫苗所缺乏的[41]。除此之外还有其他类型的PAMPs, 如干扰素基因刺激因子(Stimulator of interferon genes, STING)、维甲酸诱导基因Ⅰ(Retinoic acid-inducible gene Ⅰ, RIG-Ⅰ)和C型凝集素(C-type lectin, CLR)激动剂, 也开始被用作潜在的佐剂[42-43]。不同的免疫刺激分子靶向不同类别的特定PRR, 可提供广泛的免疫应答;不同的受体激活不同的信号传导途径, 从而影响适应性免疫应答以产生确定的细胞和抗体应答[44-45]。许多佐剂配方是由单一类型的PAMP组成, 但是往往单一的免疫激动剂在诱导有效的免疫反应方面并不总是像整个病原体一样有效, 因此人们越来越多地使用多种配体来协同增强免疫反应。通过免疫协同效应进行反应放大, 有助于区分外源抗原和自身抗原, 从而防止自身免疫反应。同时免疫协同作用还可以改变产生的反应类型, 这取决于靶向PRRs的特定组合, 确保产生的保护性免疫反应是针对感兴趣的病原体而定制的[46]。在研究中, 使用多种PAMPs作为佐剂已经被证明可以更好地促进疫苗接种的效果。例如, 之前有研究验证了在鸡单核细胞中, CpG ODN和Poly (I:C)的联用比单独使用CpG ODN或Poly (I:C)诱导的促炎反应更强烈, 持续时间更长[47]。Vassilieva等描述了一种干扰素基因刺激因子-2′, 3′-环鸟苷单磷酸-腺苷单磷酸(cGAMP)与皂苷(Quil-A)佐剂进行复合, 与亚单位流感疫苗混合使用, 结果表明, 单独使用Quil-A和cGAMP都不能保证完全抵御活病毒的攻击, 而使用cGAMP/Quil-A佐剂组合在一次接种后对小鼠提供了100%的保护[48]。由此可见, 多种免疫刺激分子复合发挥协同作用在新的佐剂开发中具有相当大的潜力。
复合佐剂可在最大程度上增强疫苗的免疫应答, 上调对机体的全面保护, 因此已成为佐剂发展的一大趋势。
4 展望本文根据佐剂的作用综述了免疫调节分子类、抗原递送类和复合类3种类型的佐剂, 以期对国内的佐剂研发提供一定的参考。综上所述, 应用于疫苗生产中的佐剂, 首先要能够增强抗原的免疫应答, 诱发对机体的保护作用;其次佐剂的作用要稳定持久, 能够保护抗原在到达靶向位置前不被降解, 使疫苗能够充分发挥作用。随着疫苗佐剂研究的不断深入和广泛应用, 佐剂的复合化使用是一大趋势, 尤其对于存在抗原性差和细胞环境易降解的合成肽疫苗、核酸疫苗等新型疫苗来说, 复合佐剂能够更大程度上增强抗原的免疫应答, 减少抗原的降解, 诱发不同类型的免疫反应, 为机体提供全面的免疫保护, 佐剂的复合化也可以更好地解决疫苗免疫抑制的问题。因此具有免疫增强和抗原递送双重作用的复合佐剂将是今后佐剂研究的一个重要方向, 在佐剂的研制中具有巨大优势。
| [1] |
Reed SG, Orr MT, Fox CB. Key roles of adjuvants in modern vaccines. Nat Med, 2013, 19(12): 1597-1608. DOI:10.1038/nm.3409 |
| [2] |
Bode C, Zhao G, Steinhagen F, et al. CpG DNA as a vaccine adjuvant. Expert Rev Vaccines, 2011, 10(4): 499-511. DOI:10.1586/erv.10.174 |
| [3] |
Moldoveanu Z, Love-Homan L, Huang WQ, et al. CpG DNA, a novel immune enhancer for systemic and mucosal immunization with influenza virus. Vaccine, 1998, 16(11/12): 1216-1224. |
| [4] |
Mendez S, Tabbara K, Belkaid Y, et al. Coinjection with CpG-containing immunostimulatory oligodeoxynucleotides reduces the pathogenicity of a live vaccine against cutaneous Leishmaniasis but maintains its potency and durability. Infect Immun, 2003, 71(9): 5121-5129. DOI:10.1128/IAI.71.9.5121-5129.2003 |
| [5] |
Zhang LH, Tian XS, Zhou FZ. In vivo oral administration effects of various oligodeoxynucleotides containing synthetic immunostimulatory motifs in the immune response to pseudorabies attenuated virus vaccine in newborn piglets. Vaccine, 2008, 26(2): 224-233. DOI:10.1016/j.vaccine.2007.10.058 |
| [6] |
Zhang LH, Tian XS, Zhou FZ. Vaccination with Newcastle disease vaccine and CpG oligodeoxynucleotides induces specific immunity and protection against Newcastle disease virus in SPF chicken. Vet Immunol Immunopathol, 2007, 115(3/4): 216-222. |
| [7] |
Wei B, Chen WJ, Zhu L, et al. Immunity enhancement of swine FMDV type-O synthetic peptide vaccine by Th epitope peptides and Poly (I:C). J Nanjing Agric Univ, 2017, 40(1): 163-168 (in Chinese). 魏冰, 陈文娟, 朱琳, 等. Th表位肽与聚肌胞苷酸对猪O型口蹄疫合成肽疫苗的免疫增强作用. 南京农业大学学报, 2017, 40(1): 163-168. |
| [8] |
Cao YM, Lu ZJ, Li YL, et al. Poly (I:C) combined with multi-epitope protein vaccine completely protects against virulent foot-and-mouth disease virus challenge in pigs. Antiviral Res, 2013, 97(2): 145-153. DOI:10.1016/j.antiviral.2012.11.009 |
| [9] |
Apostolico JDS, Lunardelli VAS, Yamamoto MM, et al. Poly (I:C) potentiates T cell immunity to a dendritic cell targeted HIV-multiepitope vaccine. Front Immunol, 2019, 10: 843. DOI:10.3389/fimmu.2019.00843 |
| [10] |
Sadeghi Z, Fasihi-Ramandi M, Bouzari S. Evaluation of immunogenicity of novel multi-epitope subunit vaccines in combination with poly I:C against Brucella melitensis and Brucella abortus infection. Int Immunopharmacol, 2019, 75: 105829. DOI:10.1016/j.intimp.2019.105829 |
| [11] |
WM, SLH, JB, et al. Adjuvant effects of IL-1β, IL-2, IL-8, IL-15, IFN-α, IFN-γ TGF-β4 and lymphotactin on DNA vaccination against Eimeria acervulina. Vaccine, 2001, 20(1/2): 267-274. |
| [12] |
Ma XL, Kadir Z, Li JY, et al. The effects of GM-CSF and IL-5 as molecular adjuvants on immune responses and contraception induced by mZP3 DNA vaccination. Am J Reprod Immunol, 2012, 68(6): 476-485. DOI:10.1111/aji.12007 |
| [13] |
Honko AN, Sriranganathan N, Lees CJ, et al. Flagellin is an effective adjuvant for immunization against lethal respiratory challenge with Yersinia pestis. Infect Immun, 2006, 74(2): 1113-1120. DOI:10.1128/IAI.74.2.1113-1120.2006 |
| [14] |
Huleatt JW, Nakaar V, Desai P, et al. Potent immunogenicity and efficacy of a universal influenza vaccine candidate comprising a recombinant fusion protein linking influenza M2e to the TLR5 ligand flagellin. Vaccine, 2008, 26(2): 201-214. DOI:10.1016/j.vaccine.2007.10.062 |
| [15] |
Hossain MS, Jaye DL, Pollack BP, et al. Flagellin, a TLR5 agonist, reduces graft-versus-host disease in allogeneic hematopoietic stem cell transplantation recipients while enhancing antiviral immunity. J Immunol, 2011, 187(10): 5130-5140. DOI:10.4049/jimmunol.1101334 |
| [16] |
Sun HX, He SW, Shi MH. Adjuvant-active fraction from Albizia julibrissin saponins improves immune responses by inducing cytokine and chemokine at the site of injection. Int Immunopharmacol, 2014, 22(2): 346-355. DOI:10.1016/j.intimp.2014.07.021 |
| [17] |
Qu DF, Han JZ, Du AF. Enhancement of protective immune response to recombinant Toxoplasma gondii ROP18 antigen by ginsenoside Re. Exp Parasitol, 2013, 135(2): 234-239. DOI:10.1016/j.exppara.2013.07.013 |
| [18] |
Bigaeva E, Van Doorn E, Liu H, et al. Meta-analysis on randomized controlled trials of vaccines with QS-21 or ISCOMATRIX adjuvant: safety and tolerability. PLoS ONE, 2016, 11(5): e0154757. DOI:10.1371/journal.pone.0154757 |
| [19] |
Geurtsen J, Banus HA, Gremmer ER, et al. Lipopolysaccharide analogs improve efficacy of acellular pertussis vaccine and reduce type Ⅰ hypersensitivity in mice. Clin Vaccine Immunol, 2007, 14(7): 821-829. DOI:10.1128/CVI.00074-07 |
| [20] |
Kundi M. New hepatitis B vaccine formulated with an improved adjuvant system. Expert Rev Vaccines, 2014, 6(2): 133-140. |
| [21] |
Alving CR, Beck Z, Matyas GR, et al. Liposomal adjuvants for human vaccines. Expert Opin Drug Deliv, 2016, 13(6): 807-816. DOI:10.1517/17425247.2016.1151871 |
| [22] |
Qu WJ, Li N, Yu R, et al. Cationic DDA/TDB liposome as a mucosal vaccine adjuvant for uptake by dendritic cells in vitro induces potent humoural immunity. Artif Cells Nanomed Biotechnol, 2018, 46(S1): 852-860. |
| [23] |
Schwendener RA. Liposomes as vaccine delivery systems: a review of the recent advances. Ther Adv Vaccines, 2014, 2(6): 159-182. DOI:10.1177/2051013614541440 |
| [24] |
Guo P, Wang XY, Xue FQ, et al. Calcium phosphate nanoparticles as adjuvant in peptide vaccine against classical swine fever. Chin J Anim Infect Dis, 2012, 20(6): 63-67 (in Chinese). 郭沛, 王霄旸, 薛飞群, 等. 纳米磷酸钙作为猪瘟多肽疫苗佐剂的研究. 中国动物传染病学报, 2012, 20(6): 63-67. DOI:10.3969/j.issn.1674-6422.2012.06.012 |
| [25] |
Lin YH, Wang X, Huang XF, et al. Calcium phosphate nanoparticles as a new generation vaccine adjuvant. Expert Rev Vaccines, 2017, 16(9): 895-906. DOI:10.1080/14760584.2017.1355733 |
| [26] |
Liang HY, Ren HM, Zhang Y, et al. Application of chitosan nanoparticles in outer membrane protein vaccine against Salmonella Paratyphi A. Chin J Biol, 2018, 31(8): 809-812, 816 (in Chinese). 梁昊宇, 任慧梅, 张影, 等. 壳聚糖纳米粒在甲型副伤寒沙门菌外膜蛋白疫苗中的应用. 中国生物制品学杂志, 2018, 31(8): 809-812, 816. |
| [27] |
Carroll EC, Jin L, Mori A, et al. The vaccine adjuvant chitosan promotes cellular immunity via DNA sensor cGAS-STING-dependent induction of type Ⅰ interferons. Immunity, 2016, 44(3): 597-608. DOI:10.1016/j.immuni.2016.02.004 |
| [28] |
Mody KT, Popat A, Mahony D, et al. Mesoporous silicananoparticles as antigen carriers and adjuvants for vaccine delivery. Nanoscale, 2013, 5(12): 5167-5179. DOI:10.1039/c3nr00357d |
| [29] |
Argyo C, Weiss V, Bräuchle C, et al. Multifunctional mesoporous silica nanoparticles as a universal platform for drug delivery. Chem Mater, 2013, 26(1): 435-451. |
| [30] |
Martin-Ortigosa S, Peterson DJ, Valenstein JS, et al. Mesoporous silica nanoparticle-mediated intracellular cre protein delivery for maize genome editing via loxP site excision. Plant Physiol, 2014, 164(2): 537-547. DOI:10.1104/pp.113.233650 |
| [31] |
Carvalho LV, Ruiz RC, Scaramuzzi K, et al. Immunological parameters related to the adjuvant effect of the ordered mesoporous silica SBA-15. Vaccine, 2010, 28(50): 7829-7836. DOI:10.1016/j.vaccine.2010.09.087 |
| [32] |
Mercuri LP, Carvalho LV, Lima FA, et al. Ordered mesoporous silica SBA-15: a new effective adjuvant to induce antibody response. Small, 2006, 2(2): 254-256. DOI:10.1002/smll.200500274 |
| [33] |
Guo HC, Feng XM, Sun SQ, et al. Immunization of mice by hollow mesoporous silica nanoparticles as carriers of porcine circovirus type 2 ORF2 protein. Virol J, 2012, 9: 108. DOI:10.1186/1743-422X-9-108 |
| [34] |
Liu ZJ. Study on biological characteristics of mesoporous silica as a vaccine adjuvant[D]. Lanzhou: Lanzhou University of Technology, 2019 (in Chinese). 刘志军.介孔二氧化硅用作疫苗佐剂的生物学特性研究[D].兰州: 兰州理工大学, 2019. |
| [35] |
Didierlaurent AM, Laupeze B, Di Pasquale A, et al. Adjuvant system AS01: helping to overcome the challenges of modern vaccines. Expert Rev Vaccines, 2017, 16(1): 55-63. DOI:10.1080/14760584.2016.1213632 |
| [36] |
Wee JLK, Scheerlinck JPY, Snibson KJ, et al. Pulmonary delivery of ISCOMATRIX influenza vaccine induces both systemic and mucosal immunity with antigen dose sparing. Mucosal Immunol, 2008, 1(6): 489-496. DOI:10.1038/mi.2008.59 |
| [37] |
Pandey RS, Dixit VK. Evaluation of ISCOM vaccines for mucosal immunization against hepatitis B. J Drug Target, 2010, 18(4): 282-291. DOI:10.3109/10611860903450015 |
| [38] |
Almeida J, Edwards DC, Brand C, et al. Formation of virosomes from influenza subunits and liposomes. The Lancet, 1975, 306(7941): 899-901. DOI:10.1016/S0140-6736(75)92130-3 |
| [39] |
Apostólico JDS, Lunardelli VAS, Coirada FC, et al. Adjuvants: classification, Modus operandi, and licensing. J Immunol Res, 2016, 2016: 1459394. |
| [40] |
Cusi MG, Zurbriggen R, Correale P, et al. Influenza virosomes are an efficient delivery system for respiratory syncytial virus-F antigen inducing humoral and cell-mediated immunity. Vaccine, 2002, 20(29/30): 3436-3442. |
| [41] |
Toussi DN, Massari P. Immune adjuvant effect of molecularly-defined toll-like receptor ligands. Vaccines, 2014, 2(2): 323-353. DOI:10.3390/vaccines2020323 |
| [42] |
Temizoz B, Kuroda E, Ishii KJ. Combination and inducible adjuvants targeting nucleic acid sensors. Curr Opin Pharmacol, 2018, 41: 104-113. DOI:10.1016/j.coph.2018.05.003 |
| [43] |
Thakur A, Andrea A, Mikkelsen H, et al. Targeting the Mincle and TLR3 receptor using the dual agonist cationic adjuvant formulation 9 (CAF09) induces humoral and polyfunctional memory T cell responses in calves. PLoS ONE, 2018, 13(7): e201253. |
| [44] |
Fischetti L, Zhong ZY, Pinder CL, et al. The synergistic effects of combining TLR ligand based adjuvants on the cytokine response are dependent upon p38/JNK signalling. Cytokine, 2017, 99: 287-296. DOI:10.1016/j.cyto.2017.08.009 |
| [45] |
Knudsen NP, Olsen A, Buonsanti C, et al. Different human vaccine adjuvants promote distinct antigen- independent immunological signatures tailored to different pathogens. Sci Rep, 2016, 6: 19570. DOI:10.1038/srep19570 |
| [46] |
Timmermans K, Plantinga TS, Kox M, et al. Blueprints of signaling interactions between pattern recognition receptors: implications for the design of vaccine adjuvants. Clin Vaccine Immunol, 2013, 20(3): 427-432. DOI:10.1128/CVI.00703-12 |
| [47] |
He HQ, MacKinnon KM, Genovese KJ, et al. CpG oligodeoxynucleotide and double-stranded RNA synergize to enhance nitric oxide production and mRNA expression of inducible nitric oxide synthase, pro-inflammatory cytokines and chemokines in chicken monocytes. Innate Immun, 2010, 17(2): 137-144. |
| [48] |
Vassilieva EV, Taylor DW, Compans RW. Combination of STING pathway agonist with saponin is an effective adjuvant in immunosenescent mice. Front Immunol, 2019, 10: 3006. DOI:10.3389/fimmu.2019.03006 |
 2021, Vol. 37
2021, Vol. 37