中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王欣俞, 张延海, 崔凯, 蔡立文, 郭奕阳
- Wang Xinyu, Zhang Yanhai, Cui Kai, Cai Liwen, Guo Yiyang
- 西门子ADVIA Centaur XP化学发光免疫分析仪检测梅毒螺旋体特异性抗体的测量阈值建立及结果比较
- Establishment of measurement threshold and comparison of results for detection of Treponema pallidum specific antibody by Siemens ADVIACentaur XP chemiluminescent immunoanalyzer
- 生物工程学报, 2020, 36(8): 1672-1678
- Chinese Journal of Biotechnology, 2020, 36(8): 1672-1678
- 10.13345/j.cjb.190567
-
文章历史
- Received: December 19, 2019
- Accepted: March 16, 2020
- Published: April 3, 2020
2. 河北医科大学 第四医院 检验科,河北 石家庄 050000
2. Department of Clinical Laboratory, The Fourth Hospital of Hebei Medical University, Shijiazhuang 050000, Hebei, China
梅毒是由梅毒螺旋体(Treponema pallidum,TP)感染引起的一种慢性的系统性的性传播疾病。人类是唯一宿主,早期通过黏膜或破损的皮肤侵入,潜伏期后侵犯患者多种组织,包括皮肤、骨、中枢神经系统和心血管系统[1-2]。世界卫生组织(World Health Organization,WHO)估计每年感染TP的病例数为3 600万例,新增感染人数超过1 200万[3]。全球每年有136万孕妇感染TP,其中约52万患者出现胎儿死亡[4]。由于梅毒的保护性免疫的抗体尚未被分离出,也无有效疫苗[5],TP外膜脆弱,人工培养和基因操控无法进行[6]。TP抗体检测是目前梅毒诊断的重要依据,得到广泛临床认可[7]。梅毒实验室检测主要依赖血清学检测,包括酶联免疫吸附试验、梅毒甲苯胺红不加热血清凝集试验、梅毒螺旋体抗体颗粒凝集试验(Treponema pallidum particle agglutination,TPPA)和梅毒螺旋体免疫印迹试验(Treponema pallidum-Western blotting,TP-WB)等。梅毒螺旋体抗体检测存在一定的假性结果[8]。目前,梅毒检测已成为临床患者、献血人员和体检人群的常规筛查项目。面对标本量的急增,临床实验室需要有高灵敏度和特异度的梅毒测定方法,同时又需要操作简便和自动化程度高。化学发光法因其灵敏度高,特异度好,已经成为国外梅毒检测的主要方法[9]。梅毒检测在临床应用血清学筛查弱反应性检测结果中存在一定假阳性率,给临床辅助诊断带来困扰。本研究主要是探讨化学发光免疫分析法(Chemiluminescence analysis,CLIA)检测梅毒螺旋体特异性抗体的测量阈值,为提高实验室检测梅毒特异性抗体的准确性提供参考,同时比较CLIA法与其他方法检测结果,为临床检验结果的综合判别提供依据。
1 材料与方法 1.1 一般资料回顾性纳入河北燕达医院2018年7月至2019年7月使用雅培ARCHITECT i2000化学发光微粒子免疫分析法(Chemiluminescence microparticle immunoassays,CMIA)梅毒血清学筛查样本30 887例,选取检测结果S/CO 1–9且快速血浆反应素环状卡片试验(Rapid plasma reagin,RPR)检测均为阴性的样本153例为研究对象,其中男76例、女77例,年龄10–85岁,中位年龄54.2岁。梅毒诊断符合《中华人民共和国卫生行业标准-梅毒诊断(WS273-2018)》[10]。
1.2 试剂和仪器CMIA法试剂(批号:07413BE00)及ARCHITECT i2000全自动微粒子化学发光分析仪器,购自美国雅培公司;CLIA法试剂(批号:26098063)及ADVIA Centaur XP全自动化学发光分析仪器,购自德国西门子公司;TPPA法试剂(批号:WN81029),购自日本富士瑞必欧株式会社公司;TP-WB法试剂(批号:D180619AG)及EUROBlotMasterll全自动免疫印迹仪器,购自德国欧蒙公司。梅毒实验室检测按标准化操作文件执行。检测样本时,同测室内质控品及阴、阳性对照,以保证监控检测质量。
1.3 方法 1.3.1 CMIA、CLIA法和TPPA法测定153份纳入研究对象的标本分别用美国雅培公司I2000化学发光免疫分析仪、西门子ADVIA Centaur XP全自动化学发光分析仪器检测。CMIA、CLIA从测试到结果判读均为仪器全自动完成,仪器内置的判断标准抗-TP的S/CO > 1.0,提示有反应性;S/CO < 1.0,提示非反应性。CLIA法检测原理将含有吖啶酯标记的TP重组抗原TPN15、TPN17的辅助试剂添加到样品中,样品中存在TP抗体,结合后形成复合物,再添加生物素化梅毒螺旋体重组抗原,结合链霉亲和素包被的磁性乳胶颗粒固相捕获TP抗体-抗原复合物,仪器检测线性为0–45。同时对153份血清标本进行TPPA检测,手工操作,按试剂说明书肉眼判读结果,反应孔中呈光滑纽扣状为阴性,出现凝集呈不规则沉积为阳性。大部分实验室用于梅毒血清学检测复核。
1.3.2 TP-WB法测定对153份血清标本进行确证实验,重组梅毒螺旋体基因蛋白抗原免疫试剂制备:采用基因重组蛋白抗原TPN47、TPN45、TPN17、TPN15制备的NC膜。最后将包被抗原的固相载体与特异性抗体和酶标第二抗体作用后,加入酶反应底物使区带染色,检测结果以实验NC膜条质控条带及各抗原条带的显色通过EUROLineScan软件判读着色强度0–13阴性,14–23灰区,≥24阳性,仪器判读检测线性为0–255。EUROLineScan软件判读结果标准为,至少两条特异性抗原带明确显色(着色强度≥24)为阳性;一条特异性抗原带明确显色(着色强度≥24)为可疑。
1.4 统计学方法以CLIA法读数值为变量,分别以TP-WB及TPPA法读数值为分类变量,采用Medcalc Ver. 14.8进行ROC分析,采用Hanley & McNei方法,得到最佳诊断值(Cut-off criterion value)、敏感度及特异度指数;计数资料的差异显著性分析采用卡方检验进行,P < 0.05为差异有统计学意义。
2 结果与分析 2.1 153例实验样本CLIA法、TPPA、CMIA法及TP-WB法梅毒抗体检测结果比较CLIA法检出143例阳性,10例阴性(1例TP-WB检测可疑阳性);TPPA法检出140例阳性,13例阴性(1例TP-WB检测可疑阳性);TP-WB检出10例阳性,43例可疑阳性,110例阴性;CMIA法检出153例阳性。CLIA法与CMIA阳性符合率93.46%,与TPPA符合率97.90%,与TP-WB法符合率36.36%,采用卡方检验进行计数资料的统计比较结果表明,CLIA法与TPPA法差异无统计学意义,与TP-WB法及CMIA法差异有统计学意义(P < 0.05)。
2.2 CLIA法检测阈值的确定以CLIA值为变量,采用国内TPPA法为金标准分类变量,ROC分析结果表明,曲线下面积(AUC)为0.961,标准误0.021 3,95%置信区间为0.917–0.986,Z=21.683,P < 0.000 1,约登指数(Youden index)=0.808 8,最佳诊断值为4.01,敏感度88.57%,特异度92.31%;采用国外TP-WB法为金标准分类变量,ROC分析结果表明,曲线下面积(AUC)为0.838,标准误0.035 1,95%置信区间为0.770–0.893,Z=9.632,P < 0.000 1,约登指数(Youden index)=0.590 2,最佳诊断值为16.06,敏感度83.02%,特异度76.00%。
| Evaluation of project | Result A* | Result B# |
| Sample size | 153 | 153 |
| Positive group: B=1 | 140 | 53 |
| Negative group: B=0 | 13 | 100 |
| Area under the ROC curve (AUC) | 0.961 | 0.838 |
| Standard error a | 0.021 3 | 0.035 1 |
| 95% Confidence interval b | 0.917–0.986 | 0.770–0.893 |
| Z statistic | 21.683 | 9.632 |
| Significance level P (Area=0.5) | < 0.000 1 | < 0.000 1 |
| Youden index J | 0.808 8 | 0.590 2 |
| Associated criterion | > 4.01 | 16.06 |
| Sensitivity | 88.57 | 83.02 |
| Specificity | 92.31 | 76.00 |
| Note: * TPPA is the gold standard; #TP-WB is the gold standard. | ||
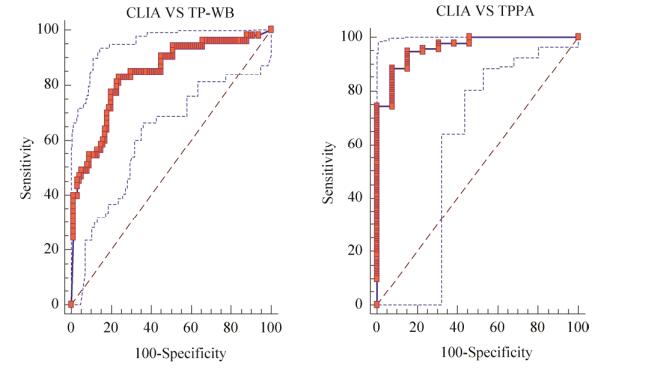
|
| 图 1 梅毒血清学检验CLIA法ROC曲线(左图以TP-WB法为金标准,右图以TPPA法为金标准) Fig. 1 The ROC curve of CLIA method for serological examination of syphilis (on the left, the TP-WB method is used as the gold standard; on the right, the TPPA method is used as the gold standard). |
| |
与TPPA法只显示阴性或阳性结果不同,CMIA法和CLIA法结果报告值同为着色强度读数,两种方法读数分布如图 2所示,153例实验样本,CMIA法读数范围在10以内,而CLIA法读数最高 > 45,提示两种方法对于同一样本检测限存在差异。
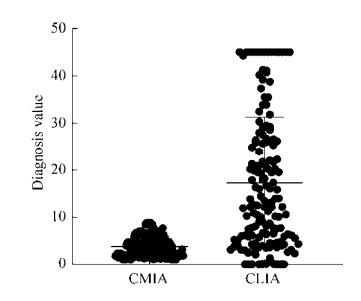
|
| 图 2 153例样本梅毒血清学检验CMIA法及CLIA法检测结果分布 Fig. 2 Distribution of serological test results for syphilis by CMIA method and CLIA method in 153 samples. |
| |
梅毒对人体危害很大,影响学习、就业、婚姻及家庭稳定。由于临床抗生素的广泛应用,致使部分患者呈隐性感染,造成漏诊和误诊。另外,梅毒孕妇通过母婴传播,引起胎儿宫内感染,导致流产、早产、死胎或胎儿先天性梅毒,危害下一代的健康[11]。近年来,梅毒在世界范围内已经成为严重威胁公共健康的一种疾病[12-13]。
血清学检测目前是国内外诊断梅毒的主要方法[14],实验室诊断程序主要有传统实验室诊断程序、逆序实验室诊断程序和第3种实验室诊断程序。传统实验室诊断程序首先采用非TP抗原血清试验,再进行TP抗体血清试验;逆序实验室诊断程序采用TP抗体血清学试验初筛,初筛阳性再行非TP抗原血清学复检;第3种实验室诊断程序以TP抗体血清试验作为初筛,阳性标本再用第2种不同的TP血清试验来确证。但值得一提的是我国CDC性病控制中心在对梅毒血清学诊断试剂进行临床应用评估时,当评估试剂检测结果与TPPA试剂检测参考结果不一致时,推荐选择免疫印迹法进行确认[15]。美国疾病预防控制中心建议实验室诊断执行逆序诊断程序,并以TP-WB检测作为最终确证方法[16-17]。在临床工作中,部分患者无接触史、病史,梅毒血清学筛查结果弱反应性,TPPA复测结果阳性,RPR结果阴性,TP-WB确证结果阴性。本研究中CLIA法与CMIA阳性符合率93.46%,与TPPA符合率97.90%,与TP-WB法符合率36.36%,与以往研究中发现的梅毒弱反应性结果时TPPA与TP-WB符合率28.4%–33%[18-19],以及黄文彩等[20]应用ROC曲线分析确定化学发光微粒子法检测TP-Ab的研究结果显示S/CO最佳临界点为6.815。当临床检测弱反应性结果,应结合患者生理、病理因素综合分析,主要是老年人、孕妇、感染性相关疾病人群、心血管系统相关疾病人群、神经系统相关疾病人群、肿瘤相关疾病人群、免疫性疾病相关人群等,避免梅毒血清学检测生物学假阳性[18-19]。
本研究建立CLIA法中梅毒螺旋体特异性抗体检测的测量阈值,ROC曲线分析发现TPPA为标准最佳诊断截断值为4.01,TP-WB为标准最佳诊断截断值为16.06;CLIA阴性结果中1例与TP-WB确证结果不一致,TP-WB的TPN47抗体表达着色强度24,判读可疑。其原因与CLIA法中包被抗原位点相关,其针对的是TPN15和TPN17,两者方法学结果均未判读阳性;CLIA法和CMIA法结果着色强度读数分布及相关性分析,CMIA法读数范围S/CO值在10以内,而CLIA法读数S/CO值最高 > 45,提示两种方法对于同一样本检测限存在差异,方法灵敏度不同。基于TP-WB着色强度与CLIA法反应性结果分析,当CLIA法梅毒特异性抗体检测S/CO值> 45时无需复查可直接发出结果,准确率达到100%。在张瑞等[21]研究中ADVIA Centaur XP全自动化学发光免疫分析仪检测感染性血清标志物HBsAg、Anti-HIV、Anti-TP、AntiHCV从精密度、临界值附近精密度、最低检出限、方法学间比较、分析测量范围的验证和评估,ADVIA Centaur XP全自动化学发光免疫分析符合预期临床应用要求。基于我们的研究结果ADVIA Centaur XP全自动化学发光免疫分析CLIA法可以用于梅毒血清学人群的筛查,但梅毒检测结果弱反应时需建立测量阈值。
综上所述,本研究结果显示临床两种自动化测定方法之间梅毒弱反应性结果时的阳性符合率具有差异性,ADVIA Centaur XP梅毒血清学检测特异性略高于ARCHITECT i2000血清学检测。当实验室CLIA测定梅毒抗体S/CO为1.00–16.06时,CLIA法建议ROC曲线分析的最佳截断值差异较大,梅毒诊断实验室血清学检测应推荐首选TP-WB方法学为确证标准,避免临床误诊发生。
| [1] |
Kojima N, Klausner JD. An update on the global epidemiology of syphilis. Curr Epidemiol Rep, 2018, 5(1): 24-38. |
| [2] |
Vanhaecke C, Grange P, Benhaddou N, et al. Clinical and biological characteristics of 40 patients with neurosyphilis and evaluation of Treponema pallidum nested polymerase chain reaction in cerebrospinal fluid samples. Clin Infect Dis, 2016, 63(9): 1180-1186. |
| [3] |
Newman L, Rowley J, Vander Hoorn S, et al. Global estimates of the prevalence and incidence of four curable sexually transmitted infections in 2012 based on systematic review and global reporting. PLoS ONE, 2015, 10(12): e0143304. |
| [4] |
Weston EJ, Workowski K, Torrone EA, et al. Adherence to CDC recommendations for the treatment of uncomplicated gonorrhea-STD surveillance network, United States, 2016. MMWR Morb Mortal Wkly Rep, 2018, 67(16): 473-476. |
| [5] |
Okamoto K, Hatakeyama S, Umezawa M, et al. Gastric syphilis: the great imitator in the stomach. ID Cases, 2018, 12: 97-98. |
| [6] |
Zheng K, Liu AY, Wu YM, et al. Vaccinece development fou syphilis. J Microb Infect, 2019, 14(3): 180-184 (in Chinese). 郑康, 刘安元, 吴移谋, 等. 梅毒螺旋体疫苗的研究进展. 微生物与感染, 2019, 14(3): 180-184. |
| [7] |
Xia DJ, Wang W, Xu SH, et al. Development of national reference panel for rapid detection of Treponema pallidum antibody. Chin J Biologicals, 2019, 32(8): 885-889 (in Chinese). 夏德菊, 王薇, 许四宏, 等. 梅毒螺旋体抗体快检试剂国家参考品的研制. 中国生物制品学杂志, 2019, 32(8): 885-889. |
| [8] |
Sommese L, Sabia C, Esposito A, et al. Comparison of performance of two Treponema pallidum automated chemiluminescent immunoassays in blood donors. Infect Dis, 2016, 48(6): 483-487. |
| [9] |
Zhang XD, Liu LH, Zhang JH, et al. Comparison of accuracy of different syphilis screening methods. Chin J Dermatov, 2017, 31(5): 569-572 (in Chinese). 张旭东, 刘连红, 张娟辉, 等. 不同梅毒筛查方法效果比较. 中国皮肤性病学, 2017, 31(5): 569-572. |
| [10] |
National Health Commission of the people's Republic of China. Health industry standard of the people's Republic of China - Diagnosis for syphilis (WS273-2018) [S]2018, 3, 6(in Chinese). 中华人民共和国国家卫生健康委员会.中华人民共和国卫生行业标准-梅毒诊断(WS273-2018) [S]2018, 3, 6. |
| [11] |
Cerqueira LRP, Monteiro DLM, Taquette SR, et al. The magnitude of syphilis: from prevalence to vertical transmission. Rev Inst Med Trop Sao Paulo, 2017, 59(21): e78. |
| [12] |
Mustapha M, Abdollah Z, Ahem A, et al. Ocular syphilis: resurgence of an old disease in modern Malaysian society. Int J Ophthalmol, 2018, 11(9): 1573-1576. |
| [13] |
Long J, Cai SN, Chen C, et al. Changes of regulatory B cells subsets before and after treatment in syphilis patients. Chinese J AIDS & STD, 2017, 23(10): 938-942 (in Chinese). 隆靖, 蔡胜男, 陈琛, 等. 梅毒患者外周血调节性B细胞亚群在治疗前后的变化研究. 中国艾滋病性病, 2017, 23(10): 938-942. |
| [14] |
Wu Q, Wang L, Ji LT, et al. Molecular epidemiological analysis for pregnant women with syphilis in Zhabei District of Shanghai. Lab Med, 2016, 31(6): 486-490 (in Chinese). 吴奇, 王丽, 季灵婷, 等. 上海闸北地区妊娠梅毒分子流行病学特征分析. 检验医学, 2016, 31(6): 486-490. |
| [15] |
Tong ML, Liu LL, Lin LR, et al. Research progress of laboratory detective algorithms for syphilis. Chin J Lab Med, 2017, 11(40): 898-903 (in Chinese). 童曼莉, 刘莉莉, 林丽蓉, 等. 梅毒实验室诊断程序研究进展. 中华检验医学杂志, 2017, 11(40): 898-903. |
| [16] |
Sommese L, Paolillo R, Sabia C, et al. Syphilis detection: evaluation of serological screening and pilot reverse confirmatory assay algorithm in blood donors. Int J STD AIDS, 2016, 27(8): 644-649. |
| [17] |
Li Y, Tan Y, Han XF, et al. Study on the grey area of HBsAg, anti HCV, anti TP and anti HIV detected by ELISA. Intern J Lab Med, 2017, 38(6): 810-812 (in Chinese). 李媛, 谭艳, 韩晓芳, 等. ELISA检测血清HBsAg、抗-HCV、抗-TP、抗-HIV灰区设定的探讨. 国际检验医学杂志, 2017, 38(6): 810-812. |
| [18] |
Wang XY, Zhao JW, Zhang YH, et al. Analysis and evaluation of four syphilis detection methods in uncertain samples of syphilis antibody. J Mod Lab Med, 2019, 34(3): 109-114 (in Chinese). 王欣俞, 赵晋文, 张延海, 等. 四种梅毒血清学检测方法在梅毒抗体不确定样本的分析及评价. 现代检验医学杂志, 2019, 34(3): 109-114. |
| [19] |
Wang XY, Zhao JW, Ding XN, et al. Anaiysis on application of detection of Treponema pallidum, cardiolipin IgG antibody in diagnosis of syphilis. Lab Med Clin, 2019, 16(15): 2123-2126 (in Chinese). 王欣俞, 赵晋文, 丁晓娜, 等. 梅毒螺旋体、心磷脂IgG抗体检测在梅毒诊断中的应用分析. 检验医学与临床, 2019, 16(15): 2123-2126. |
| [20] |
Huang WC, Wei SQ, Fu WJ, et al. Determination of TP-Ab gray area by chemiluminescent particle method using ROC curve analysis. Lab Med Clin, 2019, 16(20): 3031-3033 (in Chinese). 黄文彩, 魏斯琪, 付文金, 等. 应用ROC曲线分析确定化学发光微粒子法检测TP-Ab灰区. 检验医学与临床, 2019, 16(20): 3031-3033. |
| [21] |
Zhang R, Wu X, Qin YL, et al. Performance test and evaluation of ADVIA Centaur XP automatic chemiluminescence immunoassay system. Chin Med Equip J, 2019, 40(10): 53-56 (in Chinese). 张瑞, 吴欣, 秦永亮, 等. ADVIA Centaur XP全自动化学发光免疫分析仪检测感染性血清标志物的性能评价. 医疗卫生装备, 2019, 40(10): 53-56. |
 2020, Vol. 36
2020, Vol. 36




