中国科学院微生物研究所、中国微生物学会主办
文章信息
- 杨弘宇, 张雪, 马振平, 徐宁, 刘君
- Yang Hongyu, Zhang Xue, Ma Zhenping, Xu Ning, Liu Jun
- 谷氨酸棒杆菌过氧化氢酶的异源表达、纯化以及酶学性质
- Expression, purification and characterization of catalase from Corynebacterium glutamicum
- 生物工程学报, 2020, 36(8): 1568-1577
- Chinese Journal of Biotechnology, 2020, 36(8): 1568-1577
- 10.13345/j.cjb.190544
-
文章历史
- Received: December 8, 2019
- Accepted: April 3, 2020
2. 中国科学院天津工业生物技术研究所,天津 300308;
3. 天津科技大学 食品工程与生物技术学院,天津 300457
2. Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China;
3. College of Food Engineering and Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China
过氧化氢酶(Catalase,CAT,EC1.11.1.6)广泛存在于各种细菌、真菌、植物和动物体中[1],是一类特异性催化H2O2分解为H2O和O2的酶[2]。H2O2作为细胞内活性氧(ROS)的组成部分[3],能通过游离Fe2+催化的芬顿反应自发转化为高活性羟基自由基(OH·),这些高活性分子会通过破坏核酸、脂质和蛋白质影响细胞存活[4],而过氧化氢酶作为H2O2的有效细胞清除剂[5],可以避免H2O2对细胞的有害作用,所以过氧化氢酶在生物体的防御体系中占有非常重要的地位。
近年来,在一些医疗、食品和纺织行业,过氧化氢在杀菌或漂白过程中的应用迅速增长[6]。然而其中残留的H2O2对人体健康和环境有害,因此需要进一步去除[2]。氯酸盐化合物通常被用来去除产品或环境中持续存在的过量H2O2,但是氯酸盐化合物具有毒性和污染性[6],而具有高效[7]、安全[8]和环保[9]特性的过氧化氢酶可以作为氯酸盐化合物的替代物[6],是去除H2O2的理想选择。然而在某些工业中过氧化氢酶的使用环境较为特殊,比如纺织工业。过氧化氢酶应用于纺织工业中的热漂步骤,而热漂过程需要较高的pH环境,这就要求过氧化氢酶有良好的耐碱特性[10]。因此,开发碱性过氧化氢酶有重要的工业应用价值。目前已有关于碱性过氧化氢酶的报道,比如Zhang等[11]从嗜碱芽孢杆菌Bacillus sp. F26中纯化得到一种碱性过氧化氢酶,纯酶比活性为14 244 U/mg,还有来自不动杆菌属的Acinetobacter sp. YS0810[6]以及B. subtilis 168[7]的碱性过氧化氢酶纯酶比活性分别为37 318 U/mg和37 081 U/mg。
谷氨酸棒杆菌是一种安全的微生物[12],普遍应用于氨基酸的工业生产[13]。本实验室在前期工作中发现谷氨酸棒杆菌的过氧化氢酶具有清除细胞内活性氧、减轻氧化胁迫的生理学功能[4],而且谷氨酸棒杆菌的pH生长条件为6.0–10.0[13],说明菌株本身有一定的耐碱能力,这就使碱性过氧化氢酶的获得成为可能。因此,本研究将来源于谷氨酸棒杆菌的过氧化氢酶在大肠杆菌Escherichia coli BL21(DE3)中进行异源表达,并进行表达条件优化,采用镍柱亲和层析的方法纯化过氧化氢酶,然后进行了酶学性质的表征。研究结果表明该纯酶比酶活为55 266 U/mg,催化效率较高,并且具有良好的碱耐受性,在工业上有较好的应用前景。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒野生型谷氨酸棒杆菌ATCC 13032菌株由本实验室保存;谷氨酸棒杆菌中过氧化氢酶的基因名称为katA (GenBank登录号BX927148.1);大肠杆菌BL21(DE3)由本实验室保存;含有经过密码子优化的谷氨酸棒杆菌过氧化氢酶katA基因的重组质粒pET21b-katA-C由金斯瑞公司完成;重组菌株E. coli BL21(DE3) (pET21b-katA-C)由本实验构建;含空质粒的菌株E. coli BL21(DE3) (pET21b)由本实验室保存。
1.1.2 试剂蛋白Marker购自赛默飞世尔科技公司;氨苄青霉素(Amp)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG)购自索莱宝生物科技有限公司;Ni SepharoseTM 6 Fast Flow填料购自美国GE Healthcare公司;Bis-Tris propane购自生工生物工程(上海)股份有限公司;其他试剂如磷酸氢二钠、磷酸二氢钠、氯化钠、咪唑等均为国产分析纯。
1.1.3 培养基LB培养基(L–1):氯化钠10 g,蛋白胨10 g,酵母提取物5 g (固体培养基加2%的琼脂粉)。
CGXⅡ基本培养基(L–1):(NH4)2SO4 20 g,尿素5 g,葡萄糖40 g,KH2PO4 1 g,K2HPO4 1 g,FeSO4·7H2O 10 mg,CaCl2 10 mg,ZnSO4·7H2O 1 mg,MgSO4·7H2O 0.25 g,MOPS 42 g,NiCl2·6H2O 0.02 mg,MnSO4·H2O 10 mg,CuSO4 0.2 mg,原儿茶酸0.03 mg,生物素0.2 mg。
1.2 酶活测定方法采用分光光度法在室温下测定。反应总体积为3 mL,含0.1 mL酶液样品和2.9 mL含10 mmol/L H2O2的50 mmol/L NaH2PO4-Na2HPO4缓冲液(pH 7.0),H2O2的分解速率用分光光度计在240 nm下测定。酶活定义为:每分钟分解1 μmol H2O2所需的酶量是1 U[14]。
1.3 谷氨酸棒杆菌生长曲线和细胞内活性氧水平的测定将平板上的新鲜单个菌落转移到液体CGXⅡ基本培养基中,32 ℃、200 r/min培养16 h之后收集菌体,洗涤,分别重悬于pH 7.0和pH 5.6的CGXⅡ新鲜培养基中至起始OD600为0.1,然后每隔2 h测定OD600的值,绘制生长曲线。
将菌株在pH 7.0和pH 5.6的CGXⅡ培养基中培养20 h后,离心收集菌体,用新鲜培养基重悬,并调整菌体浓度OD600为1.0,随后加入终浓度为10 μmol/L的2′, 7′-二氯荧光素二乙酸酯(DCFH-DA)活性氧荧光探针,32 ℃黑暗振荡培养30 min。使用荧光分光光度计在激发波长和发射波长分别为495 nm和525 nm下测定样品相对荧光强度,用于衡量胞内活性氧含量。
1.4 过氧化氢酶的诱导表达优化将金斯瑞公司提供的重组质粒pET21b-katA-C通过热激法转化至感受态细胞E. coli BL21(DE3)中,涂布于含有氨苄青霉素的LB平板上,37 ℃培养,待长出菌落后,将菌接于含有100 μg/mL Amp的LB液体培养基中,37 ℃、200 r/min过夜培养,将过夜培养的菌液按2%接种量转接于含有100 μg/mL Amp的新的LB液体培养基中,待菌体浓度OD600达到0.6–0.8时加入IPTG诱导,诱导完成后,离心收菌,收集相同浓度的菌体,进行超声破碎,超声破碎应在低温下进行,超声破碎条件为:功率285 W,工作1 s,停3 s,破碎5 min。破碎完成后,于4 ℃、8 000 r/min离心10 min,上清即为粗酶液,按照1.2的方法测定粗酶液的活性。
对不同的表达条件进行优化,包括诱导剂IPTG浓度(0.1、0.2、0.4、0.6 mmol/L),诱导温度(16 ℃、25 ℃、30 ℃、37 ℃)和诱导时间(3、5、8、11、13 h)。以含有空质粒的菌株作为对照组。
1.5 过氧化氢酶的纯化将离心收集的菌体,用缓冲液(50 mmol/L Na2HPO4-NaH2PO4,pH 7.0)重悬,进行超声破碎,破碎完成后,于4 ℃、8 000 r/min离心10 min,收集上清,加载到Ni SepharoseTM 6 Fast Flow柱上,用洗脱缓冲液(20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,500 mmol/L咪唑,pH 7.0)洗脱目的蛋白,并收集洗脱液,用10 kDa的超滤管浓缩纯化的蛋白质,并用保存缓冲液(20 mmol/L磷酸盐缓冲液,pH 7.0)储存。所有纯化过程均在4 ℃下进行。用SDS-PAGE检测纯化的过氧化氢酶,并用Bradford方法测定蛋白质含量。
1.6 酶学性质的测定 1.6.1 最适pH的测定于pH 3.0–12.0的范围内测定酶的活性,不同pH缓冲液为:pH 3.0–6.0,Na2HPO4-柠檬酸缓冲液;pH 6.0–10.0,BTP溶液(Bis-Tris propane + Na2HPO4);pH 10.0–12.0,甘氨酸-NaOH缓冲液。在30 ℃测定酶活,探究pH对酶活的影响。
1.6.2 pH稳定性的测定将酶放在不同pH (3.0–12.0)的溶液里,室温处理3 h,然后于pH 11.0、室温下测定,以未经过处理的酶的酶活作为100%。
1.6.3 最适温度的测定在20–70 ℃范围内,于pH 11.0条件下测定过氧化氢酶的活性,探究温度对过氧化氢酶的影响。
1.6.4 温度稳定性的测定将酶放在pH 11.0的溶液中,置于不同温度(25–60 ℃)处理30 min之后,进行测定,测定条件:pH 11.0,30 ℃。以未经过处理的酶的酶活作为100%。
1.6.5 动力学参数的测定分别以2.5、5.0、7.5、10.0、12.5、15.0、20.0 mmol/L的过氧化氢作为底物,pH 11.0、温度30 ℃下测定酶活力。采用双倒数作图法(Lineweaver-Burk法)求该酶的Km值和Vmax值。
1.6.6 金属离子对酶活的影响在体系中添加终浓度为1 mmol/L的Mn2+、Co2+、Na+、Mg2+、K+、Ni2+、Cu2+、Fe2+,25 ℃处理30 min,pH 11.0、30 ℃下测定酶活,以不加金属离子的酶的酶活作为100%。
1.6.7 抑制剂和有机溶剂对酶活的影响将酶与抑制剂SDS、尿素、NaN3、β-巯基乙醇、EDTA混合,按酶液、95%乙醇、氯仿体积比为10︰5︰3混合,25 ℃处理30 min,pH 11.0、30 ℃条件下测定酶活。以未经处理的酶的酶活作为100%。
2 结果与分析 2.1 谷氨酸棒杆菌生长曲线和细胞内活性氧水平的测定结果在酸性胁迫下,细菌常会积累细胞内活性氧,从而影响菌株的生长[4]。因此,胞内活性氧的清除可能是细胞在低酸条件下存活的一个重要策略。基于此,我们探究了过氧化氢酶KatA在菌株应对低酸胁迫时的作用及对胞内活性氧水平的影响。由图 1A、1B所示,在pH 7.0中性条件下,katA基因缺失后对菌株的生长并未造成明显的影响,然而在pH 5.6酸性条件下,katA基因缺失后会明显减弱菌株的生长能力,在培养24 h时ΔkatA缺失菌株的生物量约为野生型菌株86%。图 1C、1D结果显示,与中性条件相比,酸性条件下野生型菌株和ΔkatA缺失菌株的胞内活性氧含量均明显增加。另外,在低酸胁迫条件下,ΔkatA缺失菌株胞内活性氧水平约是野生型菌株胞内活性氧水平的1.9倍,说明KatA能够有效降低菌株胞内活性氧浓度。上述结果表明,过氧化氢酶KatA对于菌株抵御低酸胁迫发挥着重要作用,为了更好地研究其功能,本研究拟对谷氨酸棒杆菌来源的过氧化氢酶进行体外纯化,并对其酶学性质进行测定和表征。

|
| 图 1 谷氨酸棒杆菌生长曲线和细胞内活性氧水平的测定 Fig. 1 Determination of growth curves and intracellular reactive oxygen species of C. glutamicum. (A, B) Growth curves of C. glutamicum WT and ΔkatA under pH 7.0 and pH 5.6 conditions. (C, D) Determination of intracellular reactive oxygen species of C. glutamicum WT and ΔkatA under pH 7.0 and pH 5.6 conditions. |
| |
重组菌株E. coli BL21(DE3) (pET21b-katA-C)经过IPTG诱导表达,离心收菌,超声破碎,离心取上清得到粗酶液,并对粗酶液进行SDS-PAGE检测,以含有空质粒的菌株E. coli BL21(DE3) (pET21b)作为对照,检测结果如图 2A所示。与含有空质粒的菌株相比,重组菌株在大约58 kDa处有一条明显较粗的条带,与经过预测的蛋白分子量58.71 kDa基本一致,表明过氧化氢酶成功表达。
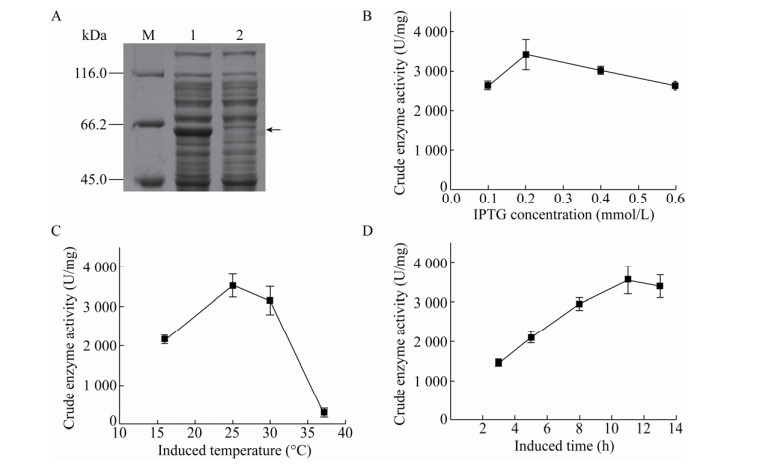
|
| 图 2 重组过氧化氢酶在大肠杆菌中的表达条件优化 Fig. 2 Optimization of expression conditions of recombinant catalase in E. coli. (A) SDS-PAGE analysis of recombinant catalase in E. coli BL21(DE3). M: protein marker; 1: cell supernatant of E. coli BL21(DE3) (pET21b-katA-C); 2: cell supernatant of E. coli BL21(DE3) (pET21b). (B) Effect of IPTG concentration on KatA expression. (C) Effect of induction temperature on KatA expression. (D) Effect of induction time on KatA expression. |
| |
首先,探究诱导剂IPTG浓度对于表达的影响。在0.1–0.6 mmol/L的IPTG浓度范围内进行诱导,结果如图 2B所示,0.2 mmol/L时过氧化氢酶活性最高,表明最适IPTG浓度为0.2 mmol/L。诱导温度也会对过氧化氢酶的表达产生影响,结果如图 2C所示,16 ℃和37 ℃时的酶活都偏低,可能是因为低温条件下大肠杆菌细胞生长缓慢,使目的蛋白的表达量偏低,而温度较高时也不利于重组蛋白的表达,最终确定最适诱导温度为25 ℃。研究诱导时间对酶表达的影响,结果如图 2D所示,当诱导时间从3 h增加到11 h,过氧化氢酶的酶活逐渐升高,而继续诱导酶活开始下降,表明最适诱导时间为11 h。以上结果表明,E. coli BL21(DE3) (pET21b-katA-C)的最适表达条件为:IPTG浓度0.2 mmol/L,诱导温度25 ℃,诱导时间11 h。
2.3 过氧化氢酶的纯化采用镍柱亲和层析的方法对加入His标签的过氧化氢酶进行纯化,并对粗酶液和纯化之后的酶进行SDS-PAGE检测,检测结果如图 3所示,纯化之后的过氧化氢酶蛋白条带较为单一,蛋白大小约为58 kDa,与经过预测的蛋白分子量58.71 kDa基本一致,所以目的蛋白成功纯化,可继续进行酶学性质的研究。
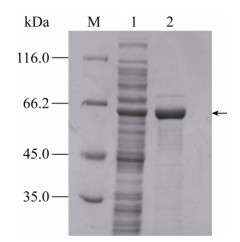
|
| 图 3 重组KatA镍柱纯化的SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of the purified enzyme. M: protein marker; 1: crude enzyme solution; 2: purified enzyme. |
| |
考察最适反应pH对催化反应极为重要,于pH 3.0–12.0的范围内测定酶的活性,如图 4A所示,该酶在pH 4.0–11.5均表现出活性,在pH 11.0时酶活达到最大。将酶放在不同pH的溶液里,室温处理3 h之后,测定酶的pH稳定性,结果如图 4B所示,在pH 4.0–11.5的范围内,剩余酶活都在75%以上,其中在pH 8.0–11.5之间剩余酶活在90%以上,由此可看出,该酶是碱性过氧化氢酶,具有较为宽广的pH稳定范围,并且在高碱条件下有良好的稳定性,因此从这一特征来看,该酶具有在纺织、造纸等工业中的应用潜力。

|
| 图 4 pH对KatA活性和稳定性的影响 Fig. 4 Effect of pH on KatA activity and stability. (A) Effect of pH on the activity of KatA. (B) Effect of pH on the stability of KatA. |
| |
在20–70 ℃范围内,测定过氧化氢酶的最适温度,如图 5A所示,酶的最适温度是30 ℃。将酶置于pH 11.0的溶液中,于不同温度处理30 min之后,测定过氧化氢酶的剩余酶活,结果如图 5B所示,25–35 ℃剩余酶活在80%以上,在40 ℃剩余酶活68.36%,在50 ℃酶活依然保留41.85%,所以,该酶在25–50 ℃热稳定性较好,已初步具备工业化应用的特征。
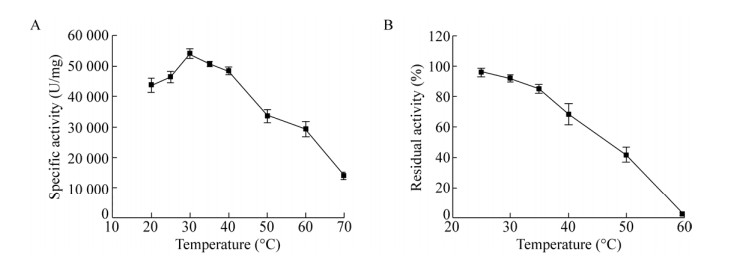
|
| 图 5 温度对KatA活性和稳定性的影响 Fig. 5 Effect of temperature on KatA activity and stability. (A) Effect of temperature on the activity of KatA. (B) Effect of temperature on the stability of KatA. |
| |
在pH 11.0、30 ℃的条件下,测定不同底物浓度时的酶活,采用双倒数作图法(Lineweaver- Burk法)求得该酶的Km值为25.89 mmol/L,Vmax为185.18 mmol/(min·mg),结果如图 6所示。
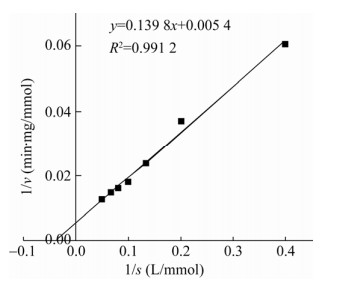
|
| 图 6 双倒数作图法测定KatA酶反应动力学参数 Fig. 6 Analysis of enzyme kinetics of KatA by Lineweaver-Burk plotting. |
| |
测定不同金属离子对酶活力的影响,结果如图 7所示,1 mmol/L的K+对该酶的活性有促进作用,酶活提高10%。Mg2+和Cu2+影响不大,剩余酶活分别是99%和92%,Mn2+、Na+、Ni2+对酶活都有部分抑制作用,Co2+和Fe2+的抑制作用最强,酶活分别下降了44%和42%。以上结果表明,不同金属离子对过氧化氢酶的活性具有不同的作用。
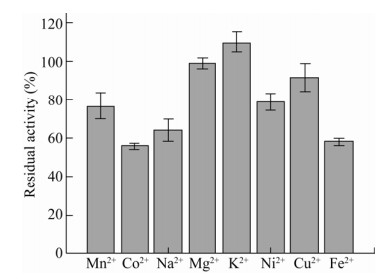
|
| 图 7 金属离子对KatA酶活的影响 Fig. 7 Effect of metal ions on the activity of KatA. |
| |
如表 1所示,在25 ℃处理30 min之后,SDS抑制作用最小,酶活下降了14.69%,尿素、NaN3和β-巯基乙醇处理后酶活分别下降了36.06%、32.13%和48.47%,EDTA抑制作用最强,酶活下降了61.37%。在酶液中添加一定比例的乙醇和氯仿对酶活基本没有影响。
| Inhibitors and organic solvents | Concentration (mmol/L) | Residual activity (%) |
| SDS | 5.0 | 85.31±8.06 |
| Urea | 10.0 | 63.94±2.57 |
| NaN3 | 0.1 | 67.87±4.46 |
| β-Mercaptoethanol | 1.0 | 51.53±3.20 |
| EDTA | 1.0 | 38.63±3.77 |
| Enzyme solution+ ethanol+chloroform | 10:5:3 | 103.70±3.50 |
过氧化氢酶广泛应用于临床分析、食品消毒、纺织、造纸等工业[15]。然而纺织和造纸工业的特殊的高碱性环境,要求过氧化氢酶具备优良的耐碱性能,所以越来越多的研究开始聚焦于碱性过氧化氢酶的开发。在这项工作中,我们第一次报道来源于谷氨酸棒杆菌的过氧化氢酶,将其在大肠杆菌中进行表达优化,并通过镍柱亲和层析得到纯酶,然后测定和表征纯酶的酶学性质。如表 2所示,本研究得到的过氧化氢酶最适pH 11.0,而且在pH 11.0、室温处理3 h,剩余酶活为93%,说明本文得到的是一种碱性过氧化氢酶。来自Acinetobacter属的YS0810CAT最适pH为11.0,在pH 11.0、4 ℃处理3 h,剩余78%的活性[6]。来自B. subtilis 168的过氧化氢酶的最适pH为12.0,在pH 11.0处理1 h,残余活性70%以上,在pH 12.0处理1 h,残余活性30%以上[7]。来自Bacillus sp. F26的过氧化氢酶最适pH为11.0,在pH 11.0、15–30 ℃处理60 min剩余活性100%[11]。与以上碱性过氧化氢酶相比,本研究得到的过氧化氢酶在高碱条件下的耐受性依然有很大的优势。纯酶比活性为55 266 U/mg,高于许多其他过氧化氢酶。所以该酶良好的碱耐受性以及较高的催化效率使其具备工业化应用的潜力。
| Source | Optimal pH | pH stability (residual activity, pH 11) | Optimal temperature (℃) | Km (mmol/L) | Specific activity (µmol/(min·mg)) | References |
| B. subtilis WB600 | 6.0 | nr | nr | 52.50 | 34 600 | [5] |
| Acinetobacter sp. YS0810 | 11.0 | 4 ℃, 3 h 78% | 60 | nr | 37 318 | [6] |
| Geobacillus sp. CHB1 | 6.0–7.0 | nr | 60–70 | 51.10 | 40 526 | [2] |
| R. sphaeroides | 6.0–10.0 | nr | 54 | 40.00 | 55 930 | [20] |
| B. subtilis 168 | 12.0 | 1 h > 70% | 37–42 | nr | 37 081 | [7] |
| B. subtilis UM1001 | 4.0–12.0 | nr | nr | 78.00 | 51 200 | [21] |
| Bacillus sp. F26 | 11.0 | 15–30 ℃, 60 min 100% | 20–40 | 32.50 | 14 244 | [11] |
| U. thermosphaericus FZSF03 | 7.0 | 60 min 70% | 60 | 101.10 | 219 360 | [22] |
| C. glutamicum ATCC 13032 | 11.0 | 25 ℃, 3 h 93% | 30 | 25.89 | 55 266 | This study |
| nr means not reported. | ||||||
该酶的最适温度是30 ℃,与大豆CAT的最适温度[16]一致,在25–50 ℃有较好的热稳定性,初步具备工业化应用的特征。该酶Km值为25.89 mmol/L,Vmax为185.18 mmol/(min·mg),与热带假丝酵母Candida tropicalis的过氧化氢酶的Km值19.20 mmol/L[17]和深红红螺菌Rhodospirillum rubrum的过氧化氢酶的Km值21.80 mmol/L[18]相近,低于许多其他来源如黄褐微球菌Micrococcus luteus[19]、枯草芽孢杆菌B. subtilis WB600[5]、地芽孢杆菌属Geobacillus sp. CHB1[2]、球形红细菌Rhodobacter sphaeroides[20]、枯草芽孢杆菌B. subtilis UM1001[21]、芽孢杆菌属Bacillus sp. F26[11]、嗜热链球菌Ureibacillus thermosphaericus FZSF03[22]的过氧化氢酶的Km值,说明本研究的过氧化氢酶有相对较低的Km值,与底物H2O2有较高的亲和力。1 mmol/L的K+对该酶有促进作用,Mg2+和Cu2+对活性影响不大,剩余酶活分别是99%和92%。
本研究将来源于谷氨酸棒杆菌的过氧化氢酶进行了异源表达、纯化并对其酶学性质进行测定。研究结果表明本文得到的过氧化氢酶具有较高的催化效率,良好的碱耐受性,在工业生产中有较好的应用前景。但是本研究报道的过氧化氢酶的热稳定性仍有待进一步提高,会对其在工业上的规模化应用产生限制,今后的研究可以通过定向进化和理性设计等分子改造手段进一步提高过氧化氢酶的催化效率和稳定性,综合提升酶的应用性能。
| [1] |
Luo H, Zhou Y, Chang YH, et al. Rapid gene cloning, overexpression and characterization of a thermophilic catalase in E. coli. Adv Mater Res, 2011, 365: 367-374. DOI:10.4028/www.scientific.net/AMR.365.367 |
| [2] |
Jia XB, Chen JC, Lin CQ, et al. Cloning, expression, and characterization of a novel thermophilic monofunctional catalase from Geobacillus sp. CHB1. Biomed Res Int, 2016, 2016: 7535604. |
| [3] |
Kimoto H, Yoshimune K, Matsuyma H, et al. Characterization of catalase from psychrotolerant Psychrobacter piscatorii T-3 exhibiting high catalase activity. Int J Mol Sci, 2012, 13(2): 1733-1746. DOI:10.3390/ijms13021733 |
| [4] |
Xu N, Lv HF, Wei L, et al. Impaired oxidative stress and sulfur assimilation contribute to acid tolerance of Corynebacterium glutamicum. Appl Microbiol Biotechnol, 2019, 103(4): 1877-1891. DOI:10.1007/s00253-018-09585-y |
| [5] |
Shi XL, Feng MQ, Zhao YJ, et al. Overexpression, purification and characterization of a recombinant secretary catalase from Bacillus subtilis. Biotechnol Lett, 2008, 30(1): 181-186. |
| [6] |
Fu XH, Wang W, Hao JH, et al. Purification and characterization of catalase from marine bacterium Acinetobacter sp. YS0810. Biomed Res Int, 2014, 2014: 409626. |
| [7] |
Yu ZX, Zheng HC, Zhao XY, et al. High level extracellular production of a recombinant alkaline catalase in E. coli BL21 under ethanol stress and its application in hydrogen peroxide removal after cotton fabrics bleaching. Bioresour Technol, 2016, 214: 303-310. DOI:10.1016/j.biortech.2016.04.110 |
| [8] |
Nakayama M, Nakajima-Kambe T, Katayama H, et al. High catalase production by Rhizobium radiobacter strain 2-1. J Biosci Bioeng, 2008, 106(6): 554-558. DOI:10.1263/jbb.106.554 |
| [9] |
Cao WL, Guo YQ, Kang Z, et al. Optimization and industrial production of catalase in Bacillus subtilis. J Food Sci Biotechnol, 2015, 34(5): 482-486 (in Chinese). 曹汶龙, 郭娅琼, 康振, 等. 枯草芽孢杆菌产过氧化氢酶的优化与工业化. 食品与生物技术学报, 2015, 34(5): 482-486. DOI:10.3969/j.issn.1673-1689.2015.05.006 |
| [10] |
Zhang DX, Du GC, Chen J. Fermentation production of microbial catalase and its application in textile industry. Chin J Biotech, 2010, 26(11): 1473-1481 (in Chinese). 张东旭, 堵国成, 陈坚. 微生物过氧化氢酶的发酵生产及其在纺织工业的应用. 生物工程学报, 2010, 26(11): 1473-1481. |
| [11] |
Zhang XQ, Xue YF, Zhao AM, et al. Purification and characterization of a monofunctional catalase from an alkaliphilic Bacillus sp. F26. Chin J Biotech, 2005, 21(1): 71-77 (in Chinese). 张心齐, 薛燕芬, 赵爱民, 等. 嗜碱芽孢杆菌Bacillus sp. F26过氧化氢酶的分离纯化及性质研究. 生物工程学报, 2005, 21(1): 71-77. DOI:10.3321/j.issn:1000-3061.2005.01.013 |
| [12] |
Yu XL, Jin HY, Liu WJ, et al. Engineering Corynebacterium glutamicum to produce 5-aminolevulinic acid from glucose. Microb Cell Factor, 2015, 14: 183. DOI:10.1186/s12934-015-0364-8 |
| [13] |
Takeshita R, Ito H, Wachi M. A role of the cspA gene encoding a mycolyltransferase in the growth under alkaline conditions of Corynebacterium glutamicum. Biosci Biotechnol Biochem, 2010, 74(8): 1617-1623. DOI:10.1271/bbb.100214 |
| [14] |
Yao HY, Hua ZZ, Du GC, et al. Purification and characterization of catalase from Bacillus subtilis WSHDZ-01. Chin J Appl Environ Biol, 2008, 14(6): 820-824 (in Chinese). 姚海勇, 华兆哲, 堵国成, 等. 枯草芽孢杆菌(Bacillus subtilis)过氧化氢酶的分离纯化及性质. 应用与环境生物学报, 2008, 14(6): 820-824. |
| [15] |
Zhang XQ, Zheng HL, Shu C, et al. Production of Micrococcus luteus catalase under optimized fermentation conditions of engineered E. coli strain. Food Drug, 2012, 14(5): 153-158 (in Chinese). 张兴群, 郑慧琳, 疏翠, 等. 表达藤黄微球菌过氧化氢酶基因的工程大肠杆菌发酵条件优化. 食品与药品, 2012, 14(5): 153-158. DOI:10.3969/j.issn.1672-979X.2012.05.001 |
| [16] |
Fang L, Sun CY, Tang YM. Isolation, purification and partial characterization of catalase from soybean (Glycine max). Food Sci, 2015, 36(1): 140-145 (in Chinese). 方玲, 孙才云, 唐云明. 大豆过氧化氢酶的分离纯化及性质研究. 食品科学, 2015, 36(1): 140-145. |
| [17] |
Yamada T, Tanaka A, Fukui S. Properties of catalase purified from whole cells and peroxisomes of n-alkane-grown Candida tropicalis. Eur J Biochem, 1982, 125(3): 517-521. DOI:10.1111/j.1432-1033.1982.tb06712.x |
| [18] |
Lee DH, Oh DC, Oh YS, et al. Cloning and characterization of monofunctional catalase from photosynthetic bacterium Rhodospirillum rubrum S1. J Microbiol Biotechnol, 2007, 17(9): 1460-1468. |
| [19] |
Switala J, Loewen PC. Diversity of properties among catalases. Arch Biochem Biophys, 2002, 401(2): 145-154. DOI:10.1016/S0003-9861(02)00049-8 |
| [20] |
Terzenbach DP, Blaut M. Purification and characterization of a catalase from the nonsulfur phototrophic bacterium Rhodobacter sphaeroides ATH 2.4.1 and its role in the oxidative stress response. Arch Microbiol, 1998, 169(6): 503-508. DOI:10.1007/s002030050603 |
| [21] |
Loewen PC, Swtala J. Purification and characterization of spore-specific catalase-2 from Bacillus subtilis. Biochem Cell Biol, 1988, 66(7): 707-714. DOI:10.1139/o88-081 |
| [22] |
Jia XB, Lin XJ, Tian YD, et al. High production, purification, biochemical characterization and gene analysis of a novel catalase from the thermophilic bacterium Ureibacillus thermosphaericus FZSF03. Int J Biol Macromol, 2017, 103: 89-98. DOI:10.1016/j.ijbiomac.2017.05.034 |
 2020, Vol. 36
2020, Vol. 36




