中国科学院微生物研究所、中国微生物学会主办
文章信息
- 李晓玉, 夏媛媛, 沈微, 杨海泉, 曹钰, 陈献忠
- Li Xiaoyu, Xia Yuanyuan, Shen Wei, Yang Haiquan, Cao Yu, Chen Xianzhong
- 肠膜明串珠菌蔗糖磷酸化酶的酶学表征及在催化合成α-熊果苷中的应用
- Characterization of a sucrose phosphorylase from Leuconostoc mesenterides for the synthesis of α-arbutin
- 生物工程学报, 2020, 36(8): 1546-1555
- Chinese Journal of Biotechnology, 2020, 36(8): 1546-1555
- 10.13345/j.cjb.190498
-
文章历史
- Received: November 8, 2019
- Accepted: January 19, 2020
2. 教育部工业生物技术重点实验室,江苏 无锡 214122
2. Key Laboratory of Industrial Biotechnology, Ministry of Education, Wuxi 214122, Jiangsu, China
蔗糖磷酸化酶(EC2.4.1.7,Sucrose phosphorylase,SPase)属于糖基水解酶13家族,催化蔗糖与磷酸进行反应,使蔗糖转化为D-果糖和α-D-葡萄糖-1-磷酸(α-D-Glc-1-P)[1-2]。该酶是一种催化转移葡萄糖苷键的特异性酶,能催化转移葡萄糖基至不同受体,包括磷酸、水、含酚羟基、醇羟基及羧基的物质[3]。目前,蔗糖磷酸化酶主要应用在以下几个方面[3-8]:1)护肤品类。将氢醌、曲酸、甘油等进行糖基化修饰后获得护肤效果好且性质稳定的化妆品添加剂,另外,氢醌具有一定的毒性,长期大量使用会对皮肤产生副作用,葡萄糖基修饰后能在一定程度减少原本物质的毒副作用。2)功能性低聚糖类。以木糖、鼠李糖、半乳糖等为受体,催化合成多一个葡萄糖基的功能性低聚糖。3)提高某些物质的稳定性。在抗坏血酸、咖啡酸上加一个葡萄糖基后进行糖基化修饰,能显著提高抗坏血酸和咖啡酸的稳定性,使其发挥更好的作用。
根据文献报道该酶主要存在于肠膜明串珠菌Leuconostoc mesenteroides[9]、青春双歧杆菌Bifidobacterium adolescentis[10]、长双歧杆菌Bifidobacterium longum[11]、变异链球菌Streptococcus mutans[12]等微生物中。
熊果苷(Arbutin)是氢醌的天然糖苷,尤其是在葡萄糖和氢醌(对苯二酚)之间具有糖苷键的β-端基形式的葡萄糖苷[13]。α-熊果苷通常由酶法合成(糖转移反应),少数是由微生物发酵生产的[14],其美白效果要比β-熊果苷好[15]。由于其对酪氨酸酶强大的抑制作用已被广泛用作化妆品的原料,用来减少黑色素从而美白皮肤。
本研究将来源于肠膜明串珠菌L. mesenteroides ATCC 12291的蔗糖磷酸化酶sucrose phosphorylase基因进行密码子优化后在大肠杆菌BL21 (DE3)中异源表达制备蔗糖磷酸化酶,将其分离纯化研究后进行酶学性质研究,并将其应用在催化合成α-熊果苷中。
1 材料与方法 1.1 材料 1.1.1 菌株及质粒E. coli BL21 (DE3)为异源表达宿主,质粒pET-28a用于构建重组载体,均来自于本实验室。
1.1.2 主要试剂果糖、蔗糖、苯酚、3, 5-二硝基水杨酸(DNS)、酒石酸钾钠、咪唑等均购自国药集团化学试剂有限公司;α-熊果苷购自上海源叶生物科技有限公司;异丙基-β-D-硫代半乳糖苷(IPTG)、氢醌、吗啉乙磺酸购自上海麦克林生化科技有限公司;硫酸卡那霉素购自生工生物工程(上海)股份有限公司。
限制性内切酶NcoⅠ、XhoⅠ均为赛默飞世尔科技公司产品;糖化酶为江苏锐阳生物科技有限公司产品。
1.1.3 主要培养基的配制LB培养基:5 g/L酵母粉,10 g/L蛋白胨,10 g/L NaCl,固体培养基另加1.5%-2.0%琼脂粉。培养基灭菌温度为121 ℃,时间为15 min。
TB培养基:24 g/L酵母粉,12 g/L蛋白胨,4 mL/L甘油,2.31 g/L KH2PO4,16.43 g/L K2HPO4·3H2O。培养基灭菌温度为121 ℃,时间为15 min。
1.2 方法 1.2.1 肠膜明串珠菌蔗糖磷酸化酶编码基因的克隆及表达载体的构建基因的获取:将来源于肠膜明串珠菌L. mesenteroides ATCC 12291的蔗糖磷酸化酶基因(GenBank登录号:D90314)根据密码子偏好性进行优化,获得目的基因,并将两个酶切位点NcoⅠ、XhoⅠ加到经过优化后的蔗糖磷酸化酶基因两端,送到金唯智生物科技有限公司合成得到spase。
基因表达载体的构建:将合成的spase和pET-28a载体用限制性内切酶NcoⅠ和XhoⅠ双酶切,酶切后产物用SolutionⅠ连接,然后将重组载体pET-28a-spase转入大肠杆菌E. coli BL21(DE3)中表达,提取质粒送至金唯智生物科技有限公司测序。
1.2.2 重组蔗糖磷酸化酶的表达将重组菌株在卡那霉素浓度为100 μg/mL的LB固体培养基上划线,挑取单菌落接种于含卡那霉素浓度为50 μg/mL的LB液体培养基中,于37 ℃、200 r/min过夜培养后,按1%接种量接入到含卡那霉素浓度为50 μg/mL的TB液体培养基中,于37 ℃、200 r/min培养至菌密度OD600达到0.6后,加入终浓度为0.5 mmol/L的IPTG诱导剂于25 ℃、200 r/min诱导24 h后收集菌液。
将菌液于4 ℃、7 000 r/min的低温冷冻离心机中离心15 min,收集菌体。制备粗酶液,菌体用50 mmol/L K2HPO4/KH2PO4缓冲液(pH 6.5)洗2次后收集菌体。将收集好的湿菌体加入20 mL磷酸盐缓冲液制成菌悬液,然后用超声波破碎菌体。超声波破碎仪工作时间2 s,间歇时间4 s,总时间60 min。将破碎后的液体于4 ℃、10 000 r/min的低温冷冻离心机下离心30 min收集上清即为蔗糖磷酸化酶粗酶液。
1.2.3 重组蔗糖磷酸化酶的纯化及酶活测定首先用His trap excel柱进行亲和层析,结合缓冲液(20 mmol/L Na2HPO4-NaH2PO4,0.5 mol/L NaCl,pH 7.0,)以l mL/min的流速平衡纯化柱,随后将含有重组蔗糖磷酸化酶粗酶液以0.5 mL/min流速上样,并用结合缓冲液洗脱未结合蛋白。然后用洗脱缓冲液(20 mmol/L Na2HPO4- NaH2PO4,0.5 mol/L NaCl,pH 7.0,500 mmol/L咪唑)洗脱并收集含有重组蔗糖磷酸化酶的组分。
再用Hitrap Desalting柱去咪唑,平衡缓冲液(50 mmol/L K2HPO4/KH2PO4,pH 6.5)以5 mL/min的流速平衡纯化柱,随后将镍柱收集到的蔗糖磷酸化酶样品以相同流速上样,并用平衡缓冲液洗脱,收集含有重组蔗糖磷酸化酶的组分,并用SDS-PAGE验证。
酶活测定方法参照文献[16],根据反应:蔗糖和磷酸盐在SPase的催化下生成葡萄糖-1-磷酸和果糖。反应体系如下:5%蔗糖溶液500 μL,重组蔗糖磷酸化酶50 μL,50 mmol/L磷酸盐缓冲液(pH 6.5) 450 μL,30 ℃准确反应10 min后,立即加入1.5 mL DNS沸水浴15 min,540 nm下测定吸光值,计算反应液中生成果糖的含量(以空载为对照组,其他条件不变)。
将每分钟水解蔗糖生成1 µmol的果糖所需酶量定义为蔗糖磷酸化酶的一个酶活力单位(U)。
Brandford法[17]测定所制备酶液中蛋白质的含量。
比活力为每毫克蛋白所具有的酶活力。
1.2.4 重组蔗糖磷酸化酶的酶学性质研究重组SPase最适温度的测定:将重组SPase纯酶液置于50 mmol/L磷酸盐缓冲液(pH 6.5)中,在不同的温度(20-65 ℃)下测定酶活,以酶活力最高者为100%对照。
重组SPase最适pH的测定:在最适温度条件下,将重组SPase纯酶液在不同pH (5.0-8.5)的磷酸氢二钠-磷酸二氢钾缓冲液中测定酶活,以酶活力最高者为100%对照。
重组SPase温度稳定性及最适温度耐受性测定:将重组SPase纯酶液置于50 mmol/L磷酸盐缓冲液(pH 6.5)中,在不同的温度(25-50 ℃)下保温1 h,然后测定其相对残余酶活。以未处理酶液的酶活为100%对照。
在最适pH的条件下,将纯酶放置在最适温度45 ℃金属浴保温,每隔1 h测定残余酶活,以未处理酶液的酶活为100%对照。
重组SPase pH稳定性测定:重组SPase纯酶液在30 ℃条件下,在不同pH (5.0-8.0)的磷酸氢二钠-磷酸二氢钾缓冲液中保温1 h,然后测定其相对残余酶活。以未处理酶液的酶活为100%对照。
重组SPase金属离子稳定性测定:将酶液与不同金属离子溶液(K+、Mg2+、Na+、Ca2+、Co2+、Fe3+、Cu2+、Zn2+、Ni+、Mn2+)于酶最适温度孵育20 min,加入5%的蔗糖溶液进行水解反应,准确计时10 min,用DNS法测定果糖含量,计算残余酶活,以未加入金属离子测定的酶活为对照,计算金属离子孵育后的相对残余酶活。
酶动力学参数测定:在最适温度和最适pH的条件下,保持反应体系中磷酸盐缓冲液的浓度一致,分别以不同底物浓度的蔗糖(50-1 000 mmol/L),酶液浓度为0.060 75 mg/mL,准确反应5 min,加入DNS沸水浴15 min,测定生成果糖的量,根据米氏方程作图,计算出Km、Vmax和kcat。
1.2.5 重组蔗糖磷酸化酶在催化合成α-熊果苷的应用高效液相色谱(HPLC)检测条件:Agilent 1260 HPLC色谱仪;Diamonsil C18(4.6 mm×250 mm)柱;流动相:水:甲醇:乙酸=95:5:1;流速:0.5 mL/min;柱温30 ℃;检测波长282 nm。
温度对催化合成α-熊果苷反应的影响:将5 g蔗糖,0.4 g氢醌,200 U/mL蔗糖磷酸化酶在10 mL的25 mmol/L MES缓冲液中,分别在25 ℃、30 ℃、37 ℃、40 ℃避光反应24 h,沸水浴5 min终止反应,再用500 U/mL糖化酶处理2.5 h (以除去氢醌麦芽低聚糖[18],提高氢醌的转化率),沸水浴5 min终止反应,离心后用HPLC分析产物。
pH对催化合成α-熊果苷反应的影响:将5 g蔗糖、0.4 g氢醌、200 U/mL蔗糖磷酸化酶在25 mmol/L的不同pH的MES缓冲液(6.0-8.0)中,反应总体积为10 mL,30 ℃避光反应24 h,沸水浴5 min终止反应,糖化酶处理2.5 h,沸水浴5 min终止反应,离心后用HPLC分析产物。
氢醌浓度对催化合成α-熊果苷反应的影响:将5 g蔗糖,分别与不同浓度氢醌(10-50 g/L)、200 U/mL蔗糖磷酸化酶在10 mL的25 mmol/L MES缓冲液(pH 7.0)中,30 ℃避光反应24 h,沸水浴5 min终止反应,糖化酶处理2.5 h,沸水浴5 min终止反应,离心后用HPLC分析产物。
供受体比例对催化合成α-熊果苷反应的影响:将氢醌(40 g/L)分别与不同浓度蔗糖(蔗糖/氢醌的摩尔比为1:1、2:1、3:1、4:1、5:1、6:1、7:1),200 U/mL蔗糖磷酸化酶在10 mL的25 mmol/L MES缓冲液(pH 7.0)中,30 ℃避光反应24 h,沸水浴5 min终止反应,糖化酶处理2.5 h,沸水浴5 min终止反应,离心后用HPLC分析产物。
加酶量对催化合成α-熊果苷反应的影响:将氢醌(40 g/L)与蔗糖(蔗糖/氢醌的摩尔比为5:1),(100-350 U/mL)蔗糖磷酸化酶在10 mL的25 mmol/L MES缓冲液(pH 7.0)中,30 ℃避光反应24 h,沸水浴5 min终止反应,糖化酶处理2.5 h,沸水浴5 min终止反应,离心后用HPLC分析产物。
反应时间对催化合成α-熊果苷的影响:将氢醌(40 g/L)与蔗糖(蔗糖/氢醌的摩尔比为5:1),250 U/mL蔗糖磷酸化酶在10 mL的25 mmol/L MES缓冲液(pH 7.0)中,30 ℃避光反应,每隔4 h取样,沸水浴5 min终止反应,糖化酶处理2.5 h,沸水浴5 min终止反应,离心后用HPLC分析产物。
2 结果与分析 2.1 重组蔗糖磷酸化酶的表达将合成的spase基因与pET-28a载体酶切连接后构建得到重组质粒pET-28a-spase,转化至大肠杆菌BL21 (DE3),测序结果正确,表明获得正确的重组菌,用于后续重组蔗糖磷酸化酶的表达。
将含重组质粒pET-28a-spase的重组菌和含空载pET-28a质粒的对照菌分别按1.2.2的方法表达制备粗酶液,将粗酶液分别进行SDS-PAGE分析,理论分子量为55 kDa。如图 1所示,重组菌发酵细胞破碎上清在55 kDa处有很明显的条带,表明重组蔗糖磷酸化酶成功表达。

|
| 图 1 重组蔗糖磷酸化酶的SDS-PAGE分析 Fig. 1 SDS-PAGE analysis of recombinant sucrose phosphorylase. M: marker; 0: control; 1, 2: crude enzyme; 3: purified SPase. |
| |
在重组质粒pET-28a-spase的SPase末端连接了6个His标签,利用镍柱亲和层析纯化蛋白。如图 1所示,由蛋白的条带可知得到单一的条带,可见得到了蔗糖磷酸化酶的纯酶液。本文中酶活测定方法均按照1.2.3中的方法进行,以蔗糖和磷酸盐为底物。纯化倍数和酶活回收率见表 1。
| Purification steps | Total protein (mg) | Total activity(U) | Specific activity(U/mg) | Purified fold | Recovery rate (%) |
| Rude enzyme | 22.40 | 3 253.70 | 145.25 | 1.00 | 100.00 |
| Ni-Affinity | 13.35 | 2 856.60 | 213.98 | 1.47 | 87.80 |
温度和pH对重组SPase酶活的影响见图 2。重组SPase最适反应温度为45 ℃,最适pH条件为6.5 (图 2A-B)。当温度由20 ℃升至45 ℃,重组SPase的酶活逐渐升高,当温度高于45 ℃,随着温度的升高,酶活呈明显的下降趋势。在最适pH条件下,测定重组SPase的热稳定性,当温度不高于40 ℃时,重组SPase的酶活力都比较稳定,置于相应的温度下1 h仍能保持95%以上的活力,当温度超过40 ℃后,酶活力急剧下降,当温度达到50 ℃后,重组SPase活力几乎丧失(图 2C)。测定最适温度下的耐受性,半衰期为3.9 h (图 2D)。重组SPase在pH 5.0至pH 7.5较稳定,相对残余酶活在60%以上,当pH高于7.5后,酶活力迅速下降(图 2E)。
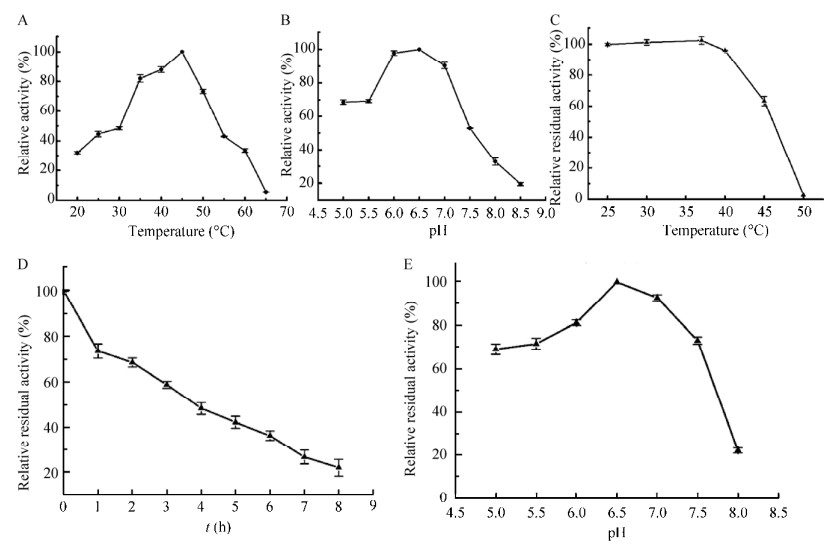
|
| 图 2 温度和pH对重组SPase酶活的影响 Fig. 2 Effect of temperature and pH on recombinant SPase activity. (A) Optimum temperature. (B) Optimum pH. (C) Relative residual activity at different temperature for 1 h. (D) The half-lives (t1/2) at 45 ℃. (E) pH stability. |
| |
不同金属离子溶液(K+、Mg2+、Na+、Ca2+、Co2+、Fe3+、Cu2+、Zn2+、Ni+、Mn2+)对重组SPase的影响结果如表 2。当金属离子浓度为1 mmol/L时,Co2+、Fe3+对重组SPase有激活作用,对Cu2+、Ni+、Mn2+有抑制作用。当金属离子浓度为5 mmol/L时,Co2+、Fe3+对重组SPase不再有激活作用,Cu2+、Zn2+、Ni+、Mn2+对重组SPase有强烈的抑制作用。
| Metal ions (1 mmol/L) | Relative activity (%) | Metal ions (5 mmol/L) | Relative activity (%) |
| Control | 100 | Control | 100 |
| K+ | 100.22±3.16 | K+ | 100.26±7.64 |
| Mg2+ | 99.75±8.46 | Mg2+ | 100.32±2.80 |
| Na+ | 99.72±8.31 | Na+ | 98.73±4.79 |
| Ca2+ | 98.94±8.38 | Ca2+ | 47.40±3.76 |
| Co2+ | 121.52±11.71 | Co2+ | 72.28±1.63 |
| Fe3+ | 131.10±10.19 | Fe3+ | 91.84±6.77 |
| Cu2+ | 46.71±4.52 | Cu2+ | - |
| Zn2+ | 102.83±4.88 | Zn2+ | - |
| Ni+ | 78.20±6.48 | Ni+ | - |
| Mn2+ | 84.89±9.21 | Mn2+ | - |
| “-” indicates undetectable enzyme activity. | |||
由GraphPad Prism软件作图分析可得酶动力学参数(图 3) Vmax为2.167 μmol/(mL·min),Km为128.8 mmol/L,kcat为39 237.86 min-1。
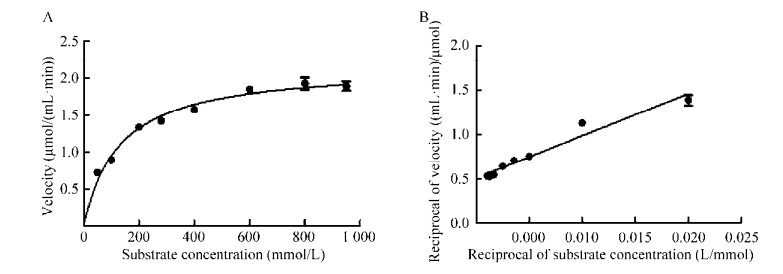
|
| 图 3 重组SPase对蔗糖的转糖基反应动力学 Fig. 3 Kinetics of transglycosylation of sucrose by recombinant SPase. (A) Michaelis-menten equation. (B) Double reciprocal plot. |
| |
利用制备的重组SPase催化合成α-熊果苷,在酶促反应结束后用糖化酶处理2.5 h以除去氢醌麦芽低聚糖,提高氢醌的转化率。利用高效液相色谱检测α-熊果苷和氢醌的含量。
2.4.1 温度对催化合成α-熊果苷反应的影响为了确定重组SPase催化合成α-熊果苷反应的最适温度,研究了不同温度对催化合成α-熊果苷反应的影响(图 4)。在30-35 ℃时,α-熊果苷的产量最大,当温度为45 ℃时,反应液颜色比较深,考虑氢醌被氧化而导致氢醌转化率和α-熊果苷产量低。最终确定催化反应最适温度为30 ℃。

|
| 图 4 温度对催化合成α-熊果苷反应的影响 Fig. 4 Effect of temperature on the catalytic synthesis of α-arbutin. |
| |
为了确定重组SPase催化合成α-熊果苷反应的最适pH,研究了在不同pH缓冲液中重组SPase催化合成α-熊果苷的产量(图 5)。在pH 6.5-7.5的范围内反应,α-熊果苷的产量比较高,pH 7.0为反应的最适pH值。
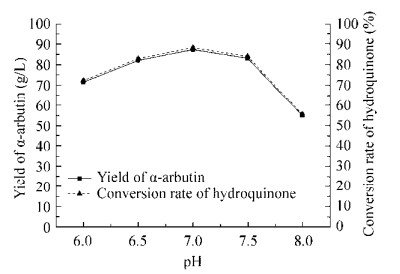
|
| 图 5 pH对催化合成α-熊果苷反应的影响 Fig. 5 Effect of pH on the catalytic synthesis of α-arbutin. |
| |
为了确定重组SPase催化合成α-熊果苷反应的最适氢醌浓度,研究了不同氢醌浓度对催化合成α-熊果苷反应的影响(图 6)。α-熊果苷产量随着氢醌的浓度增加而逐渐增加。当反应体系中氢醌浓度比较低的情况下,氢醌的转化率几乎达到100%,随着氢醌浓度增加,氢醌的转化率有所下降。当氢醌浓度增加到40 g/L时,转化率仍在90%左右,当氢醌浓度再增加,氢醌的转化率下降很快。为了使α-熊果苷产量和氢醌转化率都维持在比较高的水平,因此选择反应体系中氢醌浓度为40 g/L。

|
| 图 6 氢醌浓度对催化合成α-熊果苷反应的影响 Fig. 6 Effect of hydroquinone concentration on the catalytic synthesis of α-arbutin. |
| |
为了确定重组SPase催化合成α-熊果苷反应中比较合适的供受体比例(蔗糖/氢醌),研究了供受体比例对催化合成α-熊果苷反应的影响(图 7)。在供受体比例小于5:1时,随着供受体比例的增加,α-熊果苷的产量也在增加;当供受体比例大于5:1之后,再增加蔗糖的浓度,α-熊果苷的产量会有明显下降,有可能蔗糖浓度比较大后,导致反应液黏度大,不利于反应进行。所以,采用蔗糖/氢醌的比例为5:1。
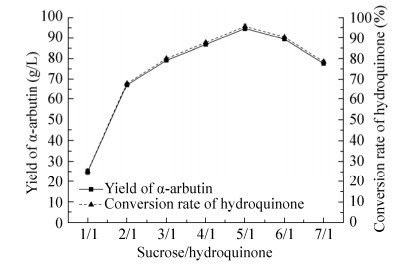
|
| 图 7 供受体比例对催化合成α-熊果苷反应的影响 Fig. 7 Effect of donor ratio on catalytic synthesis of α-arbutin. |
| |
在催化合成反应中,添加适合的酶量对反应是十分重要的,加酶量不足会使反应速度减慢,导致产量不高,加酶量太多又会导致浪费。研究了不同加酶量对α-熊果苷产量的影响,结果如图 8所示。加酶量为250 U/mL时为最优加酶量。

|
| 图 8 加酶量对催化合成α-熊果苷反应的影响 Fig. 8 Effect of enzyme amount on the catalytic synthesis of α-arbutin. |
| |
在上述优化条件确定后,研究反应时间对产量的影响,结果如图 9所示。在前4 h内,α-熊果苷的产量增加很快,之后随着时间的增加,产量增加稍微减缓,到24 h产量达到最大值97.91 g/L,氢醌转化率接近99%,以后基本保持不变。

|
| 图 9 反应时间对催化合成α-熊果苷反应的影响 Fig. 9 Effect of reaction time on the catalytic synthesis of α-arbutin. |
| |
本研究对来源于肠膜明串珠菌的蔗糖磷酸化酶基因进行密码子优化,优化之后的蔗糖磷酸化酶氨基酸序列不变,DNA序列与原始序列相似度为78.07%,在大肠杆菌BL21 (DE3)中异源表达。利用镍柱亲和层析分离纯化,得到了单一的SDS-PAGE条带,比酶活为213.98 U/mg,纯化倍数1.47倍,酶活回收率为87.80%。酶学性质分析表明,该酶的最适温度为45 ℃,最适pH值为6.5,与文献报道一致[18-19]。该酶在小于45 ℃有较好的稳定性,在45 ℃的半衰期为3.9 h,该酶活力高且稳定性较好,有望应用于工业生产。该酶对蔗糖的Km为128.8 mmol/L,Vmax为2.167 μmol/(mL·min),kcat为39 237.86 min-1。利用重组SPase催化合成α-熊果苷,优化后的反应条件为:氢醌40 g/L,蔗糖/氢醌的摩尔比为5:1,重组蔗糖磷酸化酶250 U/mL,在25 mmol/L的MES缓冲液(pH 7.0)中,反应温度30 ℃,避光反应24 h后终止反应,再用500 U/mL的糖化酶40 ℃条件下处理2.5 h。α-熊果苷产量为98 g/L,氢醌的转化率接近99%。总结并归纳了最近几年生产α-熊果苷的方法(表 3)。与已报道的生产α-熊果苷的方法相比较,利用该方法生产α-熊果苷有以下特点:1) α-熊果苷的产量高;2)氢醌利用率高,便于后续纯化;3)蔗糖相对廉价易得,而且本方法供受体比例相对较低;4)酶催化反应相比全细胞发酵法生产α-熊果苷,可以避免氢醌浓度对菌体生长的抑制,也不用中途补加氢醌。本法为α-熊果苷的工业化生产奠定了基础。
| Methods | Donor and acceptor | Concentration of HQ (g/L) | Donor: Acceptor ratio | Conversion rate (%) | Product amount (g/L) | Reference |
| Enzyme (SPase) | Sucrose and HQ | 40.0 | 4:1 | 91.0 | 90.0 | [18] |
| Enzyme (GGTase) | Maltodextrin and HQ | 8.0 | 6:1 | 25.0 | 7.9 | [18] |
| Enzyme (α-Glucosidase) | Maltose and HQ | 5.5 | 30:1 | 4.6a | 0.6 | [20] |
| Enzyme (amylosucrase) | Sucrose and HQ | 2.6 | 10:1 | 90.0a | - | [13] |
| Whole-cell (Xanthomonas BT-112) | Sucrose and HQ | - | 2:1 | 93.7 | 38.2 | [21] |
| Whole-cell (Recombinant E. coli with amylosucrase) | Sucrose and HQ | 3.3 | 40:1b | 95.0 | 83.3 | [22] |
| This study | Sucrose and HQ | 40.0 | 5:1 | 99.0 | 97.9 | |
| a Molar conversion yield. bA batch-feeding catalysis method (supplement HQ to 30 mmol/L, and sucrose to 1.2 mol/L). - : not mentioned in the references. | ||||||
| [1] |
Lee JH, Yoon SH, Nam SH, et al. Molecular cloning of a gene encoding the sucrose phosphorylase from Leuconostoc mesenteroides B-1149 and the expression in Escherichia coli. Enzym Microb Technol, 2006, 39(4): 612-620. DOI:10.1016/j.enzmictec.2005.11.008 |
| [2] |
Goedl, C, Schwarz A, Minain A, et al. Recombinant sucrose phosphorylase from Leuconostoc mesenteroides: characterization, kinetic studies of transglucosylation, and application of immobilised enzyme for production of α-D-glucose 1-phosphate. J Biotechnol, 2007, 129(1): 77-86. DOI:10.1016/j.jbiotec.2006.11.019 |
| [3] |
Goedl C, Sawangwan T, Wildberger P, et al. Sucrose phosphorylase: a powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals. Biocatal Biotransform, 2010, 28(1): 10-21. DOI:10.3109/10242420903411595 |
| [4] |
Kitao S, Serine H. Syntheses of Two Kojic Acid Glucosides with Sucrose Phosphorylase from Leuconostoc mesenteroides. Biosci Biotechnol Biochem, 2014, 58(2): 419-420. |
| [5] |
Goedl C, Sawangwan T, Mueller M, et al. A high-yielding biocatalytic process for the production of 2-O-(α-D-glucopyranosyl)-sn-glycerol, a natural osmolyte and useful moisturizing ingredient. Angew Chem Int Ed Engl, 2008, 47(52): 10086-10089. DOI:10.1002/anie.200803562 |
| [6] |
Zhu XT, Tian YQ, Zhang WL, et al. Recent progress on biological production of α-arbutin. Appl Microbiol Biotechnol, 2018, 102(19): 8145-8152. DOI:10.1007/s00253-018-9241-9 |
| [7] |
Shin MH, Cheong NY, Lee JH, et al. Transglucosylation of caffeic acid by a recombinant sucrose phosphorylase in aqueous buffer and aqueous-supercritical CO2 media. Food Chem, 2009, 115(3): 1028-1033. DOI:10.1016/j.foodchem.2009.01.013 |
| [8] |
Li Y, Li Z, He XY, et al. Characterisation of a Thermobacillus sucrose phosphorylase and its utility in enzymatic synthesis of 2-O-α-D-glucopyranosyl- L-ascorbic acid. J Biotechnol, 2019, 305: 27-34. DOI:10.1016/j.jbiotec.2019.08.018 |
| [9] |
Kitao S, Nakano E. Cloning of the sucrose phosphorylase gene from Leuconostoc mesenteroides and its overexpression using a 'sleeper' bacteriophage vector. J Fermentat Bioeng, 1992, 73(3): 179-184. DOI:10.1016/0922-338X(92)90157-P |
| [10] |
Sprogoe D, van den Broek LAM, Mirza O, et al. Crystal structure of sucrose phosphorylase from Bifidobacterium adolescentis. Biochemistry, 2004, 43(5): 1156-1162. DOI:10.1021/bi0356395 |
| [11] |
Kullin B, Abratt VR, Reid SJ. A functional analysis of the Bifidobacterium longum cscA and scrP genes in sucrose utilization. Appl Microbiol Biotechnol, 2006, 72(5): 975-981. DOI:10.1007/s00253-006-0358-x |
| [12] |
Russell RR, Mukasa H, Shimamure A, et al. Streptococcus mutans gtfA gene specifies sucrose phosphorylase. Infect Immun, 1988, 56(10): 2763-2765. DOI:10.1128/IAI.56.10.2763-2765.1988 |
| [13] |
Seo DH, Jung JH, Ha SJ, et al. High-yield enzymatic bioconversion of hydroquinone to α-arbutin, a powerful skin lightening agent, by amylosucrase. Appl Microbiol Biotechnol, 2012, 94(5): 1189-1197. DOI:10.1007/s00253-012-3905-7 |
| [14] |
Liu CQ, Deng L, Zhang P, et al. Screening of high α-arbutin producing strains and production of α-arbutin by fermentation. World J Microbiol Biotechnol, 2013, 29(8): 1391-1398. DOI:10.1007/s11274-013-1302-8 |
| [15] |
Sugimoto K, Nishimura T, Nomura K, et al. Syntheses of arbutin-α-glycosides and a comparison of their inhibitory effects with those of α-arbutin and arbutin on human tyrosinase. Chem Pharm Bull, 2003, 51(7): 798-801. DOI:10.1248/cpb.51.798 |
| [16] |
Choi HC, Seo DH, Jung JH, et al. Development of new assay for sucrose phosphorylase and its application to the characterization of Bifidobacterium longum SJ32 sucrose phosphorylase. Food Sci Biotechnol, 2011, 20(2): 513-518. DOI:10.1007/s10068-011-0071-0 |
| [17] |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt Biochem, 1976, 72(1/2): 248-254. |
| [18] |
Zhang WL. Enzymatic synthesis of α-arbutin[D]. Wuxi: Jiangnan University, 2017 (in Chinese). 张文蕾.酶法转化合成α-熊果苷的研究[D].无锡: 江南大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10295-1017250360.htm |
| [19] |
He HH, Lin HM, Kou LD, et al. Characterization of recombinant sucrose phosphorylase from Leuconostoc mesenteroides ATCC 12291 and its molecular modification for improved transglucoside activity. Food Sci, 2019, 40(20): 122-129 (in Chinese). 何贺贺, 林厚民, 寇力丹, 等. 肠膜明串珠菌ATCC 12291蔗糖磷酸化酶的酶学性质及转糖苷分子改造. 食品科学, 2019, 40(20): 122-129. DOI:10.7506/spkx1002-6630-20181024-279 |
| [20] |
Prodanović RM, Milosavić NB, Sladić D, et al. Synthesis of hydroquinone-α-glucoside by α-glucosidase from baker's yeast. Biotechnol Lett, 2005, 27(8): 551-554. DOI:10.1007/s10529-005-2880-9 |
| [21] |
Wei M, Ren Y, Liu CX, et al. Fermentation scale up for α-arbutin production by Xanthomonas BT-112. J Biotechnol, 2016, 233: 1-5. DOI:10.1016/j.jbiotec.2016.05.022 |
| [22] |
Zhu LJ, Jiang D, Zhou YY, et al. Batch-feeding whole-cell catalytic synthesis of α-arbutin by amylosucrase from Xanthomonas campestris. J Ind Microbiol Biotechnol, 2019, 46(6): 759-767. DOI:10.1007/s10295-019-02143-z |
 2020, Vol. 36
2020, Vol. 36




