中国科学院微生物研究所、中国微生物学会主办
文章信息
- 包世俊, 张金燕, 贺健, 张阳阳, 邢小勇, 温峰琴, 伏小平, 武小椿
- Bao Shijun, Zhang Jinyan, He Jian, Zhang Yangyang, Xing Xiaoyong, Wen Fengqin, Fu Xiaoping, Wu Xiaochun
- 马麝出血症病毒VP60主要抗原表位区的串联表达及对家兔的免疫保护效力分析
- Tandem expression of the major epitope domains of the Moschus chrysogaster hemorrhagic disease virus VP60 and its protective efficacy to rabbits
- 生物工程学报, 2020, 36(8): 1536-1545
- Chinese Journal of Biotechnology, 2020, 36(8): 1536-1545
- 10.13345/j.cjb.190546
-
文章历史
- Received: December 9, 2019
- Accepted: March 2, 2020
- Published: June 22, 2020
马麝(Moschus chrysogaster/sifanicus,alpine musk deer)亦称香獐,是我国特有的一种麝属动物资源,为国家一级重点保护野生动物,世界自然保护联盟(IUCN) “濒危”级野生动物[1]。其雄麝分泌的麝香被称为世界四大名贵香料之王,亦是我国多种中药名方如片仔癀、安宫牛黄丸、再造丸、大活络丹、云南白药、小儿回春丹等的组方君药,因此极具应用价值[2-5]。马麝主要分布于青藏高原及周边区域,包括青海省、宁夏回族自治区贺兰山、甘肃省祁连山及肃南裕固族自治县山地、四川省西部地区、云南省北部高山地区及西藏自治区东南部,其中甘肃省兴隆山马麝种群密度较大[6]。但由于生境的改变和疾病的暴发,导致马麝数量急剧下降。多年来,兴隆山马麝种群中流行一种高致死的出血性传染病[7-9],但真正的病原始终未能确定,2010年冬季,该病在兴隆山自然保护区人工圈养马麝种群中暴发,导致100多头马麝死亡,经济损失惨重。笔者等通过病原的分离鉴定,确定其为McHDV引起的马麝病毒性出血症(Moschus chrysogaster viral hemorrhagic disease,McVHD)[10]。近年来,该病虽未出现大规模发病,但零散病例却时有发生。基于此,本研究在成功建立马麝病毒性出血症家兔动物模型的基础上,通过McHDV VP60抗原表位的预测,设计特异性引物,采用RT-PCR扩增其主要抗原表位编码序列,并经重叠延伸PCR将不同抗原表位序列拼接,进而在构建原核表达载体及诱导表达的基础上,对重组蛋白的免疫保护效力进行分析,为马麝病毒性出血症新型疫苗的研制奠定基础。
1 材料与方法 1.1 毒株、菌种及实验动物McHDV由甘肃农业大学兽医传染病学实验室分离保存;非免疫健康易感新西兰白兔购自兰州某个体养兔场;BALB/c小鼠购自中国农业科学院兰州兽医研究所;大肠杆菌Trans5α、BL21(DE3)感受态细胞购自北京全式金生物科技有限公司;原核表达载体pET-28a(+)购于Novagen公司。
1.2 主要试剂RNA抽提试剂TRIzol购自Invitrogen公司;M-MLV反转录酶购自Promega;Recombinant Ribonuclease Inhibitor、2×PrimeSTAR®Max DNA聚合酶,核酸内切酶EcoRⅠ、XhoⅠ,T4 DNA连接酶为TaKaRa公司产品;质粒小提试剂盒、DNA回收试剂盒购自北京天根生化科技有限公司;预染蛋白Marker购自Thermo公司;兔病毒性出血症灭活疫苗(兽药生字(2015)150106004)购于山东华宏生物工程有限公司;DNA Marker、DAB显色试剂盒购于北京康为试剂生物科技有限公司;羊抗鼠HRP-IgG购自北京博奥森生物技术有限公司;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒购于碧云天生物技术有限公司;其他常规试剂为国产分析纯产品。
1.3 引物设计应用DNA Star软件预测McHDV (GenBank登录号MN478485) VP60蛋白抗原表位,其优势抗原表位主要集中在第1–100氨基酸之间(即1–300 bp)、第141–340氨基酸之间(即421–1 020 bp)和第441–489氨基酸之间(即1 321–1 467 bp) 3个区域,因此,基于3个区域的核苷酸序列,设计引物对F1/R1、F2/R2和F3/R3 (表 1),用于扩增相应区域的核苷酸序列,F1/R3则用于重叠延伸PCR以获得3个区域的串联序列。引物送由金唯智生物科技有限公司合成。
| Primer name | Primer sequence (5′–3′) | Localization (nt) | Size (bp) |
| F1 | CGGAATTCATGGAGGGCAAAGCCCGCGCAGCG | 1 | 315 |
| R1 | CGATGCCGTTGTTTTGTGGAGAATGTTG | 300 | |
| F2 | AACAACGGCATCGAGATTGGACCAGGG | 421 | 611 |
| R2 | CTGTCCGACATGTCAGGAAAGCCGTC | 1 020 | |
| F3 | TGTCGGACAGAATTGTAACCACACCCG | 1 321 | 163 |
| R3 | CCCTCGAGTTAGGAGCCTGTGCCGTACTGGGTCCC | 1 467 | |
| Underlying sequences: restriction enzyme sites of EcoRⅠand XhoⅠ. | |||
取病死麝肝脏组织匀浆悬液反复冻融3次,12 000 r/min离心15 min后取上清,采用TRIzol法提取总RNA,经反转录合成cDNA (操作参考试剂盒说明书)。应用PCR扩增3个目标序列片段,扩增体系为:cDNA模板2 μL,上下游引物各0.5 μL,2×PrimeSTAR®Max DNA聚合酶10 μL,ddH2O 7 μL。扩增条件:98 ℃ 5 min;98 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min,产物经1%琼脂糖凝胶电泳分离,目的条带回收备用。
重叠延伸PCR体系30 μL:上述PCR扩增的目的DNA片段回收产物各1 μL,2×PrimeSTAR®Max DNA聚合酶15 μL,F1 1 μL,R3 1 μL,ddH2O 10 μL。扩增条件:98 ℃ 5 min;98 ℃ 30 s,59.5 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 10 min,扩增产物分离回收备用。
1.5 McHDV VP60主要抗原表位的原核表达 1.5.1 原核表达载体的构建将重叠延伸PCR回收产物与pET-28a(+)分别用EcoRⅠ和XhoⅠ双酶切,酶切产物回收后16 ℃过夜连接。连接产物转化大肠杆菌Trans5α感受态细胞后涂布于LB平板(卡那霉素70 mg/L),37 ℃培养箱培养12 h,挑取单菌落接入5 mL LB液体培养基(卡那霉素70 mg/L),重组子提取质粒酶切鉴定,阳性质粒送由金唯智生物科技有限公司测序,符合预期的重组质粒命名为pET-truncated-VP60。
1.5.2 McHDV VP60主要抗原表位重组蛋白的表达pET-truncated-VP60转化大肠杆菌BL21(DE3)感受态细胞,涂布LB琼脂平板(卡那霉素70 mg/L)后置于37 ℃培养箱培养,待长出菌落后挑取单菌落接入适量LB液体培养基(卡那霉素70 mg/L)过夜培养后,按1︰100比例将过夜培养物转接入2×YT液体培养基(卡那霉素70 mg/L),37 ℃、210 r/min培养至OD600为0.6左右,加入终浓度为1 mmol/L的IPTG诱导6 h,离心收集菌体,经PBS洗涤后超声破碎,4 ℃、12 000 r/min离心10 min,分别取上清和沉淀,制样后应用SDS-PAGE分析蛋白表达情况。
1.6 重组蛋白的纯化及抗血清制备取200 mL按上述条件诱导的表达菌液离心收集菌体,超声破碎后参照肖敏等[11]所述方法纯化并溶解重组蛋白,进而应用BCA蛋白定量试剂盒定量。取适量纯化的重组蛋白与等体积弗氏完全佐剂混合后,免疫BALB/c小鼠(首免80 μg/只),14 d后应用弗氏不完全佐剂进行二次免疫,之后每隔7 d免疫1次,第4次免疫后6 d采集血液并分离血清,应用间接ELISA方法检测其抗体效价[11]。
1.7 多克隆抗体的Western blotting检测McVHD病死马麝肝脏组织匀浆上清、免疫浓度的兔病毒性出血症灭活疫苗(兽药生字(2015)150106004)和纯化的重组蛋白溶解液各120 μL,分别加入30 μL 5×蛋白质上样缓冲液后参照说明书制样。进而应用SDS-PAGE将蛋白分离后转印至NC膜。转印后的NC膜用5%的脱脂乳4 ℃封闭过夜后置入1︰1 000稀释的重组蛋白抗血清中,37 ℃孵育1 h后,PBST洗涤3次,每次10 min。随后置于1︰8 000稀释的羊抗鼠IgG-HRP,37 ℃孵育1 h,PBST洗涤3次,每次10 min。最后用DAB显色试剂盒显色。
1.8 免疫保护试验 1.8.1 免疫原的制备将纯化的重组蛋白与等量弗氏佐剂乳化使蛋白终浓度为400 μg/mL制备成重组蛋白疫苗;McVHD组织灭活疫苗参照文献[12]但略作调整,即取血凝试验(HA)[13]效价达1︰210以上的McHDV致死兔肝组织匀浆上清加入0.4%甲醛灭活后,与等量弗氏佐剂混匀乳化即为McVHD组织灭活苗。pET-28a空载体标签蛋白纯化后参照重组蛋白疫苗方式制备免疫原。
1.8.2 动物免疫3–4月龄非免疫新西兰大白兔25只,随机分为5组,每组5只。A组为重组蛋白免疫组,参照文献[14],分别在第1天和第14天于颈背部皮下注射免疫,每只每次400 μg (即重组蛋白疫苗1 mL)。B组McVHD为组织灭活疫苗免疫组,分别在第1天和第14天于颈背部皮下注射组织灭活疫苗,每只每次1 mL。C组为空载体标签蛋白免疫组,免疫同重组蛋白免疫组。D组为正常对照组,即未免疫未攻毒对照组。E组为兔病毒性出血症灭活苗免疫组。所有兔在每次免疫前及攻毒前经耳静脉采血并分离血清,并参照林治涌[13]所述血凝抑制试验(HI)方法检测抗体效价。
1.8.3 攻毒试验第2次免疫后7 d,所有实验兔均于颈部皮下注射McHDV致死的马麝肝脏组织匀浆悬液,每只1 mL。记录攻毒后各组实验兔的发病死亡情况,连续观察10 d,病死兔及时剖检观察,10 d后未死亡兔全部捕杀,剖检并进行病毒检测和细菌检查。
1.9 病毒检测取实验病死兔肝脏组织,按1︰10 (W/V)加入PBS后匀浆,反复冻融3次后离心取上清,测定HA效价。
1.10 细菌检查用病死兔和扑杀兔的肝脏、脾脏、肾脏组织触(涂)片,分别应用革兰氏染色和碱性美蓝液染色后,显微镜下检查。无菌取上述脏器组织块加入到LB细菌培养液,37 ℃振荡培养72 h,观察细菌生长情况。
2 结果与分析 2.1 McHDV VP60主要抗原表位的扩增与重组以McHDV基因组RNA为模板,通过反转录获得cDNA,采用PCR分别扩增出3段主要抗原表位基因片段,进而经重叠延伸PCR扩增获得McHDV VP60主要抗原表位的串联片段序列为1 050 bp的核酸片段,与预期相一致(图 1)。
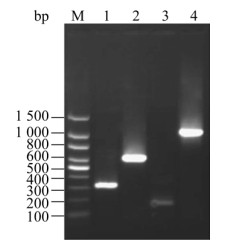
|
| 图 1 McHDV VP60主要抗原表位区RT-PCR和重叠延伸PCR扩增 Fig. 1 RT-PCR and overlap extension PCR amplification of major epitope domain of McHDV VP60. M: DNA marker (100 bp); 1: the major epitope domain 1 of McHDV VP60; 2: the major epitope domain 2 of McHDV VP60; 3: the major epitope domain 2 of McHDV VP60; 4: tandem of major epitope domain from McHDV VP60. |
| |
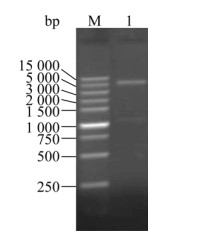
McHDV VP60主要抗原表位串联序列与pET-28a(+)质粒双酶切后连接并转化大肠杆菌Trans5α,挑取单菌落扩增培养后提取质粒应用EcoRⅠ和XhoⅠ双酶切,切出1 050 bp左右条带的质粒送由金唯智测序(图 2),结果符合预期的质粒命名为pET-truncated-VP60。
|
| 图 2 重组表达质粒pET-truncated-VP60的酶切鉴定 Fig. 2 Endonuclease digestion identification of pET-truncated-VP60. M: DNA marker (Super DNA marker); 1: the double digested products of pET-truncated-VP60 by EcoRⅠ and XhoⅠ. |
| |
质粒pET-truncated-VP60转化大肠杆菌BL(DE3)后经IPTG诱导,表达产物应用SDS-PAGE分析。结果显示,重组蛋白相对分子量约为45 kDa,与预期基本一致,且检测表明重组蛋白以包涵体形式存在(图 3)。

|
| 图 3 重组蛋白的SDS-PAGE分析 Fig. 3 SDS-PAGE analysis of the expression protein. M: prestained protein molecular weight marker (Thermo 26617); 1: total cellular proteins of E. coli BL21(DE3) cells transformed by pET-28a(+); 2: total cellular proteins of E. coli BL21(DE3) cells transformed by pET-truncated- VP60; 3: supernatant of lysate of E. coli BL21(DE3) cells transformed by pET-truncated-VP60; 4: sediment of lysate of E. coli BL21(DE3) cells transformed by pET-truncated- VP60; 5: purified recombinant proteins. |
| |
纯化重组蛋白免疫BALB/c小鼠,经4次免疫后采集血液分离血清,用间接ELISA检测抗体效价(免疫前血清按1︰1 000稀释)。结果显示,4次免疫后BALB/c小鼠血清中重组蛋白抗体效价可达1︰51 200以上(表 2),表明重组蛋白具有良好的免疫原性。
| Dilution multiple | 1:1 600 | 1:3 200 | 1:6 400 | 1:12 800 | 1:25 600 | 1:51 200 | 1:102 400 |
| Post-immune serum | 1.294 5 | 1.054 4 | 0.891 0 | 0.661 7 | 0.542 4 | 0.415 2 | 0.305 6 |
| Pre-immune serum | 0.153 (1:1 000) | ||||||
McHDV悬液、RHDV疫苗株和纯化的重组蛋白分别制样并经SDS-PAGE分离后,转膜并进行Western blotting。结果显示,重组蛋白的BALB/c小鼠抗血清能与纯化的重组蛋白、McHDV蛋白和RHDV疫苗株蛋白特异性结合,且条带分别位于45 kDa和57 kDa处(图 4),与预期基本一致,表明应用重组蛋白制备的多克隆抗体具有良好的反应原性。
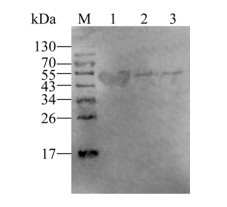
|
| 图 4 多克隆抗体的Western blotting检测 Fig. 4 Western blotting test for the expression protein. M: prestained protein molecular weight marker (Thermo 26617); 1: purified recombinant proteins; 2: total proteins of McHDV; 3: total proteins of RHDV vaccine strain. |
| |
HI检测结果表明,所有试验兔免疫前血清的HI效价均小于log2,经重组蛋白疫苗和组织灭活疫苗免疫的新西兰大白兔血清抗体升高,但重组蛋白免疫组第一次免疫后兔血清HI效价为3log2–4log2,而组织灭活苗第一次免疫后兔血清HI效价即可达5log2–6log2;重组蛋白疫苗第二次免疫后兔血清HI效价可达4log2–5log2,组织灭活苗第二次免疫后兔血清HI效价基本都在7log2以上;标签蛋白免疫组免疫前后HI效价变化不明显。攻毒后,标签蛋白免疫组免于4 d内全部死亡。攻毒后7 d,重组蛋白疫苗组兔血清HI效价为5log2–7log2,组织灭活苗兔血清HI效价为8log2–10log2 (表 3)。
| Groups | Time (d) | |||
| 0a | 7 | 21 | 28 | |
| Recombinant protein immunization | ≤log2 | 3log2–4log2 | 4log2–5log2 | 5log2–7log2 |
| Tissue inactivated vaccine immunization | ≤log2 | 5log2–6log2 | 7log2–9log2 | 8log2–10log2 |
| His protein tag immunization | ≤log2 | ≤log2 | ≤log2 | – |
| The normal control group | ≤log2 | ≤log2 | ≤log2 | |
| RHD inactivated vaccine immunization | ≤log2 | 5log2–7log2 | 8log2–9log2 | 8log2–10log2 |
| a: the serum samples were taken at the beginning of immunization and measured with HI at that of 1:2. | ||||
攻毒后,标签蛋白免疫组兔在40 h开始死亡,72 h全部死亡,死亡率达100%;病兔发病急,病程短,常无症状突然死亡,死前抽搐、痉挛、尖叫,死后呈角弓反张姿势,部分死兔鼻孔有泡沫状血样液体;死亡兔剖检可见全身败血症变化,肺脏有大小不等的出血斑点,切面流出多量红色泡沫状液体;喉头、气管黏膜淤血或弥漫性出血;肝脏肿胀变性,淤血呈紫红色,有出血斑;脾脏淤血肿大,呈暗紫色;肾肿大颜色斑驳,有的有针尖状出血。重组蛋白免疫兔和组织灭活苗免疫兔攻毒后持续观察10 d,所有试验兔均健活,保护率达100%,两组兔捕杀后剖检未见明显病理变化。表明纯化McHDV VP60主要抗原表位序列串联原核表达产物配苗后免疫的新西兰大白兔可有效抵抗McHDV毒株的攻击。这为MSHD新型亚单位疫苗或基因工程疫苗的研制提供了新的候选抗原。
2.6 病毒检测取实验病死兔肝脏组织,按1︰10 (W/V)加入PBS后匀浆,反复冻融3次后离心取上清进行HA试验,测得HA效价达10log2,重组蛋白免疫兔和组织灭活苗免疫兔肝脏组织匀浆上清的HA效价均小于log2 (表 4)。
| Groups | HI titers of sera at challenginga | Surviving rates (%) | HA titers of liver tissuea | Bacterial detection |
| Recombinant protein immunization | 4log2–5log2 | 100 (5/5) | < log2 | –b |
| Tissue inactivated vaccine immunization | 7log2–9log2 | 100 (5/5) | < log2 | – |
| His protein tag immunization | ≤log2 | 0 (0/5) | 10log2 | – |
| The normal control group | ≤log2 | 100 | ≤log2 | – |
| RHD inactivated vaccine immunization | 8log2–9log2 | 100 (5/5) | < log2 | – |
| a: the titers of HA/HI was measured at initial of log2. b: the results were negative. | ||||
用病死兔的肝脏、脾脏、肾脏组织触(涂)片,经革兰氏染色和碱性美蓝液染色后,显微镜下均未观察到细菌。肝、脾、肾等组织块接入LB培养液中,37 ℃振荡培养72 h,无细菌生长(表 4)。
3 讨论马麝作为国家一级重点保护动物,具有极高的经济应用价值。多年来,我国马麝研究多集中于种群的地理分布、生态学、行为学和饲养学等领域[15-18],而关于马麝疾病的研究资料却相对较少。但随着马麝人工驯养产业的逐步扩大,传染性疾病的危害日益严重[7-10]。因此,开展马麝传染性疾病及其防控措施的研究,将为我国珍贵稀有动物资源的保护,以及相关产业的健康发展提供保障。
马麝出血症是流行于甘肃省兴隆山马麝群中的一种急性、高度致死性传染病,其发病急、致死率高,严重威胁兴隆山马麝种群的安全。但该病的真正病原始终未能确定。笔者所在研究团队经过反复确证,证实该病病原为一种杯状病毒,其全基因组核苷酸序列(GenBank登录号MN478485)与GenBank中RHDV全基因组核苷酸序列(登录号KY437668.1, DQ280493.1, EF363035.1, DQ189077.1, EU003579.1, KX844830.1, MH190418.1, EF558575.1, EF558578.1, EF558573.1, EF558576.1, EF558586.1, EF558577.1, EF558579.1, EF558580.1, EF558574.1, Z49271.2, X87607.1, M67473.1, Z29514.1, U54983.1, KM878681.1)的同源性为85.6%–98.7%[10]。。目前,RHDV尚无有效的病毒体外培养方法,因此预防用免疫制剂均为组织灭活苗。但此类疫苗的制备需要大量的感染致死动物内脏组织,不仅生产成本高且不符合动物保护和动物伦理相关的法规和制度。因此,研究者将注意力转向病毒的免疫保护性抗原VP60[19-20]。杨丽梅等[21]研究证实,VP60基因的部分核酸序列具有较好的免疫原性。王永山等[14]和隋慧等[22]应用VP60基因的大肠杆菌表达产物免疫的易感兔可获得100%保护,但VP60全蛋白的表达效率较低,因而筛选VP60主要抗原表位区成为相关疾病分子诊断和新型疫苗研究的热点。笔者所在研究团队虽然通过大量的试验,以期获得McHDV的体外培养,但迄今未能达到预期目的。因此本研究基于相关研究[14, 22],通过McHDV VP60序列的分析,确定其优势抗原表位编码序列主要集中于1–300 bp、421–1 020 bp和1 321–1 467 bp三个区域,且3个区域的核苷酸序列与RHDV VP60相应DNA片段的同源性分别为84.3%–98.3%、83.5%–98.7%和80.0%–99.3%。3个区域串联后的核苷酸序列与RHDV VP60相应DNA片段串联序列的同源性为83.2%–98.7%,其编码的氨基酸序列与RHDV VP60相应DNA片段串联编码的氨基酸序列同源性为90.9%–99.1%,不同毒株之间相关序列存在较大的差异。因此,为确保串联表达产物的免疫保护性,本研究基于McHDV三个区域的核苷酸序列,设计特异性引物扩增获得其主要的抗原表位序列,并采用重叠延伸PCR将所有表位序列融合在一起,进而构建原核表达载体表达重组蛋白并完成了重组蛋白的免疫原性、反应原性和免疫保护性分析。
由于马麝为“濒危”级野生动物,属于国家一级重点保护物种,禁止用于动物感染试验和攻毒试验,因而本研究以易感兔作为动物模型进行重组蛋白的免疫保护效力分析,为重组蛋白疫苗在马麝养殖产业的应用提供了基础数据资料。
本研究筛选的抗原表位串联序列在大肠杆菌中可有效表达,但以包涵体形式表达,纯化包涵体溶解后免疫动物,间接ELISA检测结果显示,抗血清效价可达1︰51 200以上,表明重组蛋白具有良好的免疫原性。Western blotting检测结果显示,抗血清可与McHDV组织毒和疫苗毒VP60蛋白特异性结合,表明制备的血清亦具有良好的反应原性。因此,重组蛋白可作为疫苗候选对象,用于新型亚单位疫苗或基因工程疫苗的研制。免疫保护试验结果显示,重组蛋白免疫2次的试验兔100%获得保护,且大肠杆菌表达系统及重组蛋白纯化技术已相当成熟,易于大批量生产,且成本较低,并可避免组织灭活苗生产需要感染并致死大量动物以及真核表达系统成本较高的弊端。尤其随着有效维持蛋白天然构象的表达系统的开发和应用[23-27],选择有利于重组蛋白可溶性表达和天然构象形成的表达系统,将会有效提高重组蛋白的免疫效果,进一步降低生产成本,提高生产效益。
4 结论McHDV VP60抗原表位优势区串联原核表达产物具有良好的免疫原性,重组蛋白免疫的易感新西兰白兔可有效抵抗McHDV的攻击,免疫保护率可达100%。
| [1] |
Lv XH, Qiao JY, Wu XM, et al. Investigation on intestinal parasitic infection in Moschus sifanicus(chrysogaster) of Qinghai. Chin J Vet Med, 2010, 46(12): 56-57 (in Chinese). 吕向辉, 乔继英, 吴晓民, 等. 青海马麝肠道寄生虫感染情况调查. 中国兽医杂志, 2010, 46(12): 56-57. DOI:10.3969/j.issn.0529-6005.2010.12.023 |
| [2] |
Meng XX, Feng JZ, Zhou YJ, et al. Behavioral patterns of wild-caught and captive-bred male musk deer. Chin J Appl Ecol, 2006, 17(11): 2084-2087 (in Chinese). 孟秀祥, 冯金朝, 周宜君, 等. 野捕和圈养繁殖雄性马麝行为格局的比较. 应用生态学报, 2006, 17(11): 2084-2087. DOI:10.3321/j.issn:1001-9332.2006.11.017 |
| [3] |
Meng XX, Yang QS, Feng ZJ, et al. Comparative studies on the behavioral patterns of female wild-caught and captive-bred Alpine Musk Deer in captivity. J Jilin Agric Univ, 2007, 29(6): 647-651 (in Chinese). 孟秀祥, 杨奇森, 冯祚建, 等. 不同来源雌性圈养马麝行为格局的比较研究. 吉林农业大学学报, 2007, 29(6): 647-651. DOI:10.3969/j.issn.1000-5684.2007.06.014 |
| [4] |
Li M, Sheng HL. Research status of the musk deer in China. Chin J Zool, 1996, 31(2): 56-58 (in Chinese). 李明, 盛和林. 中国麝科动物分类的研究现状. 动物学杂志, 1996, 31(2): 56-58. |
| [5] |
Liu WH, Tong JM. Analysis on protection and utilization of musk deer resources in China. Rev China Agric Sci Technol, 2005, 7(4): 28-32 (in Chinese). 刘文华, 佟建明. 中国的麝资源及其保护与利用现状分析. 中国农业科技导报, 2005, 7(4): 28-32. DOI:10.3969/j.issn.1008-0864.2005.04.006 |
| [6] |
Tong M, Pan SX, Wang XW, et al. Summer habitat selection of alpine musk deer in Xinglong mountain national Nature Reserve, Northwestern China. Zool Res, 2010, 31(6): 610-616 (in Chinese). 佟梦, 潘世秀, 王向伟, 等. 甘肃兴隆山自然保护区马麝夏季栖息地特征及生境选择格局. 动物学研究, 2010, 31(6): 610-616. |
| [7] |
Lu H, Jiang YW, Huang YD. Primary epidemiological investigation of respiratory disease of Moschus sifanicus in Xinglong mountain of Gansu Province. Chin J Zool, 2004, 39(6): 62-64 (in Chinese). 路浩, 蒋应文, 黄有德. 甘肃兴隆山马麝呼吸系统疾病流行病初步调查. 动物学杂志, 2004, 39(6): 62-64. DOI:10.3969/j.issn.0250-3263.2004.06.013 |
| [8] |
Lu H, Huang YD, Liu ZP. Etiologic study on respiratory disease in Moschus sifanicus. Chin J Vet Sci, 2008, 28(1): 45-47 (in Chinese). 路浩, 黄有德, 刘宗平. 马麝呼吸系统疾病病原学研究. 中国兽医学报, 2008, 28(1): 45-47. |
| [9] |
Lu H, Hu JJ, Huang YD, et al. Pathological observation on hemorrhagic pneumonia in Moschus sifanicus. Chin J Vet Med, 2010, 46(6): 38-39 (in Chinese). 路浩, 胡俊杰, 黄有德, 等. 马麝出血性肺炎的病理学观察. 中国兽医杂志, 2010, 46(6): 38-39. DOI:10.3969/j.issn.0529-6005.2010.06.014 |
| [10] |
Bao SJ, Xing XY, Ding XQ, et al. A new animal infectious disease, Moschus Chrysogaster viral hemorrhagic disease. Sci Agric Sin, 2018, 51(5): 1012 (in Chinese). 包世俊, 邢小勇, 丁小琴, 等. 一种新的动物传染病--马麝病毒性出血症. 中国农业科学, 2018, 51(5): 1012. |
| [11] |
Xiao M, Bao SJ, Xing XY, et al. Cloning and prokaryotic expression off gene of peste des petits ruminants virus GS strain and preparation of polyclonal antibody. J Agric Biotechnol, 2017, 25(3): 477-484 (in Chinese). 肖敏, 包世俊, 邢小勇, 等. 小反刍兽疫病毒甘肃株F基因的克隆、原核表达及多克隆抗体的制备. 农业生物技术学报, 2017, 25(3): 477-484. |
| [12] |
Jiang P. Veterinary Biologicology. 3rd ed. Beijing: China Agricultural Press, 2018: 518-519 (in Chinese). 姜平. 兽医生物制品学. 3版. 北京: 中国农业出版社, 2018: 518-519. |
| [13] |
Lin ZY. Methods of hemagglutination and hemagglutination inhibition test for rabbit haemorrhagic disease. J Anim Sci Vet Med, 1995, 14(2): 53-55 (in Chinese). 林治涌. 兔瘟血凝及血凝抑制试验操作方法. 畜牧兽医杂志, 1995, 14(2): 53-55. |
| [14] |
Wang YS, Lu CP, Zhou ZA, et al. Protection of rabbit hemorrhagic disease virus by immunization with the recombinant capsid protein expressed in E.coli. Sci Agric Sin, 2004, 37(11): 1677-1681 (in Chinese). 王永, .陆承平, 周宗安, 等. 原核表达的兔出血症病毒衣壳蛋白对兔的免疫保护效果. 中国农业科学, 2004, 37(11): 1677-1681. DOI:10.3321/j.issn:0578-1752.2004.11.016 |
| [15] |
Xia L, Yang QS, Wei FW, et al. Study on geographical division of alpine musk deer (Moschus sifanicus). Acta Theriol Sin, 2004, 24(1): 1-5 (in Chinese). 夏霖, 杨奇森, 魏辅文, 等. 马麝诸种群地理分化初步探讨. 兽类学报, 2004, 24(1): 1-5. DOI:10.3969/j.issn.1000-1050.2004.01.001 |
| [16] |
Liu ZX, Li Q, Kang FG, et al. Some ecological characteristics of the isolated population of alpine musk deer (Moschus chrysogaster) in the Xinglong forest, Gansu Province. Acta Ecol Sin, 2001, 21(6): 964-968 (in Chinese). 刘志霄, 李强, 康发攻, 等. 甘肃兴隆山林区马麝(Moschus chrysogaster)隔离种群的生态特征. 生态学报, 2001, 21(6): 964-968. DOI:10.3321/j.issn:1000-0933.2001.06.018 |
| [17] |
Hao ZL, Zhang XY, Guo YL, et al. The nutrients of main wild plants eatable to musk deer in Xinglong mountain national nature reserve. Pratacult Anim Husbandry, 2002, 22(4): 41-44 (in Chinese). 郝正里, 张学炎, 郭艳丽, 等. 兴隆山自然保护区马麝主要可食野生植物的营养成分. 中国草食动物, 2002, 22(4): 41-44. DOI:10.3969/j.issn.2095-3887.2002.04.015 |
| [18] |
Hao ZL, Wang PM, Jiang YW, et al. Nutritional evaluation of ten plants eaten by Moschus chrysogaster from Xinglong mountain in autumn. China Herbiv, 2002, 22(6): 40-42 (in Chinese). 郝正里, 王培民, 蒋应文, 等. 兴隆山马麝喜食10种植物秋季营养评价. 中国草食动物, 2002, 22(6): 40-42. DOI:10.3969/j.issn.2095-3887.2002.06.020 |
| [19] |
Kinnear M, Linde CC. Capsid gene divergence in rabbit hemorrhagic disease virus. J Gen Virol, 2010, 91(1): 174-181. DOI:10.1099/vir.0.014076-0 |
| [20] |
Rohde J, Schirrmeier H, Granzow H, et al. A new recombinant Orf virus (ORFV, Parapoxvirus) protects rabbits against lethal infection with rabbit hemorrhagic disease virus (RHDV). Vaccine, 2011, 29(49): 9256-9264. DOI:10.1016/j.vaccine.2011.09.121 |
| [21] |
Yang LM, Ma L, Zhang ZM, et al. Cloning, truncated expression and activity identification of rabbit hemorrhagic disease virus VP60 gene of ZB strain. Progr Vet Med, 2013, 34(9): 57-61 (in Chinese). 杨丽梅, 马力, 张志美, 等. 兔出血症病毒ZB分离株VP60基因克隆、截短表达与活性鉴定. 动物医学进展, 2013, 34(9): 57-61. DOI:10.3969/j.issn.1007-5038.2013.09.014 |
| [22] |
Sui H, Yang JS. Prokaryotic expression and immunogenicity of major antigen epitope of rabbit haemorrhagic disease virus VP60. J Anhui Agric Sci, 2010, 38(28): 15660-15661 (in Chinese). 隋慧, 杨金生. 兔出血症病毒VP60主要抗原表位的原核表达及其免疫原性. 安徽农业科学, 2010, 38(28): 15660-15661. DOI:10.3969/j.issn.0517-6611.2010.28.084 |
| [23] |
Yuan DW, Liu JS, Guo DC, et al. Development of VP60 gene vaccine against RHDV and immunity test in mice. Chin J Vet Sci, 2011, 31(11): 1582-1586 (in Chinese). 原冬伟, 刘家森, 郭东春, 等. 兔出血症病毒VP60基因真核表达质粒的构建及初步评价. 中国兽医学报, 2011, 31(11): 1582-1586. |
| [24] |
Lu ZX.Construction and immunogenicity of recombinant eukaryotic plasmid of VP60 gene of rabbit hemorrhagic disease virus[D].Ya'an: Sichuan Agricultural University, 2015(in Chinese). 鲁忠祥.兔瘟病毒VP60基因重组真核质粒的构建及其免疫原性[D].雅安: 四川农业大学, 2015. |
| [25] |
Farnós O, Rodríguez M, Chiong M, et al. The recombinant rabbit hemorrhagic disease virus VP60 protein obtained from Pichia pastoris induces a strong humoral and cell-mediated immune response following intranasal immunization in mice. Vet Microbiol, 2006, 114(3/4): 187-195. |
| [26] |
Farnós O, Fernández E, Chiong M, et al. Biochemical and structural characterization of RHDV capsid protein variants produced in Pichia pastoris:advantages for immunization strategies and vaccine implementation. Antiv Res, 2009, 81(1): 25-36. DOI:10.1016/j.antiviral.2008.08.007 |
| [27] |
Laurent S, Vautherot JF, Madelaine MF, et al. Recombinant rabbit hemorrhagic disease virus capsid protein expressed in baculovirus self-assembles into viruslike particles and induces protection. J Virol, 1994, 68(10): 6794-6798. DOI:10.1128/JVI.68.10.6794-6798.1994 |
 2020, Vol. 36
2020, Vol. 36




