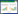中国科学院微生物研究所、中国微生物学会主办
文章信息
- 王伟, 秦贻, 王亚茹, 邹节节, 陈静, 陈金武, 张雁, 耿明, 徐忠东, 戴敏, 潘礼龙
- Wang Wei, Qin Yi, Wang Yaru, Zou Jiejie, Chen Jing, Chen Jinwu, Zhang Yan, Geng Ming, Xu Zhongdong, Dai Min, Pan Lilong
- L929细胞条件培养基诱导培养的小鼠原代巨噬细胞生物学特性对比
- Characteristic comparison of mouse primary macrophages cultured in L929 cell conditioned medium
- 生物工程学报, 2020, 36(7): 1431-1439
- Chinese Journal of Biotechnology, 2020, 36(7): 1431-1439
- 10.13345/j.cjb.190517
-
文章历史
- Received: November 19, 2019
- Accepted: March 3, 2020
- Published: April 7, 2020
2. 安徽中医药大学 药学院,安徽 合肥 230012;
3. 江南大学 医学院,江苏 无锡 214122
2. School of Pharmacy, Anhui University of Chinese Medicine, Hefei 230012, Anhui, China;
3. School of Medicine, Jiangnan University, Wuxi 214122, Jiangsu, China
巨噬细胞在固有免疫和适应性免疫中都起着至关重要的作用[1]。巨噬细胞在机体的各种组织中均有分布,其在发育早期阶段就能通过执行特定免疫反应对抗不同类型病原微生物感染,因此是宿主防御系统必不可少的部分。巨噬细胞具有显著的异质性和可塑性,在维持组织稳态、重塑组织、清除细胞碎片、调节免疫反应等方面发挥重要生理作用[2]。目前已证实,巨噬细胞参与多种炎症性疾病病理过程,包括动脉粥样硬化、哮喘、炎性肠病、类风湿关节炎、纤维化和癌症等[3-8]。鉴于巨噬细胞在生理及病理过程中的重要作用,基于靶向巨噬细胞功能研究日益增多,而巨噬细胞体外培养在其中扮演不可或缺的角色。
体外培养的巨噬细胞主要来自于永生化细胞系和原代细胞,常用的巨噬细胞细胞系包括人单核细胞株(THP-1)和小鼠巨噬细胞株(RAW 264.7)等,前者需要在佛波酯(PMA)诱导下分化为巨噬细胞进行后续研究[9]。相对于经过基因修饰永生化的细胞系,原代细胞生物学性质和特点上更接近于真实的生理及病理环境。目前,原代巨噬细胞培养多来源于小鼠腹腔巨噬细胞(PM)和骨髓源巨噬细胞(BMDM),然而上述两种原代细胞培养难度、培养时间以及生物学功能是否存在差异目前仍不清楚。本实验通过对比分析两种不同来源的小鼠巨噬细胞在细胞数量、形态学、生长曲线、细胞纯度、吞噬和极化功能上的差异,为巨噬细胞原代培养方法的选择提供理论和实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物及细胞雄性C57BL/6小鼠(体重(22±3) g)购自北京维通利华实验动物技术有限公司,许可证号:SCXK (京) 2012-0001。L929细胞株购于美国ATCC公司。
1.1.2 试剂DMEM培养基(高糖型)、RPMI-1640培养基、胎牛血清(FBS,经56 ℃30 min热灭活)购自以色列BI公司;胰蛋白酶购自北京索莱宝生物科技有限公司;红细胞裂解液、中性红试剂盒、CCK-8试剂盒购自江苏碧云天生物技术有限公司;细菌脂多糖(LPS,大肠杆菌055:B5)和巯基乙酸钠购自美国Sigma-Aldrich公司;IFN-γ、IL-4购自美国Peprotech公司;大鼠抗小鼠CD11b抗体(FITC)、大鼠抗小鼠CD11b同型对照抗体(大鼠IgG2b,kappa单克隆抗体-FITC)购自英国Abcam公司;大鼠抗小鼠F4/80抗体(APC)、大鼠抗小鼠F4/80同型对照抗体(大鼠IgG2a,kappa单克隆抗体-APC)购自美国eBioscience公司;Trizol、RNA酶抑制剂和SBYR Green购自美国Thermo Fisher Scientific公司;M-MLV逆转录酶购自美国Promega;引物由上海捷瑞生物工程有限公司设计合成。
1.1.3 仪器CO2培养箱(美国Thermo Fisher Scientific公司,#3111);细胞计数仪(美国Inno-Alliance Biotech公司,#IC 1000);全波长多功能酶标仪(美国MD公司,#SpectraMax M2);倒置显微镜(日本OLYMPUS公司,#IX71);流式细胞仪(美国BD公司,#C6);台式高速冷冻离心机(美国Beckman公司,# Allegra X-30R);实时荧光定量PCR仪(美国Applied Biosystems公司,#Stepone)。
1.2 方法 1.2.1 L929细胞培养常规复苏L929细胞,用含10% FBS的DMEM培养基培养24 h后,更换培养液1次,继续培养24 h后消化传代,传代过程中离心(1 000 r/min 5 min)收集细胞上清液(L929细胞条件培养基),0.22 μm滤膜过滤后放置-80 ℃冰箱保存。
1.2.2 小鼠PM原代培养小鼠腹腔注射4.0%巯基乙酸钠3.0 mL,刺激72 h后颈椎脱臼法处死小鼠,75%酒精浸泡3 min,超净台内剪开皮肤后充分暴露腹膜,腹腔注射4 ℃预冷RPMI-1640培养基4.0 mL,轻揉小鼠腹部2 min,用注射器回抽腹腔灌洗液,收集于15 mL离心管中,重复抽吸过程2–3次。上述操作均需避免刺破腹腔脏器及血管。将获得的细胞悬液离心(1 000 r/min 5 min)后弃上清。用含10% FBS的RPMI-1640培养基重悬细胞至培养皿内,细胞计数仪计算总细胞数,细胞培养箱(37 ℃、5% CO2)培养2 h后,更换培养液去除未贴壁细胞以纯化巨噬细胞[10],细胞计数仪计数未贴壁悬浮细胞。PM细胞数=总细胞数-未贴壁悬浮细胞数。
1.2.3 小鼠BMDM原代培养颈椎脱臼法处死小鼠后放入75%的酒精中完全浸没3–5 min,分离双侧股骨和胫骨,仔细去除骨骼外肌组织及结缔组织,完全暴露出骨质,放于75%酒精内浸泡5 min后转移至超净工作台,眼科剪沿骨垢线剪断长骨两端,用DMEM培养液(10% FBS+15% L929细胞条件培养基)冲洗骨髓腔内细胞,200目筛网过滤冲洗液以去除细胞团块和骨骼碎片,滤液离心(1 000 r/min 5 min)后弃上清,用红细胞裂解液(1.0 mL)重悬细胞,室温裂解2 min后加入10 mL DMEM培养液,200目筛网过滤以去除裂解的红细胞,滤液离心(1 000 r/min 5 min)后用DMEM培养液重悬细胞接种至培养皿内,细胞计数仪分析细胞数量。
1.2.4 巨噬细胞纯度测定原代细胞以相同密度(5×105个/mL)接种6孔板,毎孔加入2.0 mL细胞悬液。原代细胞培养过程中观察细胞形态学变化。培养7 d后,吸出各孔内细胞培养液,用4 ℃预冷的PBS清洗后胰蛋白酶消化细胞,离心弃上清液后每管加入100 μL PBS重悬细胞,分别加入CD11b抗体、CD11b同型对照抗体、F4/80抗体和F4/80同型对照抗体,室温下避光孵育30 min,流式细胞仪检测荧光信号(FL1-H和FL4-H通道)。
1.2.5 细胞增殖检测胰蛋白酶消化收集原代培养7 d后巨噬细胞,以相同密度(1×104个/mL)接种于96孔板,毎孔200 μL细胞悬液。两种来源的巨噬细胞培养液均为DMEM培养液(10% FBS+15% L929细胞条件培养基)。铺板后第1、3、5和7天分别使用CCK-8法检测细胞活性及增殖情况。毎孔内加入20 μL的CCK-8溶液,细胞培养箱内孵育2 h,全波长多功能检测仪测定450 nm波长下的OD值。
1.2.6 巨噬细胞吞噬功能检测原代细胞以相同密度(1×104个/mL)接种于96孔板。培养7 d后,采用不同浓度LPS (0.1、1、10 μg/mL)作用细胞24 h,每孔加入20 μL中性红染色液,细胞培养箱内孵育2 h,吸出含有中性红染色液的细胞培养液,PBS洗涤1次,各孔加入200 μL中性红检测裂解液,室温摇床上裂解10 min,全波长多功能检测仪测定540 nm波长下的OD值。
1.2.7 巨噬细胞极化功能检测原代细胞培养7 d后,采用LPS (100 ng/mL)+ IFN-γ (20 ng/mL)作为巨噬细胞M1型诱导剂,采用IL-4 (20 ng/mL)作为巨噬细胞M2型诱导剂,分别刺激两种来源巨噬细胞24 h,刺激结束后毎孔加入1 mL Trizol提取总RNA,统一RNA浓度后逆转录合成cDNA,逆转录体系为DEPC水(10.125 μL)、5×Buffer (5 μL)、dNTPs (1.25 μL)、RNA酶抑制剂(0.625 μL)和M-MLV逆转录酶(1 μL),反应结束后,取出cDNA样品,加入75 μL DEPC水,吹打混匀后备用。实时荧光定量PCR (qPCR)反应体系为2 μL模板cDNA、7 μL DEPC水、10 μL SBYR Green Master Mix、0.5 μL上游引物、0.5 μL下游引物,引物序列见表 1。反应程序:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 1 min,循环40次。以GAPDH为内参基因,采用2-ΔΔCt法计算mRNA相对表达水平。
| Primer name | Primer sequence (5'–3') |
| Tnfα-forward | CAGGCGGTGCCTATGTCTC |
| Tnfα-reverse | CGATCACCCCGAAGTTCAGTAG |
| Nos2-forward | ATCTTTGCCACCAAGATGGCCTGG |
| Nos2-reverse | TTCCTGTGCTGTGCTACAGTTCCG |
| Arg1-forward | TGACTGAAGTAGACAAGCTGGGGAT |
| Arg1-reverse | CGACATCAAAGCTCAGGTGAATCGG |
| Ym1-forward | ATGAAGCATTGAATGGTCTGAAAG |
| Ym1-reverse | TGAATATCTGACGGTTCTGAGGAG |
| Gapdh-forward | AAGAAGGTGGTGAAGCAGG |
| Gapdh-reverse | GAAGGTGGAAGAGTGGGAGT |
采用GraphPad Prism 8.0软件进行统计学分析,实验数据以平均值±标准误(x±s)表示,两组间比较采用独立样本t检验(双尾法),P < 0.05表示差异有显著性意义。
2 结果与分析 2.1 细胞数量分析细胞计数结果显示,从单只小鼠腹腔中获取的巨噬细胞数为(18.33±3.63)×104个/mL,而经骨髓腔冲洗获得的细胞数为(416.70±72.65)×104个/mL。经独立样本t检验(双尾),P=0.009 8,差异具有显著统计学意义,说明从骨髓中获取的细胞数显著高于腹腔(图 1)。
|
| 图 1 对比分析不同来源巨噬细胞数量 Fig. 1 Comparison of the number of macrophages from different sources. **P < 0.01. |
| |
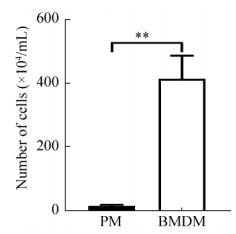
倒置显微镜观察发现,PM贴壁速度快,细胞在悬浮状态时或者刚开始贴壁时呈圆形,原代培养1 d后呈现出具有突起的不规则形态。骨髓源细胞贴壁速度较PM慢,原代培养3 d后部分细胞贴壁生长,原代培养7 d后,多数细胞开始伸展呈细长梭形,有钝圆形的突起,部分细胞呈现出星形,有伪足和突起,呈现出典型的巨噬细胞体外培养形态(图 2)。
|
| 图 2 对比分析不同来源巨噬细胞形态学变化 Fig. 2 Comparison of the morphology of macrophages from different sources (scale bar=25 μm). |
| |
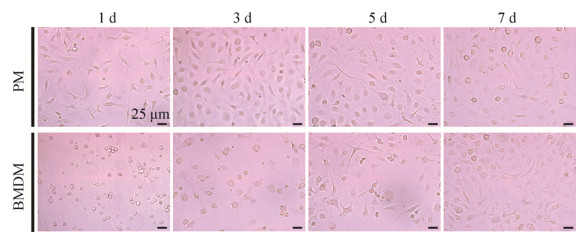
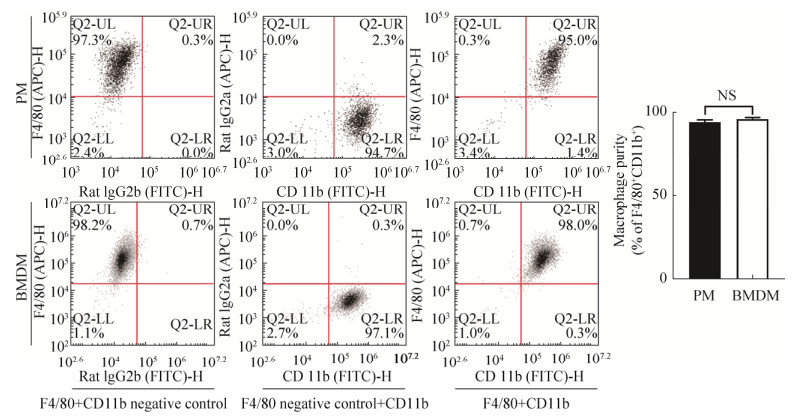
原代培养7 d后,流式细胞仪检测发现,PM中F4/80+CD11b+细胞比例为94.83%±1.42%,BMDM中F4/80+CD11b+细胞比例为98.30%±0.53%,经独立样本t检验(双尾),P=0.083 7,差异无统计学意义,说明两种原代巨噬细胞培养均可获得高纯度的巨噬细胞(图 3)。
|
| 图 3 对比分析不同来源巨噬细胞纯度 Fig. 3 Comparison of the purity of macrophages from different sources. |
| |
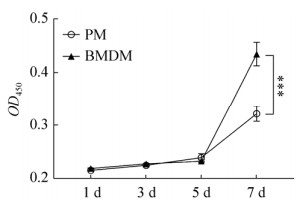
CCK-8检测结果表明,两种来源的巨噬细胞生长曲线具有相似特征,对数生长期均出现在5–7 d。培养7 d后,BMDM数量显著高于PM (P < 0.001),说明在L929细胞条件培养基培养体系中,BMDM体外增殖能力显著高于PM (图 4)。
|
| 图 4 对比分析不同来源巨噬细胞增殖能力 Fig. 4 Comparison of the proliferation of macrophages from different sources. ***P < 0.001. |
| |
中性红检测发现,基础状态下PM吞噬能力显著低于BMDM (P < 0.01),经LPS刺激24 h后,除低剂量LPS (0.1 μg/mL)外,PM吞噬能力均显著低于BMDM (P < 0.01或P < 0.001),说明不同来源巨噬细胞吞噬能力上存在差异,BMDM吞噬功能在基础和细菌内毒素LPS刺激状态下均强于PM (图 5)。

|
| 图 5 对比分析不同来源巨噬细胞吞噬功能 Fig. 5 Comparison of the phagocytic function of macrophages from different sources (scale bar, 25 μm). **P < 0.01, ***P < 0.001. |
| |
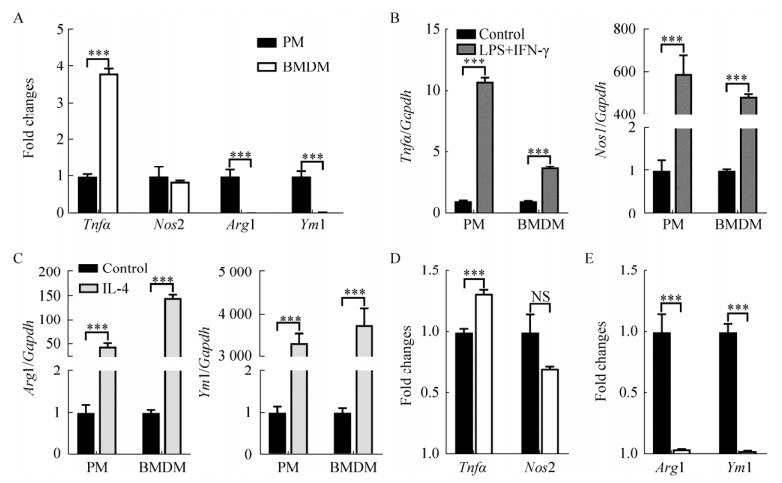
qPCR结果显示,基础状态下巨噬细胞M1型标志基因肿瘤坏死因子-α (Tnfα)在PM中表达显著低于BMDM (P < 0.001),M2型标志基因精氨酸酶-1 (Arg1)和类几丁质酶3样分子1 (Ym1)在PM中表达显著高于BMDM (P < 0.001),说明基础状态下,不同来源巨噬细胞M1/M2型标志基因表达存在差异(图 6A)。
|
| 图 6 对比分析不同来源巨噬细胞极化特征 Fig. 6 Comparison of the polarization properties of macrophages from different sources. (A) Untreated cells. (B and D) LPS and IFN-γ treated cells. (C and E) IL-4 treated cells. ***P < 0.001. |
| |
与对照组相比,细胞经LPS和IFN-γ的共同诱导后,M1型标志基因一氧化氮合成酶2 (Nos2)和Tnfα在PM和BMDM中表达均显著升高(P < 0.001)。与对照组相比,细胞经IL-4诱导后,M2型标志基因(Arg1和Ym1)在PM和BMDM中表达均显著升高(P < 0.001),说明两种不同来源的巨噬细胞极化功能均可满足极化实验要求(图 6B和C)。进一步分析发现,细胞经LPS和IFN-γ的共同诱导后,Tnfα在PM中表达显著低于BMDM (P < 0.001) (图 6D)。细胞经IL-4诱导后,M2型标志基因(Arg1和Ym1)在PM中表达显著高于BMDM (P < 0.001) (图 6E),说明PM向M2型极化能力可能高于BMDM,而在M1型极化能力上BMDM更占优势。
3 讨论目前认为,巨噬细胞并非终分化细胞且广泛分布于多种组织中[11-12],然而体外实验中获取大量巨噬细胞仍十分困难。腹腔是小鼠原代巨噬细胞常见来源,腹腔中除了巨噬细胞外,还含有大量的淋巴细胞,包括B淋巴细胞、T淋巴细胞和自然杀伤(NK)细胞,而巨噬细胞只占其中35%[13]。我们发现小鼠经巯基乙酸钠腹腔刺激后,单只鼠可获取PM数量为(18.33±3.63)×104个/mL。与之前报道一致[14],本实验发现单只小鼠经骨髓可获取细胞数为(416.70±72.65)×104个/mL,显著高于腹腔(P < 0.01)。细胞增殖实验发现,在L929细胞条件培养基体系中,不同来源巨噬细胞具有类似的生长曲线,但BMDM增殖能力显著高于PM。L929细胞上清液中含有其分泌的巨噬细胞集落刺激因子(M-CSF),而M-CSF可显著诱导巨噬细胞增殖[15]。与本实验发现一致,在M-CSF诱导下,体外培养的BMDM增殖能力显著高于PM[16]。在阿霉素诱导的小鼠肾病模型发现,相对于脾脏源巨噬细胞,静脉输注的M2型BMDM在肾脏中显示出更加显著的增殖能力,但增加的M2型BMDM却未表现出肾损伤保护作用[17],提示巨噬细胞增殖能力可能与其功能和表型稳定呈负相关。
巨噬细胞具有极强的可塑性,能通过相关受体激活或所处微环境变化进行表型转换[18-19]。巨噬细胞可极化为具有促炎作用的经典激活表型(M1型巨噬细胞)或具有抗炎、抗纤维化和伤口愈合作用的替代激活表型(M2型巨噬细胞)。M1型巨噬细胞高表达Fc受体并产生促炎细胞因子(MCP-1、IL-6、TNF、IL-12)和一氧化氮。相反,M2型巨噬细胞高表达Arg1、Ym1、Il10和Tgfβ等基因[20]。我们发现原代培养7 d后,基础状态下M1型巨噬细胞标志基因Tnfα在PM中表达显著低于BMDM,M2型标志基因Arg1和Ym1在PM中表达显著高于BMDM,说明基础状态下,与PM相比,BMDM更偏向M1型状态,原因可能是骨髓祖细胞经M-CSF诱导分化的巨噬细胞多为M1型[21]。M1型诱导剂(LPS和IFN-γ)刺激后,M1型标志基因Tnfα在PM中表达依然显著低于BMDM,而M2型诱导剂(IL-4)诱导细胞后,M2型标志基因(Arg1和Ym1)在PM中表达显著高于BMDM,提示基础状态下两种不同来源的巨噬细胞表型差异在特定表型诱导剂刺激后依然存在。
巨噬细胞表型对其吞噬功能有着直接的影响。体外实验证实,M1表型巨噬细胞(人或鼠源)吞噬能力均显著强于M2表型[22-24]。原代培养7 d后,BMDM吞噬能力显著高于PM。在经细菌内毒素LPS进一步刺激后,上述差异依然存在,提示体外培养的BMDM在基础状态和激活状态,其吞噬功能均强于PM。该发现进一步佐证了巨噬细胞极化功能检测结果,BMDM表型偏向于M1极化状态。然而,表型差异如何影响吞噬功能还有待进一步研究。
综上所述,尽管原代培养的腹腔源和骨髓源巨噬细胞在纯度和诱导后极化状态均可满足实验要求,然而PM和BMDM无论在体外培养过程或生物学特性均存在一定差异。BMDM在可获取数量上明显多于PM,但其基础状态较PM却呈现出M1表型特征及较强的吞噬能力,这一差异在特定诱导剂处理后依然存在。因此,在巨噬细胞相关病理或药理研究过程中应谨慎合理选择巨噬细胞原代培养方法,以避免原代培养巨噬细胞生物学特性差异对实验结果产生影响。
| [1] |
Epelman S, Lavine KJ, Randolph GJ. Origin and functions of tissue macrophages. Immunity, 2014, 41(1): 21-35. |
| [2] |
Tarique AA, Logan J, Thomas E, et al. Phenotypic, functional, and plasticity features of classical and alternatively activated human macrophages. Am J Respir Cell Mol Biol, 2015, 53(5): 676-88. |
| [3] |
Kuznetsova T, Prange KHM, Glass CK, et al. Transcriptional and epigenetic regulation of macrophages in atherosclerosis. Nat Rev Cardiol, 2019. DOI:10.1038/s41569-019-0265-3 |
| [4] |
Di Benedetto P, Ruscitti P, Vadasz Z, et al. Macrophages with regulatory functions, a possible new therapeutic perspective in autoimmune diseases. Autoimmun Rev, 2019, 18(10): 102369. |
| [5] |
Bercovici N, Guérin MV, Trautmann A, et al. The remarkable plasticity of macrophages: a chance to fight cancer. Front Immunol, 2019, 10: 1563. |
| [6] |
Tang PMK, Nikolic-Paterson DJ, Lan HY. Macrophages: versatile players in renal inflammation and fibrosis. Nat Rev Nephrol, 2019, 15(3): 144-158. |
| [7] |
Zhou X, Li WY, Wang S, et al. YAP aggravates inflammatory bowel disease by regulating M1/M2 macrophage polarization and gut microbial homeostasis. Cell Rep, 2019, 27(4): 1176-89.e5. |
| [8] |
Tokunaga Y, Imaoka H, Kaku Y, et al. The significance of CD163-expressing macrophages in asthma. Ann Allergy Asthma Immunol, 2019, 123(3): 263-270. |
| [9] |
Safar R, Doumandji Z, Saidou T, et al. Cytotoxicity and global transcriptional responses induced by zinc oxide nanoparticles NM 110 in PMA-differentiated THP-1 cells. Toxicol Lett, 2019, 308: 65-73. |
| [10] |
Rios FJ, Touyz RM, Montezano AC. Isolation and differentiation of murine macrophages. Methods Mol Biol, 2017, 1527: 297-309. |
| [11] |
Davies LC, Taylor PR. Tissue-resident macrophages: then and now. Immunology, 2015, 144(4): 541-548. |
| [12] |
Lavin Y, Mortha A, Rahman A, et al. Regulation of macrophage development and function in peripheral tissues. Nat Rev Immunol, 2015, 15(12): 731-744. |
| [13] |
Zhao YL, Tian PX, Han F, et al. Comparison of the characteristics of macrophages derived from murine spleen, peritoneal cavity, and bone marrow. J Zhejiang Univ Sci B, 2017, 18(12): 1055-1063. |
| [14] |
Parsa R, Andresen P, Gillett A, et al. Adoptive transfer of immunomodulatory M2 macrophages prevents type 1 diabetes in NOD mice. Diabetes, 2012, 61(11): 2881-2892. |
| [15] |
Ramón-Vázquez A, De La Rosa JV, Tabraue C, et al. Bone marrow-derived macrophage immortalization of LXR nuclear receptor-deficient cells. Methods Mol Biol, 2019, 1951: 75-85. |
| [16] |
Wang CQ, Yu X, Cao Q, et al. Characterization of murine macrophages from bone marrow, spleen and peritoneum. BMC Immunol, 2013, 14: 6. |
| [17] |
Wang YP, Harris DC. Macrophages in renal disease. J Am Soc Nephrol, 2011, 22(1): 21-27. |
| [18] |
Orecchioni M, Ghosheh Y, Pramod AB, et al. Macrophage polarization: different gene signatures in M1(LPS+) vs. classically and M2(LPS-) vs. Alternatively activated macrophages. Front Immunol, 2019, 10: 1084. |
| [19] |
Lu JY, Cao Q, Zheng D, et al. Discrete functions of M2a and M2c macrophage subsets determine their relative efficacy in treating chronic kidney disease. Kidney Int, 2013, 84(4): 745-755. DOI:10.1038/ki.2013.135 |
| [20] |
Das A, Sinha M, Datta S, et al. Monocyte and macrophage plasticity in tissue repair and regeneration. Am J Pathol, 2015, 185(10): 2596-2606. |
| [21] |
Ho VW, Sly LM. Derivation and characterization of murine alternatively activated (M2) macrophages//Reiner N. Macrophages and Dendritic Cells. Totowa: Humana Press, 2009: 173-85.
|
| [22] |
Qie YQ, Yuan HF, Von Roemeling CA, et al. Surface modification of nanoparticles enables selective evasion of phagocytic clearance by distinct macrophage phenotypes. Sci Rep, 2016, 6: 26269. |
| [23] |
Deng HM, Li ZC, Tan YF, et al. A novel strain of Bacteroides fragilis enhances phagocytosis and polarises M1 macrophages. Sci Rep, 2016, 6: 29401. |
| [24] |
Zhang M, Hutter G, Kahn SA, et al. Anti-CD47 treatment stimulates phagocytosis of glioblastoma by M1 and M2 polarized macrophages and promotes m1 polarized macrophages in vivo. PLoS ONE, 2016, 11(4): e0153550. |
 2020, Vol. 36
2020, Vol. 36