中国科学院微生物研究所、中国微生物学会主办
文章信息
- 陶玲芸, 张怡雯, 李雅乾, 罗来鹏, 张曾鲁, 陈捷
- Tao Lingyun, Zhang Yiwen, Li Yaqian, Luo Laipeng, Zhang Zenglu, Chen Jie
- 棘孢木霉挥发性次级代谢产物检测及抑菌活性分析
- Antagonistic activity of volatile metabolites from Trichoderma asperellum
- 生物工程学报, 2020, 36(6): 1181-1189
- Chinese Journal of Biotechnology, 2020, 36(6): 1181-1189
- 10.13345/j.cjb.190442
-
文章历史
- Received: September 28, 2019
- Accepted: March 20, 2020
- Published: April 17, 2020
2. 上海交通大学 农业部都市农业 (南方) 重点实验室,上海 200240
2. Key Laboratory of Urban Agriculture (South), Ministry of Agriculture, Shanghai Jiao Tong University, Shanghai 200240, China
木霉(Trichoderma spp.)是一类具有重要的生防价值的丝状真菌,其抗逆性强,至少对18个属20余种病原真菌和多种病原细菌有拮抗作用,已有数种木霉(深绿木霉Trichoderma atroviride、哈茨木霉Trichoderma harzianum、绿色木霉Trichoderma viride等)商业化用于防控根腐病、枯萎病、菌核病和纹枯病等植物病害,均取得了显著的防效[1-2]。
研究表明,木霉菌在重寄生过程中,分泌多种细胞壁降解酶如几丁质酶、葡聚糖酶、纤维素酶和蛋白酶等,并产生丰富多样具有抗菌活性的次级代谢产物,如聚酮类和抗菌肽类物质,通过酶与抗菌物质协同增效防治植物病害[3-4]。基因组测序证实了木霉包含近40个次级代谢产物生物合成基因簇,其中聚酮合酶(PKS)和非核糖体肽合成酶(NRPS)分别负责合成聚酮类化合物如吡喃酮以及非核糖体肽类物质如Trichorzianines A和B、Atroviridin_A、Trichotoxin_A-40等[5-6]。这些挥发性和非挥发性代谢产物在病害防治中发挥重要作用。
6-正戊基-2H-吡喃-2-酮(6-PAP)是一种木霉产生的吡喃酮类挥发性代谢产物,散发椰子香味,具有广谱抗菌活性,对尖孢镰孢菌Fusarium oxysporum、立枯丝核菌Rhizoctonia solani、灰葡萄孢Botrytis cinerea等多种植物病害表现出很强的拮抗活性[7-9]。6-PAP最早从绿色木霉中分离出来,随后在多种木霉中被检测到[10]。研究表明6-PAP来源于脂肪酸亚油酸的氧化,尽管哈茨木霉中6-PAP主要合成步骤已经被阐明,但其生物合成途径中关键酶仍待鉴定。6-PAP除了能抑制真菌的生长,还可以降低串珠镰孢菌中镰孢菌酸和禾谷镰孢菌中脱氧雪腐镰孢菌烯醇的产量[11-12]。此外,Vinale等研究表明6-PAP对豌豆、番茄和油菜具有类似生长素的作用,即在低浓度下促进植物生长而在较高浓度时会抑制植物生长[13]。因此,6PAP具有低毒性、环境相容性等特点,成为开发新型生防杀菌剂的优选产品。
棘孢木霉的生长速度快和代谢产物多样性的优势引起研究者更多关注[14-15]。本研究基于实验室前期分离鉴定获得的12株棘孢木霉,通过比较不同棘孢木霉拮抗尖孢镰孢菌的特性,确定2株木霉菌ZJSX5003和GDFS1009具有较好的拮抗性,进一步利用顶空固相微萃取(Headspace solid phase micro-extraction,HS-SPME)和气质联用法(GC-MS)测定了其挥发性代谢产物,从代谢角度阐明该棘孢木霉的优良拮抗特性,为棘孢木霉菌剂在生防领域的研发提供依据。
1 材料与方法 1.1 供试材料 1.1.1 菌株木霉:实验前期从浙江省绍兴市的不同农作物(萝卜、四季豆、丝瓜、青菜、番薯)黑垆土土壤中分离出了6株木霉,通过形态和分子鉴定(ITS和tef1-α)确定6株棘孢木霉T. asperellum,分别为ZJSX1003、ZJSX4002、ZJSX5001、ZJSX5002、ZJSX5003、ZJSX5008。从广东省佛山(生菜、鸡毛菜、罗汉果、白菜、丝瓜)等灌淤土壤中分离到的菌株,通过形态和分子鉴定(ITS和tefl-α)确定6株棘孢木霉,分别为GDFS1009、GDFS1010、GDFS2001、GDFS2011、GDFS2012、GDFS5201。12株棘孢木霉均保存在上海交通大学木霉保藏中心(http://www.china-cctc.org/ClassificationKnow.aspx)。
病原菌:尖孢镰孢菌(F. oxysporum),由上海交通大学植物病理学实验室提供。
1.1.2 培养基培养基:马铃薯葡萄糖琼脂培养基(PDA)。配方:马铃薯200 g,葡萄糖20 g,琼脂15–20 g,蒸馏水1 000 mL。自然pH。液体培养基(PD):成分同PDA,去除琼脂。培养基121 ℃,15 min灭菌后备用。
菌株的活化及形态观察:将尖孢镰孢菌和棘孢木霉分别接种在PDA新鲜培养基28 ℃培养,定期拍照记录菌落形态。
1.2 木霉拮抗尖孢镰孢菌平板对峙实验活化后的12株棘孢木霉分别和尖孢镰孢菌在新鲜PDA培养基上对峙培养。对照组:以单独培养的病原菌作为阴性对照,单独培养的木霉菌做阳性对照,28 ℃的恒温培养箱中进行无光培养,培养期间观察、拍照并测量和记录尖孢镰孢菌落的半径,计算抑制率。
抑制率的计算公式:抑制率=(C−T)/C×100%。其中,C为对照组尖孢镰孢菌的半径,T为实验组尖孢镰孢菌的半径。
1.3 棘孢木霉抗生性次级代谢产物提取和鉴定木霉菌分生孢子中抗生物质的提取:木霉菌纯化后,接种在PDA平板培养基,28 ℃培养6 d,待分生孢子长满后,用干净已灭菌的药匙小心地刮下平板表面的孢子,常温下干燥孢子至恒重,待用。代谢产物提取方法参考文献[16]。
GS-MS分析:采用GS-MS对提取物成分展开分析,仪器型号为美国Perkin Elmer公司AutoSystem XL GC/TurboMass MS,色谱柱为DB-5MS (30 m×0.25 mm×0.25 μm);参数设置为:柱温50 ℃,保持4 min,以5 ℃/min升至300 ℃,保持10 min;进样温度为280 ℃;离子源为EI,电子能量为70 eV;离子源温度为200 ℃;接口温度为260 ℃;质量扫描范围为33–500 amu;光电倍增管电压450 V;汽化室温度为300 ℃;载气为氦气(99.999%);分流比为无分流;进样量为1 μL。
1.4 顶空固相微萃取-气质联用测定挥发性代谢产物将菌株ZJSX5003和GDFS1009接种在PD液体培养基上,在28 ℃、170 r/min摇床上培养7 d,取发酵液,首先将固相微萃取(SPME)针头插入气相色谱仪的进样口,推出萃取头,在氦气流中260 ℃老化20 min,然后将萃取头缩回保护针管,立即将SPME针头插入顶空瓶中,推出萃取头,萃取挥发性物质30 min,再将SPME针头插入气相色谱仪的进样口,推出萃取头,解吸附30 s,随后取出SPME进样手柄和萃取头[17]。
固相微萃取(SPME)实验条件,用DB-wax型毛细管柱(30 m×0.25 mm×0.25 µm)分离挥发性物质,载气为氮气,流速为1 mL/min,不分流模式。升温程序:40 ℃保持5 min,以5 ℃ /min升至220 ℃,以20 ℃/min升至250 ℃,保持2.5 min;接口温度260 ℃;离子源温度230 ℃;四级杆温度150 ℃;电离方式:EI+,70 eV;扫描方式:全扫描;质谱范围:20–400 amu;NIST 2014谱库。
GC-MS结果分析:采用气相色谱-质谱联用仪进行定性分析,利用NIST2014谱库并结合计算机检索技术,对化学成分进行分离鉴定,应用气相色谱峰面积归一化法测定各成分的相对含量。
1.5 6-PAP平板抑菌试验分别将6-PAP配成3个不同浓度(20、50和100 mg/L)的溶液,用乙酸乙酯作为溶剂,比较3个浓度下,6-PAP在PDA平板对尖孢镰刀菌生长的抑菌效果。
2 结果与分析 2.1 棘孢木霉形态差异比较12株棘孢木霉分别接种PDA平板,28 ℃培养7 d,观察菌株表型差异。由图 1A看出6株棘孢木霉生长各异,ZJSX5001、ZJSX5002和ZJSX5003生长相对较快,菌丝致密,产生黄色或绿色色素,而ZJSX4002生长得最慢。其中ZJSX5001形成的孢子数量显著多,并产生绿色色素,而ZJSX5008的菌丝发达,但孢子数量少,产生的绿色或者黄色色素极少。图 1B中的6株棘孢木霉菌落生长迅速,其中GDFS2012、GDFS1009生长较快,孢子数量较多,有绿色色素产生,GDFS1009、GDFS2001、GDFS2011、GDFS2012的菌丝成羊绒状的气生菌丝,GDFS1010、GDFS5201的菌丝成毡状的气生菌丝,产孢量较低。

|
| 图 1 棘孢木霉在PDA平板上菌落表型差异比较 Fig. 1 Comparison of colony phenotypes of different T. asperellum on PDA plates. Strains isolated from Shaoxing, Zhejiang Province (A) and Foshan, Guangdong Province (B) inoculated on PDA at 2 d and 5 d culture were shown. |
| |
按照经典的平板对峙培养方法,12株棘孢木霉分别与尖孢镰孢菌在PDA平板对峙培养,图 2A结果表明,与生长速度接近的ZJSX5001、ZJSX5002菌株相比,ZJSX5003具有更好的抑制病原菌生长能力,抑菌效果最差的是ZJSX5008,该菌株属于产丝型棘孢木霉。图 2B的平板对峙中显示菌株GDFS2012和GDFS1009生长速度快,产孢量多,具有较好的拮抗效果。进一步测定抑菌率,如图 3所示,ZJSX5003的抑菌率达到72.58%,GDFS1009抑菌率高达74.19%。

|
| 图 2 棘孢木霉与尖孢镰孢菌的平板对峙 Fig. 2 Plate confrontation test of different T. asperellum and F. oxysporum. Strains isolated from Shaoxing, Zhejiang Province (A) and Foshan, Guangdong Province (B) antagonism against F. oxysporum. Both T. asperellum and F. oxysporum are as positive and negative control. |
| |

|
| 图 3 不同棘孢木霉对尖孢镰孢菌抑制率 Fig. 3 Inhibition rate of different T. asperellum to F. oxysporum. |
| |
采用GC-MS分析棘孢木霉ZJSX5003和GDFS1009中的挥发性代谢产物种类,结果如表 1所示。菌株ZJSX5003孢子提取物内共检测到70多种化学成分:其中烷烃类(Alkanes)数量最多为31种,其他成分为萜烯类(Terpenes)、羧酸及其衍生物类(Carboxylic acids and derivatives)、聚酮类(Polyketides)、含氮及杂环化合物(Nitrogen heterocyclic compounds)等,其中萜烯类的总相对含量较高,为22.18%,其次是烷烃类化合物(21.18%)、羧酸及其衍生物(18.42%)、聚酮类(3.84%),与之相比,GDFS1009菌株中含羧酸及其衍生物含量45.09%,含氮及杂环化合物含量14.4%,明显高于菌株ZJSX5003,但是烷烃类(15.30%)和聚酮类(1.15%)明显低于ZJSX5003菌株,且没有检测到萜烯类物质。因此不同地域来源木霉,尽管都属于棘孢木霉,其代谢产物的种类和数量存在明显差异。
| Strain code | The percentage content of antibiosis secondary metabolites (%) | ||||||
| Polyketides | Terpenes | Carboxylic acids and derivatives | Nitrogen heterocyclic compounds | Alkanes | Alcohols | Aldehydes | |
| ZJSX5003 | 3.84 | 22.18 | 18.42 | 2.97 | 21.18 | 0.05 | 0.18 |
| GDFS1009 | 1.15 | 0.00 | 45.09 | 14.40 | 15.30 | 0.21 | 0.23 |
利用顶空固相微萃取-气质联用法分别检测其挥发性代谢产物(表 2),通过对GC-MS谱图的NIST14谱库搜索和人工解析结果发现,ZJSX5003和GDFS1009有6种相同的挥发性代谢物,分别是异丁醇、异戊醇、3-甲基-3-丁烯-1-醇、3-羟基- 2-丁酮、2, 3-丁二醇和6-正戊基-2H-吡喃-2-酮(6-PAP)。其中,异丁醇、异戊醇、3-羟基-2-丁酮在ZJSX5003中的相对含量较高,异戊醇的含量高达14.61%。3-甲基-3-丁烯-1-醇、2, 3-丁二醇和6-正戊基-2H-吡喃-2-酮(6-PAP)在GDFS1009中相对含量较高。异丁醇、异戊醇、2, 3-丁二醇这3种醇类物质在两株菌中的含量都比较高。ZJSX5003特有的挥发性代谢产物有9种,分别是三氯甲烷、2-丁烯醛、5-庚烯-2-酮、(3E, 5E)-3, 5-庚二烯-2-酮、2, 4-己二烯酸乙酯、5-甲基-2-异丙烯基-苯酚、β-倍半水芹烯、苯乙醇、4, 8-二甲基- 1-(1-甲基乙基)-螺[4.5]癸-8-烯-7-醇。GDFS1009特有的挥发性代谢产物有4种,分别是3-甲基呋喃、2, 5-二甲基呋喃、3-乙基环戊酮、3-乙基-2-环戊烯-1-酮。因此,两株菌中共同检测到的挥发性代谢产物主要是醇类和酮类。
| No. | Name | tR/min | Molecular formula | Molecular weight | Relative content (%) | |
| ZJSX5003 | GDFS1009 | |||||
| 1 | Furan, 3-methyl- | 3.099 | C5H6O | 82 | – | 0.74 |
| 2 | Furan, 2, 5-dimethyl- | 4.448 | C6H8O | 96 | – | 0.31 |
| 3 | Trichloromethane | 6.226 | CHCl3 | 118 | 0.28 | – |
| 4 | 2-Butenal | 6.712 | C4H6O | 70 | 0.64 | – |
| 5 | 1-Propanol, 2-methyl- | 8.987 | C4H10O | 74 | 7.25 | 1.84 |
| 6 | 1-Butanol, 3-methyl- | 12.562 | C5H12O | 88 | 14.61 | 6.87 |
| 7 | 5-Hepten-2-one | 13.387 | C7H12O | 112 | 0.33 | – |
| 8 | 3-Buten-1-ol, 3-methyl- | 13.695 | C5H10O | 86 | 0.40 | 0.54 |
| 9 | Acetoin | 14.640 | C4H8O2 | 88 | 0.62 | 0.20 |
| 10 | 3-Ethylcyclopentanone | 15.791 | C7H12O | 112 | – | 0.60 |
| 11 | trans, trans-3, 5-Heptadien-2-one | 19.863 | C7H10O | 110 | 1.01 | – |
| 12 | 2, 4-Hexadienoic acid, ethyl ester | 20.668 | C8H12O2 | 140 | 0.13 | – |
| 13 | 2, 3-Butanediol | 22.526 | C4H10O2 | 90 | 2.09 | 2.63 |
| 14 | 2-Cyclopenten-1-one, 3-ethyl- | 23.643 | C7H10O | 110 | – | 0.27 |
| 15 | 3-Buten-2-ol, 4-phenyl-, (E)- | 24.579 | C10H12O | 148 | 0.37 | – |
| 16 | Cyclohexene, 3-(1, 5-dimethyl-4-hexenyl)-6- methylene-, [S-(R*, S*)]- | 26.933 | C15H24 | 204 | 0.09 | – |
| 17 | Phenylethyl Alcohol | 29.925 | C8H10O | 122 | 0.19 | – |
| 18 | Spiro[4.5]dec-8-en-7-ol, 4, 8-dimethyl-1-(1-met hylethyl)- | 37.226 | C15H26O | 222 | 0.28 | – |
| 19 | 2H-Pyran-2-one, 6-pentyl- | 35.109 | C10H14O2 | 166 | 0.37 | 1.00 |
为了验证吡喃酮6-PAP对尖孢镰孢菌的抑菌效果,配置3种不同浓度(20、50、100 mg/L)的6-PAP平板,28 ℃培养5 d和7 d观察抑菌效果(图 4),结果表明,100 mg/L几乎能全部抑制尖孢镰孢菌的生长。而20 mg/L抑制该菌的生长达到75%,说明6-PAP对尖孢镰孢菌具有较强的抑制效果,同时我们检测了6-PAP对番茄灰霉病和水稻纹枯病菌,20 mg/L抑制70%以上,而100 mg/L几乎全部抑制其生长。
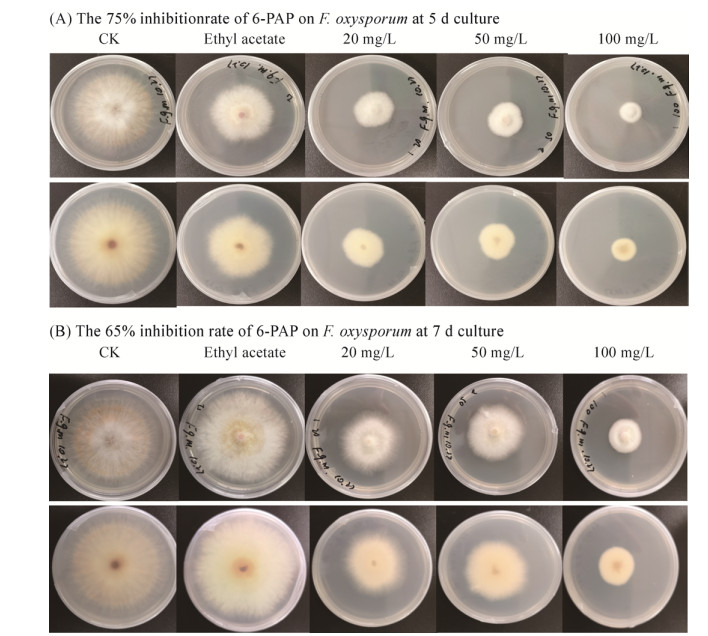
|
| 图 4 三个不同浓度(20、50和100 mg/L) 6-PAP对尖孢镰孢菌的抑制 Fig. 4 The inhibition effects of 6-PAP with different concentration (20、50 and 100 mg/L) on F. oxysporum at 5 d culture (A) and at 7 d culture (B) in vitro. |
| |
本研究比较了12株棘孢木霉对尖孢镰孢菌的抑制作用,结果表明,广东省佛山市分离的棘孢木霉总体拮抗活性优于浙江省绍兴市分离的棘孢木霉,其中菌株ZJSX5003和GDFS1009均具有较好的拮抗活性,抑菌率分别达73%和74%。表型和代谢产物分析结果表明,ZJSX5003和GDFS1009二者生长速度较快、菌丝丰富致密、产孢量大,其代谢产物种类丰富,其中ZJSX5003分泌更多的是萜烯类、聚酮类、醇类等抑菌活性物质,而GDFS1009分泌的代谢产物主要是羧酸及其衍生物、含氮杂环类化合物和烷烃类化合物。
本研究利用顶空固相微萃取气质联用法在棘孢木霉GDFS1009和ZJSX5003中检测挥发性代谢产物包括6-PAP,进而通过体外抑菌试验证明6-PAP在抑制尖孢镰孢菌的抑制中发挥重要作用。Stoppacher等利用顶空固相微萃取气质联用法,鉴定深绿木霉含有的挥发性代谢产物主要分为醇类、酮类、烷烃类、呋喃类以及具有生物活性的6-戊基-α-吡喃[18]。Henryk等研究表明几乎所有的深绿木霉都能检测到分泌6-PAP,不同木霉产6-PAP具有菌株水平的差异性,而非种水平的差异。6-PAP的浓度2 μg/plug基本完全抑制培养5 d的镰孢菌的生长。40 μg/plug的6-PAP能够完全抑制镰孢菌从培养第5–18天的生长[19]。Cooney等研究证实木霉产生的6-PAP能够抑制镰孢菌菌丝生长和单端孢真菌毒素(DON)的形成[12]。El-Hasan等证实6-戊基-α-吡喃酮抑制镰孢菌的镰孢菌酸合成[21]。6-PAP不仅具有抑菌活性,还能促进小麦种子萌发,增加番茄根系的长度[22]。
本研究表明棘孢木霉挥发性次级代谢产物具有明显拮抗作用,其中6-PAP拮抗尖孢镰孢菌效果显著,未来可以作为新型生防菌剂的潜在候选者,通过遗传和生物工程手段提高棘孢木霉6-PAP的含量,发展以6-PAP代谢产物为主要成分的木霉生防菌剂,应用于植物病害防治的生产实践中。
| [1] |
Lorito M, Peterbauer C, Hayes CK, et al. Synergistic interaction between fungal cell wall degrading enzymes and different antifungal compounds enhances inhibition of spore germination. Microbiology, 1994, 140(3): 623-629. DOI:10.1099/00221287-140-3-623 |
| [2] |
Harman GE, Howell CR, Viterbo A, et al. Trichoderma species—opportunistic, avirulent plant symbionts. Nat Rev Microbiol, 2004, 2(1): 43-56. |
| [3] |
Harman GE. Overview of mechanisms and uses of Trichoderma spp. Phytopathology, 2006, 96(2): 190-194. |
| [4] |
Zeilinger S, Gruber S, Bansal R, et al. Secondary metabolism in Trichoderma—Chemistry meets genomics. Fungal Biol Rev, 2016, 30(2): 74-90. DOI:10.1016/j.fbr.2016.05.001 |
| [5] |
Mukherjee PK, Horwitz BA, Kenerley CM. Secondary metabolism in Trichoderma—a genomic perspective. Microbiology, 2012, 158(1): 35-45. DOI:10.1099/mic.0.053629-0 |
| [6] |
Kubicek CP, Herrera-Estrella A, Seidl-Seiboth V, et al. Comparative genome sequence analysis underscores mycoparasitism as the ancestral life style of Trichoderma. Genome Biol, 2011, 12(4): R40. DOI:10.1186/gb-2011-12-4-r40 |
| [7] |
Pezet R, Pont V, Tabacchi R. Simple analysis of 6-pentyl-α-pyrone, a major antifungal metabolite of Trichoderma spp., useful for testing the antagonistic activity of these fungi. Phytochem Anal, 1999, 10(5): 285-288. |
| [8] |
Sivan A, Chet I. The possible role of competition between Trichoderma harzianum and Fusarium oxysporum on rhizosphere colonization. Phytopathology, 1989, 79(2): 198-203. DOI:10.1094/Phyto-79-198 |
| [9] |
Alabouvette C, Olivain C, Migheli Q, et al. Microbiological control of soil-borne phytopathogenic fungi with special emphasis on wilt-inducing Fusarium oxysporum. New Phytol, 2009, 184(3): 529-544. DOI:10.1111/j.1469-8137.2009.03014.x |
| [10] |
Collins RP, Halim AF. Characterization of the major aroma constituent of the fungus Trichoderma viride. J Agric Food Chem, 1972, 20(2): 437-438. DOI:10.1021/jf60180a010 |
| [11] |
Chen LH, Cui YQ, Yang XM, et al. An antifungal compound from Trichoderma harzianum SQR-T037 effectively controls Fusarium wilt of cucumber in continuously cropped soil. Australas Plant Pathol, 2012, 41(3): 239-245. DOI:10.1007/s13313-012-0119-5 |
| [12] |
Buśko M, Chełkowski J, Popiel D, et al. Solid substrate bioassay to evaluate impact of Trichoderma on trichothecene mycotoxin production by Fusarium species. J Sci Food Agric, 2008, 87: 536-541. |
| [13] |
Vinale F, Sivasithamparam K, Ghisalberti EL, et al. A novel role for Trichoderma secondary metabolites in the interactions with plants. Physiol Mol Plant Pathol, 2008, 72(1/3): 80-86. |
| [14] |
Wonglom P, Ito SI, Sunpapao A. Volatile organic compounds emitted from endophytic fungus Trichoderma asperellum T1 mediate antifungal activity, defense response and promote plant growth in lettuce (Lactuca sativa). Fungal Ecol, 2020, 43: 100867. DOI:10.1016/j.funeco.2019.100867 |
| [15] |
Zapata-Sarmiento DH, Palacios-Pala EF, Rodríguez-Hernández AA, et al. Trichoderma asperellum, a potential biological control agent of Stemphylium vesicarium, on onion (Allium cepa L.). Biologi Control, 2020, 140: 104105. DOI:10.1016/j.biocontrol.2019.104105 |
| [16] |
Chen K, Yang HT, Li JS, et al. Analysis of chemical components and antifungal activity of extraction from conidia of Trichoderma viride LTR-2. Microbiol China, 2007, 34(3): 455-458 (in Chinese). 陈凯, 杨合同, 李纪顺, 等. 绿色木霉菌LTR-2孢子提取物的抑菌活性及化学成分分析. 微生物学通报, 2007, 34(3): 455-458. DOI:10.3969/j.issn.0253-2654.2007.03.014 |
| [17] |
Jeleń HH. Use of solid phase microextraction (SPME) for profiling fungal volatile metabolites. Lett Appl Microbiol, 2003, 36(5): 263-267. DOI:10.1046/j.1472-765X.2003.01305.x |
| [18] |
Stoppacher N, Kluger B, Zeilinger S, et al. Identification and profiling of volatile metabolites of the biocontrol fungus Trichoderma atroviride by HS-SPME-GC-MS. J Microbiol Methods, 2010, 81(2): 187-193. DOI:10.1016/j.mimet.2010.03.011 |
| [19] |
Jeleń H, Blaszczyk L, Chelkowski J, et al. Formation of 6-npentyl-2H-pyran-2-one (6-PAP) and other volatiles by different Trichoderma species. Mycol Prog, 2014, 13(3): 589-600. DOI:10.1007/s11557-013-0942-2 |
| [20] |
Cooney JM, Laurent DR, Di Menna ME. Impact of competitive fungi on trichothecene production by Fusariumgraminearum. J Agric Food Chem, 2001, 49(1): 522-526. DOI:10.1021/jf0006372 |
| [21] |
El-Hasan A, Walker F, Buchenauer H. Trichoderma harzianum and its metabolite 6-pentyl-alpha-pyrone suppress fusaric acid produced by Fusarium moniliforme. J Phytopathol, 2008, 156(2): 79-87. |
| [22] |
Vinale F, Sivasithamparam K, Ghisalberti EL, et al. Trichoderma secondary metabolites active on plants and fungal pathogens. Open Mycol J, 2014, 8(8): 127-139. |
 2020, Vol. 36
2020, Vol. 36




