中国科学院微生物研究所、中国微生物学会主办
文章信息
- 胡巧, 史雨馨, 杨晓玲, 张静, 李波, 廖晓玲, 刘雪
- Hu Qiao, Shi Yuxin, Yang Xiaoling, Zhang Jing, Li Bo, Liao Xiaoling, Liu Xue
- 神经递质的可视化荧光检测技术研究进展
- Progress in fluorescent visualization techniques for neurotransmitter detection
- 生物工程学报, 2020, 36(6): 1051-1059
- Chinese Journal of Biotechnology, 2020, 36(6): 1051-1059
- 10.13345/j.cjb.190441
-
文章历史
- Received: September 27, 2019
- Accepted: December 19, 2019
- Published: January 6, 2020
2. 重庆科技学院 纳微生物医学检测技术重庆市工程实验室,重庆 401331
2. Chongqing Engineering Laboratory of Nano/Micro Biomedical Detection Technology, Chongqing University of Science and Technology, Chongqing 401331, China
神经递质主要是指在神经化学传递中完成信号转导的特定化学物质,促使肌体完成特定的生物学反应[1]。测定脑神经递质的浓度变化和空间分布,是探索人类感知和思维的基础,同时也是预防和诊断治疗脑神经疾病的基础。但是由于人体是一个复杂的环境,内源性成分干扰大[2],体内神经递质含量少,往往在特定的神经环路中处于不断的更新变化和代谢的动态平衡中,且疾病的发生往往是多种神经递质含量变化的共同结果[3]。因而,对神经递质的高时间和空间分辨率的可视化检测一直是生物医学分析的难点。
近年来光致发光的荧光蛋白和通过低分子物质催化而发光的发光蛋白被广泛地应用于生物小分子的检测中[4],基于荧光和发光蛋白发展起来的检测方法相较于传统的方法具有较高的时间和空间分辨率,有效解决了传统分析方法不能实时检测活细胞中神经递质分布规律或不能反映神经递质活性变化的弊端。开发针对神经递质的生物探针一直是国际神经科学上的重大课题,旨在复杂的生物体系中实现高时间和空间分辨率的检测快速变化的特定神经递质。这要求神经递质探针设计时,选择恰当的受体蛋白和荧光蛋白,构建具有高特异性、能精确反映神经递质真实动态信息的生物传感器。本文综述近年来利用荧光和发光蛋白开发的可视化监测技术和在不同神经递质中的应用情况,包括了具有较好研究基础的谷氨酸(Glutamic acid,Glu)和γ-氨基丁酸(γ-aminobutyric acid,GABA),以及近几年新发展的多巴胺(Dopamine,DA)和乙酰胆碱(Acetylcholine,ACh)探针,归纳总结了不同方法的优缺点,并对未来神经递质探针发展进行了展望,为神经递质的可视化监测提供较为系统的参考。
1 神经递质的荧光可视化方法目前神经递质的体内检测技术主要分为3类。第一类经典检测技术是微透析,但是由于其采样量大、采样率低和时间分辨率低,使其不适用于复杂和快速演变的行为中检测神经递质的动态变化[5]。第二类技术是快速扫描循环伏安法(Fast scan cyclic voltammetry,FSCV),FSCV具有出色的时间分辨率(亚秒级)、高灵敏度(纳摩尔级)和空间分辨率(微米级)。然而,FSCV难以区分结构相似的神经递质,例如DA和去甲肾上腺素(Norepinephrine,NE)[6]。此外,微透析和FSCV都需要将相对较大的探针(直径约为70–300 mm)植入脑组织,这限制了对内源性神经递质释放空间的精确测量[7]。第三类是随着荧光蛋白和发光蛋白发展起来的各类神经递质生物传感器。这类生物传感器具有更加优良的时间和空间分辨率,可以实现对细胞内不同区域中的神经递质快速释放过程的可视化监测,如细胞器(0–10 μm)、脂筏(70 μm左右)等,是现阶段最具研究价值的神经递质监测方法。目前,第三类检测方法主要包含两种较为成熟的技术:基于荧光共振能量转移(Fluorescence resonance energy transfer,FRET)技术的生物传感器和基于单荧光蛋白的生物传感器。
1.1 基于FRET的生物传感器近年来荧光技术发展迅速,基于FRET技术的神经递质传感器发展日趋成熟,因其可以实现活体、原位条件下信号分子的动态实时检测而被广泛应用于生命科学研究中,通过蛋白构象改变(结合/解离)诱导两个荧光基团产生荧光共振现象,不仅可以检测神经递质活性,还可以实现神经递质在突触间隙/细胞内的动态空间分布的可视化[8]。FRET生物传感器的设计需要考虑两个主要问题,首先是选择恰当的感知结构域,能对目标神经递质产生特异性的生物反应,发生构象的变化;其次是两个荧光基团FRET效率的变化必须足够大,确保荧光强度比Ia/Id的变化足够明显,便于相关成像设备检测。与传统的技术相比,基于FRET的神经递质传感器能够在不损伤活细胞的前提下研究神经递质在不同脑功能区的时空分布,可以高特异性地实现在视网膜切片、突触间隙和活体等多个模型的长期稳定成像,具有更加优良的时间和空间分辨率。
1.2 基于单荧光蛋白的生物传感器单荧光探针也是实现可视化监测神经递质的理想工具。比如,构象敏感的绿色荧光蛋白的突变体(Circularly permutated green fluorescent protein,cpGFP),它是由GFP序列前后置换改造而来,其荧光强度可由多肽链N端和C端不同的结合状态而改变。探针蛋白与目标神经递质结合后,由于构象改变而引发cpGFP荧光强度的变化。与FRET探针相比,cpGFP探针的结构更加简单,单荧光记录模式适用范围更广,特别适合于组织切片以及在体内可视化检测神经递质释放的时空规律。通过病毒转染实现体内表达,记录不同脑功能区中单个细胞的活动,甚至可以分辨单个树突棘中的神经活动。cpGFP作为荧光输出模块,具有荧光强度高、表达效率高和荧光稳定好的优势,是构建结构更简单的神经递质传感器的理想工具。典型代表包括了检测Glu的iGluSnFR[9]、检测GABA的iGABASnFR[10]、检测DA的GRABDA[11]和dLight1[12],以及检测ACh的GACh[13]。
2 可视化方法在不同神经递质中的应用 2.1 谷氨酸谷氨酸是脊椎动物中枢神经系统中主要的兴奋性氨基酸神经递质[14],介导着复杂的信号传递,基本上影响所有形式的行为,精神分裂症和帕金森等神经类疾病的发生都是由于谷氨酸浓度和分布的变化而引发的[15]。经过多年研究,谷氨酸探针已经成为发展最为成熟且种类最多的神经递质可视化监测技术。
Okumoto等[16]通过将绿色荧光蛋白变体FP附着到成熟天冬氨酸结合蛋白ybeJ (也称为GltI)的每个末端构建了初代谷氨酸纳米传感器FLIPE。谷氨酸结合会触发GltI内的构象变化,从而使得cpGFP的去质子化和荧光增强。FLIPE能够靶向定位于亚细胞区室,可用于监测活细胞表面的宽浓度范围内的谷氨酸浓度变化,适用于测量胶质谷氨酸代谢和转运、可视化溢出效应和生物体中神经元活性等。在视网膜中,谷氨酸含量和分布的变化是导致糖尿病引起的视网膜神经退行性病变[17]、急性青光眼节细胞死亡等重要原因[18]。为了揭示谷氨酸在视网膜中释放的时空变化规律与信息传递的关系,Firl等[19]创建了基于FRET的优化谷氨酸传感器FLII81E-1μ。表达该探针蛋白并孵育视网膜切片,记录到了突触间隙中类似于钙波的谷氨酸波,揭示了通过内网状层传播的谷氨酸释放的时空变化规律与信息传递的关系。
iGluSnFR[9]系列的生物传感器也是实现可视化检测谷氨酸的一种重要的技术(图 1),iGluSnFR是一种由大肠杆菌GltI和cpGFP构建的单波长Glu传感器,突破性地实现了在完整组织中可视化谷氨酸释放过程。iGluSnFR具有适合于体内成像的信噪比和动力学,可对原位谷氨酸特异性反应。应用iGluSnFR在树突棘上观察到了大而快速的Glu信号,测量了视网膜中双极细胞的感受野,有效地实现了在体细胞、树突、视网膜、蠕虫、斑马鱼和老鼠中长期稳定的成像。iGluSnFR具有高谷氨酸亲和力和大的动态范围,但目前的时间分辨率不适用于监测突触中谷氨酸快速释放。因此,Helassa等[20]通过对连接子和结合亲和力优化,开发了两个可快速检测的iGluSnFR变体iGluf (用于“快速”)和iGluu (用于“超快速”),实现了在高频传输过程中准确跟踪突触中谷氨酸动态,并精确调控同谷氨酸结合过程中产生荧光的明亮程度。与iGluSnFR相比,iGluf和iGluu在体外的构象变化速度提升6倍,在突触中的动力学速度提高了5倍,并且能够直接报告100 Hz的离散突触谷氨酸释放事件。最近报道的红色荧光的R-iGluSnFR1进一步扩展了谷氨酸传感器的颜色[21]。
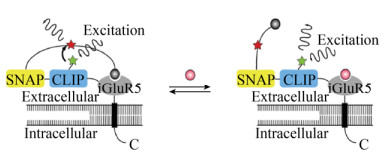
Masharina团队[22]基于FRET技术研发的半合成荧光传感器蛋白(Snifits)在神经递质的检测中也占据着重要的地位。Snifits是由SNAP-tag[23]、CLIP-tag[24]和分析物结合蛋白组成的融合蛋白(图 2)。Snifit利用天然受体-拮抗剂对,为细胞表面荧光代谢物传感器的设计提供了思路。例如,基于离子型谷氨酸受体5 (iGluR5)设计的针对Glu的传感器Snifit-iGluR5。Snifit-iGluR5能在HEK 293细胞表面显示对Glu最大的荧光比率变化为1.56,高于任何其他现有的谷氨酸生物传感器。此外,Snifit-iGluR5在细胞表面上用远红色荧光基团进行的专有标记将有助于在组织样品上或体内应用以及与其他生物传感器组合使用,进一步优化和表征将允许原位检测Glu的生理水平。
2.2 γ-氨基丁酸GABA是抑制性神经递质,调控多种神经疾病,如癫痫[25]、焦虑症和精神分裂症[26]。GABA功能的详细表征需要以高时间和空间分辨率测量其浓度。目前GABA探针已有一定基础,但结构较复杂,应用仍不够广泛。
基于FRET的荧光生物传感器非常适合测量体内的小分子浓度。Masharina等[27]利用Snifit构建了第一个用于测量活细胞表面GABA浓度的荧光比率传感器GABA-Snifit (图 3),可以在活哺乳动物细胞的表面上以高特异性和时空分辨率检测GABA。当在细胞表面组装时,GABA-Snifit允许感测微摩尔至毫摩尔GABA浓度。此外,可以使用GABA-Snifit来定量GABAB受体激动剂、拮抗剂和变构调节剂的作用的相对结合亲和力。GABA-Snifit是研究GABA和GABAB受体在生物系统中功能的有价值的工具。然而,它在神经元系统中的效用是有限的,添加两个单独的小分子使传感器的结构复杂化,并且其对GABA的亲和力非常弱(约400 μmol/L)。此外,GABA受体的过表达可能破坏细胞信号传导,GABA受体的异源寡聚化可能降低传感器功能。
Marvin等[10]基于谷氨酸受体iGluSnFR的原理,开发出可检测GABA浓度的荧光探针iGABASnFR。实现了对培养神经元和急性小鼠脑切片中GABA释放效用的观测。应用iGABASnFR追踪了线粒体中GABA含量,在体内观察到小鼠视皮层中的大量GABA瞬变,并利用癫痫模型进一步检测iGABASnFR的可行性。最后,在斑马鱼中,利用iGABASnFR将小脑中的GABA能信号与运动输出相关联。iGABASnFR具有现有GABA传感器中最佳的性能,是唯一适合体内使用的GABA传感器。未来的iGABASnFR将向着可控的亲和力、动力学和更优的信噪比发展。
针对以上GABA探针结构较复杂且需一定时间等待基因表达的问题。Hu等[28]在GABAB受体的胞外区两端连接荧光蛋白,构建了基于FRET的GABA探针FGB1-VFT。在体外表达该探针蛋白并孵育脑片,可实现对神经组织中突触释放的快速检测。
2.3 多巴胺DA是非常重要的单胺类神经递质,参与调节广泛的复杂过程,包括奖励信号[29]、感知学习、注意力的变化和运动控制[30]。在人脑中,DA的传播和受损同多种神经类疾病有着紧密的联系,如精神分裂症[31]和帕金森[32]。
CNiFERs[33]可以测量通过G蛋白偶联受体(G protein-coupled receptors,GPCRs)发出信号的任何神经递质的释放,且具有天然GPCR的特性,保留了内源表达受体的化学特异性、亲和力和时间动力学。迄今为止,利用CNiFERs已经实现了对体内ACh、DA和NE的检测。Muller等[34]创建的检测DA的CNiFERs (图 4),它具有纳摩尔的高灵敏度、秒的时间分辨率以及较宽的动态范围,并且对大脑的影响较小。目前,已有报道利用CNiFERs传感器研究学习期间脑内神经递质DA释放过程的动力学,并将CNiFERs移植到小鼠额叶皮层内,得到小鼠学习与奖励时,神经信号的变化。CNiFERs传感器为研究DA在神经系统中更复杂的行为提供了更高的时间和空间分辨率。
dLight1[12]在急性脑切片和行为期间小鼠中能进行动态的高分辨率成像,亚微摩尔亲和力和快速动力学造就了高时间分辨率,能够长期跟踪监测由学习引起的纹状体中DA毫秒级的变化情况。
GRABDA[11]将cpGFP作为荧光输出模块偶联到神经递质受体上,构建受体-cpGFP嵌合体,随后通过突变、筛选和表征得到性能优异的神经递质传感器(图 5)。GRABDA能够在离体和体内的多个模型系统中,对内源性DA动态进行特异性的实时检测。与现有的检测方法相比,GRABDA具有更高的灵敏度,较大的表观亲和力,优异的膜运输性;相对较小的基因编码区,可适用于转基因和病毒包装;对DA具有高度特异性;具有快速响应动力学,适合快速检测神经递质的释放情况。
2.4 乙酰胆碱ACh介导中枢和外周神经系统以及非神经系统的细胞间通讯。ACh释放含量和分布同注意力、感知力、联想学习和睡眠/清醒平衡[35]都有密切关系。CNiFERs传感器也可以实现对ACh的检测[33],CNiFER直接植入大脑,能够以小于100 μm的空间分辨率感知神经递质ACh释放。
Jing[13]通过将cpGFP耦合到毒蕈碱型ACh受体(Muscarinic receptor,MR)中构建一种更加用户友好、广泛适用的GACh传感器(图 6)。利用病毒或者遗传学手段转染ACh给十几种不同动物来源的神经元及非神经元细胞,从而验证了GACh传感器的性能。GACh传感器具有高灵敏度、信噪比、对细胞生理学干扰小和强的光稳定性,适用于监测体外、离体和体内不同组织中的胆碱能信号。
3 总结与展望神经递质释放是神经网络中信息处理的核心部分,在神经科学的研究中神经递质浓度的时间和空间变化可视化是完全理解神经网络工作原理的必要部分。神经递质的可视化检测一直是科学研究中的一大难题,主要是由于:第一,在神经系统中存在化学或结构同神经递质类似的物质,这会对检测的特异性、准确性造成干扰;第二,神经递质在人体中浓度较小且处于不更新变化和代谢的动态平衡中,想要实时观察神经递质的释放过程就要求检测工具具有足够高的时间和空间分辨率,较强的荧光比率;第三,如果是针对某一特定区域监测神经递质浓度的变化情况,还要求监测工具具有一定的靶向性,以特异性分析特定位置神经递质的浓度变化情况;第四,对神经递质的研究一般是针对单细胞/突触水平以及神经元或体内小网络中神经递质释放规律,这就要求监测工具的结构/体积尽量不要太复杂/大。
要实现神经递质的可视化,还需在以下几个方面进行努力。首先,选择恰当的感应模块和荧光报告模块成为提高神经递质传感器特异性和简化传感器结构/体积的关键;其次,提高传感器的分辨率和动态响应范围,一方面可以通过改造发色团偶极取向,另一方面可以通过突变发色团附近的氨基酸残基,筛选特异性更好、灵敏度更高和动态响应范围更大的发色基团[36];最后,利用遗传编码等技术持续开发更多的检测工具,寻找更优的荧光和发光蛋白都将为神经递质的可视化带来突破性进展。
在过去二十年里,各类荧光探针的开发所取得的成果为未来实现神经递质的可视化监测奠定了坚实的基础。其中DA和ACh两种神经递质的受体为单亚基结构,近年来基于cpGFP的荧光探针发展逐渐成熟,使二者的探针可以用于体外、体内等不同组织[11, 13, 37]。而Glu和GABA的探针虽然发展时间较长且种类较多,但由于其受体的双亚基结构,所开发出的探针往往结构复杂,以体外应用为主。作为神经系统中最主要的两类神经递质Glu和GABA的检测仍需要更有效的探针。神经递质可视化生物传感器各具特色,在不同的性能指标上具有一定的差异(表 1),合理的选择和优化检测工具将推进神经递质传感器解决更多的现实问题。除以上神经递质外,其他神经递质的可视化工具也值得进一步研究,现有的神经递质探针多以受体为目标进行改造,限制了探针的空间移动性。Ca2+探针是神经影像学中广泛使用的工具,借鉴Ca2+探针的理念,荧光探针进入细胞膜内,和细胞内的酶发生反应,生成装载细胞内的生物探针。这类神经递质探针不受细胞膜的空间限制,将突破性地提高神经递质探针的应用范围。
| Indicators | Type | Reporting module | Dynamic range | Affinity | Temporal resolution | Selected applications | References |
| FLIPE | FRET | ECFP, Venus | < 5% | ~600 nmol/L | ~1 ms | Rat hippocampal neurons, PC12 cells, Retina | [16] |
| iGluSnFR | Single-FP | cpGFP | 450% | (107±9) μmol/L | ~5 ms | Cultivate neurons, retinas, worms, zebrafish and mice | [9] |
| iGABASnFR | Single-FP | cpGFP | 250% | ~9 μmol/L | 1–10 s | Cultured neurons, acute hippocampal slices, mouse visual cortex, mice, zebrafish | [10] |
| Snifit-iGluR5 | FRET | SNAP-tag CLIP-tag | 156% | (15±5) μmol/L | < 1 s | HEK 293T cells | [22] |
| GABA-Snifit | FRET | SNAP-tag CLIP-tag | 180% | ~400 μmol/L | 1–10 s | HEK 293T cells | [27] |
| CNiFER | FRET | calcium concentration | ~9% | (2.5±0.1) nmol/L | 1–10 s | HEK 293T cells | [33] |
| GRABDA | Single-FP | cpGFP | ~90% | 130 nmol/L | ≤100 ms | HEK 293 cells, cultured neurons, acute brain slices of mice, flies, fish and mice | [11] |
| GACh | Single-FP | cpGFP | 90.1%±1.7% | 100 μmol/L | (280±32) ms, (762±75) ms | Culture neurons, non-neuronal tissue, brain slices, fruit flies, mouse visual cortex | [13] |
| dLight1 | Single-FP | cpGFP | 340%±20% | (330±30) nmol/L | 10 ms on and 100 ms off | Acute brain slices of mice, HEK 293 cells | [12] |
另一方面,对神经递质可视化检测技术的研究可以以需求为导向,利用神经系统中的经典模型或者久未解决的问题推动研究工作的开展。比如在视网膜的外网状层中,GABA是否参与了负反馈调节一直是争论的焦点[38]。当免疫荧光、电生理等传统技术都无法解决这一问题时,寻找合适的GABA释放实时可视化监测技术可能是解决问题的关键。
除了为不同的神经递质开发新的可视化监测技术外,生物发光技术的不断进步也引发了用于脑成像的生物发光传感器的革命。相关研究通过将现有的基于FRET的生物传感器中的供体与荧光素酶交换,开发了新的基于生物发光共振能量转移技术(Bioluminescent resonance energy transfer,BRET)的生物传感器。特别是用NanoLuc替代FRET传感器中的CFP使得BRET传感器具有良好的灵敏度和响应幅度。由于大多数基于FRET的生物传感器是模块化的,因此该方法原则上可适用于开发各种生物分子或功能的BRET生物传感器。目前,已经开发了针对ATP[39]、膜电压[40]和Zn2+[41]的BRET传感器。未来将基于BRET的生物传感器引入对神经递质的可视化监测是必然的趋势。此外,可以将萤光素酶(例如NanoLuc和teLuc)直接插入适当的感知结构域中,以得到高荧光强度的生物传感器。
各类荧光探针的发展还同相关的光学仪器和成像数据处理技术有着紧密的联系,近年来多光子成像[42]、数字光片显微镜[43]、像差校正多焦点显微镜[44]和空间光调制器显微镜[45]的发展将为各类荧光探针的发展提供保障。总的来说,神经递质的可视化研究已经具备较好的基础,未来的神经递质检测技术必然向着无创、定量特异、信号增强和实时可视化发展,具有更高时间和空间分辨率的神经递质检测工具在神经生物学中将有十分良好的应用前景。
| [1] |
Chiu SY, Kriegler S. Neurotransmitter-mediated signaling between axons and glial cells. Glia, 1994, 11(2): 191-200. DOI:10.1002/glia.440110213 |
| [2] |
Zhao F, Li Q, Liang ML, et al. Simultaneous determination of eight kinds of neurotransmitters in rat blood serum by ultra-high performance liquid chromatograph-tandem mass spectrometry. Chin J Analyt Chem, 2018, 46(1): 121-128 (in Chinese). 赵芳, 李强, 梁梅丽, 等. 超高效液相色谱-串联质谱法快速测定大鼠血清中8种神经递质. 分析化学, 2018, 46(1): 121-128. |
| [3] |
Li J. A study on the changes of serum monoamine neurotransmitters and myocardial enzymes in patients with refractory epilepsy[D]. Changchun: Jilin University, 2017 (in Chinese). 李菁.难治性癫痫患者血清单胺类神经递质及心肌酶变化的研究[D].长春: 吉林大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10183-1017156137.htm |
| [4] |
Chen ZJ, Truong TM, Ai HW. Illuminating brain activities with fluorescent protein-based biosensors. Chemosensors, 2017, 5(4): 32. DOI:10.3390/chemosensors5040032 |
| [5] |
Giorgi-Coll S, Blunt-Foley H, Hutchinson PJ, et al. Heparin-gold nanoparticles for enhanced microdialysis sampling. Anal Bioanal Chem, 2017, 409(21): 5031-5042. DOI:10.1007/s00216-017-0447-y |
| [6] |
Jeon J, Hwang I, Chung TD. Electrochemical detection of neurotransmitters: toward synapse-based neural interfaces. Biomed Eng Lett, 2016, 6(3): 123-133. DOI:10.1007/s13534-016-0230-6 |
| [7] |
Jaquins-Gerstl A, Michael AC. A review of the effects of FSCV and microdialysis measurements on dopamine release in the surrounding tissue. Analyst, 2015, 140(11): 3696-3708. DOI:10.1039/C4AN02065K |
| [8] |
Youssef SA. Genetically encoded FRET-based probes for live cell imaging[D]. California: University of California, 2016.
|
| [9] |
Marvin JS, Borghuis BG, Tian L, et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nat Methods, 2013, 10(2): 162-170. DOI:10.1038/nmeth.2333 |
| [10] |
Marvin JS, Shimoda Y, Magloire V, et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nat Methods, 2018, 16(8): 763-770. |
| [11] |
Sun FM, Zeng JZ, Jing M, et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell, 2018, 174(2): 481-496. DOI:10.1016/j.cell.2018.06.042 |
| [12] |
Patriarchi T, Cho JR, Merten K, et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science, 2018, 360(6396): eaat4422. DOI:10.1126/science.aat4422 |
| [13] |
Jing M, Zhang P, Wang GF, et al. A genetically encoded fluorescent acetylcholine indicator for in vitro and in vivo studies. Nat Biotechnol, 2018, 36(8): 726-737. DOI:10.1038/nbt.4184 |
| [14] |
Shi ZF, Zhang W, Lu Y, et al. Aquaporin 4-mediated glutamate-induced astrocyte swelling is partially mediated through metabotropic glutamate receptor 5 activation. Front Cell Neurosci, 2017, 11: 116. DOI:10.3389/fncel.2017.00116 |
| [15] |
Ribeiro FM, Vieira LB, Pires RGW, et al. Metabotropic glutamate receptors and neurodegenerative diseases. Pharmacol Res, 2017, 115: 179-191. DOI:10.1016/j.phrs.2016.11.013 |
| [16] |
Okumoto S, Looger LL, Micheva KD, et al. Detection of glutamate release from neurons by genetically encoded surface-displayed FRET nanosensors. Proc Natl Acad Sci USA, 2005, 102(24): 8740-8745. DOI:10.1073/pnas.0503274102 |
| [17] |
Pulido JE, Pulido JS, Erie JC, et al. A role for excitatory amino acids in diabetic eye disease. Exp Diabetes Res, 2007, 2007: 36150. |
| [18] |
Carpi-Santos R, Maggesissi RS, Von Seehausen MP, et al. Retinal exposure to high glucose condition modifies the GABAergic system: regulation by nitric oxide. Exp Eye Res, 2017, 162: 116-125. DOI:10.1016/j.exer.2017.07.010 |
| [19] |
Firl A, Sack GS, Newman ZL, et al. Extrasynaptic glutamate and inhibitory neurotransmission modulate ganglion cell participation during glutamatergic retinal waves. J Neurophysiol, 2013, 109(7): 1969-1978. DOI:10.1152/jn.00039.2013 |
| [20] |
Helassa N, Dürst CD, Coates C, et al. Ultrafast glutamate sensors resolve high-frequency release at schaffer collateral synapses. Proc Natl Acad Sci USA, 2018, 115(21): 5594-5599. DOI:10.1073/pnas.1720648115 |
| [21] |
Wu JH, Abdelfattah AS, Zhou H, et al. Genetically encoded glutamate indicators with altered color and topology. ACS Chem Biol, 2018, 13(7): 1832-1837. DOI:10.1021/acschembio.7b01085 |
| [22] |
Brun MA, Tan KT, Griss R, et al. A semisynthetic fluorescent sensor protein for glutamate. J Am Chem Soc, 2012, 134(18): 7676-7678. DOI:10.1021/ja3002277 |
| [23] |
Keppler A, Gendreizig S, Gronemeyer T, et al. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol, 2003, 21(1): 86-89. DOI:10.1038/nbt765 |
| [24] |
Gautier A, Juillerat A, Heinis C, et al. An engineered protein tag for multiprotein labeling in living cells. Chem Biol, 2008, 15(2): 128-136. DOI:10.1016/j.chembiol.2008.01.007 |
| [25] |
Reddy DS, Yoshimura RF, Ramanathan G, et al. Role of β2/3-specific GABA-A receptor isoforms in the development of hippocampus kindling epileptogenesis. Epilepsy Behavior, 2018, 82: 57-63. DOI:10.1016/j.yebeh.2018.02.020 |
| [26] |
Shukla DK, Wijtenburg SA, Chen HJ, et al. Anterior cingulate glutamate and GABA associations on functional connectivity in schizophrenia. Schizophr Bull, 2018, 45(3): 647-658. |
| [27] |
Masharina A, Reymond L, Maurel D, et al. A fluorescent sensor for GABA and synthetic GABAB receptor ligands. J Am Chem Soc, 2012, 134(46): 19026-19034. DOI:10.1021/ja306320s |
| [28] |
Hu Q, Liao XL, Liu X. Design and preparation of FRET probe for γ-aminobutyric acid//The 13th Biennial Conference of Chinese Neuroscience Society, Suzhou: CNS, 2019: 1036-1037.
|
| [29] |
Schuvailo ON, Dzyadevych SV, El'Skaya AV, et al. Carbon fibre-based microbiosensors for in vivo measurements of acetylcholine and choline. Biosens Bioelectron, 2006, 21(1): 87-94. |
| [30] |
Liu TT, Hu PP, Cao RH, et al. Dopaminergic modulation of biological motion perception in patients with parkinson's disease. Sci Rep, 2017, 7: 10159. DOI:10.1038/s41598-017-10463-2 |
| [31] |
Weinstein JJ, Chohan MO, Slifstein M, et al. Pathway-specific dopamine abnormalities in schizophrenia. Biol Psych, 2017, 81(1): 31-42. DOI:10.1016/j.biopsych.2016.03.2104 |
| [32] |
Burbulla LF, Song PP, Mazzulli JR, et al. Dopamine oxidation mediates mitochondrial and lysosomal dysfunction in parkinson's disease. Science, 2017, 357(6357): 1255-1261. DOI:10.1126/science.aam9080 |
| [33] |
Lacin E, Muller A, Fernando M, et al. Construction of cell-based neurotransmitter fluorescent engineered reporters (CNiFERs) for optical detection of neurotransmitters in vivo. J Vis Exp, 2016, 111: e53290. |
| [34] |
Muller A, Joseph V, Slesinger PA, et al. Cell-based reporters reveal in vivo dynamics of dopamine and norepinephrine release in murine cortex. Nat Methods, 2014, 11(12): 1245-1252. DOI:10.1038/nmeth.3151 |
| [35] |
Ueda M, Matsuura Y, Hosoda R, et al. In vivo imaging of nicotinic acetylcholine receptors in the central nervous system//Akaike A, Shimohama S, Misu Y. Nicotinic Acetylcholine Receptor Signaling in Neuroprotection. Singapore: Springer, 2018: 17-44.
|
| [36] |
Zhou JS. Fluorescence kinetics of genetically encoded histidine probe FHisJ and its applications[D]. Shanghai: East China Normal University, 2018 (in Chinese). 周加胜.基因编码组氨酸探针FHisJ的荧光动力学研究及应用[D].上海: 华东师范大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10269-1018821630.htm |
| [37] |
Feng JS, Zhang CM, Lischinsky JE, et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron, 2019, 102(4): 745-761. DOI:10.1016/j.neuron.2019.02.037 |
| [38] |
Liu X, Hirano AA, Sun XP, et al. Calcium channels in rat horizontal cells regulate feedback inhibition of photoreceptors through an unconventional GABA-and pH-sensitive mechanism. J Physiol, 2013, 591(13): 3309-3324. DOI:10.1113/jphysiol.2012.248179 |
| [39] |
Yoshida T, Kakizuka A, Imamura H. BTeam, a novel BRET-based biosensor for the accurate quantification of ATP concentration within living cells. Sci Rep, 2016, 6: 39618. DOI:10.1038/srep39618 |
| [40] |
Inagaki S, Tsutsui H, Suzuki K, et al. Genetically encoded bioluminescent voltage indicator for multi-purpose use in wide range of bioimaging. Sci Rep, 2017, 7: 42398. DOI:10.1038/srep42398 |
| [41] |
Aper SJA, Dierickx P, Merkx M. Dual readout BRET/FRET sensors for measuring intracellular zinc. ACS Chem Biol, 2016, 11(10): 2854-2864. DOI:10.1021/acschembio.6b00453 |
| [42] |
So PT, Dong CY, Masters BR, et al. Two-photon excitation fluorescence microscopy. Ann Rev Biomed Eng, 2000, 2: 399-429. DOI:10.1146/annurev.bioeng.2.1.399 |
| [43] |
Keller PJ, Schmidt AD, Wittbrodt J, et al. Reconstruction of zebrafish early embryonic development by scanned light sheet microscopy. Science, 2008, 322(5904): 1065-1069. DOI:10.1126/science.1162493 |
| [44] |
Abrahamsson S, Chen JJ, Hajj B, et al. Fast multicolor 3D imaging using aberration-corrected multifocus microscopy. Nat Methods, 2013, 10(1): 60-63. DOI:10.1038/nmeth.2277 |
| [45] |
Quirin S, Peterka DS, Yuste R. Instantaneous three-dimensional sensing using spatial light modulator illumination with extended depth of field imaging. Opt Expr, 2013, 21(13): 16007-16021. DOI:10.1364/OE.21.016007 |
 2020, Vol. 36
2020, Vol. 36